| 18F-FDG PET-CT对椎管内病变的诊断价值 |
椎管由脊髓、脊髓被膜、神经、血管及少量结缔组织构成,椎管内病变分为原发性、转移性肿瘤、淋巴瘤、非特异性炎症等。早期病变不易查出。常规X线、CT等对椎管内病变显示不佳,检出率较低。MRI对显示椎管内病变有一定优势,但在鉴定病变良恶性方面仍有一定局限性。18F-FDG PET-CT作为一种分子显像手段,通过评价肿瘤葡萄糖代谢水平,在肿瘤诊疗中发挥重要作用,能较准确评估椎管病变范围、性质及原发灶情况。
1 资料与方法 1.1 一般资料回顾性分析2007年12月至2017年9月我院发现的椎管内病变41例,男23例,女18例;年龄(56.02±16.36)岁。其中15例为良性病变,26例恶性病变,以椎管内转移瘤、淋巴瘤、神经鞘瘤及室管膜瘤多见。
1.2 仪器与方法采用Siemens Biograph Sensation 16HD PET-CT仪,18F-FDG由CTI RSD111型回旋加速器及Siemens Explora FDG4和Explora One 2台药物合成设备提供。药物放化纯均>95%。检查前患者空腹6 h以上,未使用降糖药物及葡萄糖制剂,空腹血糖控制在11.1 mmoL/L,严格按照5.55 MBq/kg体质量静脉注射18F-FDG。患者饮水休息40~70 min后行全身显像。CT扫描参数:120 kV,100 mA,重建层厚3 mm。PET为3D采集,全身扫描7~8床位,每个床位1.5 min。采集结束使用CT数据对PET图像进行校正,图像重建采用有序子集最大期望值迭代法,迭代次数为3,迭代子集为24。图像经过Siemens MSV工作站自动融合得出横断位、矢状位、冠状位图像。
1.3 图像分析由PET-CT诊断医师通过Siemens MSV工作站对图像进行独立分析,测定椎管内病变标准摄取最大值(SUVmax)。
1.4 统计学分析运用SPSS 20.0软件,数据以x±s表示,分析良恶性病变SUVmax,采用独立样本t检验,按α=0.05的检验水准,以P < 0.05为差异有统计学意义。以病理及随访结果为对照,计算SUVmax> 2.5标准时18F-FDG PET-CT的诊断敏感度、特异度、阳性预测值及阴性预测值。采用ROC曲线选择诊断椎管良恶性病变的最佳SUVmax值,并确定敏感度、特异度、阳性预测值及阴性预测值。
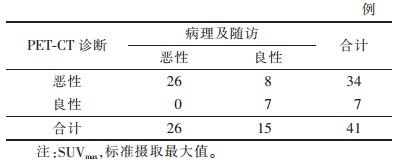
2 结果41例中位于颈段2例,胸段21例,腰段16例,骶段2例。病理及随访结果证实恶性26例,良性15例,其中转移瘤19例,淋巴瘤7例,神经鞘瘤3例,室管膜瘤5例,随访6个月以上7例(图 1)。良性病变组SUVmax=2.85±1.71,恶性病变组SUVmax=9.73± 6.57(P < 0.05)。目前多将SUVmax>2.5作为良恶性病变鉴别阈值,其诊断椎管内良性病变7例,SUVmax= 1.44±0.51,恶性34例,SUVmax=8.41±6.25;PET-CT诊断敏感度100.00%、特异度46.67%、阳性预测值76.47%、阴性预测值100.00%(表 1)。
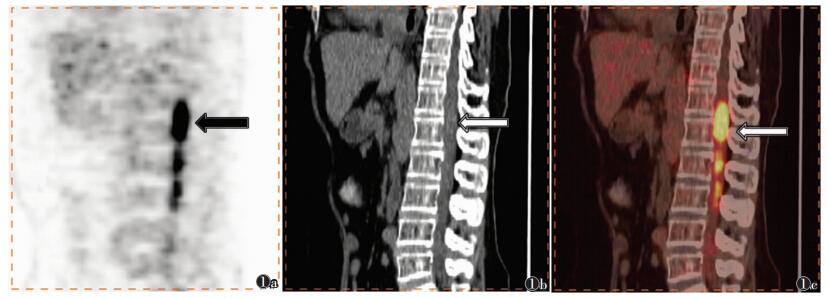 |
| 图 1 女,53岁,胸腰段椎管内弥漫大B细胞淋巴瘤 图 1a PET显像示T12~L3段椎管内条形放射性摄取异常增高灶(箭头),SUVmax=12.5 图 1b 同机CT上椎管内混杂密度影(箭头) 图 1c PET-CT融合图像显示病灶活性摄取范围及形态(箭头) |
| 表 1 SUVmax>2.5标准诊断椎管良恶性病变与病理及随访对照结果 |
 |
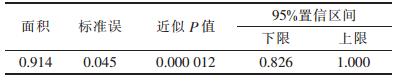
利用ROC曲线确定18F-FDG PET-CT诊断椎管内恶性病变SUVmax的最佳诊断阈值为2.95。ROC曲线下面积为0.914,即诊断椎管内恶性病变准确率为91.4%(表 2,图 2)。SUVmax>2.95标准时PET-CT诊断椎管内恶性病变的敏感度100.00%、特异度60.00%、阳性预测值81.25%、阴性预测值100.00%。
| 表 2 SUVmax值的ROC曲线假设检验结果 |
 |
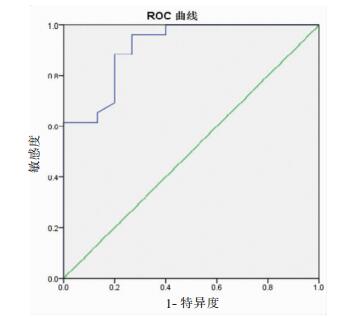 |
| 图 2 利用18F-FDG PET-CT诊断椎管内病变良恶性,ROC曲线下面积为0.914 |
3 讨论
椎管内肿瘤包含发生在椎管内各组织,如脊髓、被膜、神经根、邻近组织的肿瘤及转移性肿瘤。北美国家统计椎管内肿瘤发病率为0.97/10万人[1]。研究[2-3]发现,椎管内神经鞘瘤、室管膜瘤和脊膜瘤多见。PET能准确反映椎管内病变代谢改变情况,MSCT能清晰显示椎管内病变大小,以及与脊髓、硬膜囊、周边骨质关系。但目前,PET-CT诊断椎管内病变的报道较少。
本研究椎管内良性病变15例中,7例随访6个月以上,临床诊断良性病变,SUVmax=1.50±0.65。另8例为肿瘤性病变,3例神经鞘瘤和5例室管膜瘤。
神经鞘瘤起源于神经鞘膜施万细胞,可发生于椎管各段,以胸段多见[4]。CT上多为类圆形软组织密度影,其中1例向椎间孔生长呈哑铃状改变,MRI上T1呈等信号,T2呈低于脑脊液的高信号,增强扫描明显强化[5]。PET-CT上病灶呈不同程度高摄取,本研究中SUVmax=4.73±1.46。有学者[6]研究发现神经鞘瘤延迟显像SUVmax升高。
室管膜瘤起源于中央管室管膜上皮细胞,病灶呈膨胀性生长,常与正常脊髓神经纤维粘连。好发颈段椎管,MRI呈等信号,病变段脊髓增粗,位于髓内中央部多见,MRI增强扫描呈中度不均匀强化,两端可出现脊髓空洞[7]。18F-FDG PET-CT呈摄取增高表现[8]。本研究中室管膜瘤SUVmax=3.62±1.41。其中1例黏液乳头型室管膜瘤是室管膜瘤的一种亚型(WHO Ⅰ级),好发腰骶椎管[9]。CT示病灶密度与脊髓相近,平扫不易分清。病理组织学上肿瘤细胞呈乳头状排列,围绕乳头状结构的结缔组织常有黏液样变,且常可见自发性出血,肿瘤可沿终丝进入神经孔向脊髓外及硬膜外生长,常导致邻近椎间孔扩张。本例病变发生T12~L3段椎管内,病灶呈条形,密度均匀,SUVmax=5.9。
椎管内转移瘤临床少见,占椎骨肿瘤5%以下,多发于硬膜外[10]。超半数的转移瘤来自肺部、乳腺、前列腺[1]。本研究19例转移瘤的原发肿瘤分别为肺癌6例,不明原发灶4例,甲状腺癌2例,骨肿瘤1例,乳腺癌、肾癌、贲门癌、骨髓瘤、尤文氏瘤及肝癌各1例,其中肺癌转移居首位(占31.58%)。PET-CT上转移瘤病灶呈不同程度高摄取,SUVmax=7.25±3.22。椎管内转移途径包含3种情况:①血行转移,脊髓动脉来源于椎动脉及节段动脉性动脉,脊髓动脉分支形成交通网,肿瘤细胞经过交通网进入脊髓动脉,为最常见转移途径;椎静脉转移,由于静脉管径较粗、压力低、无静脉瓣,胸腹腔压力增高时,肿瘤细胞可进入脊髓内。②软脊膜转移途径,肿瘤种植软脊膜后通过血管间隙进入脊髓。③病灶直接侵犯,通过邻近组织直接侵犯至椎管内[12-13]。临床早期多无症状,多出现神经根性疼痛就诊,常合并其他脏器转移。18F-FDG PET-CT显像可有效反映原发病灶与椎管内转移病变体积、代谢水平,为临床分期及放疗靶区勾画提供准确指导。
椎管内淋巴瘤为少见的节外器官淋巴瘤,病理多见非霍奇金淋巴瘤,常见B细胞来源[14];好发于胸段椎管,髓外多见,病变多包裹硬膜囊,沿椎管长轴生长[15-16]。本研究中7例淋巴瘤均为继发淋巴瘤,SUVmax=16.47±8.74。病理示5例为弥漫大B细胞淋巴瘤,1例T细胞淋巴瘤;1例为淋巴激酶阴性渐变性大细胞淋巴瘤。18F-FDG PET-CT对椎管内淋巴瘤的诊断及疗效评估价值已得到广泛认可,优于常规CT、MRI检查[17-18]。椎管内淋巴瘤多为软组织密度影,邻近骨质密度减低,与椎旁软病灶通过椎间孔相连接,呈哑铃状改变,椎体附件及邻近肋骨可出现虫蚀样改变;病灶代谢水平与原发部位一致,18F-FDG在淋巴瘤摄取率与肿瘤细胞增殖呈正相关性。
SUVmax作为评价病变良恶性的半定量指标,具有较好的可重复性和一致性,但其易受多种因素影响。本研究中椎管内良性肿瘤呈高摄取,神经鞘瘤可能原因为外周神经中施万细胞轴索复极时具有潜在转运葡萄糖能力[19];室管膜瘤可能原因为肿瘤细胞糖酵解水平较正常组织升高。
综上所述,PET-CT鉴别椎管内病变良恶性时以SUVmax>2.95作为最佳阈值,所得到的特异度、阳性预测值较高。
| [1] |
Duong LM, Mccarthy BJ, Mclendon RE, et al. Descriptive epidemiology of malignant and nonmalignant primary spinal cord, spinal meninges, and cauda equina tumors, United States, 2004-2007[J]. Cancer, 2012, 118: 4220-4227. DOI:10.1002/cncr.27390 |
| [2] |
李德志, 孔德生, 郝淑煜, 等. 2447例椎管内肿瘤的流行病学特点[J]. 中华神经外科杂志, 2014, 30(7): 653-657. |
| [3] |
邹飞, 管韵致, 王洪立, 等. 椎管内髓外硬膜下肿瘤的临床特点及病理学构成——167例病例分析[J]. 中国脊柱脊髓杂志, 2014, 24(11): 991-994. DOI:10.3969/j.issn.1004-406X.2014.11.06 |
| [4] |
Merker VL, Esparza S, Smith MJ, et al. Clinical features of schwannomatosis:a retrospective analysis of 87 patients[J]. Oncologist, 2012, 17: 1317-1322. DOI:10.1634/theoncologist.2012-0162 |
| [5] |
汤永祥, 张金平, 王成道. 椎管内神经鞘瘤的MRI诊断[J]. 肿瘤影像学, 2001, 10(4): 254-256. |
| [6] |
Hamada K, Ueda T, Higuchi I, et al. Peripheral nerve schwannoma:two cases exhibiting increased FDG uptake in early and delayed PET imaging[J]. Skeletal Radiol, 2005, 34: 52-57. DOI:10.1007/s00256-004-0845-z |
| [7] |
崔晓, 李连翔, 呼虹宇, 等. 脊髓内室管膜瘤影像学表现及临床病理研究[J]. 陕西医学杂志, 2017, 46(2): 188-189. |
| [8] |
李德鹏, 李坤成, 马云川, 等. 胶质瘤的18F-FDG PET影像分析[J]. 中国医学影像技术, 2006, 22(6): 941-944. |
| [9] |
阎晓玲. 黏液乳头型室管膜瘤[J]. 中国现代神经疾病杂志, 2017, 17(3): 222. |
| [10] |
Byrne TN, Borges LF, Loeffler JS. Metastatic epidural spinal cord compression:update on management[J]. Semin Oncol, 2006, 33: 307-311. DOI:10.1053/j.seminoncol.2006.03.002 |
| [11] |
梁峰, 王明杰, 陈淑艳, 等. 脊髓髓内型及髓外硬膜下型转移瘤的MRI诊断分析[J]. 实用放射学杂志, 2016, 32(7): 1152-1154. |
| [12] |
Yang KH, Lee HR, Yi SY, et al. Intramedullary spinal cord metastasis from rectal cancer[J]. Ann Coloproctol, 2014, 30: 237-240. DOI:10.3393/ac.2014.30.5.237 |
| [13] |
Rykken JB, Diehn FE, Hunt CH, et al. Intramedullary spinal cord metastases:MRI and relevant clinical features from a 13-year institutional case series[J]. AJNR Am J Neuroradiol, 2013, 34: 2043-2049. DOI:10.3174/ajnr.A3526 |
| [14] |
Sachdev RK, Sen A, Pathak A, et al. Primary extradural non-hodgkin's lymphoma[J]. Indian J Nucl Med, 2012, 247: 185-186. |
| [15] |
张华文, 敦旺欢, 李敏. 原发性椎管内淋巴瘤的MRI诊断(附8例报告)[J]. 现代肿瘤医学, 2013, 21(8): 1852-1854. |
| [16] |
易自生, 刘一平, 谢京. 原发性椎管内硬膜外占位性病变的MRI表现[J]. 中国中西医结合影像学杂志, 2016, 14(5): 570-572. |
| [17] |
王全师, 吴湖炳, 王明芳, 等. 18F-FDG显像对淋巴瘤分期及疗效评价的价值[J]. 中华核医学与分子影像杂志, 2004, 24(1): 8-10. |
| [18] |
陈伟华, 冷吉艳. 18F-FDG PET-CT显像对恶性淋巴瘤诊断和分期中的临床应用价值[J]. 中国实验诊断学, 2010, 14(5): 682-684. |
| [19] |
Ahmed AR, Watanabe H, Aoki J, et al. Schwannoma of the extremities:the role of PET in preoperative planning[J]. Eur J Nucl Med, 2001, 28: 1541-1551. DOI:10.1007/s002590100584 |
 2018, Vol. 16
2018, Vol. 16

 ,
潘博,
倪明,
刘昕,
张依凡,
谢强,
谢吉奎,
汪世存
,
潘博,
倪明,
刘昕,
张依凡,
谢强,
谢吉奎,
汪世存