| CT诊断常见卵巢良恶性病变的准确度 |
2. 山东中医药大学附属医院,山东 济南 250011;
3. 山东大学齐鲁医院放射科,山东 济南 250012
卵巢肿瘤根据来源分为上皮性肿瘤、生殖细胞肿瘤、性索间质肿瘤和转移瘤。卵巢癌占妇科恶性肿瘤的23%[1],居妇科恶性肿瘤的第3位[2],居女性恶性肿瘤死亡原因的第5位[3]。由于症状隐匿,初诊时,2/3的卵巢癌为Ⅲ或Ⅳ期[4],5年生存率仅为42.9%[5]。随着年龄和分期的增加,卵巢癌的发病率和死亡率增加,5年存活率为45%[6]。大多卵巢癌诊断时已发生远处或广泛转移,因此早期、正确诊断尤为重要。临床检查和CA125水平检出卵巢癌的敏感性低于50%。超声检出卵巢癌敏感,但特异性相对较低,导致许多良性病变行不必要的外科手术。CT可获取薄层图像,行图像后处理,为卵巢肿瘤的定性及指导外科治疗提供重要信息[7]。本文旨在分析CT诊断良恶性卵巢病变的准确度。
1 资料与方法 1.1 一般资料回顾性分析山东大学齐鲁医院和山东省肿瘤医院2014年9月至2018年2月收治的232例经组织病理学证实为卵巢肿瘤及肿瘤样病变患者的CT图像,年龄9~82岁,平均(53.41±13.7)岁。恶性病变162例,包括浆液性囊腺癌133例(12例观察到乳头状结构),黏液性囊腺癌7例,黏液、浆液混合性腺癌1例,透明细胞腺癌6例,子宫内膜样癌4例,粒层细胞瘤2例,癌肉瘤2例,淋巴瘤2例,卵巢卵黄囊瘤1例,小细胞癌1例,移行细胞癌1例,恶性苗勒氏管肿瘤1例,恶性畸胎瘤1例。良性病变70例,包括浆液性囊腺瘤13例(2例观察到乳头状结构),黏液囊腺瘤16例,Brenner瘤2例,Brenner瘤伴黏液性囊腺瘤1例,纤维瘤3例,纤维卵泡膜细胞瘤14例,畸胎瘤19例,卵巢甲状腺肿2例。
1.2 仪器与方法采用Philips Brilliance 256层CT扫描仪,扫描范围从膈肌到耻骨联合,120 kV,200 mAs,层厚、层距均为5 mm。采用高压注射器经肘静脉注射优维显(300 mgI/mL)90 mL,流率3.0 mL/s。注射对比剂后30、70 s行动脉期、静脉期扫描。
1.3 图像分析由观察者A(9年工作经验)、B(15年工作经验)分别独立阅读CT图像,得出各自诊断结论。病变定位依据:病变位于子宫侧方,与子宫圆韧带关系密切或卵巢血管进入病变,从而确定来源于卵巢。CT判断良恶性病变的参考标准:良性病变多为单侧发病,较小,形态规则,表面光滑,以囊性密度为主,囊壁及分隔薄、厚薄均匀,常无腹、盆腔积液及腹膜结节,无远处转移。恶性病变多为双侧发病,较大,形态不规则,边界模糊,以囊实性或实性为主,囊壁或分隔厚薄不均,多有壁结节,多伴腹、盆腔积液、腹膜结节及远处转移等。良恶性判断还应结合患者年龄、临床症状及肿瘤标志物水平。
1.4 统计学方法数据分析使用SPSS 19.0统计软件。计算分类变量(良性和恶性)的频率和百分比、连续变量(年龄)的平均值和标准差;计算敏感度、特异度、95%可信区间(CI)、阳性预测值、阴性预测值和准确度;使用Kappa分析计算观察者之间的一致性,以及CT诊断与病理学结果的一致性。
2 结果组织病理学证实232例中,162例(69.8%)恶性,70例(30.2%)良性。观察者A诊断158例(68.1%)恶性,74例(31.9%)良性。观察者B诊断160例(69.0%)恶性,72例(31.0%)良性。
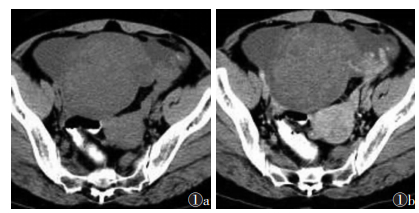
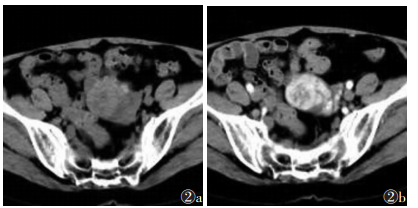
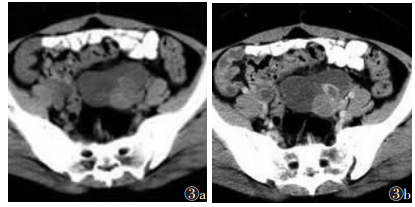
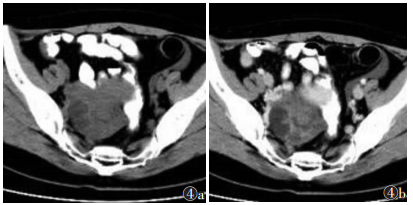
观察者A诊断结果为:真阳性149例,假阳性9例,真阴性61例和假阴性13例。观察者B诊断结果为:真阳性153例,假阳性7例,真阴性63例和假阴性9例。观察者A诊断假阳性9例,其中4例纤维瘤(图 1)或纤维卵泡膜细胞瘤、3例浆液或黏液性囊腺瘤、1例卵巢甲状腺肿(图 2)及1例子宫内膜异位囊肿(图 3)诊断为恶性肿瘤。其中7例被观察者B诊断为恶性肿瘤。观察者A诊断假阴性13例,术后病理证实为恶性肿瘤,其中8例为浆液性囊腺癌,1例黏液性囊腺癌,1例透明细胞癌,1例小细胞癌,2例分化差的粒层细胞瘤。其中9例被观察者诊断为良性肿瘤(图 4)。观察者A和B的CT诊断的敏感度、特异度、阳性预测值、阴性预测值和诊断准确度见表 1。观察者间CT诊断的一致性为优(K=0.933)。对于2位观察者,CT与组织病理学间的K值分别为0.779和0.838。
| 表 1 观察者A和B的CT诊断敏感度、特异度、阳性预测值、阴性预测值和准确度(%) |
 |
3 讨论
卵巢恶性肿瘤临床症状出现晚,且无特异性,多数患者因腹部肿块或腹痛超声检查发现[8-9]。确定卵巢肿瘤的良恶性有利于制订治疗方案,诊断主要基于实验室检查和影像检查[10-11]。CT能够检出病变,鉴别良恶性,评估病变范围和有无转移。文献[12]报道CT鉴别卵巢肿块的敏感度和特异度为81.0%和87.0%;鉴别附件肿块良恶性的敏感度和特异度达90.5%和93.7%[12]。本研究中,观察者A采用CT诊断的敏感度和特异度分别为92.0%和87.1%,观察者B为94.4%和90.0%。CT与组织病理学间的一致性及2位观察者间CT诊断的一致性为优。
CT成像速度快,能够同时评估附件和腹部,显示附件肿块特征的能力大大提高。各向同性的图像能够获取高分辨的多平面和3D重组图像,帮助病变定位,直观显示病变与周围结构的关系。薄层和高的分辨力能够显示肿块内部的细节和特征,从而准确鉴别良恶性病变。CT能够发现腹水、腹膜侵犯和淋巴结转移,增加了诊断恶性病变的依据[13],对病变分期及制订手术方案起重要作用。本研究中良性病变多为囊性,囊壁或间隔薄,较均匀,少见壁结节,增强扫描病变强化不明显或仅囊壁及间隔强化。而恶性病变形态不规则,多以囊实性或实性为主,密度不均匀,见不规则壁结节或突起,增强扫描多明显不均匀强化,可见腹盆腔积液、腹膜种植及其他远处转移表现。病变较大时,与周围结构分界不清,仅靠物理位置,难以正确判断病变来源,增强扫描薄层及MPR图像显示卵巢动静脉增粗并进入病变,从而确定为卵巢来源,对合并扭转病变的定位尤其有价值,本研究2位观察者通过此种方法正确定位病变。
卵巢肿块分类复杂,CT表现多样。然而,一些肿瘤具有特定的影像特征,熟练掌握这些特征有助于作出诊断:①成熟囊性畸胎瘤可见脂肪、钙化、漂浮的毛发及脂肪液平。②纤维瘤多为实性,平扫密度略低,增强扫描呈轻度缓慢强化。③浆液性囊腺瘤多为单房;而浆液性囊腺癌多为双侧、多房,病变相对较小,可见实性成分,沙砾体样钙化及腹膜种植多见。④黏液性囊腺瘤多为囊性,病变较大、多房;而黏液性囊腺癌表现为大的多发囊性肿块,类似彩色玻璃样。本研究中,观察者A和观察者B的诊断准确度分别为90.5%和93.1%,与文献[12, 14]报道一致。观察者A诊断假阳性9例,假阴性13例。观察者B诊断假阳性7例,假阴性9例。导致假阳性诊断的原因包括:病变较大;成分复杂、密度不均;出现腹、盆腔积液。假阴性诊断的原因包括:病变较小,6例直径<4 cm,诊断为良性;病变以囊性为主或表现为单纯性囊肿,仅内部分隔;未充分结合临床信息,低估其他伴随影像表现的诊断价值,如病变内部小的壁结节、内部分隔不光滑,有强化、腹膜结节、淋巴结略大及少量腹盆腔积液等。
本研究分析了观察者间的一致性,而以往研究[11, 15]未分析。本研究的不足:为回顾性研究,存在选择偏倚;仅分析CT的诊断准确度和价值,未与MRI进行比较研究;由2位观察者评估图像,难以代表放射科医师的总体诊断水准。
| [1] |
Woodward PJ, Hosseinzadeh K, Saenger JS. Radiologic staging of ovarian carcinoma with pathologic correlation[J]. Radiographics, 2004, 24: 225-246. DOI:10.1148/rg.241035178 |
| [2] |
Tanwani AK. Prevalence and pattern of ovarian lesions[J]. Ann Pak Inst Med Sci, 2005, 1: 211-214. |
| [3] |
张京顺, 徐影, 郑连文. 卵巢癌耐药机制的研究进展[J]. 中国妇幼保健, 2018, 33(2): 474-478. |
| [4] |
袁航, 张玉敏, 黄文倩, 等. 美国妇科肿瘤学会和临床肿瘤学会"2016初诊晚期卵巢癌新辅助化疗临床实践指南"解读[J]. 中国实用妇科与产科杂志, 2016, 32(9): 860-863. |
| [5] |
刘洋, 侯友芳, 张捷. 微小RNA与卵巢癌关系的研究进展[J]. 重庆医学, 2016, 45(10): 1407-1409. DOI:10.3969/j.issn.1671-8348.2016.10.040 |
| [6] |
刘剑羽, 周延. MRI在女性生殖系统恶性肿瘤诊断、分期和疗效评价中的价值[J]. 中华放射学杂志, 2015, 49(5): 323-327. |
| [7] |
秦全波, 宋涛, 王保茎. CT和磁共振成像在卵巢肿瘤定性分期侵袭和转移中临床诊断价值的对比分析[J]. 实用医学影像杂志, 2017, 18(3): 202-204. |
| [8] |
施敏敏, 刘碧英, 戚婉. 多b值DWI和DCE-MRI联合应用在卵巢肿瘤诊断中的价值初探[J]. 中国中西医结合影像学杂志, 2018, 16(2): 140-144. DOI:10.3969/j.issn.1672-0512.2018.02.011 |
| [9] |
王海燕. 30例卵巢肿瘤的超声诊断及图像分析[J]. 中国中西医结合影像学杂志, 2016, 14(3): 353-354. DOI:10.3969/j.issn.1672-0512.2016.03.044 |
| [10] |
Parkin DM, Bray F, Ferlay J, et al. Global cancer statistics, 2002[J]. CA Cancer J Clin, 2005, 55: 74-108. DOI:10.3322/canjclin.55.2.74 |
| [11] |
Tsili AC, Tsampoulas C, Argyropoulou M, et al. Comparative ev-aluation of multidetector CT and MR imaging in the differenti-ation of adnexal masses[J]. Eur Radiol, 2008, 18: 1049-1057. DOI:10.1007/s00330-007-0842-4 |
| [12] |
Kinkel K, Lu Y, Mehdizade A, et al. Indeterminate ovarian mass at ultrasound:incremental value of second imaging test for cha-racterization-meta analysis and Bayesian analysis[J]. Radiology, 2005, 236: 85-94. DOI:10.1148/radiol.2361041618 |
| [13] |
甘晓晶, 周永, 文智. CT表现与肿瘤标志物水平及术后病理对卵巢癌复发的影响[J]. 中国医学影像学杂志, 2016, 24(2): 133-137. DOI:10.3969/j.issn.1005-5185.2016.02.013 |
| [14] |
Gatreh-Samani F, Tarzamni MK, Olad-Sahebmadarek E, et al. Ac-curacy of 64-multidetector computed tomography in diagnosis of adnexal tumors[J]. J Ovarian Res, 2011, 4: 15. DOI:10.1186/1757-2215-4-15 |
| [15] |
Adel El-Badrawy, Eman O, Ashraf K, et al. 64 multidetector CT with multiplanar reformation in evaluation of bilateral ovarian masses[J]. Egypt J Radiol Nucl Med, 2012, 43: 285-291. DOI:10.1016/j.ejrnm.2012.01.002 |
 2018, Vol. 16
2018, Vol. 16