| 多种ADC值预测直肠腺癌区域淋巴结转移的价值 |
2. 江苏省徐州市第一人民医院/徐州医科大学附属徐州市立医院,江苏 徐州 221002
结直肠癌是常见的恶性肿瘤之一,预计至2030年全球将有220万新增病例和110万死亡病例[1]。在我国结直肠癌发病率及死亡率分别居恶性肿瘤的第2位、第5位,总病例数居世界第1位,其中直肠癌占结直肠癌半数以上[2]。直肠癌区域淋巴结分期可指导患者术前治疗方案的选择、预后评估及疗效评价[3]。目前,转移及非转移淋巴结影像学特征重叠较多,影像学分辨能力存在局限性,术前区域淋巴结分期准确率存在较大差异[4]。Yang等[5]发现肿瘤原发灶特征与淋巴结分期之间存在相关性,可利用肿瘤原发灶特征预测淋巴结转移情况。Curvo-Semedo等[6]发现ADC值具有成为肿瘤侵袭性标志物的潜力,其与淋巴结转移具有显著相关性,随着淋巴结分期的增加,ADC值呈降低的趋势。最新研究显示,影像组学[7]、特异性淋巴结对比剂[8]的应用可提高对淋巴结转移的预测价值,但多为科研阶段,且预测区域淋巴结转移的价值差异性仍较大。DWI是MRI最常用的功能序列,可得到定量参数ADC。本研究探讨多种最易获得的ADC值预测直肠癌区域淋巴结转移的价值。
1 资料与方法 1.1 一般资料选取徐州市第一人民医院2018年1月至2022年4月收治的50例直肠癌患者,其中男30例,女20例;年龄40~83岁,中位年龄66岁。根据美国癌症联合委员会(AJCC)/国际抗癌联盟(UICC)结直肠癌TNM分期系统(2017年第8版)分期标准[9]:50例患者中,N0期27例,N1期19例,N2期4例。根据病理分期,分为转移淋巴结组27例,非转移淋巴结组23例。
1.2 纳入及排除标准① 纳入标准:术前2周行盆腔MRI检查及直肠癌手术,术后病理为直肠腺癌,术后淋巴结病理分期明确。②排除标准:术前已行相关治疗,如放疗、化疗和/或局部切除等;术后病理为非直肠腺癌,淋巴结转移分期无法明确,图像质量差或直肠癌病灶较小、无法测量。
1.3 仪器与方法采用Philips Ingenia 3.0 T MRI扫描仪及16通道相控阵体部线圈。患者检查前行肠道准备,取仰卧位,足先进,适当充盈膀胱。扫描范围从髂前上棘至耻骨联合下缘。
扫描序列与参数:轴位T1WI,TR 669 ms,TE 10 ms,层厚4 mm,层距1 mm,视野38 cm×38 cm,矩阵768×768;轴位T2WI,TR 4 804 ms,TE 1 000 ms,层厚4 mm,层距1 mm,视野38 cm×38 cm,矩阵560×560;轴位T2WI STIR,TR 4 975 ms,TE 100 ms,层厚4 mm,层距1 mm,视野38 cm×38 cm,矩阵640×640;矢状位T2WI,TR 3 643 ms,TE 80 ms,层厚3 mm,层距1 mm,视野24 cm×24 cm,矩阵576×576;冠状位T2WI,TR 2 813 ms,TE 80 ms,层厚4 mm,层距1 mm,视野38 cm×38 cm,矩阵1 008×1 008。DWI序列,TR 3 589 ms,TE 80 ms,b=1 000 s/mm2。层厚4 mm,层距1 mm,视野31 cm×31 cm,矩阵512×512。
1.4 图像处理分析将MRI图像传至Philips后处理工作站,由2名医师分别进行测量、分析及处理。参照T1WI、T2WI及DWI图像,在b=1 000 s/m2图像上采用肿瘤轮廓勾画法,选实性成分最大层面及上下层面勾画ROI,尽量避开囊变、坏死区,得出最小ADC值(ADCmin)及平均ADC值(ADCmean),并计算2名医师测量的平均值;在同层面臀大肌层面勾画ROI(0.8~1.0 cm2),得出臀大肌平均ADC值(ADC肌),并计算平均值;计算相对最小ADC值(rADCmin,公式为rADCmin=ADCmin/ADC肌)及相对平均ADC值(rADCmean,公式为rADCmean=ADCmean/ADC肌)。
1.5 统计学处理应用SPSS 19.0软件进行数据分析。计量资料以x±s表示。2名医师所测参数的一致性分析采用组内相关系数(ICC)。ICC > 0.8,一致性好;0.6<ICC≤0.8,一致性中等;0.4<ICC≤0.6,一致性一般;ICC≤0.4,一致性差。计量资料行正态性分布Kolmogorov-Smirnov检验。符合正态分布的计量资料组间比较行独立样本t检验,不符合正态分布行非参数检验。采用ROC曲线评价单一ADC值对区域淋巴结转移的阈值及预测效能;采用logistic回归分析及ROC曲线评价2个及以上ADC值联合预测区域淋巴结转移的效能。检验水准α=0.05。以P<0.05为差异有统计学意义。
2 结果 2.1 2名医师测量参数的一致性2名医师测量ADCmin、ADCmean、ADC肌的ICC分别为0.953、0.898、0.923,可重复性好。
2.2 2组ADC值比较(表 1)| 表 1 直肠腺癌非转移淋巴结组与转移淋巴结组的ADC值比较 |
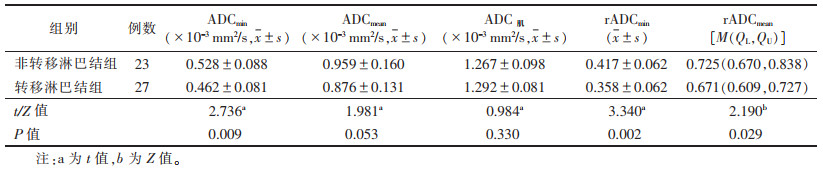 |
转移淋巴结组ADCmin、ADCmean、rADCmin、rADCmean值均较非转移淋巴结组小,其中ADCmin、rADCmin、rADCmean值差异均有统计学意义(均P<0.05),ADCmean、ADC肌值差异均无统计学意义(均P > 0.05)(图 1,2)。
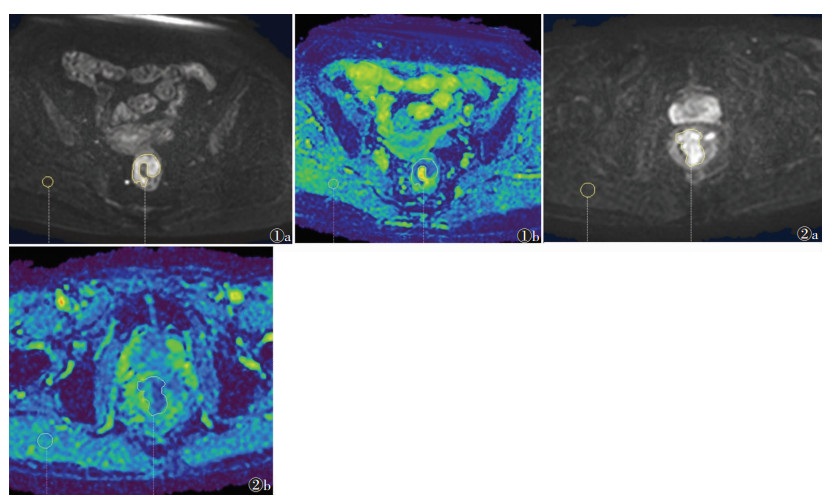 |
| 注:图 1患者,女,70岁,中段直肠腺癌,有区域淋巴结转移。图 1a为DWI序列,b=1 000 s/mm2,直肠壁不均匀增厚,呈高信号;图 1b为ADC图,直肠癌病灶ADCmin=0.360×10-3 mm2/s,ADCmean=1.150×10-3 mm2/s,ADC肌=1.430×10-3 mm2/s,rADCmin=0.250,rADCmean=0.800。图 2患者,男,72岁,下段直肠腺癌,无区域淋巴结转移。图 2a为DWI序列,b=1 000 s/mm2,直肠壁不均匀增厚,呈高信号;图 2b为ADC图,直肠癌病灶ADCmin=0.520×10-3 mm2/s,ADCmean=1.160×10-3 mm2/s,ADC肌=1.360×10-3 mm2/s,rADCmin=0.380,rADCmean=0.850 图 1~2 直肠腺癌伴/不伴淋巴结转移的DWI及ADC图像 |
2.3 ADC值对直肠癌区域淋巴结转移的预测效能(表 2)
| 表 2 单一ADC值及多种ADC值联合对直肠腺癌淋巴结转移的预测效能 |
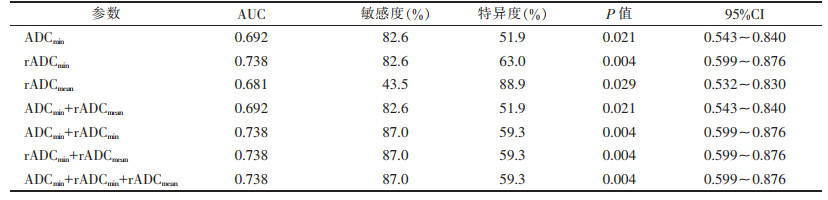 |
绘制ADCmin、rADCmin、rADCmean预测直肠癌区域淋巴结转移的ROC曲线,得出诊断转移淋巴结最佳界值分别为0.525×10-3 mm2/s、0.410、0.657,其AUC分别为0.692、0.738、0.681(图 3),敏感度为43.5%~82.6%,特异度为51.9%~88.9%。
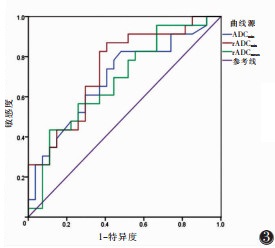 |
| 图 3 ADCmin、rADCmin、rADCmean分别预测区域转移淋巴结的ROC曲线 |
采用logistic回归分析及ROC曲线分析ADCmin、rADCmin、rADCmean联合对直肠癌淋巴结转移的预测效能,AUC为0.692~0.738(图 4),敏感度为82.6%~87.0%,特异度为51.9%~59.3%。
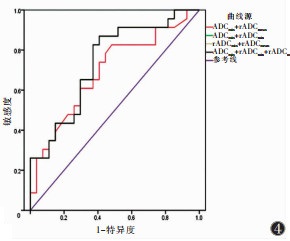 |
| 注:其中ADCmin+rADCmin、rADCmin+rADCmean、ADCmin+rADCmin+rADCmean预测区域转移淋巴结的ROC曲线(黑色)重叠。 图 4 ADCmin、rADCmin、rADCmean两两联合及三者联合预测区域转移淋巴结的ROC曲线 |
3 讨论 3.1 直肠癌区域淋巴结转移的诊断
区域淋巴结转移是直肠癌术前评估的重要部分,是直肠癌最重要的危险分层指标及预后危险因素之一,与治疗方案的选择、预后评估、疗效评价及患者生存率密切相关[10]。术前直肠癌区域淋巴结转移评估准确率较低,一项国家队列研究对1 888例早期直肠癌患者以不同分组进行研究,淋巴结分期准确率及特异度为70%~80%,敏感度仅为20%~30%[11]。直肠癌易伴发小淋巴结,Langman等[12]研究发现244例直肠癌患者(10 473枚淋巴结)中,转移淋巴结344枚,占3.3%,其中95枚直径≤3 mm。Akashi等[13]研究发现,28%的切除淋巴结直径<3 mm,其中11%直径<3 mm的淋巴结是转移淋巴结。目前,由于影像设备分辨力的限制,无法对小淋巴结直接评价。另外,较大淋巴结由于转移淋巴结、反应性淋巴结影像特征存在重叠,也会影响评估的准确率。Brouwer等[14]报道,以淋巴结直径 > 5 mm为阈值,诊断淋巴结转移的敏感度、特异度分别为81%、68%,准确率仅为58%。术前准确评估转移淋巴结、反应性淋巴结及小淋巴结存在一定困难,通过淋巴结大小、形态、边缘及信号等特点评估较难保证诊断的稳定性与准确率[14-16]。本研究避开直接评估淋巴结状态的难点,探讨基于直肠癌原发灶多种ADC值对区域淋巴结转移的预测价值。
3.2 ADCmin、ADCmean预测直肠癌区域淋巴结转移的价值本研究发现转移淋巴结组ADCmean、ADCmin值均小于无转移淋巴结组,可一定程度上反映肿瘤生物学行为;其中ADCmean在2组间差异无统计学意义,无法预测区域淋巴结转移;ADCmin在2组间差异有统计学意义,可预测区域淋巴结转移,但诊断效能呈低等。Sun等[17]报道ADCmean在转移和非转移淋巴结组间差异无统计学意义,ADCmean随着淋巴结分期的增加而下降,与本研究结果相似;且ADCmean与淋巴结分期存在相关性,ADCmean值可作为预测良恶性淋巴结的手段,但整体预测可靠性偏低。Curvo-Semedo等[6]发现肿瘤原发灶ADCmean值在转移和非转移淋巴结组间差异有统计学意义,转移淋巴结组原发灶ADCmean值更低,但未进一步分析ADCmean值预测区域淋巴结转移的价值。
直肠癌具有恶性肿瘤的特点,表现为组织增生活跃、细胞密度增高、细胞核高度异性,细胞外间隙变小,水分子弥散受限,DWI呈高信号,ADC值较低。另外,肿瘤恶性程度越高越易发生淋巴结转移[18-19],即通常情况下,伴淋巴结转移的直肠癌恶性程度更高,ADC值更低。
ADCmin是ADC值中最可靠、最准确的参数,具有良好的可重复性,受ROI勾画方式影响最小,主要反映肿瘤内细胞最密集区的ADC值,ADCmin比ADCmean具有更高的诊断价值[17],更能反映肿瘤的特征。本研究发现,ADCmin具有较好的诊断效能,且在2名医师间具有更高的一致性。Yuan等[20]的报道与本研究相似,直肠癌原发灶ADCmin在转移和非淋巴结转移组差异有统计学意义,预测区域淋巴结转移的诊断效能均较低;且ACDmin是预测淋巴结分期独立危险因素,可评估T分期、壁外血管侵犯等。Kim等[21]也发现ADCmin较ADCmean能够更好地反映肿瘤细胞结构紧密程度及分化情况。
另外,也有报道不同淋巴结分期的肿瘤原发灶ADC值并无差异[22]。笔者认为不同研究结果的差别,主要是由于ADC值会受到样本量大小、ROC的勾画、患者年龄、肿瘤病理分型、T分期、肿瘤标志物不同等影响。其中值得重视的是Cai等[23]发现部分直肠癌中存在丰富的间质,含有较少数量的细胞且组织密度较低,此类直肠癌淋巴结转移发生率较高,ADCmean显著升高,这与通常所认为的ADC值随肿瘤淋巴结分期增加而降低不同。本研究排除了黏液腺癌等含间质较多的直肠癌,以尽量减少对研究结果的影响。
3.3 rADCmin、rADCmean及多种ADC值联合预测直肠癌区域淋巴结转移的价值rADC通常为病灶ADC值与ADC参考值的比值。人体组织内水分子运动复杂,易受到多种因素的影响,除了肿瘤本身的情况外,还受细胞内外水的黏滞度、细胞膜的通透性及个体温度的影响,rADC可降低个体差异对ADC值的影响,具有更高的稳定性。
rADC值最近研究较多,主要集中在乳腺、肾脏、颅内肿瘤及脑梗死等方面。Yilmaz等[24]报道rADC值对良恶性乳腺肿块具有鉴别价值,但敏感度、特异度较ADC值略低。Yu等[25]报道,rADCmin、rADCmean是常规影像学的重要补充,可对侧脑室内中枢神经细胞瘤、室管膜瘤、脑膜瘤及高级别胶质瘤进行鉴别,部分诊断效能达良好、优秀等级;另外,rADC值与肿瘤组织病理情况、肿瘤进展有关,在肿瘤分级中有重要帮助。但是,rADC值在直肠癌原发灶预测区域淋巴结转移方面的应用较少。李燕等[26]在直肠黏液腺癌、非黏液腺癌研究中发现,ADC值的诊断价值略高于rADC值,与本研究结果相似。本研究直肠癌原发灶的rADCmin、rADCmean可预测区域淋巴结转移,与ADCmin诊断效能比较,rADCmin诊断效能稍提高,为低中等,rADCmean诊断效能相差不大,仍为低等;进一步研究发现ADCmin、rADCmin及rADCmean 3个参数两两联合及三者联合,诊断区域淋巴结的效能并未明显提高,仍为低中等。原因可能为本研究参数均为ADC值,较为单一、同质性明显,以及ADC值是由单指数模型得出的指标,易受毛细血管微灌注的干扰,无法完全准确地反映组织内水分子扩散。
本研究存在的不足之处:①为回顾性分析,未纳入术前行放疗、化疗的患者,以及病理类型为黏液腺癌、印戒细胞癌等的患者,可能使研究结果存在偏差;②例数较少,N2期仅4例,可能造成淋巴结转移组的特性更倾向N1期,需扩大大样本进一步提高研究的准确率;③未将肿瘤形态、病理类型、T分期、周围血管淋巴结管侵犯、直肠固有筋膜状态、肿瘤标志物等纳入研究因素,可能对结果存在一定影响;④仅对ADC值进行研究,ADCmean、ADCmin、rADCmean、rADCmin值具有同源性,在联合ADC值行ROC曲线分析时,部分值联合诊断效能无变化,需进一步联合其他非同源特征,如肿瘤病理、T分期等进行分析。
综上所述,直肠腺癌原发灶ADCmin、rADCmean、rADCmin值对区域淋巴结转移具有一定预测价值,应用单一ADC值及多种ADC值联合的诊断效能相似,均为低中等。
| [1] |
SUN W, AL-RAJABI R, PEREZ R O, et al. Controversies in rectal cancer treatment and management[J]. Am Soc Clin Oncol Educ Book, 2020, 40: 1-11. |
| [2] |
FENG R M, ZONG Y N, CAO S M, et al. Current cancer situation in China: good or bad news from the 2018 Global Cancer Statistics[J]. Cancer Commun (Lond), 2019, 39(1): 22. DOI:10.1186/s40880-019-0368-6 |
| [3] |
BEETS-TAN R G, LETTINGA T, BEETS G L. Pre-operative imaging of rectal cancer and its impact on surgical performance and treatment outcome[J]. Eur J Surg Oncol, 2005, 31(6): 681688. |
| [4] |
CURVO-SEMEDO L. Rectal cancer: staging[J]. Magn Reson Imaging Clin N Am, 2020, 28(1): 105-115. DOI:10.1016/j.mric.2019.09.003 |
| [5] |
YANG L, LIU D, FANG X, et al. Rectal cancer: can T2WI histogram of the primary tumor help predict the existence of lymph node metastasis[J]. Eur Radiol, 2019, 29(12): 6469-6476. DOI:10.1007/s00330-019-06328-z |
| [6] |
CURVO-SEMEDO L, LAMBREGTS D M, MAAS M, et al. Diffusionweighted MRI in rectal cancer: apparent diffusion coefficient as a potential noninvasive marker of tumor aggressiveness[J]. J Magn Reson Imaging, 2012, 35(6): 1365-1371. DOI:10.1002/jmri.23589 |
| [7] |
李盼盼, 贾玉萍, 吴瑞, 等. 基于多参数MRI影像组学模型预测直肠腺瘤癌变的研究[J/CD]. 中华消化病与影像杂志(电子版), 2021, 11(3): 111-116.
|
| [8] |
HEIJNEN L A, LAMBREGTS D M, MARTENS M H, et al. Performance of gadofosveset-enhanced MRI for staging rectal cancer nodes: can the initial promising results be reproduced?[J]. Eur Radiol, 2014, 24(2): 371-379. DOI:10.1007/s00330-013-3016-6 |
| [9] |
HODA S A. AJCC cancer staging manual, 8th edition[J]. Adv Anat Pathol, 2017, 24(2): 112. DOI:10.1097/PAP.0000000000000137 |
| [10] |
OGAWA S, HIDA J I, IKE H, et al. Prediction of lateral pelvic lymph node metastasis from lower rectal cancer using magnetic resonance imaging and risk factors for metastasis: multicenter study of the lymph node committee of the Japanese society for cancer of the colon and rectum[J]. Int J Colorectal Dis, 2017, 32(10): 1479-1487. DOI:10.1007/s00384-017-2874-9 |
| [11] |
ROSEN R, NILSSON E, RAHMAN M, et al. Accuracy of MRI in early rectal cancer: national cohort study[J]. Br J Surg, 2022, 109(7): 570-572. DOI:10.1093/bjs/znac059 |
| [12] |
LANGMAN G, PATEL A, BOWLEY D M. Size and distribution of lymph nodes in rectal cancer resection specimens[J]. Dis Colon Rectum, 2015, 58(4): 406-414. DOI:10.1097/DCR.0000000000000321 |
| [13] |
AKASHI M, NAKAHUSA Y, YAKABE T, et al. Assessment of aggressiveness of rectal cancer using 3-T MRI: correlation between the apparent diffusion coefficient as a potential imaging biomarker and histologic prognostic factors[J]. Acta Radiol, 2014, 55(5): 524-531. DOI:10.1177/0284185113503154 |
| [14] |
BROUWER N P M, STIJNS R C H, LEMMENS V E P P, et al. Clinical lymph node staging in colorectal cancer; a flip of the coin?[J]. Eur J Surg Oncol, 2018, 44(8): 1241-1246. DOI:10.1016/j.ejso.2018.04.008 |
| [15] |
伏红超, 冯赟, 赵宾飞, 等. MRI超薄斜轴位结合DWI对直肠癌系膜内淋巴结转移的诊断价值[J]. 中国中西医结合影像学杂志, 2020, 18(4): 396-398. |
| [16] |
谭春燕, 杨松华, 罗涛, 等. 直肠癌术前原发灶及淋巴结的MRI特征对壁外血管侵犯的补充诊断价值[J]. 中国中西医结合影像学杂志, 2020, 18(6): 544-547. DOI:10.3969/j.issn.1672-0512.2020.06.002 |
| [17] |
SUN Y, TONG T, CAI S, et al. Apparent diffusion coefficient (ADC) value: a potential imaging biomarker that reflects the biological features of rectal cancer[J]. PLoS One, 2014, 9(10): 109371. DOI:10.1371/journal.pone.0109371 |
| [18] |
任继鹏, 孟楠, 金兴兴, 等. 多模型体素不相干运动成像对直肠癌的诊断价值[J]. 中国中西医结合影像学杂志, 2019, 17(3): 248-251. DOI:10.3969/j.issn.1672-0512.2019.03.009 |
| [19] |
ZHANG W, JIN G Q, LIU J J, et al. Diagnostic performance of ADCs in different ROIs for breast lesions[J]. Int J Clin Exp Med, 2015, 8(8): 12096-12104. |
| [20] |
YUAN Y, CHEN X L, LI Z L, et al. The application of apparent diffusion coefficients derived from intratumoral and peritumoral zones for assessing pathologic prognostic factors in rectal cancer[J]. Eur Radiol, 2022, 32(8): 5106-5118. DOI:10.1007/s00330-022-08717-3 |
| [21] |
KIM H S, KIM S Y. A prospective study on the added value of pulsed arterial spin-labeling and apparent diffusion coefficients in the grading of gliomas[J]. AJNR Am J Neuroradiol, 2007, 28(9): 1693-1699. DOI:10.3174/ajnr.A0674 |
| [22] |
杨智钧, 尚乃舰, 张红霞. MR扩散加权成像及背景抑制扩散加权成像对直肠癌术前转移淋巴结的辅助诊断价值[J]. 临床放射学杂志, 2014, 33(5): 744-748. |
| [23] |
CAI C, HU T, GONG J, et al. Multiparametric MRI-based radiomics signature for preoperative estimation of tumor-stroma ratio in rectal cancer[J]. Eur Radiol, 2021, 31(5): 3326-3335. DOI:10.1007/s00330-020-07403-6 |
| [24] |
YILMAZ E, SARI O, YILMAZ A, et al. Diffusion-weighted imaging for the discrimination of benign and malignant breast masses; utility of ADC and relative ADC[J]. J Belg Soc Radiol, 2018, 102(1): 24. DOI:10.5334/jbsr.1258 |
| [25] |
YU Y, ZHANG H, XIAO Z, et al. Diffusion-weighted MRI combined with susceptibility-weighted MRI: added diagnostic value for four common lateral ventricular tumors[J]. Acta Radiol, 2018, 59(8): 980-987. DOI:10.1177/0284185117738562 |
| [26] |
李燕, 余静, 李海, 等. DWI对直肠黏液腺癌与非黏液腺癌的鉴别诊断价值[J]. 放射学实践, 2017, 32(1): 48-51. |
 2022, Vol. 20
2022, Vol. 20


