| 硬化性肺泡细胞瘤的CT表现分析 |
硬化性肺泡细胞瘤(sclerosing pneumocytoma,SP)是一种少见的肺良性肿瘤,Liebow等[1]首次报道并命名为肺硬化性血管瘤(pulmonary sclerosing hemangioma,PSH)。2015年WHO重新命名为SP[2],归类于腺瘤。SP临床症状无特异性,部分表现为咳嗽、咯血、发热、胸闷等,偶见伴淋巴结转移、胸膜转移的报道[3-4]。SP的CT主要表现为肺内肿块或结节,需与其他CT表现为肺内肿块或结节的疾病鉴别。现回顾性分析经病理证实的SP 26例,分析其CT特征及鉴别诊断。
1 资料与方法 1.1 一般资料收集2009年1月至2017年6月经病理证实的SP 26例,男4例,女22例;年龄26~63岁,中位年龄48岁。其中经手术病理证实17例,经CT引导穿刺活检病理证实8例,1例多发病灶经手术病理及穿刺活检病理证实。
1.2 仪器与方法26例均行CT平扫及增强扫描。采用GE Healthcare Lightspeed VCT和Philips 64排螺旋CT机,扫描参数:120 kV,250~350 mAs,层厚5 mm。扫描范围从肺尖到肺底包括全肺。增强扫描:采用非离子型碘对比剂碘帕醇(300 mgI/mL),自肘前静脉经高压注射器以3~4 mL/s流率团注,常规动脉期20~25 s、静脉期50~60 s扫描。1 mm重建图像传后处理工作站行MPR、MIP和MinIP。
1.3 图像分析由2位高年资心胸组放射科医师共同阅片,意见不统一时经协商达成一致。图像分析内容包括肿瘤的位置、形态、大小、密度、边缘、强化特征,气道改变,胸部淋巴结改变,是否伴胸腔积液,胸廓骨质破坏情况,统计贴边血管征(紧贴病灶表面强化的血管影)、贴边支气管征(紧贴病灶表面细支气管影)、晕征(病灶周围出现的斑片状磨玻璃影)、空气新月征(病灶周围新月形或不规则形无肺纹理区域)。
2 结果26例共27个病灶,位于左肺上叶5个(18.5%),左肺下叶8个(29.6%),右肺上叶6个(22.2%),右肺中叶2个(7.4%),右肺下叶6个(22.2%)。CT均表现为肺内肿块或结节。病灶形态为类圆形或椭圆形,其中4例可见浅分叶或毛刺。病灶最小短径6 mm,最大短径54 mm。CT平扫,20个(74.1%)病灶密度大致均匀,7个(25.9%)密度欠均匀,6个(22.2%)可见点状、沙砾样钙化,位于病灶边缘(图 1)。增强扫描示静脉期病灶均匀强化20个(74.1%),不均匀强化7个(25.9%)。26例CT均未发现肺门纵隔淋巴结肿大、胸腔积液及胸廓骨质破坏。
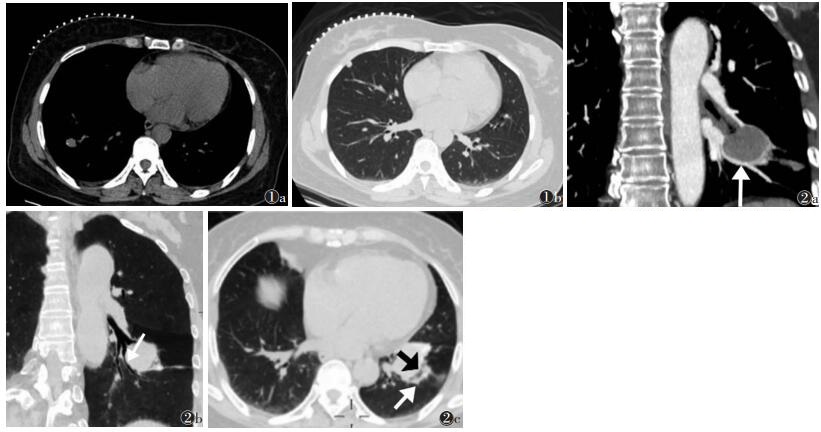 |
| 图 1 女,47岁,体检发现肺部结节。右肺下叶结节楔形切除,右肺中叶结节CT引导穿刺,病理证实两病灶均为硬化性肺泡细胞瘤 图 1a CT平扫纵隔窗示右肺下叶结节,边缘沙砾样钙化 图 1b CT平扫肺窗示右肺中叶结节 图 2 女,63岁,因咳嗽15 d入院,手术病理为硬化性肺泡细胞瘤 图 2a MPR示贴边血管征(箭头) 图 2b MinIP示贴边支气管征(箭头) 图 2c 横断位肺窗示晕征(白箭)、空气新月征(黑箭) |
MPR、MIP、MinIP图像后处理,19个(70.4%)病灶出现贴边血管征(图 2a),病灶直径22~54 mm,病灶贴边血管主要为正常肺动脉或肺静脉分支,其中9个为肺动脉分支,5个为肺静脉分支,5个为肺动脉和肺静脉分支;14个病灶周围贴边血管受压推移。12个(44.4%)病灶出现贴边支气管征(图 2b),病灶直径22~54 mm,其中8个病灶周围贴边支气管受压推移、狭窄。10个病灶(37.0%)出现晕征,病灶直径16~48 mm,其中6个(22.2%)伴空气新月征(图 2c)。
3 讨论SP约占肺部良性肿瘤的22%[5],亚洲地区的中年女性为好发人群,男女比例1:(5~7)[6-7]。本组男女比例1:6,中位年龄48岁,与文献报道基本相符。SP临床表现无特征性。
3.1 SP的CT表现SP的CT主要表现为肺内的结节或肿块,两肺各叶均可发生,本组26例27个病灶遍布两肺各叶。SP以单发多见,罕见多发[7-9]。董有文[10]报道135例SP中仅1例发现2个病灶,本组1例发现2个病灶分别位于于右肺中叶和右肺下叶,右肺中叶病灶行CT引导下穿刺,右肺下叶内镜下切割缝合器楔形切除,2个病灶经病理证实均为SP,为罕见病例。SP形态学多表现为类圆形或椭圆形,边缘光整[11],本组均表现为类圆形或椭圆形,23个病灶边缘光整,有文献称之为笔画征[8]。部分病灶可呈分叶、毛刺征、胸膜凹陷等肺部恶性肿瘤的特征[12],有的SP病理上合并原位腺癌[7],本组4例有分叶或毛刺,病理未发现恶变病灶。平扫多密度均匀,20%~36%病灶内可见钙化[10],本组27个病灶中钙化6个(22.2%),主要为沙砾状,病灶中心及周边均可见,病灶内钙化可能为胆固醇结晶[8]。CT增强扫描病灶均匀强化多见,王建卫等[8]发现增强扫描早期病灶可不均匀强化,延时后病灶均匀强化。本组均于静脉期观察,均匀强化者约74.1%(20/27)。史景云等[13]研究SP的CT增强扫描与微血管密度关系发现,病灶内组织结构与病灶大小有关,直径 < 3 cm的病灶内间质小血管丰富,增强扫描均匀强化;直径≥3 cm的病灶内,形成大范围的硬化型结构,增强扫描不均匀强化。SP病灶直径多 < 3 cm[14-15],所以SP均匀强化者多见。SP为肺内良性病变,本组均未发现肺门纵隔淋巴结肿大、胸腔积液及胸廓骨质破坏。
多数文献[7, 9, 11, 15-16]报道,CT增强扫描SP病灶周边出现贴边血管征(或周围血管包绕),甚至有学者[10, 17]认为贴边血管征是SP的特异性CT表现之一,发生概率高达51.0%~82.6%。贴边血管征为肿瘤生长过程中压迫、推移周围血管所形成,横断位显示为肿瘤边缘点状、弧形强化,强化程度与肺动脉/肺静脉相近。本组MPR、MIP均清晰显示贴边血管征,约70.4%(19/27)病灶出现贴边血管征,发生概率与文献报道基本相符。贴边支气管征的形成原理与贴边血管征相似,由于肿瘤生长过程中压迫、推移周围支气管形成,横断位显示为肿瘤边缘点状、弧形小气道影,MPR、MinIP可更清晰显示。本组44.4%(12/27)出现贴边支气管征。本研究贴边血管征和贴边支气管征均见于直径>22 mm的病灶,提示两者的出现可能与病灶大小有关。文献[10, 17]报道贴边血管征出现率为51%~82.6%,可能与不同研究选择的病灶大小分布不均有关。
晕征的形成机制可能与病灶周围肺泡内出血、肺泡上皮增生或病灶周围肺组织皱缩通气不良有关[7]。本组10个(37.0%)病灶周边出现晕征,术后病理发现病灶内及周围出血且含铁血黄素沉着,笔者认为,SP晕征的出现与病灶内及周围肺泡内出血有关。瘤周出血吸收后形成瘤周裂隙状透亮无肺纹理区,为新月形或不规则形,形成空气新月征[18],本组6个(22.2%)病灶出现空气新月征。晕征和空气新月征为病灶周围出血、吸收改变,两者可同时存在。
3.2 鉴别诊断SP与肺癌的鉴别:①由于肺癌向不同方向不均一生长形成分叶征,肿瘤的扩散浸润、癌性淋巴管炎等致肺癌边缘形成短小毛刺。肺癌可伴肺门纵隔淋巴结肿大、胸腔积液及胸廓骨质转移破坏,本组均发现。②由于肺癌的侵袭性,病灶较大时周围的血管、支气管被包埋,甚至截断,尤其以淋巴上皮瘤样癌包埋血管、支气管更为突出。SP为肺内良性肿瘤,对周边血管、支气管压迫推移改变形成贴边血管征和贴边支气管征。病灶与周围血管、支气管的关系,可作为SP和肺癌CT鉴别诊断的重要参考。
SP与其他肺内良性结节或肿块的鉴别:①肺错构瘤,CT表现为肺内孤立性结节或肿块,以病灶内爆米花状钙化为特征性表现,病理可能与病灶内软骨成分有关。当肺错构瘤病灶内无钙化或出现沙砾状钙化时需与SP鉴别。肺错构瘤为肺内良性肿瘤,也可出现贴边血管征、贴边支气管征,但晕征及空气新月征尚未见报道,因此,晕征及空气新月征可作为SP与肺错构瘤CT鉴别诊断的重要参考依据。②结核球,有明确的结核病史,结核球体积相对SP较小,病灶内可呈沙砾样钙化,病灶周围可有卫星病灶,与SP鉴别诊断相对容易。③隐球菌、曲霉菌感染,CT均可表现为结节或肿块样。病灶周围血管可表现为贴边血管征,也可正常穿行于病灶实质内。晕征可出现在肺部真菌感染,尤其是血管侵袭性肺曲霉菌病,形成机制与SP相似,为病灶周围的急性出血。侵袭性肺部真菌感染与SP鉴别诊断,主要依靠临床特征,侵袭性肺部真菌感染病灶常多发,不同形态的病灶同时存在,治疗后随访病灶会发生一定的变化[19]。
| [1] |
Liebow AA, Hubbell DS. Sclerosing hemangioma (histiocytoma, xanthoma) of the lung[J]. Cancer, 1956, 9: 53-75. DOI:10.1002/(ISSN)1097-0142 |
| [2] |
Travis WD, Brambila E, Burk AP, et al. WHO classification of tumours of lung, pleura, thymus and heart[M]. 4th ed. Lyon: IARC Press, 2015: 183-299.
|
| [3] |
Adachi Y, Tsuta K, Hirano R, et al. Pulmonary sclerosing hemangioma with lymph node metastasis:a case report and literature review[J]. Oncol Lett, 2014, 7: 997-1000. DOI:10.3892/ol.2014.1831 |
| [4] |
Suzuki H, Saitoh Y, Koh E, et al. Pulmonary sclerosing hemangioma with pleural dissemination:report of a case[J]. Surg Today, 2011, 41: 258-261. DOI:10.1007/s00595-009-4220-5 |
| [5] |
Jungraithmayr W, Eggeling S, Ludwig C, et al. Sclerosing hemangioma of the lung:a benign tumour with potential for malignancy?[J]. Ann Thorac Cardiovasc Surg, 2006, 12: 352-354. |
| [6] |
张松, 张曙光, 刘相利, 等. 肺硬化性血管瘤69例临床诊断与治疗分析[J]. 中国医科大学学报, 2014, 4(5): 470-472. |
| [7] |
黎良山, 徐甜甜, 柯勤兵, 等. 硬化性肺泡细胞瘤的CT表现[J]. 临床放射学杂志, 2017, 36(2): 227-230. |
| [8] |
王建卫, 林冬梅, 石木兰. 肺硬化性血管瘤的影像学与病理学对照研究[J]. 中华放射学杂志, 2004, 38(9): 962-966. DOI:10.3760/j.issn:1005-1201.2004.09.015 |
| [9] |
张丽红, 黄贤会. 肺硬化性血管瘤64层螺旋CT诊断与鉴别[J]. 中国中西医结合影像学杂志, 2012, 10(3): 242-244. DOI:10.3969/j.issn.1672-0512.2012.03.016 |
| [10] |
董有文. CT与18F-FDG PET/CT显像在硬化性肺泡细胞瘤诊断中的价值[D].天津: 天津医科大学, 2016. http://www.cnki.com.cn/Article/CJFDTotal-ZSZD201606010.htm
|
| [11] |
元昌珍, 龚建平, 蔡武, 等. 64排螺旋CT在诊断肺硬化性血管瘤中的价值[J]. 临床放射学杂志, 2013, 32(3): 433-436. |
| [12] |
高美佳.肺硬化性血管瘤CT增强特征与病理分析[D].杭州: 浙江大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10335-1015614928.htm
|
| [13] |
史景云, 易祥华, 刘士远, 等. 肺硬化性血管瘤增强CT表现及其与微血管密度的关系[J]. 临床放射学杂志, 2004, 23(1): 5356. |
| [14] |
Katzenstein AL, Gmelich JT, Carrington CB. Sclerosing hemang ioma of the lung:a clinicopathologic study of 51 cases[J]. Am J Surg Pathol, 1980, 4: 343-356. DOI:10.1097/00000478-198008000-00003 |
| [15] |
史讯, 张志勇, 张兴伟, 等. 肺硬化性血管瘤的CT表现与病理对照分析(附21例报告)[J]. 实用放射学杂志, 2007, 23(3): 311-314. DOI:10.3969/j.issn.1002-1671.2007.03.008 |
| [16] |
陈淮, 曾庆思, 周洁, 等. 肺硬化性血管瘤的影像征象与病理分析[J]. 中国医学影像学杂志, 2012, 20(4): 268-271. |
| [17] |
关晶. MSCT平扫及双期增强扫描并薄层重建对诊断肺硬化性血管瘤的意义[D].石家庄: 河北医科大学, 2015. http://med.wanfangdata.com.cn/Paper/Detail/DegreePaper_Y2785582
|
| [18] |
董有文, 徐文贵. 硬化性肺泡细胞瘤的影像及临床特征研究进展[J]. 天津医科大学学报, 2016, 22(5): 463-465. |
| [19] |
孙龙伟, 龙莉玲, 黄仲奎. 侵袭性肺部真菌感染的CT表现与临床特点分析[J]. 实用放射学杂志, 2009, 25(2): 180-183. DOI:10.3969/j.issn.1002-1671.2009.02.009 |
 2018, Vol. 16
2018, Vol. 16


