| 不同性别胰腺实性假乳头状瘤的MRI表现特征 |
2. 山东省济南市济阳区人民医院医学影像科,山东 济南 251400;
3. 山东省招远市人民医院影像科,山东 招远 265400;
4. 山东第一医科大学附属省立医院医学影像科, 山东 济南 250021
胰腺实性假乳头状瘤(solid pseudopapillary neoplasm of pancreas,SPNP)好发于年轻女性,发病机制尚不明确,患者无典型特异性症状,多因腹部不适就诊或查体发现,实验室指标亦无特异性表现,目前,其术前诊断主要依赖影像学检查[1-3]。SPNP的治疗方法主要为手术治疗,预后较好。虽然有文献报道SPNP存在多发转移、侵犯的生物学行为,更有关于患者因SPNP进展而死亡的报道[4-5],但是多数文献报道,其术后生存率较高,即使术后发生转移或复发,患者仍可生存多年[4]。男性SPNP患者除因该病在男性中发病率较低不会首先考虑到SPNP的诊断外,体积较小的SPNP也易与其他肿瘤混淆,从而影响后期治疗方式的选择。有报道称SPNP在男性患者中具有独特的影像及病理特点[6]。因此,总结SPNP男性患者的影像表现,准确诊断,对患者和医师都有重要的临床意义。
近年来,关于SPNP的文献一般是利用CT对其进行分析,关于MRI研究的文献较少。MRI较CT的软组织分辨力更高,可更清晰分辨病变内的组织成分,对SPNP病变及其他胰腺肿瘤有较高的鉴别诊断价值[7-9]。回顾性分析32例SPNP患者的MRI及临床资料,总结SPNP的MRI表现,以及不同性别间的特点,为该病的诊断提供参考。
1 资料与方法 1.1 一般资料收集山东第一医科大学附属省立医院2014年9月至2021年5月经手术病理证实的32例SPNP患者,均为单发,其中男9例,女23例;年龄15~59岁,平均(36.00±11.41)岁。纳入2017年3月至2021年3月的31例健康志愿者作为对照组。患者及志愿者纳入标准:①均行上腹部MRI平扫及增强扫描;②图像清晰;③在MRI扫描前,无肿瘤病史及其他胰腺病史;④经本人或家属签知情同意书。
1.2 仪器与方法采用Siemens Megneton Skyra 3.0 T超导MRI扫描仪与腹部线圈,检查前空腹4 h以上。扫描序列及参数:上腹部脂肪抑制T1WI,层厚3 mm,视野380 mm×320 mm,TR 4.31 ms,TE 2.03 ms;脂肪抑制T2WI,层厚4 mm,视野380 mm×380 mm,TR 1 400.0 ms,TE 96 ms;DWI,层厚6.0 mm,视野400 mm×320 mm,TR 5 600 ms,TE 58.0 ms,b值50、800 s/mm2。增强扫描经左侧肘正中静脉注射对比剂Gd-DTPA,用量0.1 mmol/kg体质量,流率2.5 mmol/s,后注入生理盐水冲洗。
1.3 图像分析由1名资深影像科医师分析图像,观察病变位置、大小、囊实性、边界是否清晰、有无包膜、胰管有无扩张、弥散是否受限、T1WI、T2WI信号及病变的强化特点等。其中病变位置分为头颈部、体尾部;囊性成分 > 50%或均为囊性成分定义为囊性为主或囊性,<50%或无囊性成分则定义为实性为主或实性[6];因钙化在MRI图像上不易鉴定,未纳入分析内容;病变包膜在MRI上表现为延迟强化,强化程度高于肿瘤组织,在门脉期及延迟期强化程度亦高于胰腺组织;T1WI、T2WI信号界定标准:肿瘤大部分(> 50%)信号高于周围正常胰腺组织为高信号,反之为低信号[8];T1WI局灶高信号为只要存在高信号,即为有。
使用ITK-SNAP 3.8.0(www.itksnap.org)软件对图像进行勾画,主要对病变与周围正常胰腺组织及对照组胰腺组织的ROI进行三维勾画,采集脂肪抑制T1WI及增强扫描各期的信号强度及ADC值。根据脂肪抑制T1WI平扫及增强扫描各期的信号强度判断其强化方式为渐进性强化、非渐进性强化还是无强化。
1.4 统计学分析采用SPSS 24.0软件分析数据,计量资料以x±s表示,组间比较行独立样本t检验;计数资料以例数表示,组间比较行χ2检验;ADC值与病灶最大径之间行相关性分析。以P<0.05为差异有统计学意义。
2 结果 2.1 不同性别SPNP患者的临床资料比较(表 1)| 表 1 不同性别SPNP患者的临床资料比较 |
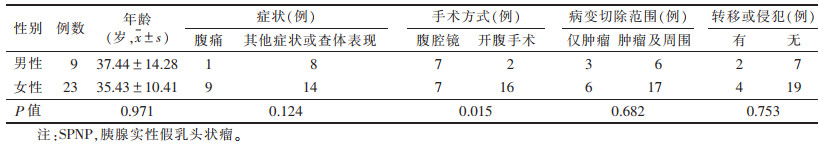 |
不同性别患者的年龄、症状、病变切除范围、转移或侵犯情况比较,差异均无统计学意义(均P > 0.05)。32例均行外科治疗,不同性别间手术方式差异有统计学意义(P<0.05)。6例病理可见周围的局部浸润或远处转移,其中3例周围胰腺组织发生浸润,1例脾脏受侵,1例病变侵犯十二指肠达黏膜下层,1例发生远处肝脏转移。
2.2 不同性别SPNP患者的MRI表现比较(表 2)| 表 2 不同性别SPNP患者的MRI表现比较 |
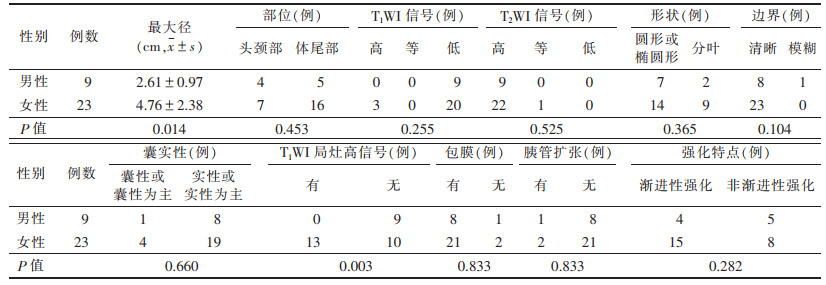 |
女性患者肿块最大径大于男性患者,差异有统计学意义(P=0.014)。23例女性患者中,13例T1WI序列可发现肿瘤内存在点状、片状或线状的局灶高信号,T2WI呈低信号,DWI未见扩散受限,提示出血或钙化,而9例男性患者T1WI图像均未发现肿瘤内有局灶高信号,不同性别间差异有统计学意义(χ2=8.568,P=0.003)(图 1~4)。不同性别间肿瘤部位、T1WI信号、T2WI信号、形状、边界、囊实性、包膜、胰管扩张,以及强化特点差异均无统计学意义(均P > 0.05)。
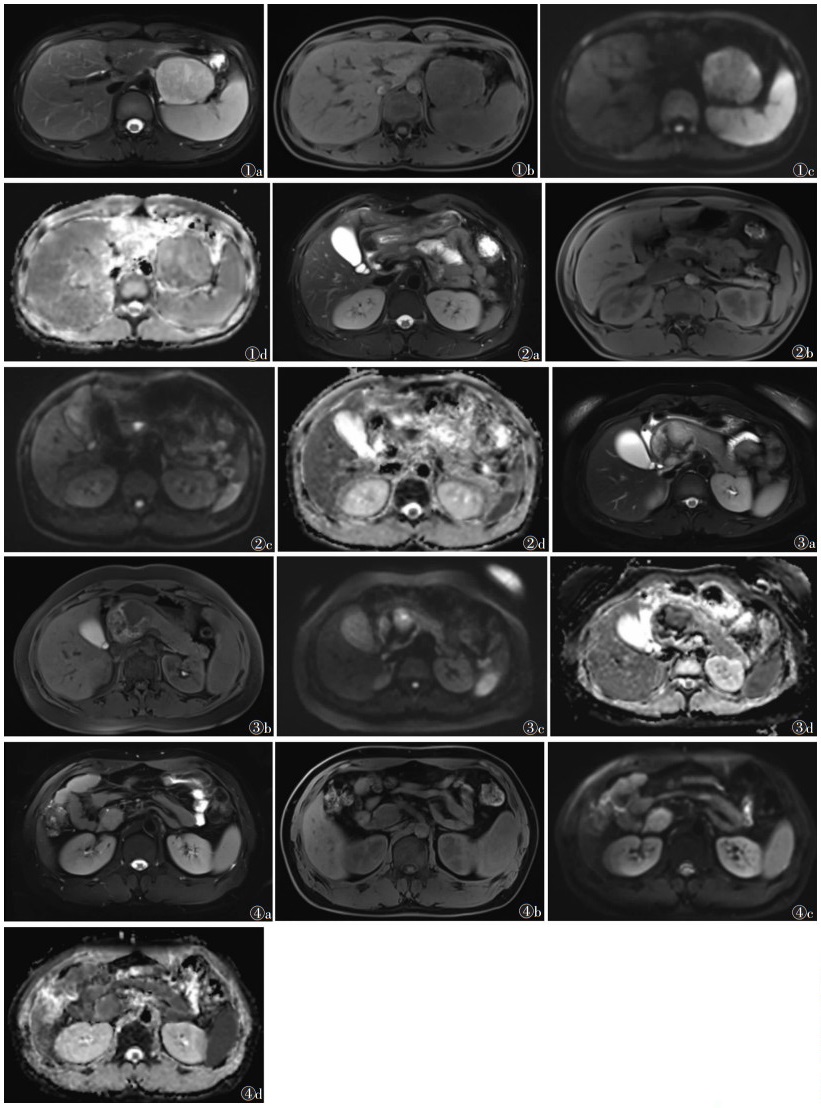 |
| 图 1 女,15岁,胰腺实性假乳头状瘤。MRI示胰腺尾部团块影,边界清晰,最大横截面为5.9 cm× 4.4 cm 图 1a 脂肪抑制T2WI横轴位图像,可见病灶呈高信号 图 1b 脂肪抑制T1WI图像,病灶呈低信号 图 1c DWI图像(b值800 s/mm2),可见病灶扩散受限 图 1d 相应ADC图,病灶呈低信号 图 2 男,33岁,胰腺实性假乳头状瘤。MRI示胰腺体部小结节灶,边界清,最大横截面为1.1 cm×1.0 cm 图 2a 脂肪抑制T2WI横轴位图像,可见病灶呈高信号(箭头) 图 2b 脂肪抑制T1WI图像,病灶呈低信号 图 2c DWI图像(b值800 s/mm2),可见病灶扩散明显受限 图 2d 相应ADC图,病灶呈低信号 图 3 女,28岁,胰腺实性假乳头状瘤。MRI示胰腺头颈部团块,边界清,最大横截面为5.7 cm×4.9 cm 图 3a,3b 分别为脂肪抑制T2WI及脂肪抑制T1WI横轴位图像,可见病灶呈高低混杂信号 图 3c,3d 分别为DWI图像(b值800 s/mm2)及相应ADC图,示T1WI高信号区在DWI呈高低混杂信号,在ADC图呈低信号 图 4 男,34岁,胰腺实性假乳头状瘤。MRI示胰头部团块影,边界清,最大横截面为3.7 cm×2.7 cm 图 4a 脂肪抑制T2WI横轴位图像,可见病灶呈均匀高信号 图 4b 脂肪抑制T1WI图像,病灶呈均匀低信号 图 4c DWI图像(b值800 s/mm2),可见病灶扩散受限 图 4d 相应ADC图,病灶呈低信号 |
2.3 胰腺组织ADC值的测量与相关性分析
1例女性患者因ADC图损坏无法测量ADC值,测量余31例的ADC值,9例男性SPNP的ADC值为(1 055.12±338.65)mm2/s,22例女性为(1 158.06±349.21)mm2/s,2组差异无统计学意义(P=0.459)。31例SPNP的病灶胰腺组织ADC值为(1 128.17±343.80)mm2/s,病灶周围正常胰腺组织为[(1 316.82±260.14)mm2/s],对照组为(1 282.48±128.29)mm2/s;SPNP的ADC值低于病灶周围正常胰腺组织及对照组胰腺组织(P= 0.018,0.023),SPNP病灶周围正常胰腺组织的ADC值与对照组差异无统计学意义(P=0.512)(图 5,6)。
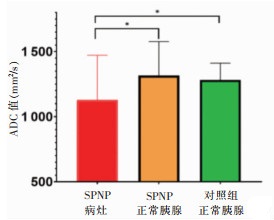 |
| 图 5 胰腺实性假乳头状瘤(SPNP)病灶、病灶周围正常胰腺及对照组正常胰腺的ADC值直方图 |
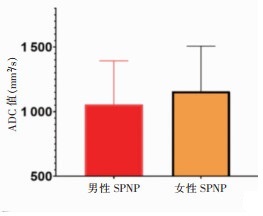 |
| 图 6 不同性别SPNP的ADC值直方图 |
不同性别SPNP患者病灶周围正常胰腺组织ADC值及对照组男女胰腺组织的ADC值,差异均无统计学意义(均P > 0.05)。对31例SPNP的ADC值及病灶最大径行相关性分析,发现两者呈正相关(r=0.408,P=0.023),即病变体积越大,ADC值越高(图 7)。分别分析男性和女性的病变最大径和ADC的关系,在男性患者中两者存在相关性(P=0.006),在女性患者中无相关性(P=0.125)。
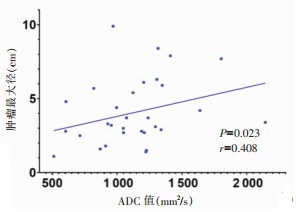 |
| 图 7 SPNP的ADC值与病变最大径关系散点图(r=0.408,P=0.023) |
3 讨论
目前,SPNP发病机制尚不明确,恶性程度较低,好发于年轻女性。病理发现,SPNP由3个部分组成:实性部分、囊性部分和假乳头状混合物[4]。SPNP为退行性肿瘤,病变较小时,一般边界不清晰,偏实性,成分较单一,随着肿瘤的进展,病变发生退行性改变,发生坏死、囊变、钙化[10]。SPNP被发现时往往体积较大,成分混杂,在MRI上表现为囊实性的混杂信号肿瘤[11-12]。
SPNP好发于女性的机制尚存争议,有文献提出可能与体内性激素相关[4],但男女之间肿瘤组织的性激素受体染色并未发现特异性[11-12]。同一试验中对肿瘤进行的15份孕酮检测样本均为阳性,由此推测孕激素可能会促进病变的进展[12]。本研究32例患者中9例为男性,男性患者的肿瘤体积相对较小,成分较女性单一,支持上述文献所提出的假说。但也有研究发现,女性患者的肿瘤体积并未大于男性患者[13-15],既往文献亦有出血或钙化无明显性别差异的结论[16],与本研究结论不同的原因可能是SPNP的低患病率使得大部分研究中例数较少,尤其男性患病率更低,致使不同性别的样本量差异性较大。
DWI是指水分子的运动,ADC值描述的是水分子运动受限的程度,DWI与ADC值可联合使用来评价肿瘤的分级。在本研究中,31例SPNP均扩散受限,男女之间ADC值并无差异,说明SPNP有恶性潜能,但肿瘤的恶性程度在男女之间无差异性,这与以往的研究结果[17]相符,也有部分研究发现在SPNP中男性更倾向恶性[18]。另外,本研究中,SPNP患者病灶周围正常胰腺组织的ADC值与健康志愿者胰腺组织的ADC值差异无统计学意义,表明SPNP对周围胰腺组织的影响或浸润不明显,符合SPNP为低度恶性这一性质,且这一特性在男女不同性别之间无差异。在31例SPNP患者及男性患者中,病变最大径越大,ADC值越高,恶性程度相对低的肿瘤可以长得很大。而在女性患者中未测出两者的相关性,可能是因为男性患者病变成分较单一,实性成分占比例较大,在测量ADC值时不易受到混杂信号的干扰,而女性患者的病变成分更复杂,尤其是囊性成分较多时,对ADC值产生了影响。
本研究中32例SPNP患者中大部分在MRI上表现为T1WI、T2WI呈高低混杂信号,边界多数清晰,DWI示扩散受限;增强扫描呈渐进性强化,延迟期可见强化程度高于周围胰腺组织的包膜。另外,SPNP恶性程度较低,即使在初次诊断时发现转移的患者,术后仍可生存多年。SPNP男性患者的肿瘤体积较小,成分偏向单一的实性,需与体积较小的无功能性神经内分泌肿瘤及胰腺癌相鉴别,这三者的术前鉴别诊断直接影响治疗方式的选择,尤其对于生物学习性较好的SPNP而言。三者一般均以实性成分为主,无功能性神经内分泌肿瘤的强化方式为早期明显延迟强化[8-9];体积较小的胰腺癌强化方式与SPNP极为相似,但胰腺癌在T2WI上的信号低于SPNP,边界不清,形状不规则,会有胰管的扩张;SPNP一般无胰管扩张,体积较小的SPNP边界多清晰。另外可借助实验室检查,胰腺癌可有CA19-9及CA125升高[19]。本研究的不足之处是样本量小,尤其男性SPNP患者,在分析其特点时可能会存在误差,且不同性别间样本量差异较大,SPNP男性患者的MRI表现较女性还有哪些特异性尚需进一步研究。
综上所述,SPNP男性患者除具备典型的SPNP影像特点外,与女性患者相比其体积更小、T1WI出现局灶高信号概率更低,可为与其他胰腺肿瘤的鉴别诊断提供依据。
| [1] |
李耀敏. MRI对胰腺实性假乳头状瘤14例的诊断价值[J]. 影像研究与医学应用, 2018, 2(16): 151-153. DOI:10.3969/j.issn.2096-3807.2018.16.100 |
| [2] |
YAO X, JI Y, ZENG M, et al. Solid pseudopapillary tumor of the pancreas: cross-sectional imaging and pathologic correlation[J]. Pancreas, 2010, 39(4): 486-491. DOI:10.1097/MPA.0b013e3181bd6839 |
| [3] |
LAW J K, AHMED A, SINGH V K, et al. A systematic review of solid-pseudopapillary neoplasms: are these rare lesions?[J]. Pancreas, 2014, 43(3): 331-337. DOI:10.1097/MPA.0000000000000061 |
| [4] |
YU P F, HU Z H, WANG X B, et al. Solid pseudopapillary tumor of the pancreas: a review of 553 cases in Chinese literature[J]. World J Gastroenterol, 2010, 16(10): 1209-1214. DOI:10.3748/wjg.v16.i10.1209 |
| [5] |
PAPAVRAMIDIS T, PAPAVRAMIDIS S. Solid pseudopapillary tumors of the pancreas: review of 718 patients reported in English literature[J]. J Am Coll Surg, 2005, 200(6): 965-972. DOI:10.1016/j.jamcollsurg.2005.02.011 |
| [6] |
SUR Y K, LEE J H, KIM J K, et al. Comparison of MR imaging features of solid pseudopapillary neoplasm of pancreas between male and female patients[J]. Eur J Radiol, 2015, 84(11): 2065-2070. DOI:10.1016/j.ejrad.2015.07.025 |
| [7] |
CHAE S H, LEE J M, BAEK J H, et al. Magnetic resonance imaging spectrum of solid pseudopapillary neoplasm of the pancreas[J]. J Comput Assist Tomogr, 2014, 38(2): 249-257. DOI:10.1097/01.rct.0000445639.26581.65 |
| [8] |
VENTRIGLIA A, MANFREDI R, MEHRABI S, et al. MRI features of solid pseudopapillary neoplasm of the pancreas[J]. Abdom Imaging, 2014, 39(6): 1213-1220. DOI:10.1007/s00261-014-0169-y |
| [9] |
YU M H, LEE J Y, KIM M A, et al. MR imaging features of small solid pseudopapillary tumors: retrospective differentiation from other small solid pancreatic tumors[J]. AJR Am J Roentgenol, 2010, 195(6): 1324-1332. DOI:10.2214/AJR.10.4452 |
| [10] |
鲁首男, 苏志雷, 邰升. 胰腺实性假乳头状瘤的分子机制及影像学诊断研究进展[J]. 疑难病杂志, 2018, 17(6): 644-648. DOI:10.3969/j.issn.1671-6450.2018.06.027 |
| [11] |
TIEN Y W, SER K H, HU R H, et al. Solid pseudopapillary neoplasms of the pancreas: is there a pathologic basis for the observed gender differences in incidence?[J]. Surgery, 2005, 137(6): 591-596. DOI:10.1016/j.surg.2005.01.015 |
| [12] |
ADAMS A L, SIEGAL G P, JHALA N C. Solid pseudopapillary tumor of the pancreas: a review of salient clinical and pathologic features[J]. Adv Anat Pathol, 2008, 15(1): 39-45. DOI:10.1097/PAP.0b013e31815e5237 |
| [13] |
黄芳芳. 胰腺实性假乳头状瘤的影像学特征及病理基础[D]. 杭州: 浙江大学, 2014.
|
| [14] |
史曙光, 胡春洪, 周莹. 胰腺实性假乳头状瘤的性别差异: 临床和MSCT表现[J]. 放射学实践, 2020, 35(2): 213-216. |
| [15] |
DE ROBERTIS R, MARCHEGIANI G, CATANIA M, et al. Solid pseudopapillary neoplasms of the pancreas: clinicopathologic and radiologic features according to size[J]. AJR Am J Roentgenol, 2019, 213(5): 1073-1080. DOI:10.2214/AJR.18.20715 |
| [16] |
JUN S Y, HONG S M. Nonductal pancreatic cancers[J]. Surg Pathol Clin, 2016, 9(4): 581-593. DOI:10.1016/j.path.2016.05.005 |
| [17] |
邓霖, 周良平, 吴斌, 等. 胰腺实性假乳头状瘤的CT表现及良、恶性鉴别[J]. 中国癌症杂志, 2018, 28(2): 128-133. |
| [18] |
MACHADO M C, MACHADO M A, BACCHELLA T, et al. Solid pseudopapillary neoplasm of the pancreas: distinct patterns of onset, diagnosis, and prognosis for male versus female patients[J]. Surgery, 2008, 143(1): 29-34. DOI:10.1016/j.surg.2007.07.030 |
| [19] |
JANG K M, KIM S H, KIM Y K, et al. Imaging features of small (≤3 cm) pancreatic solid tumors on gadoxetic-acid-enhanced MR imaging and diffusion-weighted imaging: an initial experience[J]. Magn Reson Imaging, 2012, 30(7): 916-925. DOI:10.1016/j.mri.2012.02.017 |
 2022, Vol. 20
2022, Vol. 20


