| 基于CT测定的细胞外体积分数预测肝细胞癌血管包绕肿瘤细胞簇模式的价值 |
2. 山东中医药大学附属医院放射科,山东 济南 250014;
3. 济南市历城区中医医院放射科,山东 济南 250199;
4. 山东医学高等专科学校,山东 济南 250002;
5. 日照市人民医院CT室,山东 日照 276827;
6. 青岛大学附属威海市中心医院影像科,山东 威海 264400
2. Department of Radiology, Affiliated Hospital of Shandong University of Traditional Chinese Medicine, Jinan 250014, China;
3. Department of Radiology, Licheng Hospital of Traditional Chinese Medicine, Jinan 250199, China;
4. Shandong Medical College, Jinan 250002, China;
5. Department of CT, Rizhao People's Hospital, Rizhao 276827, China;
6. Department of Radiology, Weihai Central Hospital Affiliated to Qingdao University, Weihai 264400, China
肝细胞癌(hepatocellular carcinoma,HCC)是全球第六大常见癌症,也是2020年癌症相关死亡的第三大原因。预计未来20年,肝癌的发病率和死亡人数将继续增加[1]。HCC是肝脏最常见的原发性恶性肿瘤,占所有原发性肝癌的约80%[2]。近年来,HCC血管包绕肿瘤细胞簇(vessel encapsulated tumor cluster,VETC)作为一种新型转移模式正受到越来越多的关注。与经典的上皮-间质转化模式不同,VETC中的肿瘤细胞簇被血管内皮细胞所包围,因此肿瘤细胞可逃避免疫监视,从而更易发生转移[3]。临床研究揭示,VETC与肝癌的更低分化[4]、较高的复发率和转移率密切相关[5]。VETC是肝切除和肝移植治疗后HCC患者肿瘤复发的独立危险因素[6]。另外,HCC的VETC表现出较高的Ang2血管生成因子表达,提示这一机制可能与肿瘤的血管生成密切相关,索拉非尼通过抑制Ang2介导的血管生成,可能在这种模式下具有较好的治疗效果[7]。因此,术前准确识别VETC具有重要的临床意义。
目前,HCC的VETC的确诊主要依靠术后病理,但病理为有创操作,穿刺活检也仅能反映肿瘤局部,不能代表其整体特征,具有较大局限性。细胞外体积分数(extracellular volume fraction,ECV)能反映微血管密度和细胞外基质成分等肿瘤微环境,可应用于全身多种肿瘤[8],且均取得满意的预测效果。目前尚未发现将ECV应用于预测HCC的VETC的研究中。本研究旨在探索基于临床特征、CT特征及ECV构建的列线图模型术前预测HCC的VETC模式的应用价值。
1 资料与方法 1.1 一般资料回顾性收集2019年1月至2023年12月在山东大学齐鲁医院接受手术并经病理确诊的101例HCC患者,其中男81例,女20例;年龄37~77岁,平均(57±12)岁。收集其性别、年龄、癌胚抗原(CEA)、甲胎蛋白(AFP)、血细胞比容(HCT)及有无乙型肝炎、肝硬化等资料。
纳入标准:①经手术病理证实为HCC,并行CD34免疫组化染色;②术前1~2周内行CT平扫及增强扫描(包括动脉期、门静脉期和平衡期)。排除标准:①CT检查前并非初诊或接受过有创诊断或治疗;②临床资料不全;③CT图像质量欠佳;④病理切片及CD34免疫组化染色效果差,无法清晰观察。根据免疫组化结果将患者分为VETC阳性组46例与VETC阴性组55例。本研究经医院医学伦理委员会审批(批号:KYLL-202502-038)。
1.2 仪器与方法使用Siemens Somatom Force CT及Philips Brilliance iCT扫描机。扫描范围从膈肌至耻骨联合。扫描参数按2016年《CT检查技术专家共识》设置[9]:120 kV,有效管电流采用自动毫安秒技术,螺距0.98~1.37,球管转速0.6~0.8 s/r,探测器宽度64×0.625 mm,视野300 mm×350 mm。采用高压注射器经肘静脉注射对比剂优维显300(碘浓度300 mg/mL),流率3.0 mL/s,剂量1.5 mL/kg体质量。扫描时监测肝门水平腹主动脉对比剂浓度,当CT值达100 HU时,自动触发扫描,触发后5 s行动脉期扫描,动脉期结束后40 s行门静脉期扫描、120 s行平衡期扫描。
1.3 图像分析由2位具有10年以上腹部CT诊断经验的医师在对患者病理结果不知情的前提下在PACS独立阅片,并达成一致意见。
1.3.1 定性指标① 肿瘤形态是否规则;②肿瘤内有无未强化的坏死灶;③强化假包膜与假包膜完整:指平衡期肿瘤周围有无强化的薄层结构,以及这个薄层结构是否完整;④非边缘廓清:平衡期时肿瘤强化是否低于邻近肝实质;⑤动脉期低强化区:动脉期肿瘤组织出现较周围正常肝组织对比度低的区域;⑥有无腹水;⑦非环形动脉期高强化:动脉期肿瘤是否存在不规则非环形强化灶;⑧有无瘤内动脉。
1.3.2 定量指标① ECV:选取肿瘤最大层面,分别在平扫、平衡期[10]手动绘制ROI,避开坏死、囊变区。测量肿瘤实性部分及同层面主动脉的CT值,测量3次,取平均值。ECV计算公式如下:ECV=(1-HCT)×(ΔHU肿瘤/ΔHU主动脉)×100%。其中ΔHU肿瘤是肿瘤实性部分平衡期CT值减去相应平扫CT值,ΔHU主动脉是主动脉平衡期CT值减去相应平扫CT值。②肿瘤直径:于轴位平衡期CT显示肿瘤最大层面测量其最大长径。
1.4 CD34免疫组化检查病理切片由1位具有20年腹部病理学经验的病理学家盲评。VETC被定义为在CD34免疫组化染色中,肿瘤整体或部分存在类似窦状的血管,这些血管形成网状结构并包裹肿瘤簇,在CD34免疫染色切片上形成类似于蜘蛛网状结构[11]。
1.5 统计学方法使用SPSS 26.0软件及R软件(4.1.2版)分析数据。计量资料的正态性分布采用Kolmogorov-Smirnov检验,符合正态分布时组间比较行独立样本t检验,非正态分布时组间比较行Mann-Whitney U检验。计数资料组间比较行χ检验。单因素和多因素logistic回归分析用于筛选预测VETC的独立危险因素,并构建预测模型(列线图模型),绘制列线图。采用ROC曲线评估联合模型对VETC的预测效能,采用校准曲线评价模型预测VETC与实际结局一致性,采用DeLong检验比较AUC的差异。以P < 0.05为差异有统计学意义。
2 结果 2.1 2组临床及CT特征比较2组AFP水平差异有统计学意义(P < 0.05);性别、年龄、乙肝、肝硬化、CEA、AFP差异均无统计学意义(均P>0.05)(表 1)。
| 表 1 VETC阳性组与VETC阴性组临床及CT特征比较 |
 |
2组肿瘤的动脉期低强化区、瘤内动脉、ECV差异均有统计学意义(均P < 0.05);肿瘤形态、瘤内出血坏死、强化假包膜、假包膜完整、非边缘廓清、腹水、非环形动脉期高强化、肿瘤直径>5 cm差异均无统计学意义(均P>0.05)(表 1)。
HCC的CT表现与病理图像见图 1。
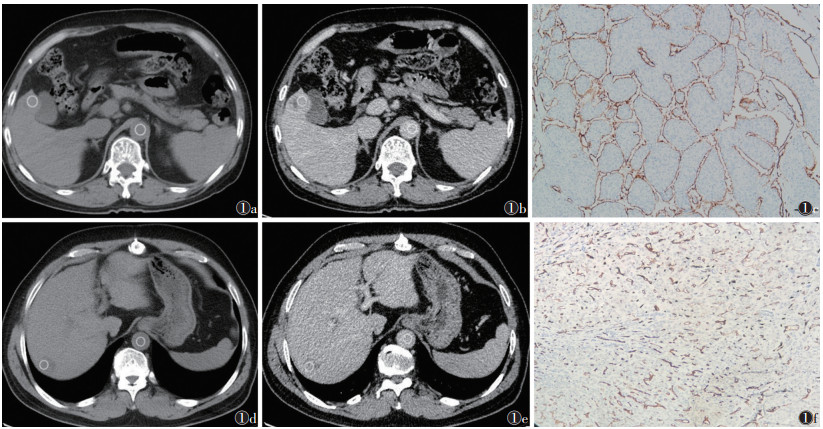 |
| 注:图 1a~1c患者,男,58岁,细胞外体积分数(ECV)为35.08%。图 1a为CT平扫图像,图 1b为增强扫描平衡期图像,图 1c为CD34染色的病理图像,证实为血管包绕肿瘤细胞簇(VETC)阳性HCC。图 1d~1f患者,男,70岁,ECV为29.27%;图 1d为平扫图像,图 1e为平衡期图像,图 1f为CD34染色的病理图像,证实为VETC阴性HCC。白色圆圈勾画的是主动脉及病灶的ROI 图 1 肝细胞癌(HCC)的典型CT与病理图像 |
2.2 多因素logistic回归分析
将单因素logistic回归分析差异有统计学意义的变量ECV、动脉期低强化区、瘤内动脉、AFP ≥ 400 μg/L纳入多因素logistic回归分析中,结果表明ECV、AFP ≥ 400 μg/L及瘤内动脉是预测VETC的独立危险因素(表 2)。
| 表 2 HCC的VETC模式的多因素logistic回归分析 |
 |
2.3 构建列线图模型及诊断效能评估
联合AFP ≥ 400 μg/L、瘤内动脉、ECV 3个独立危险因素构建列线图模型,绘制列线图及校准曲线(图 2,3),结果显示模型的C指数为0.781,校准曲线与模型一致性良好。ROC曲线显示,AFP ≥ 400 μg/L、瘤内动脉、ECV预测VETC的AUC分别为0.617、0.679和0.662,列线图模型的AUC为0.781(表 3,图 4)。DeLong检验显示,列线图模型预测VETC模式的AUC均大于AFP、瘤内动脉、ECV,差异均有统计学意义(Z=3.490,2.759,2.330;均P < 0.05)。
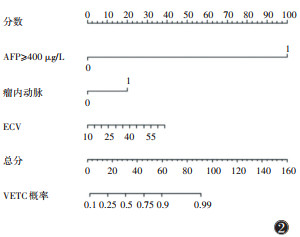 |
| 注:AFP为甲胎蛋白,ECV为细胞外体积分数 图 2 基于临床指标和CT增强扫描预测肝细胞癌(HCC)血管包绕肿瘤细胞簇(VETC)模式的列线图 |
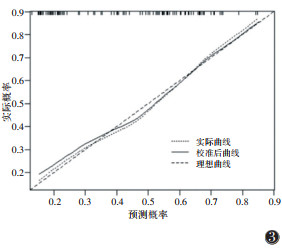 |
| 图 3 联合模型的校准曲线 |
| 表 3 ECV、AFP及瘤内动脉预测VETC模式的ROC曲线分析 |
 |
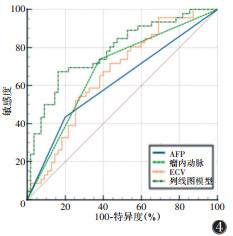 |
| 图 4 各独立危险因素及联合模型预测HCC的VETC模式的ROC曲线 |
3 讨论
VETC常预示着HCC预后更差[12-13],恶性程度更高,切除后复发概率越大,与患者总生存期、肿瘤疗效密切相关,是有效的预后指标[14]。研究表明,索拉非尼对VETC阳性的HCC患者治疗有效[7],且在手术切除前与手术切除后的辅助治疗中均有效,对VETC阴性患者则无效,因此,通过非侵入性方法识别VETC,有助于选择最有益的治疗方案。
本研究发现,VETC阳性组AFP ≥ 400 μg/L发生率高于VETC阴性组。AFP是目前使用最广泛且最易被患者接受的预测HCC恶性程度的血清标志物,其水平的变化与肿瘤大小、数量、恶性程度、进展、转移、复发及总生存期密切相关[15]。
本研究中VETC阳性组瘤内动脉发生率与阴性组差异有统计学意义,与Liu等[16]的结论一致,表明多个不规则的瘤内动脉与VETC存在显著相关性。瘤内动脉的存在常意味着肿瘤内血管生成活跃,这是HCC侵袭性和转移性的一个重要标志,反映了VETC中的血管生成激活,并提供了促进肿瘤细胞簇进入血流的血管基础,表明该肿瘤具有更强的侵袭性生物学特征。
本研究发现,VETC阳性组动脉期低强化区较阴性组发生率更高,提示VETC可能具有更显著的动脉期相对缺血特征。有研究表明,坏死或严重缺血在预测VETC时起重要作用[17],原因可能是血管包裹肿瘤簇的区域因血管内皮细胞的包绕与肿瘤细胞的压迫导致局部血流停滞或血液供应中断,以及该区域的氧气和营养供给严重不足,最终形成相对缺血肿瘤区域。但本研究中,动脉期低强化区在多因素logistic回归分析中并未成为独立危险因素,与Liu等[16]的研究结果一致,考虑可能是因大多数患者存在瘤内动脉肿瘤血管生成活跃,其与肿瘤的侵袭性、转移性等直接相关,而缺血可能仅是肿瘤生长的一个不良反应,因此瘤内动脉的强相关性掩盖了相对缺血的表现,表明瘤内动脉可能在影响肿瘤的生物学行为和预后中起更关键的作用。
本研究中,VETC阳性组的ECV大于VETC阴性组,差异有统计学意义。推测原因可能是:VETC阳性患者常表现出较高的Ang2血管生成因子表达,血管生成更丰富,而这些新生血管往往通透性较高,生成更多的细胞外基质成分,可能进一步支持新血管的形成,增强肿瘤的侵袭性[18];HCC的VETC易发生在缺氧区域,缺氧微环境会激活成纤维细胞,从而导致HCC内纤维基质更丰富[19],减缓HCC平衡期对比剂的廓清,表现为ECV较高[20]。
本研究构建了一种能有效预测HCC VETC阳性的列线图模型。该模型整合了多种来源的临床医学、影像学和检验医学信息,在多个疾病的诊断中展现出显著优势[21], 可为HCC患者提供更精准的治疗预后信息,具有重要的临床价值。
本研究存在的局限性:为回顾性研究,可能存在一定的选择偏倚;尽管列线图模型已通过单中心的内部验证,但仍需其他研究中心在使用不同CT的情况下进一步验证其可靠性;样本量较小,需在更广泛的患者群体中开展后续研究,以验证结论。
综上所述,基于CT测定的ECV及临床、CT特征构建的列线图模型是一种潜在的非侵入性预测HCC患者VETC的有效手段,有助于临床医师选择合适的治疗方案及评估预后。
| [1] |
RUMGAY H, ARNOLD M, FERLAY J, et al. Global burden of primary liver cancer in 2020 and predictions to 2040[J]. J Hepatol, 2022, 77(6): 1598-1606. DOI:10.1016/j.jhep.2022.08.021 |
| [2] |
RUMGAY H, FERLAY J, DE MARTEL C, et al. Global, regional and national burden of primary liver cancer by subtype[J]. Eur J Cancer, 2022, 161: 108-118. DOI:10.1016/j.ejca.2021.11.023 |
| [3] |
WANG Y, WANG M, CAO L, et al. A nomogram for preoperative prediction of vessels encapsulating tumor clusters (VETC) pattern and prognosis of hepatocellular carcinoma[J]. Am J Surg, 2024, 234: 172-178. DOI:10.1016/j.amjsurg.2024.05.004 |
| [4] |
KAWASAKI J, TOSHIMA T, YOSHIZUMI T, et al. Prognostic impact of vessels that encapsulate tumor cluster (VETC) in patients who underwent liver transplantation for hepatocellular carcinoma[J]. Ann Surg Oncol, 2021, 28(13): 8186-8195. DOI:10.1245/s10434-021-10209-5 |
| [5] |
WOO H Y, RHEE H, YOO J E, et al. Lung and lymph node metastases from hepatocellular carcinoma: Comparison of pathological aspects[J]. Liver Int, 2022, 42(1): 199-209. DOI:10.1111/liv.15051 |
| [6] |
LIU K, DENNIS C, PRINCE D S, et al. Vessels that encapsulate tumour clusters vascular pattern in hepatocellular carcinoma[J]. JHEP Rep, 2023, 5(8): 100792. DOI:10.1016/j.jhepr.2023.100792 |
| [7] |
FANG J H, XU L, SHANG L R, et al. Vessels that encapsulate tumor clusters (VETC) pattern is a predictor of sorafenib benefit in patients with hepatocellular carcinoma[J]. Hepatology, 2019, 70(3): 824-839. DOI:10.1002/hep.30366 |
| [8] |
王艺洁, 杨亚英, 魏博, 等. 基于MRI及CT的细胞外体积在恶性肿瘤中的应用与研究进展[J]. 磁共振成像, 2023, 14(9): 131-135. |
| [9] |
中华医学会影像技术分会, 中华医学会放射学分会. CT检查技术专家共识[J]. 中华放射学杂志, 2016, 50(12): 916-928. DOI:10.3760/cma.j.issn.1005-1201.2016.12.004 |
| [10] |
PENG Y, SHEN H, TANG H, et al. Nomogram based on CT-derived extracellular volume for the prediction of post-hepatectomy liver failure in patients with resectable hepatocellular carcinoma[J]. Eur Radiol, 2022, 32(12): 8529-8539. DOI:10.1007/s00330-022-08917-x |
| [11] |
FANG J H, ZHOU H C, ZHANG C, et al. A novel vascular pattern promotes metastasis of hepatocellular carcinoma in an epithelial-mesenchymal transition-independent manner[J]. Hepatology, 2015, 62(2): 452-465. DOI:10.1002/hep.27760 |
| [12] |
RENNE S L, WOO H Y, ALLEGRA S, et al. Vessels encapsulating tumor clusters (VETC) is a powerful predictor of aggressive hepatocellular carcinoma[J]. Hepatology, 2020, 71(1): 183-195. DOI:10.1002/hep.30814 |
| [13] |
DING T, XU J, ZHANG Y, et al. Endothelium-coated tumor clusters are associated with poor prognosis and micrometastasis of hepatocellular carcinoma after resection[J]. Cancer, 2011, 117(21): 4878-4889. DOI:10.1002/cncr.26137 |
| [14] |
WANG M, CAO L, WANG Y, et al. The prognostic value of vessels encapsulating tumor clusters (VETC) in patients with hepatocellular carcinoma: a systematic review and meta-analysis[J]. Clin Transl Oncol, 2024, 26(8): 2037-2046. DOI:10.1007/s12094-024-03427-2 |
| [15] |
GALLE P R, FOERSTER F, KUDO M, et al. Biology and significance of alpha-fetoprotein in hepatocellular carcinoma[J]. Liver Int, 2019, 39(12): 2214-2229. DOI:10.1111/liv.14223 |
| [16] |
LIU Z, MAO Y, LIU L, et al. Preoperative CT features for characterization of vessels that encapsulate tumor clusters in hepatocellular carcinoma[J]. Eur J Radiol, 2024, 179: 111681. DOI:10.1016/j.ejrad.2024.111681 |
| [17] |
ZHANG J, LIU M, QU Q, et al. Radiomics analysis of gadoxetic acid-enhanced MRI for evaluating vessels encapsulating tumour clusters in hepatocellular carcinoma[J]. Front Oncol, 2024, 14: 1422119. DOI:10.3389/fonc.2024.1422119 |
| [18] |
HUANG C W, LIN S E, HUANG S F, et al. The vessels that encapsulate tumor clusters (VETC) pattern is a poor prognosis factor in patients with hepatocellular carcinoma: an analysis of microvessel density[J]. Cancers (Basel), 2022, 14(21): 5428. DOI:10.3390/cancers14215428 |
| [19] |
PAN J, HUANG H, ZHANG S, et al. Intraindividual comparison of CT and MRI for predicting vessels encapsulating tumor clusters in hepatocellular carcinoma[J]. Eur Radiol, 2025, 35(1): 61-72. |
| [20] |
OZAKI K, OHTANI T, ISHIDA S, et al. Extracellular volume fraction obtained by dual-energy CT depicting the etiological differences of liver fibrosis[J]. Abdom Radiol (NY), 2023, 48(6): 1975-1986. DOI:10.1007/s00261-023-03873-6 |
| [21] |
GU X, RONG J, ZHU L, et al. Hepatoid adenocarcinoma of the stomach: discrimination from conventional gastric adenocarcinoma with a computed tomography-based radiomics nomogram[J]. J Gastrointest Oncol, 2024, 15(5): 2041-2052. DOI:10.21037/jgo-24-210 |
 2025, Vol. 23
2025, Vol. 23


