| 钆塞酸二钠增强MRI对肝硬化患者肝功能的量化评估 |
2. 南通市肿瘤医院/南通大学附属肿瘤医院影像科,江苏 南通 226000;
3. 南通大学医学院,江苏 南通 226000
2. Department of Imaging, Nantong Tumor Hospital, Nantong Tumor Hospital Affiliated to Nantong University, Nantong 226000, China;
3. Medical School, Nantong University, Nantong 226000, China
肝硬化属于晚期慢性肝病,肝硬化患者肝功能与预后、并发症和死亡率相关[1]。目前肝功能量化主要基于临床和实验室评分,如Child-Pugh评分、终末期肝病模型(model for end-stage liver disease,MELD)评分[2]。研究发现,钆塞酸二钠(gadolinium ethoxybenzyl diethylene-triamine-pentaacetic-acid,Gd-EOB-DTPA)增强MRI具有一站式评估肝脏病变及肝功能的潜力[3-5]。本研究结合多种临床评分系统将肝硬化患者分为肝功能良好组和肝功能不良组,探讨Gd-EOB-DTPA增强MRI对肝硬化患者肝功能的评估能力。
1 资料与方法 1.1 一般资料回顾性收集南通大学附属南通第三医院2017年8月至2019年7月行Gd-EOB-DTPA增强MRI检查的76例肝硬化患者。纳入标准:①均符合《肝硬化诊治指南》[6]中肝硬化的诊断依据。②临床及影像资料齐全;③MRI检查前2周内接受生化检查。排除标准: ①图像质量差;②肝脏巨块型及弥漫性病变;③既往有肝脏病变治疗及脾脏切除术史。最终纳入76例,男61例,女15例;年龄37~75岁,平均(53.9±8.7)岁。本研究经医院伦理委员会批准(批号:EK2024064),患者或家属均签署知情同意书。
记录患者的性别、年龄、身高、体质量、有无肝性脑病,以及白蛋白、凝血酶原时间、总胆红素、国际标准化比值、血肌酐、腹水及吲哚菁绿15 min滞留率(indocyanine green retention rate at 15 minutes,ICG-R15)等。计算Child-Pugh评分、MELD评分及白蛋白-胆红素(albumin-bilirubin,ALBI)评分[2]:①采用Child-Pug评分结合血清白蛋白、总胆红素、凝血酶原延长时间、腹水及肝性脑病情况进行分级,5~6分为A级,7~9分为B级,10~15分为C级,分级越低,肝功能越好。②MELD评分=9.57×ln血肌酐+3.78×ln总胆红素+11.2×ln国际标准化比值+6.43;为避免MELD评分出现负数,当血肌酐、总胆红素及国际标准化比值< 1时,MELD评分计为1分;根据MELD评分,分为MELD评分≤10分组和MELD评分 > 10分组,分值越低,肝功能越好。③ALBI评分=lg胆红素×0.66-0.085×白蛋白;ALBI评分 < -2.60分为Ⅰ级,-2.60~-1.39分为Ⅱ级,> -1.39分为Ⅲ级,分级越低,肝功能越好。
1.2 仪器与方法采用Philips 3.0 T Achieva MRI扫描仪行上腹部平扫及增强扫描。增强扫描经外周静脉注射对比剂Gd-EOB-DTPA,流率1.0 mL/s,剂量0.025 mmol/kg体质量,后用20 mL生理盐水冲洗。在对比剂注射前及注射后20、60、180 s分别采集平扫、动脉期、门静脉期、移行期图像,肝胆期图像于注射对比剂后19 min采集。
T1 mapping扫描:采用Look-Locker序列,于注射对比剂前及注射后20 min在肝门层面采集图像。扫描参数:TR 1.96 ms,TE 0.88 ms,翻转角20°,层厚10 mm,采集次数1,视野320 mm×320 mm,矩阵180×160,共56期,扫描时间11 s。
1.3 图像分析由2位高年资(10、15年)放射科腹部诊断医师分别对影像资料进行分析。测量肝脏平扫T1弛豫时间(precontrast T1,T1pre)、增强后20 min(肝胆期)T1弛豫时间(postcontrast T1,T1post)、平扫及肝胆期肝脏信号强度(signal intensity,SI)、肝胆期脾脏和竖脊肌SI。计算肝胆期肝脏-脾脏信号强度比(liver-to-spleen ratio,LSR)、肝胆期肝脏-竖脊肌信号强度比(liver-to-muscle ratio,LMR)、相对增强程度(relative enhancement,RE)、相对增强指数(relative enhancement index,REI)、T1弛豫时间减低率(reduction rate of T1,rrT1)、肝脏功能影像评分(functional liver imaging score,FLIS)。ROI放置在肝左外叶、左内叶、右前叶、右后叶、竖脊肌和脾脏,大小为1.0~3.5 cm2,避开大血管、病变和伪影,不同患者不同序列ROI尽量放置于同一解剖部位,肝脏取4个ROI的平均值作为该患者肝脏的参数。计算公式:LSR=SI肝脏(肝胆期)/SI脾脏(肝胆期);LMR=SI肝脏(肝胆期)/SI竖脊肌(肝胆期);RE=[SI肝脏(肝胆期)-SI肝脏(平扫)]/SI肝脏(平扫);rrT1=(T1pre-T1post)/T1pre×100%。通过T1WI脂肪抑制序列测定肝脏体积(liver volume,LV),计算REI,公式:REI=RE×LV[7]。
FLIS评分包括:①肝实质强化评分,与右肾实质信号相比较,肝实质信号低于、等于、高于肾实质得分分别为0、1、2分;②胆道对比剂排泄评分,胆道信号强度低于、等于、高于肝实质得分分别为0、1、2分;③门静脉强化得分,门静脉信号强度高于、等于、低于肝实质得分分别为0、1、2分。FLIS评分为上述3个评分之和,总分为0~6分。
1.4 统计学分析使用SPSS 22.0、MedCalc 15.0软件进行统计分析。采用Shapiro-Wilk检验分析数据的正态性,正态分布的连续变量以x±s表示,非正态分布时以M(QL,QU)表示。采用独立样本t检验和Mann-Whitney检验比较不同组别患者的LMR、LSR、FLIS、REI、T1post、rrT1。基于Child-Pugh分级、MELD评分、ICG-R15和ALBI分级,采用k-means聚类算法将患者分为肝功能良好组和肝功能不良组,比较不同分组患者的LMR、LSR、FLIS、REI、T1post、rrT1。绘制ROC曲线分析MRI各参数对肝功能不良的诊断效能。以P<0.05为差异有统计学意义。
2 结果76例中,Child-Pugh A级51例,B+C级25例;MELD ≤ 10分57例,MELD>10分19例;ICG-R15 ≤ 20% 50例,ICG-R15>20% 26例;ALBI Ⅰ级33例,ALBI Ⅱ+Ⅲ级43例。
LMR、LSR、FLIS、T1post、rrT1在不同Child-Pugh分级、MELD评分、ICG-R15分组、ALBI分级间比较,差异均有统计学意义(均P<0.05);REI在不同MELD评分及ALBI分级间比较,差异均有统计学意义(均P<0.05)(表 1~4)。
| 表 1 不同Child-Pugh分级患者MRI增强扫描肝胆期各参数的比较 |
 |
| 表 2 不同MELD评分患者MRI增强扫描肝胆期各参数的比较 |
 |
| 表 3 不同ICG -R15分组患者MRI增强扫描肝胆期各参数的比较 |
 |
| 表 4 不同ALBI分级患者MRI增强扫描肝胆期各参数的比较 |
 |
基于肝硬化患者的Child-Pugh评分、MELD评分、ICG-R15和ALBI评分,采用k-means聚类算法将患者分为肝功能良好组52例及肝功能不良组24例。LMR、LSR、FLIS、T1post、rrT1在2组间差异均有统计学意义(均P<0.05),REI在2组间差异无统计学意义(P>0.05)(表 5;图 1, 2)。
| 表 5 肝功能良好与不良患者MRI增强扫描肝胆期各参数的比较 |
 |
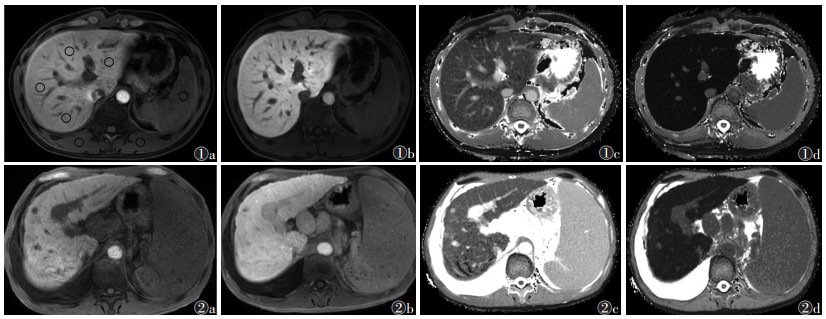 |
| 注:图 1患者,男,27岁,肝功能良好。图 1a~1d分别为MRI平扫、肝胆期、T1pre及T 1post图像,LSR=3.06,LMR=3.81,REI=1 574.64,FLIS=6分,rrT1=64.68%,T1post=249.20 ms。图 2患者,男,54岁,肝功能不良。图 2a~2d分别为MRI平扫、肝胆期、T1pre及T1post图像,LSR=1.80,LMR=2.18,REI=1 336.35,FLIS=4分,rrT1=56.79%,T1post= 412.64 ms(T1pre为平扫肝脏T1弛豫时间,T1post为肝胆期T1弛豫时间,LSR为肝脏-脾脏信号强度比,LMR为肝胆期肝脏-竖脊肌信号强度比,REI为相对增强指数,FLIS为肝脏功能影像评分,rrT1为T1弛豫时间减低率) 图 1-2 肝功能良好组及不良组患者MRI图像 |
ROC曲线显示,MRI各参数中,LMR敏感度最高,为95.83%;rrT1特异度最高,为94.23%;T1post的AUC最高,为0.951(表 6,图 3);REI的AUC分别与LMR、LSR、FLIS、T1post、rrT1比较,差异均有统计学意义(均P<0.05);LMR、LSR、FLIS、T1post、rrT1的AUC两两比较,差异均无统计学意义(均P>0.05)。
| 表 6 MRI各参数对肝功能不良的诊断效能 |
 |
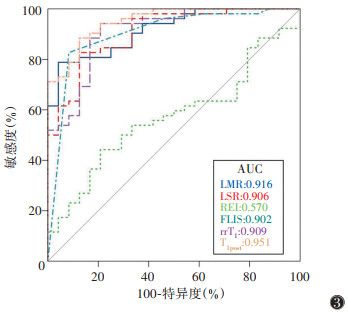 |
| 注:LMR为肝胆期肝脏-竖脊肌信号强度比,LSR为肝脏-脾脏信号强度比,REI为相对增强指数,FLIS为肝脏功能影像评分,rrT1为T1弛豫时间减低率,T1post为肝胆期T1弛豫时间 图 3 MRI各参数诊断肝功能不良的ROC曲线 |
3 讨论
目前常用的临床肝功能评分系统有Child-Pugh分级、ALBI分级、MELD评分及ICG-R15。Gd-EOB-DTPA增强MRI作为肝脏一站式无创检查方法,可对肝病患者肝功能进行定量及半定量评估。
SI的衍生参数是目前应用最广泛的定量评估肝功能的影像学生物标志物。Wang等[8]报道LSR、LMR与Child-Pugh分级、MELD评分呈强相关性。一项前瞻性多中心研究发现,LSR与白蛋白、胆红素、天冬氨酸转氨酶、血小板计数及钠有显著相关性,LSR可用于区分不同ALBI、Child-Pugh和MELD-Na分级患者[9]。本研究显示,LSR、LMR在不同Child-Pugh分级、MELD评分、ICG-R15分组、ALBI分级,以及肝功能良好组与不良组中比较,差异均有统计学意义(均P<0.05);肝功能越差,LSR、LMR越低,LSR采用1.76、LMR采用2.65作为临界值,诊断肝功能不良的AUC均高于0.90,LMR的敏感度高达95.83%。Eiras-Araujo等[7]研究表明,REI与Child-Pugh分级、MELD评分和吲哚菁绿血浆清除率(indocyanine green plasma disappearance rate,ICG-PDR)具有良好的相关性,结合Child-Pugh分级、MELD评分和ICG-PDR将患者分为肝功能良好组和肝功能不良组,REI诊断肝功能不良的AUC为0.94、敏感度为100%、特异度为76%。但在本研究的4个常用临床评分系统中REI仅在不同MELD评分和ALBI分级中差异有统计学意义(均P<0.05),且诊断肝功能不良的AUC仅0.570,与文献[7]报道不同。Wang等[8]研究也发现,RE与Child-Pugh分级、MELD评分无显著相关性。可见,采用肝实质增强参数RE及引入LV后的增强参数REI对评估肝功能价值有限,尚需进一步探讨。
Bastati等[10]开发了一种简单的肝功能评估方法——FLIS,与其他定量参数相比,这种半定量方法更易获取,直观反映了肝实质增强、胆道对比剂排泄、门静脉强化程度,FLIS为0~6分,代表上述3个参数的总和,分值越低,肝功能差。以往研究发现,FLIS与Child-Pugh分级有较强的相关性,是评估肝功能最简单、最好的MRI参数[3, 11-12]。本研究显示,FLIS在不同Child-Pugh分级、MELD评分、ICG-R15分组和ALBI分级中差异均有统计学意义(均P<0.05),以5分作为临界值,FLIS诊断肝功能不良的AUC为0.902,敏感度和特异度分别为91.67%、82.69%。随病情进展,正常肝细胞的数量持续减少,肝实质强化减弱,排泄至胆道系统的速度及程度降低,对比剂在门静脉中持续存在,均可引起FLIS降低,提示肝功能受损。
T1 mapping不受设备本身的影响,能反映组织真实的T1值,随病情进展,正常功能肝细胞减少,肝细胞对Gd-EOB-DTPA的摄取减少,T1弛豫时间缩短,可作为评价肝功能的无创影像学指标[13-14]。本研究显示T1post、rrT1在4种肝功能评分组间比较差异均有统计学意义(均P<0.05),与之前的研究结果[8, 15-17]一致,分别采用347.67 ms、61.16%作为临界值,诊断肝功能不良的AUC分别为0.951、0.909,且rrT1在各参数中特异度最高、T1post的AUC最高。
本研究存在的局限性:样本量较小,按不同临床评分系统分组时样本量分布不一致;为单中心研究,需扩大样本量行多中心前瞻性研究进一步验证;针对整个肝脏功能进行评价,未对肝段功能进行研究。
综上所述,Gd-EOB-DTPA增强MRI参数LMR、LSR、FLIS、T1post、rrT1可用于评估肝功能,对肝硬化患者肝功能进行分级;LMR的敏感度最高、rrT1的特异度最高、T1post的AUC最高;有助于为慢性肝病患者的随访监测及个体化治疗提供参考。
| [1] |
MOKDAD A A, LOPEZ A D, SHAHRAZ S, et al. Liver cirrhosis mortality in 187 countriesbetween 1980 and 2010:a systematic analysis[J]. BMC Med, 2014, 12: 145. DOI:10.1186/s12916-014-0145-y |
| [2] |
BEER L, MANDORFER M, BASTATI N, et al. Inter- and intra-reader agreement for gadoxetic acid-enhanced MRI parameter readings in patients with chronic liver diseases[J]. Eur Radiol, 2019, 29(12): 6600-6610. DOI:10.1007/s00330-019-06182-z |
| [3] |
LEE H J, HONG S B, LEE N K, et al. Validation of functional liver imaging scores (FLIS) derived from gadoxetic acid-enhanced MRI in patients with chronic liver disease and liver cirrhosis: the relationship between Child-Pugh score and FLIS[J]. Eur Radiol, 2021, 31(11): 8606-8614. DOI:10.1007/s00330-021-07955-1 |
| [4] |
毕新军, 张学琴, 陆健, 等. 钆塞酸二钠增强MRI肝细胞摄取定量参数评估肝功能[J]. 放射学实践, 2021, 36(4): 514-519. |
| [5] |
姚吕祥, 赖文佳, 靳仓正, 等. 基于Gd-EOB-DTPA增强MRI的评分系统在肝功能评估中的应用[J]. 临床放射学杂志, 2022, 41(5): 897-901. |
| [6] |
中华医学会肝病学分会. 肝硬化诊治指南[J]. 临床肝胆病杂志, 2019, 35(11): 2408-2425. DOI:10.3969/j.issn.1001-5256.2019.11.006 |
| [7] |
EIRAS-ARA JO A L, PARENTE D B, DA SILVA A C, et al. Relative enhancement index can be used to quantify liver function in cirrhotic patients that undergo gadoxetic acid-enhanced MRI[J]. Eur Radiol, 2023, 33(7): 5142-5149. DOI:10.1007/s00330-023-09402-9 |
| [8] |
WANG Q, KESEN S, LILJEROTH M, et al. Quantitative evaluation of liver function with gadoxetic acid enhanced MRI: comparison among signal intensity-, T1-relaxometry-, and dynamic-hepatocyte-specific-contrast-enhanced MRI-derived parameters[J]. Scand J Gastroenterol, 2022, 57(6): 705-712. DOI:10.1080/00365521.2022.2032321 |
| [9] |
CAL O, PEYNIRCIOGLU B, LOEWE C, et al. Correlation of liver enhancement in gadoxetic acid-enhanced MRI with liver functions: a multicenter-multivendor analysis of hepatocellular carcinoma patients from SORAMIC trial[J]. Eur Radiol, 2022, 32(2): 1320-1329. DOI:10.1007/s00330-021-08218-9 |
| [10] |
BASTATI N, BEER L, MANDORFER M, et al. Does the functional liver imaging score derived from gadoxetic acid-enhanced MRI predict outcomes in chronic liver disease?[J]. Radiology, 2020, 294(1): 98-107. DOI:10.1148/radiol.2019190734 |
| [11] |
杜艳妮, 吕志彬, 关春爽, 等. 钆塞酸二钠增强MRI功能性肝脏影像评分影像征象与Child-Turcotte-Pugh分级评估肝功能的对照研究[J]. 临床放射学杂志, 2021, 40(11): 2134-2138. DOI:10.3969/j.issn.1001-9324.2021.11.lcfsxzz202111018 |
| [12] |
ASLAN S, ERYURUK U, TASDEMIR M N, et al. Determining the efficacy of functional liver imaging score (FLIS) obtained from gadoxetic acid-enhanced MRI in patients with chronic liver disease and liver cirrhosis: the relationship between Albumin-Bilirubin (ALBI) grade and FLIS[J]. Abdom Radiol (NY), 2022, 47(7): 2325-2334. DOI:10.1007/s00261-022-03557-7 |
| [13] |
MA B, XU H, WU X, et al. Evaluation of liver function using Gd-EOB-DTPA-enhanced MRI with T1 mapping[J]. BMC Med Imaging, 2023, 23(1): 73. DOI:10.1186/s12880-023-01028-z |
| [14] |
张海燕, 孙占国. 钆塞酸二钠增强MRI T1 mapping成像对慢性肝病及肝功能评估的研究进展[J]. 中国中西医结合影像学杂志, 2023, 21(3): 331-334, 339. DOI:10.3969/j.issn.1672-0512.2023.03.021 |
| [15] |
毕新军, 张学琴, 陆健, 等. 钆塞酸二钠增强MR T1mapping成像对肝功能的定量评估价值[J]. 临床放射学杂志, 2020, 39(10): 1992-1996. |
| [16] |
杨品, 姜艳丽, 王鹏飞, 等. Gd-EOB-DTPA增强MRI T1 mapping技术对肝功能评估的诊断价值[J]. 临床放射学杂志, 2023, 42(5): 773-777. |
| [17] |
BI X J, ZHANG X Q, ZHANG T, et al. Quantitative assessment of liver function with hepatocyte fraction: comparison with T1 relaxation-based indices[J]. Eur J Radiol, 2021, 141: 109779. DOI:10.1016/j.ejrad.2021.109779 |
 2025, Vol. 23
2025, Vol. 23


