| 基于药代动力学对比增强MRI影像组学模型列线图预测乳腺癌腋窝淋巴结转移的价值 |
2. 烟台毓璜顶医院影像科,山东 烟台 264000
2. Department of Imaging, Yantai Yuhuangding Hospital, Yantai 264000, China
乳腺癌是常见的女性恶性肿瘤,发病率逐年上升且趋向年轻化,严重威胁女性的身心健康[1-2]。腋窝淋巴结(axillary lymph node,ALN)是乳腺癌最常见的转移部位,其状态直接关系到治疗方案的选择[3-4]。前哨淋巴结活检是评估ALN状态的主要手段,但其为有创检查,且并发症较多,易增加患者感染风险[5-6]。
目前,超声、乳腺X线摄影、MRI被认为是评估乳腺癌ALN转移的主要方法[7],但超声诊断易受医师主观因素影响[8];乳腺X线摄影有辐射且易受体位影响,难以观察到完整的腋窝区域[9];MRI因无辐射、软组织分辨力高、可多参数、多方位成像等优势成为评估乳腺癌ALN转移的主要手段[10]。药代动力学对比增强(pharmacokinetic dynamic contrast-enhanced,Pk-DCE)可反映对比剂在血管和组织之间的转运情况,提供定量参数,监测肿瘤组织的微循环状态,对肿瘤转移的评估预测更具优势[11]。
影像组学是医学影像与计算机科学、数据挖掘技术深度融合的产物,其利用先进的算法,通过ROI勾画、特征提取及筛选,从医学影像图像中获取深层次的信息,结合统计学和机器学习工具最终建立模型。影像组学可量化有关肿瘤异质性或其他有价值的特征,为疾病的诊断、预测和治疗评估提供更多可能,从而辅助医师进行更精准、更全面的诊断[12-14]。目前,基于动态对比增强(dynamic contrast-enhanced,DCE) MRI术前预测乳腺癌ALN转移的国内外研究较多见 [15-17],鲜有基于Pk-DCE-MRI预测乳腺癌ALN转移的研究。本研究基于Pk-DCE-MRI图像,运用影像组学方法从影像中提取定量特征,构建一种无创的乳腺癌术前ALN转移预测模型,以辅助临床制订个性化治疗方案。
1 资料与方法 1.1 一般资料回顾性收集烟台毓璜顶医院2019年11月至2022年11月术前行乳腺DCE-MRI且经病理证实的乳腺癌患者。纳入标准:①直径>5 mm的肿块性病变;②病理结果及临床资料齐全,临床资料包括年龄、肿瘤直径、雌激素受体、孕激素受体、人类表皮生长因子受体2 (human epidermal growth factor receptor 2,Her-2)和Ki67等。排除标准:①既往行乳腺手术、化疗、放疗、激素治疗的患者;②图像质量不佳。共纳入591例,其中ALN转移243例,无ALN转移348例;按照9∶1的比例随机分为训练集531例和测试集60例。本研究经医院伦理委员会审批(批号:2022-248),免除患者知情同意。
1.2 仪器与方法采用GE Discovery 750W 3.0 T MRI扫描仪,8通道乳腺专用线圈。患者取俯卧位,DCE-MRI在轴向平面上行快速序列扫描,扫描参数:TR 6.2 ms,TE 2.3 ms,翻转角15°,矩阵288×320,视野36 cm× 36 cm,层厚2 mm,无间隔。扫描30期,第1期为蒙片,采用高压注射器以团注方式注入对比剂Gd-DTPA (碘浓度470 mg/mL),剂量0.2 mmol/kg体质量,流率2.5 mL/s,后注射生理盐水30 mL,单期扫描时间16 s,共扫描8 min。
1.3 药代动力学参数提取将DCE-MRI数据传输至离线工作站,由2位分别有10、15年乳腺影像诊断经验的放射科医师(医师1、医师2),采用双盲法进行分析:①使用定量分析软件OmniKinetics(GE Healthcare),利用非线性配准框架算法纠正因呼吸或不自主运动引起的相位错位,以消除潜在的图像失真和伪影,确保数据的准确性。②手动绘制胸主动脉,提取动脉输入函数,描述对比剂在血液中的浓度变化,以准确计算药代动力学参数。③选用二室扩展Tofts模型计算药代动力学参数,包括容量转移常数(Ktrans)、流出速率常数(Kep)、血管外细胞间隙体积分数(Ve)和血浆容积分数(Vp)。
1.4 图像分割将DCE-MRI原始图及参数图导入ITK-SNAP软件进行图像分割。医师1在DCE-MRI强化最明显一期的原始图及参数图上沿肿瘤边缘逐层勾画ROI,保存为VOI,由医师2审查。为评估观察者间分割的一致性,在训练集中随机选择60例患者,由医师2和1位具有12年乳腺影像诊断经验的医师3勾画ROI,医师1在30 d后重新勾画。ROI包括整个肿瘤区域,并尽量避开坏死和囊腔。用Dice系数评价观察者间图像分割的一致性。
1.5 影像组学特征提取及筛选为确保提取的特征具有较高一致性,在图像特征提取之前,通过Z-score对DCE-MRI图像进行标准化处理,用Pyradiomics3.0.1进行特征提取,提取的特征包括一阶特征、形状特征、纹理特征和滤波特征。通过ICC评估影像组学特征提取的一致性。影像组学特征筛选:①用方差阈值法进行筛选,去除方差<0.8的特征值;②用Select-K Best筛选P<0.05的特征;③用最小绝对收缩和选择算子(least absolute shrinkage and selection operator regression,LASSO) 算法和5折交叉验证选择最佳特征。将筛选出的特征行logistic回归分析,获得各特征对应的回归系数,通过特征值和回归系数线性组合得到影像组学评分(Radscore)。
1.6 模型构建基于DCE原始图、Ktrans、Kep、Ve、Vp参数图建立影像组学模型,即DCE模型、Ktrans模型、Kep模型、Ve模型、Vp模型,并计算各模型的Radscore。筛选有无ALN转移患者差异有统计学意义的临床指标建立临床模型。将差异有统计学意义的临床特征和Radscore行单因素logistic回归分析,将P<0.05的特征再行多因素logistic回归分析,筛选出最有价值的特征构建联合模型,并绘制列线图。
1.7 统计学分析采用Python(3.6.0)和R语言(4.0.3)软件进行数据分析。采用Kolmogorov-Smirnov法行正态分布检验,符合正态分布的数据以 x±s表示,组间比较行t检验;非正态分布的数据以M(QL,QU)表示,组间比较采用秩和检验。分类变量间比较采用χ2检验。绘制ROC曲线评估模型的预测效能。通过DeLong检验评估不同模型之间的预测效能。绘制校准曲线和决策曲线分析(decision curve analysis,DCA)评估模型的临床净收益。以P<0.05为差异有统计学意义。
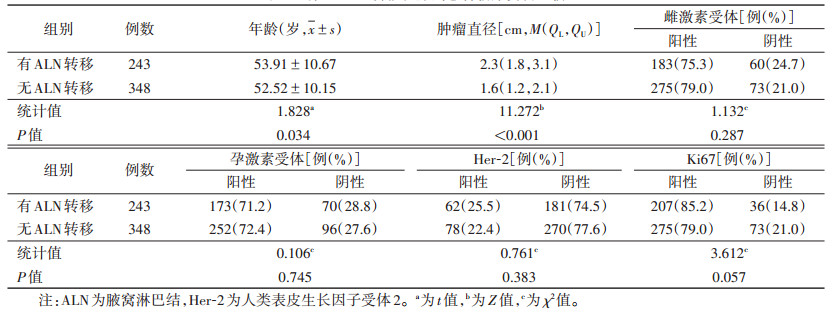
2 结果 2.1 有无ALN转移乳腺癌患者临床资料比较有无ALN转移乳腺癌患者之间,年龄、肿瘤直径差异均有统计学意义(均P<0.05),其他指标差异均无统计学意义(均P>0.05)(表 1)。
| 表 1 有无ALN转移乳腺癌患者临床资料比较 |
 |
2.2 特征筛选与影像组学模型构建
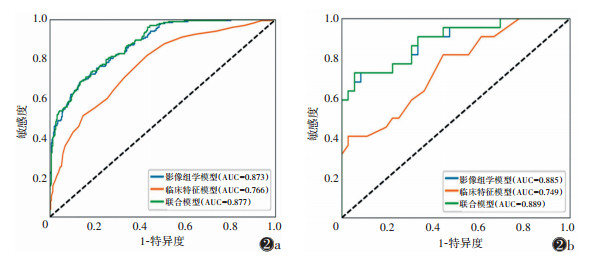
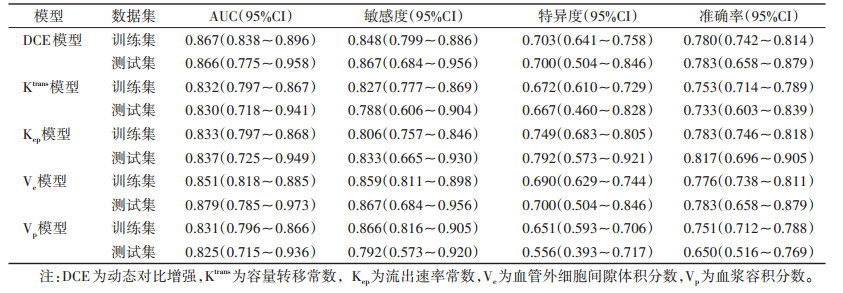
每组图像提取1 409个影像组学特征,最终从DCE图像中筛选出26个;从Ktrans图像中筛选出18个;从Kep图像中筛选出22个;从Ve图像中筛选出30个;从Vp图像中筛选出18个。通过logistic回归分析建立DCE模型、Ktrans模型、Kep模型、Ve模型、Vp模型,计算出各模型的Radscore。通过ROC曲线评估模型的预测能力(表 2)。在测试集中,Ve模型效能最佳,AUC为0.879(95%CI 0.785~0.973),敏感度为0.867(95%CI 0.684~0.956),特异度为0.700(95%CI 0.504~0.846)。
| 表 2 各模型在训练集和测试集中的预测效能 |
 |
2.3 变量筛选与临床特征模型、联合模型构建
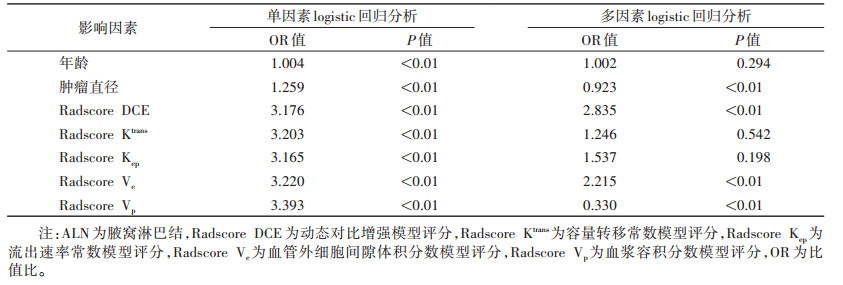
将年龄、肿瘤直径、Radscore DCE、Radscore Ktrans、Radscore Kep、Radscore Ve、Radscore Vp行单因素和多因素logistic回归分析。多因素分析显示,年龄、Radscore Ktrans、Radscore Kep差异均无统计学意义(均P>0.05) (表 3)。最终选择肿瘤直径构建临床特征模型,选择Radscore DCE、Radscore Ve、Radscore Vp构建影像组学模型,选择肿瘤直径、Radscore DCE、Radscore Ve、Radscore Vp构建联合模型,并绘制列线图(图 1)。
| 表 3 乳腺癌ALN转移单因素和多因素logistic回归分析结果 |
 |
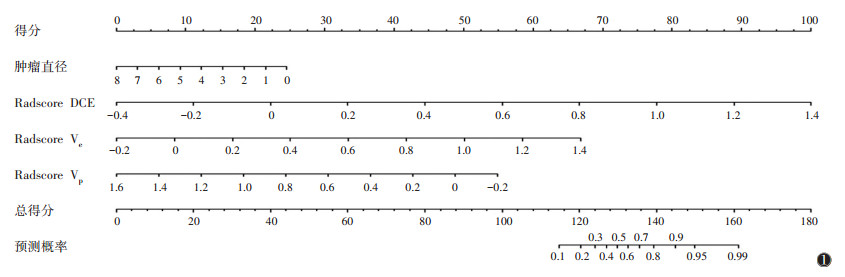 |
| 图 1 预测乳腺癌淋巴结转移的联合模型的列线图 |
2.4 模型效能与评估验证
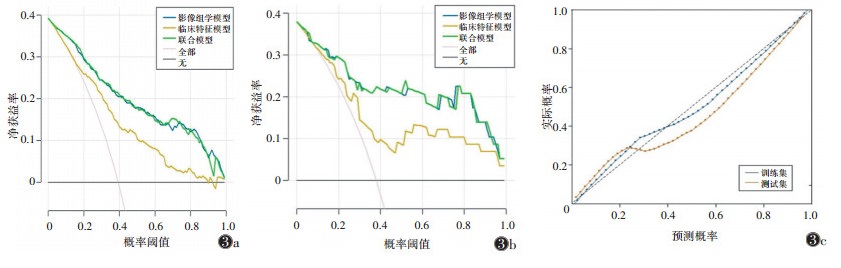
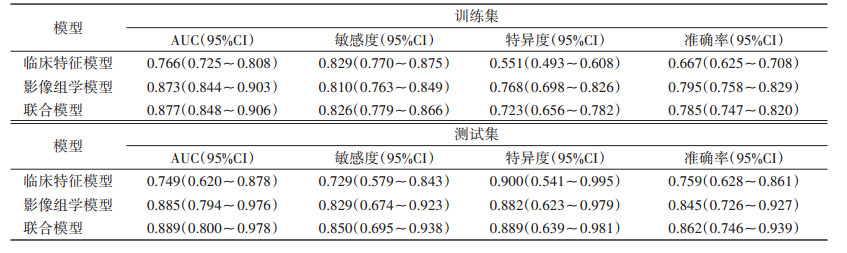
联合模型的预测效能优于临床特征模型、影像组学模型(表 4)。在训练集中,联合模型的AUC为0.877(95%CI 0.848~0.906)(图 2a),比临床特征模型和影像组学模型的AUC分别提高14.5%和0.45%;与临床特征模型相比,两者的敏感度水平相当,联合模型的准确率、特异度明显高于临床特征模型;与影像组学模型相比,联合模型的敏感度高出约2.0%,特异度、准确率略低。在测试集中,联合模型的AUC为0.889(95%CI 0.800~0.978)(图 2b),比临床特征模型和影像组学模型的AUC分别提高约18.7% 和0.45%,且联合模型的敏感度、准确率均明显高于临床特征模型和影像组学模型。DeLong检验表明,训练集和测试集中影像组学模型及联合模型的AUC均优于临床特征模型(均P<0.05),影像组学模型与联合模型之间差异无统计学意义(均P>0.05)。DCA显示,联合模型预测乳腺癌ALN转移有显著的临床净收益(图 3a,3b)。校准曲线显示训练集和测试集预测的一致性良好(图 3c)。
| 表 4 临床特征模型、影像组学模型、联合模型的诊断效能 |
 |
3 讨论
乳腺癌患者术前ALN的评估对制订治疗方案和预后有重要意义[18],因此,寻求一种无创的术前预测乳腺癌淋巴结转移的方法对患者和临床医师均有较大帮助[19]。Liu等[20]基于DCE-MRI图像进行特征提取,建立联合模型预测ALN转移的AUC为0.763,但其纳入的样本量较小,模型预测效能有待提高。Dong等[21]基于脂肪抑制T2WI图像和DWI图像建立预测乳腺癌ALN转移的联合模型,验证集和训练集的AUC分别为0.863和0.805,低于本研究结果,表明常规MRI序列预测效能不够理想。本研究采用DCE-MRI图像和药代动力学参数图像建立预测模型,可获取更丰富的信息,提高预测效能。
Pk-DCE-MRI可通过提供定量参数反映对比剂在血管和组织之间的转运情况,在显示肿瘤内部异质性和提供肿瘤微观信息方面更有优势[22]。目前,在影像组学领域,基于Pk-DCE-MRI影像组学预测术前乳腺癌ALN转移主要通过Ktrans、Kep、Ve、Vp参数,而本研究基于Ktrans、Kep、Ve、Vp参数图像,勾画ROI,提取影像组学特征并建立Ktrans模型、Kep模型、Ve模型、Vp模型预测乳腺癌ALN转移。Liu等[23]基于Pk-DCE-MRI影像组学建立预测术前乳腺癌ALN转移的联合模型,其训练集和验证集的AUC分别为0.80和0.76,此模型在肿瘤的最大层面提取影像组学特征,预测结果略低于本研究。本研究基于整个肿瘤的VOI,可获取更多的特征,预测效能更高。Zhou等[24]用Pk-DCE-MRI影像组学建立模型,预测乳腺癌良恶性的Ktrans、Kep、Ve、Vp模型的AUC分别为0.95、0.93、0.89和0.96,临床意义较高;但在预测分子分型雌激素受体/孕激素受体、Her-2、Ki-67的AUC为0.71~0.77、0.61~0.68、0.67~0.74。该研究仅用影像组学特征建立模型,靠单一指标很难准确预测乳腺癌的分子分型。
列线图作为一种可视化预测工具,可结合影像组学特征和临床特征,将复杂的统计学模型转化为直观的图形界面,仅找到相应的特征值,将预测值相加,即可得到最终的预测结果 [25]。本研究纳入临床特征肿瘤直径和Radscore DCE、Radscore Ve、Radscore Vp建立联合模型,在训练集中的AUC为0.877 (95%CI 0.848~0.906),在测试集的AUC为0.889(95%CI 0.800~0.978),诊断效能较好。这与Mao等[26]在DCE MRI图像上提取的影像组学特征并结合MRI报告的淋巴结状态构建列线图的结果相似,表明联合模型预测乳腺癌ALN转移有较高的效能。
本研究仍存在一定的局限性:①样本量较小,后期会继续开展大样本、多中心研究;②手动勾画ROI可能存在部分偏差,出现结果偏倚;③仅用1种分类器构建模型,后续可选用其他模型进行验证和比较,以增加研究的全面性和准确性;④未纳入非肿块型乳腺癌,后续将加入此类患者。
综上所述,基于Pk-DCE-MRI影像组学构建的模型,可有效预测乳腺癌ALN状态,具有显著临床净收益,为临床预测乳腺癌ALN转移提供了一种新颖且有效的方法,有助于在术前精准评估乳腺癌淋巴结状态,为患者提供个性化诊疗服务,进一步提高治疗效果和患者的生活质量。
| [1] |
SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020:globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
LOIBL S, POORTMANS P, MORROW M, et al. Breast cancer[J]. Lancet, 2021, 397(10286): 1750-1769. DOI:10.1016/S0140-6736(20)32381-3 |
| [3] |
ROSE B S, JIANG W, PUNGLIA R S. Effect of lymph node metastasis size on breast cancer-specific and overall survival in women with node-positive breast cancer[J]. Breast Cancer Res Treat, 2015, 152(1): 209-226. DOI:10.1007/s10549-015-3451-y |
| [4] |
PARK K U, CAUDLE A. Management of the axilla in the patient with breast cancer[J]. Surg Clin North Am, 2018, 98(4): 747-760. DOI:10.1016/j.suc.2018.04.001 |
| [5] |
GIULIANO A E, BALLMAN K V, MCCALL L, et al. Effect of axillary dissection vs no axillary dissection on 10-year overall survival among women with invasive breast cancer and sentinel node metastasis: the ACOSOG Z0011(ALLIANCE)randomized clinical trial[J]. JAMA, 2017, 318(10): 918-926. DOI:10.1001/jama.2017.11470 |
| [6] |
PILGER T L, FRANCISCO D F, CANDIDO DOS REIS F J. Effect of sentinel lymph node biopsy on upper limb function in women with early breast cancer: a systematic review of clinical trials[J]. Eur J Surg Oncol, 2021, 47(7): 1497-1506. DOI:10.1016/j.ejso.2021.01.024 |
| [7] |
MARINO M A, AVENDANO D, ZAPATA P, et al. Lymph node imaging in patients with primary breast cancer: concurrent diagnostic tools[J]. Oncologist, 2020, 25(2): e231-e242. DOI:10.1634/theoncologist.2019-0427 |
| [8] |
CHANG J M, LEUNG J W T, MOY L, et al. Axillary nodal evaluation in breast cancer: state of the art[J]. Radiology, 2020, 295(3): 500-515. DOI:10.1148/radiol.2020192534 |
| [9] |
DIESSNER J, ANDERS L, HERBERT S, et al. Evaluation of different imaging modalities for axillary lymph node staging in breast cancer patients to provide a personalized and optimized therapy algorithm[J]. J Cancer Res Clin Oncol, 2023, 149(7): 3457-3467. DOI:10.1007/s00432-022-04221-9 |
| [10] |
CHEN Y, WANG L, DONG X, et al. Deep learning radiomics of preoperative breast MRI for prediction of axillary lymph node metastasis in breast cancer[J]. J Digit Imaging, 2023, 36(4): 1323-1331. DOI:10.1007/s10278-023-00818-9 |
| [11] |
CHEN Y L, LI R, CHEN T W, et al. Whole-tumour histogram analysis of pharmacokinetic parameters from dynamic contrast-enhanced MRI in resectable oesophageal squamous cell carcinoma can predict T-stage and regional lymph node metastasis[J]. Eur J Radiol, 2019, 112: 112-120. DOI:10.1016/j.ejrad.2019.01.012 |
| [12] |
GILLIES R J, KINAHAN P E, HRICAK H. Radiomics: images are more than pictures, they are data[J]. Radiology, 2016, 278(2): 563-577. DOI:10.1148/radiol.2015151169 |
| [13] |
MAO N, SHI Y, LIAN C, et al. Intratumoral and peritumoral radiomics for preoperative prediction of neoadjuvant chemotherapy effect in breast cancer based on contrast-enhanced spectral mammography[J]. Eur Radiol, 2022, 32(5): 3207-3219. DOI:10.1007/s00330-021-08414-7 |
| [14] |
GENG X, ZHANG Y, LI Y, et al. Radiomics-clinical nomogram for preoperative lymph node metastasis prediction in esophageal carcinoma[J]. Br J Radiol, 2024, 97(1155): 652-659. DOI:10.1093/bjr/tqae009 |
| [15] |
马芹芹, 卢星如, 李芷凡, 等. 基于全病变MRI动态增强扫描直方图分析对小乳腺癌腋窝淋巴结转移的预测价值[J]. 中国中西医结合影像学杂志, 2024, 22(4): 424-429. DOI:10.3969/j.issn.1672-0512.2024.04.011 |
| [16] |
CHEN M, KONG C, LIN G, et al. Development and validation of convolutional neural network-based model to predict the risk of sentinel or non-sentinel lymph node metastasis in patients with breast cancer: a machine learning study[J]. EClinicalMedicine, 2023, 63: 102176. DOI:10.1016/j.eclinm.2023.102176 |
| [17] |
王贇霞, 尚怡研, 郭亚欣, 等. DCE-MRI影像组学特征在预测乳腺癌腋窝淋巴结转移中的价值[J]. 磁共振成像, 2023, 14(3): 21-27. |
| [18] |
TO B, ISAAC D, ANDRECHEK E R. Studying lymphatic metastasis in breast cancer: current models, strategies, and clinical perspectives[J]. J Mammary Gland Biol Neoplasia, 2020, 25(3): 191-203. DOI:10.1007/s10911-020-09460-5 |
| [19] |
于海童, 李芹, 吴莎莎, 等. MRI影像组学在乳腺癌腋窝淋巴结转移预测中的研究进展[J]. 磁共振成像, 2023, 14(7): 176-180. |
| [20] |
LIU Z, FENG B, LI C, et al. Preoperative prediction of lymphovascular invasion in invasive breast cancer with dynamic contrast-enhanced-MRI-based radiomics[J]. J Magn Reson Imaging, 2019, 50(3): 847-857. DOI:10.1002/jmri.26688 |
| [21] |
DONG Y, FENG Q, YANG W, et al. Preoperative prediction of sentinel lymph node metastasis in breast cancer based on radiomics of T2-weighted fatsuppression and diffusion-weighted MRI[J]. Eur Radiol, 2018, 28(2): 582-591. DOI:10.1007/s00330-017-5005-7 |
| [22] |
ZHANG Q, PENG Y, LIU W, et al. Radiomics based on multimodal MRI for the differential diagnosis of benign and malignant breast lesions[J]. J Magn Reson Imaging, 2020, 52(2): 596-607. DOI:10.1002/jmri.27098 |
| [23] |
LIU M, MAO N, MA H, et al. Pharmacokinetic parameters and radiomics model based on dynamic contrast enhanced MRI for the preoperative prediction of sentinel lymph node metastasis in breast cancer[J]. Cancer Imaging, 2020, 20(1): 65. DOI:10.1186/s40644-020-00342-x |
| [24] |
ZHOU X, GAO F, DUAN S, et al. Radiomic features of Pk-DCE MRI parameters based on the extensive Tofts model in application of breast cancer[J]. Phys Eng Sci Med, 2020, 43(2): 517-524. DOI:10.1007/s13246-020-00852-9 |
| [25] |
DING J, GUO X, ZHANG M, et al. Development and validation of mathematical nomogram for predicting the risk of poor sleep quality among medical students[J]. Front Neurosci, 2022, 16: 930617. DOI:10.3389/fnins.2022.930617 |
| [26] |
MAO N, DAI Y, LIN F, et al. Radiomics nomogram of DCE-MRI for the prediction of axillary lymph node metastasis in breast cancer[J]. Front Oncol, 2020, 10: 541849. DOI:10.3389/fonc.2020.541849 |
 2025, Vol. 23
2025, Vol. 23