| 基于双能CT探讨胰腺碘定量参数对糖尿病的评估价值 |
2. 康复大学青岛医院/青岛市市立医院放射科, 山东 青岛 266011
2. Department of Radiology, Qingdao Hospital of University of Health and Rehabilitation Sciences, Qingdao Municipal Hospital, Qingdao 266011, China
糖尿病在我国已成为继肿瘤、心血管疾病之后第三大严重威胁人类健康的慢性疾病,其中2型糖尿病占90%以上,且呈高发趋势[1-2]。糖尿病前期是指空腹血糖受损或糖耐量受损,是一种血糖水平高于正常值但又未达到糖尿病诊断阈值的状态,也是有效预防糖尿病、逆转糖尿病进展的重要阶段。胰岛B细胞功能持续损伤是糖尿病病情进展的关键因素,胰岛细胞功能状态与胰腺微循环及纤维化程度密切相关。近年来,碘定量已被用于胰腺病变的检测、表征和相关治疗检测[3-7]。双能CT通过两束X线能量衰减差异进行物质材料分解分析获得的碘基图,能定量和直观评估组织中的碘浓度(iodine concentration,IC)及标准化碘浓度(normalized iodine concentration,NIC),间接反映组织血流动力学变化[8-9]。细胞外体积是指血管外-细胞外和血管内间隙的总和,前者随着组织纤维化进展而扩大[10]。NIC和细胞外体积分数(extracellular volume fraction,ECVIC)可有效、无创地检测组织纤维化及其程度[11-13]。本研究利用双能CT获得平衡期碘基图,分析胰腺IC、NIC及ECVIC与糖化血红蛋白(hemoglobin A1c,HbA1c)的相关性及其评估糖尿病病情的可行性。
1 资料与方法 1.1 一般资料回顾性选取2022年10月至2023年3月于青岛市市立医院行腹部双能CT 3期增强扫描的腹部疾病患者168例,根据2020年中华医学会糖尿病学分会[2]或2024年美国糖尿病协会标准[14]将其分为3组:无糖尿病组48例(HbA1c<5.7%)、糖尿病前期组45例(5.7% ≤HbA1c<6.5%)和糖尿病组75例(HbA1c≥ 6.5%)。
纳入标准:①年龄≥18岁;②有HbA1c和红细胞压积(hematocrit,Hct)结果。排除标准:①严重胰腺萎缩、弥漫性胰腺钙化、胰腺脂肪浸润和其他肿瘤性或非肿瘤性病变;②胰十二指肠术后;③近期有输血史、出血史的患者;④腹部CT检查前后30 d内未检测HbA1c值;⑤腹部CT与测量Hct时间间隔>2周。本研究获得青岛市市立医院伦理委员会批准[批号:2024-KY-086(快)]。
1.2 仪器与方法采用GE Revolution 256排CT机,患者取仰卧位、足先进,检查前对患者进行屏气训练,扫描时对甲状腺及盆腔进行放射屏蔽防护。扫描范围自膈肌顶部上方1 cm至肝下缘水平(包括全胰腺)。扫描参数:80/140 kV(瞬时切换),405 mA,螺距0.992,转速0.5 s/r,层厚5 mm,重建层厚1.25 mm。获取定位像后经肘静脉采用高压注射器注射碘佛醇(碘浓度320 mg/mL),剂量1.2 mL/kg体质量,流率2.0 mL/s,延迟约30、60和180 s以能谱成像(gemstone spectral imaging,GSI)模式行动脉期、门脉期和平衡期图像3期增强扫描。
1.3 图像分析将平衡期能谱数据输至AW 4.7工作站,使用GSI Viewer软件获得碘基图。由2位放射科医师采用双盲法于碘基图中胰腺头、体和尾实质部分手动勾画ROI(大小50~55 mm2),避开主胰管、局灶性病变、邻近脂肪和血管等,在胰腺ROI同一水平的腹主动脉上也放置相同大小ROI,记录每个ROI的IC(图 1)。所获得的数据取平均值后分别计算胰腺的NIC和ECVIC,公式为[11-12]: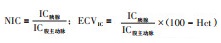
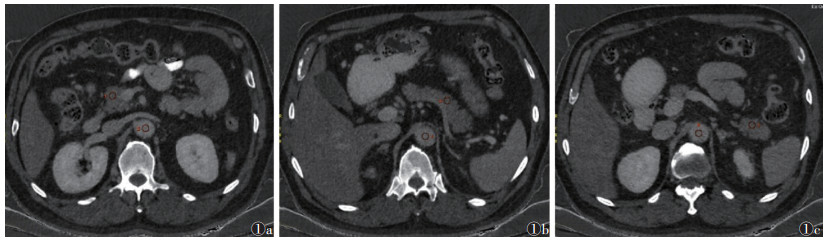 |
| 注:患者,男,52岁,糖尿病,手动勾画ROI。图 1a示胰头及同层腹主动脉碘浓度(IC)的测量,图 1b示胰体及同层腹主动脉IC的测量,图 1c示胰尾及同层腹主动脉IC的测量 图 1 能谱成像(GSI)Viewer软件将平衡期图像生成碘基图 |
1.4 统计学分析
采用SPSS 26.0及GraphPad Prism 9.5.0软件分析数据。符合正态分布的计量资料以 x±s表示,组间比较行单因素方差分析;符合偏态分布的计量资料以M(QL,QU)表示,组间比较行非参数检验;计数资料组间比较行χ2检验。采用Spearman秩相关分析评估胰腺IC、NIC及ECVIC与HbA1c的相关性,绘制ROC曲线分析胰腺碘定量参数对糖尿病病情的诊断效能。以P<0.05为差异有统计学意义。
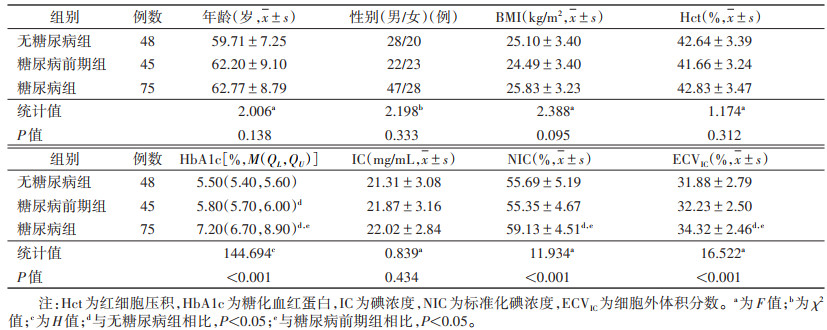
2 结果 2.1 3组临床及影像学资料比较3组患者的年龄、性别、BMI及Hct差异均无统计学意义,具有可比性(均P>0.05)。无糖尿病组、糖尿病前期组和糖尿病组HbA1c两两比较,差异均有统计学意义(均P<0.05)。糖尿病组NIC、ECVIC均明显高于无糖尿病组及糖尿病前期组,差异均有统计学意义(均P<0.05);无糖尿病组与糖尿病前期组NIC、ECVIC差异均无统计学意义(均P>0.05)。各组间IC差异均无统计学意义(均P>0.05)(表 1)。
| 表 1 3组临床及影像学资料比较 |
 |
2.2 HbA1c与胰腺碘定量参数的相关性分析
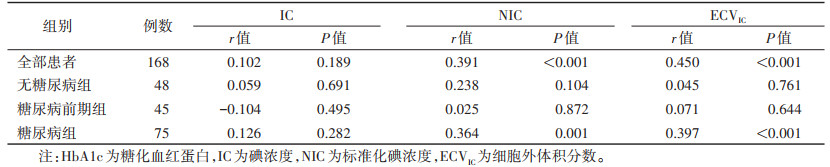
全部患者及糖尿病组胰腺NIC、ECVIC均与HbA1c呈正相关(均P<0.05);无糖尿病组及糖尿病前期组胰腺NIC、ECVIC与HbA1c差异均无统计学意义(均P>0.05)。3组间胰腺IC与HbA1c差异均无统计学意义(均P>0.05)(表 2)。
| 表 2 HbA1c与胰腺IC、NIC及ECVIC的相关性分析 |
 |
2.3 胰腺碘定量参数对不同组别的鉴别诊断
以57.56% 为最佳截断值,NIC区分无糖尿病组与糖尿病组的敏感度、特异度及AUC分别为65.3%、72.9% 及0.704(95%CI 0.606~0.802);以32.62% 为最佳截断值,ECVIC区分无糖尿病组与糖尿病组的敏感度、特异度及AUC分别78.7%、64.6%及0.753(95%CI 0.664~0.842);NIC与ECVIC的AUC差异无统计学意义(Z=1.281,P=0.200)(图 2a)。
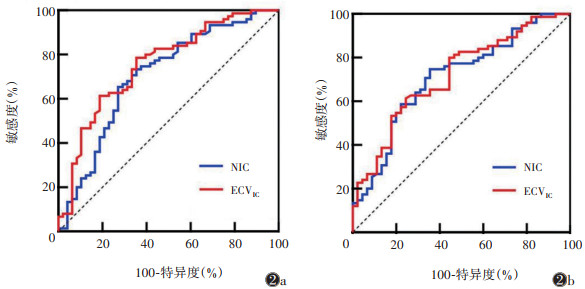 |
| 注:图 2a示ECVIC区分无糖尿病组与糖尿病组的AUC为0.753,NIC区分无糖尿病组与糖尿病组的AUC为0.704,两者差异无统计学意义。图 2b示ECVIC区分糖尿病前期组与糖尿病组的AUC为0.717,NIC区分糖尿病前期组与糖尿病组的AUC为0.708,差异无统计学意义 图 2 胰腺标准化碘浓度(NIC)和细胞外体积分数(ECVIC)区分不同组别的ROC曲线 |
以56.57% 为最佳截断值,NIC区分糖尿病前期组与糖尿病组的敏感度、特异度及AUC分别为74.7%、64.4% 及0.708(95%CI 0.612~0.804);以33.95%为最佳截断值,ECVIC区分糖尿病前期组与糖尿病组的敏感度、特异度及AUC分别61.3%、75.6% 及0.717(95%CI 0.623~0.810);NIC与ECVIC的AUC差异无统计学意义(Z=0.204,P=0.838)(图 2b)。
3 讨论糖尿病是慢性代谢性疾病,从糖尿病前期到终末期往往经过较长的临床过程。相比于非糖尿病(包括无糖尿病和糖尿病前期)患者,糖尿病患者胰岛B细胞产生胰岛素时需消耗更多的氧气,更易产生缺氧环境;胰腺血供丰富,高糖状态可引起毛细血管发生炎性病变及损伤,使周围组织缺血缺氧。胰腺星状细胞在高糖、缺氧、氧化应激等多种因素作用下由静止态转为激活态,促进细胞外基质沉积,引起细胞外间隙扩大和纤维化,导致胰腺血管阻力增高、血流速度减慢[15-16]。纤维组织中碘对比剂的进入及廓清缓慢,多呈延迟强化,故本研究基于平衡期进行胰腺碘定量参数研究。而HbA1c亦随血糖水平升高而升高。因此,本研究中反映胰腺纤维化程度和/或血流动力学改变的NIC、ECVIC在糖尿病组中明显升高,且与HbA1c呈正相关,与既往相关研究[17-18]类似。而非糖尿病阶段(包括无糖尿病和糖尿病前期)胰腺星状细胞尚处于静止状态,其产生细胞外基质能力有限,因此不会引起细胞外基质的积极增生和纤维化,这可能也是无糖尿病组与糖尿病前期组NIC、ECVIC差异均无统计学意义的原因。
对于纤维化而言,血流动力学改变早于形态学。各组间IC差异均无统计学意义可能与个体间血流量及血流速度不同有关;NIC以同层腹主动脉为参照标准化后排除上述个体差异或通过减少碘分布的生理波动来减轻变异性,可更客观地评估血流动力学变化[9]。胰腺ECVIC鉴别糖尿病病情时AUC略高于NIC,可能是因ECVIC可通过利用Hct来减少血管内空间的潜在影响,而NIC未考虑Hct。
本研究的局限性:为单中心回顾性研究且样本量较小,可能存在选择偏倚;手动勾画ROI可能存在测量误差;肾素-血管紧张素-醛固酮系统是激活胰腺星状细胞的关键通路,未分析血管紧张素转换酶抑制剂使用情况,相关用药机制能否改变胰腺碘定量参数评估糖尿病病情有待进一步探索。
综上所述,胰腺NIC、ECVIC与HbA1c均有一定的相关性,可间接评估胰腺纤维化程度及血流动力学改变,通过反映胰腺病理生理改变评估糖尿病病情。
| [1] |
中华医学会糖尿病学分会, 国家基层糖尿病防治管理办公室. 国家基层糖尿病防治管理手册(2022)[J]. 中华内科杂志, 2022, 61(7): 717-748. DOI:10.3760/cma.j.cn112138-20220509-00350 |
| [2] |
中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2020年版)[J]. 中华糖尿病杂志, 2021, 13(4): 315-409. |
| [3] |
梅碧, 王嵩. 双能量CT定量分析技术对早期急性胰腺炎的诊断价值[J]. 中国中西医结合影像学杂志, 2023, 21(6): 610-613. DOI:10.3969/j.issn.1672-0512.2023.06.003 |
| [4] |
李淑华, 赵灿灿, 高玉青, 等. 能谱CT在术前预测胰腺癌淋巴结转移的价值[J]. 中国临床医学影像杂志, 2022, 33(2): 108-113. |
| [5] |
武凌宇, 白潇涵, 余静, 等. 双能CT细胞外容积分数在鉴别胰腺导管内乳头状黏液性肿瘤良恶性中的应用价值[J]. 南京医科大学学报(自然科学版), 2023, 43(9): 1273-1278. |
| [6] |
FUKUKURA Y, KUMAGAE Y, HIGASHI R, et al. Extracellular volume fraction determined by equilibrium contrast-enhanced dual-energy CT as a prognostic factor in patients with Ⅳ stage pancreatic ductal adenocarcinoma[J]. Eur Radiol, 2020, 30(3): 1679-1689. DOI:10.1007/s00330-019-06517-w |
| [7] |
NOID G, GODFREY G, HALL W, et al. Predicting treatment response from extracellular volume fraction for chemoradiation therapy of pancreatic cancer[J]. Int J Radiat Oncol Biol Phys, 2023, 115(3): 803-808. DOI:10.1016/j.ijrobp.2022.09.084 |
| [8] |
MANOHARAN D, NETAJI A, DAS C J, et al. Iodine parameters in triple-bolus dual-energy ct correlate with perfusion CT biomarkers of angiogenesis in renal cell carcinoma[J]. AJR Am J Roentgenol, 2020, 214(4): 808-816. DOI:10.2214/AJR.19.21969 |
| [9] |
LENNARTZ S, CAO J, PISUCHPEN N, et al. Intrapatient variability of iodine quantification across different dual-energy CT platforms: assessment of normalization techniques[J]. Eur Radiol, 2024, 34(8): 5131-5141. DOI:10.1007/s00330-023-10560-z |
| [10] |
SOFUE K, UESHIMA E, MASUDA A, et al. Estimation of pancreatic fibrosis and prediction of postoperative pancreatic fistula using extracellular volume fraction in multiphasic contrast-enhanced CT[J]. Eur Radiol, 2022, 32(3): 1770-1780. DOI:10.1007/s00330-021-08255-4 |
| [11] |
MARRI U K, DAS P, SHALIMAR, et al. Noninvasive staging of liver fibrosis using 5-minute delayed dualenergy CT: comparison with us elastography and correlation with histologic findings[J]. Radiology, 2021, 298(3): 600-608. DOI:10.1148/radiol.2021202232 |
| [12] |
YOON J H, LEE J M, KIM J H, et al. Hepatic fibrosis grading with extracellular volume fraction from iodine mapping in spectral liver CT[J]. Eur J Radiol, 2021, 137: 109604. DOI:10.1016/j.ejrad.2021.109604 |
| [13] |
NARANG M, SINGH A, MAHAPATRA S J, et al. Utility of dual-energy CT and advanced multiparametric MRI based imaging biomarkers of pancreatic fibrosis in grading the severity of chronic pancreatitis[J]. Abdom Radiol (NY), 2024, 49(10): 3528-3539. DOI:10.1007/s00261-024-04443-0 |
| [14] |
American Diabetes Association Professional Practice Committee. 2. diagnosis and classification of diabetes: standards of care in diabetes-2024[J]. Diabetes Care, 2024, 47(Suppl 1): S20-S42. |
| [15] |
FERDEK P E, KRZYSZTOFIK D, STOPA K B, et al. When healing turns into killing-the pathophysiology of pancreatic and hepatic fibrosis[J]. J Physiol, 2022, 600(11): 2579-2612. DOI:10.1113/JP281135 |
| [16] |
HRABÁK P, KALOUSOVÁ M, KRECHLER T, et al. Pancreatic stellate cells-rising stars in pancreatic pathologies[J]. Physiol Res, 2021, 70(Suppl 4): S597-S616. |
| [17] |
NODA Y, GOSHIMA S, TSUJI Y, et al. Pancreatic extracellular volume fraction using T1 mapping in patients with impaired glucose intolerance[J]. Abdom Radiol(NY), 2020, 45(2): 449-456. DOI:10.1007/s00261-019-02384-7 |
| [18] |
蔡晓艺, 季旸, 王国华, 等. 双能量CT测量胰腺细胞外体积分数及标准化碘浓度评估2型糖尿病[J]. 中国医学影像技术, 2023, 39(3): 385-388. |
 2025, Vol. 23
2025, Vol. 23


