| 双层探测器光谱CT多参数成像术前预测粗梁实体型肝细胞癌的价值 |
2. 威海市基于影像科学的介入微创技术重点实验室, 山东 威海 264400;
3. 青岛大学附属威海市中心医院病理科, 山东 威海 264400;
4. 飞利浦医疗临床科研部,上海 200070
2. Weihai Key Laboratory of Interventional Minimally Invasive Technology Based on Radiology, Weihai 264400, China;
3. Department of Pathology, Weihai Central Hospital Affiliated to Qingdao University, Weihai 264400, China;
4. Clinical Science, Philips Healthcare, Shanghai200070, China
肝细胞癌是肝脏最常见的原发性恶性肿瘤,占原发性肝癌的75%~85%,其发病率和致死率分别居全球第6位和第4位[1]。肝细胞癌的治疗多采用外科手术切除和肝移植,然而术后5年复发率仍较高[2-4]。肝细胞癌的预后与其组织病理学亚型密切相关[5]。粗梁实体型肝细胞癌(macrotrabecular-massive hepatocellular carcinoma,MTM-HCC)是肝细胞癌的一种特殊病理学亚型,其特点为粗梁结构>6个细胞厚度,占肿瘤比例>50%[6-7];且MTM-HCC具有血管包绕肿瘤簇的独特血管转移模式[8]。研究表明,MTM-HCC具有较强的血管侵犯和转移潜能,即使手术切除或行射频消融术治疗,仍存在早期复发和生存率低的风险[9-10]。早期诊断并选择科学的治疗方案有助于改善预后、降低复发风险。目前临床对MTM-HCC的诊断依赖术后病理学检查,存在明显滞后性和有创性;而穿刺活检的病理样本也较局限,无法对MTM-HCC进行全面诊断。因此,术前精准、无创地预测MTM-HCC对制订个体化治疗方案并改善患者预后具有重要意义。双层探测器光谱CT具有多参数功能成像的特点,可无创、定量地反映肿瘤的病理学特征[11-12]。但关于双层探测器光谱CT多参数特征与MTM-HCC的相关性研究鲜有报道。本研究旨在探讨双层探测器光谱CT多参数功能成像预测MTM-HCC的价值,为临床术前无创预测MTM-HCC提供新的诊断依据。
1 资料与方法 1.1 一般资料回顾性收集2020年5月至2024年4月在威海市中心医院就诊的肝细胞癌患者。纳入标准:①经手术病理证实;②术前1周内完善肝脏光谱CT增强扫描及相关实验室检查。排除标准:①肝细胞癌术后复发;②术前接受抗癌治疗;③图像有严重呼吸运动伪影;④通过穿刺活检获得组织病理学检查;⑤多发病灶。共纳入52例,其中MTM-HCC 18例(MTM-HCC组),非MTM-HCC 34例(非MTM-HCC组)。本研究获得威海市中心医院伦理委员会批准(批号:2022-121-01)。
1.2 仪器与方法采用双层探测器光谱CT(Philips Healthcare,Best,The Netherlands)。扫描参数:120 kV,自动调节管电流,探测器宽度0.625 mm×64,球管转速0.5 s/r,螺距1.234∶1。采用Smart Prep动态监测技术监测肝门水平腹主动脉对比剂浓度,当CT值达100 HU时,自动触发,触发后5 s行动脉期扫描,扫描结束后40、120 s行门静脉期和平衡期扫描。
1.3 图像分析由2位具有8年以上工作经验的影像医师对肿瘤的定性和定量指标进行评估,不一致时经协商达成一致。在40 keV虚拟单能量图像上对肝细胞癌的形态学进行评估,参考既往文献[6, 13]和肝脏成像报告和数据系统v2018[14],评估内容包括:①肿瘤最大径,横轴位主病灶的最大径线;②非边缘动脉期高强化;③非边缘门静脉期廓清;④不光整的肿瘤边缘,有突出于肿瘤边缘或局部呈浸润性的芽状突起;⑤包膜完整,肿瘤大部分或全部与周围肝实质分界清楚,门脉期或平衡期可见环形强化;⑥瘤内坏死,横轴位肿瘤最大径线层面各期均无强化区域占同层面肿瘤面积的比例≥20%;⑦瘤内血管,动脉期肿瘤内部持续存在的血管影;⑧动脉期瘤内低强化区,不包含瘤内坏死的动脉期肿瘤相对低强化区域占肿瘤体积的比例≥ 20%[15]。
由于动脉期肿瘤不均匀或不明显的强化会影响ROI选取的准确性,定量指标评估选择门脉期和平衡期的碘浓度(iodine concentration,IC)、标准化碘浓度(normalized iodine concentration,NIC)、有效原子序数(Z-effective atomic number,Zeff)及能谱曲线斜率(λ)。在同一病灶中选择多个圆形ROI,测量时应避开血管、钙化和液化坏死区域,取平均值,同时测量病灶同层面腹主动脉的IC。NIC的计算公式为: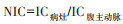
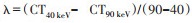
由1位具有10年工作经验的病理科医师在不知晓其他临床和影像结果的情况下评价病理HE染色标本。MTM-HCC定义为粗梁结构>6个细胞厚度,且占肿瘤比例>50%。
1.5 统计学方法使用SPSS 23.0软件进行统计学分析。采用Kolmogorov‑Smirnov对定量数据行正态性检验,符合正态分布的以x±s表示,组间比较行独立样本t检验。肿瘤标志物及光谱CT定性指标组间比较行χ2检验。采用单因素分析筛选出差异有统计学意义的变量纳入到多因素logistic回归分析中,获得预测MTM-HCC的独立危险因素。对独立危险因素及其建立的联合模型行ROC曲线分析,采用DeLong检验比较各独立危险因素及联合模型AUC的差异。以P<0.05为差异有统计学意义。
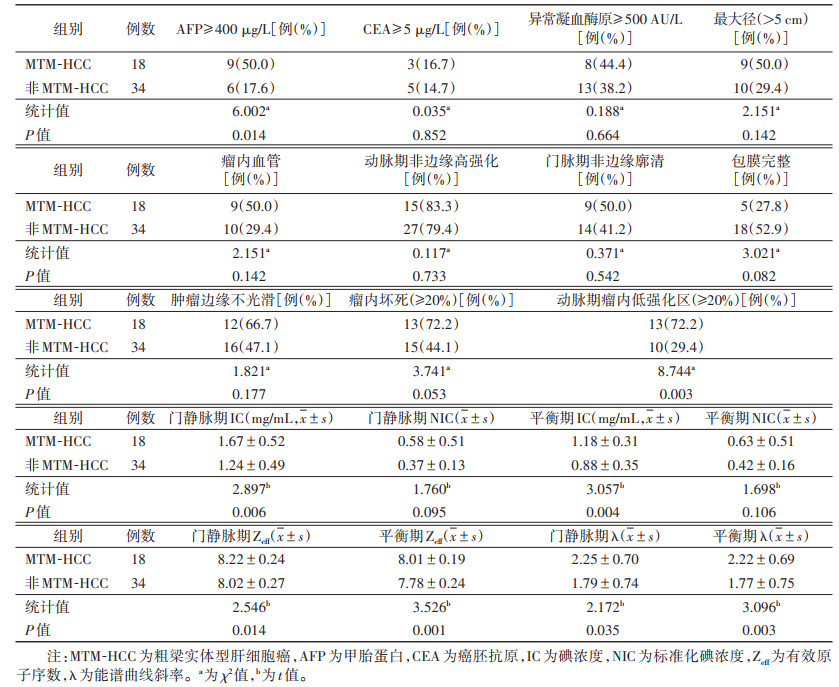
2 结果 2.1 2组肿瘤标志物比较MTM-HCC组血清AFP≥ 400 μg/L的患者占比高于非MTM-HCC组,差异有统计学意义(P=0.014)。2组间CEA≥ 5 μg/L、异常凝血酶原≥ 500 AU/L的患者占比差异均无统计学意义(均P>0.05)(表 1)。
| 表 1 MTM-HCC组与非MTM-HCC组肿瘤标志物、光谱CT定性特征及定量参数比较 |
 |
2.2 2组光谱CT定性影像学特征比较
MTM-HCC组的动脉期瘤内低强化区明显高于非MTM-HCC组,差异有统计学意义(P=0.003);2组肿瘤最大径、瘤内血管、动脉期非边缘高强化、门脉期非边缘廓清、包膜完整、肿瘤边缘不光滑、瘤内坏死差异均无统计学意义(均P>0.05)(表 1)。
2.3 2组光谱CT定量参数比较MTM-HCC组门脉期及平衡期IC、Zeff、λ均高于非MTM-HCC组,差异均有统计学意义(均P<0.05);2组门脉期及平衡期NIC差异均无统计学意义(均P>0.05)(表 1)。2组光谱CT多参数图像及病理图像见图 1,2。
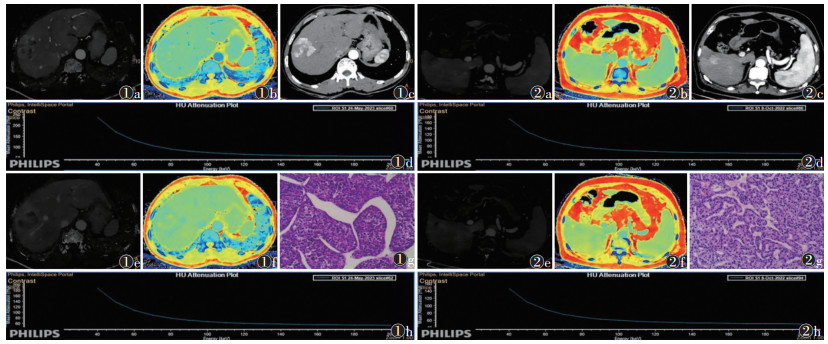 |
| 注:图 1患者,男,22岁,病理证实为MTM-HCC。图 1a~1h分别为门静脉期碘浓度(IC)图、门静脉期有效原子序数(Zeff)图、动脉期40 keV虚拟单能量图像、门静脉期光谱曲线、平衡期IC图、平衡期Zeff图、HE染色(高倍放大)及平衡期光谱曲线。图 2患者,男,34岁,病理证实为非MTM-HCC。图 2a~2h分别为门静脉期IC图、门静脉期Zeff图、动脉期40 keV虚拟单能量图像、门静脉期光谱曲线、平衡期IC图、平衡期Zeff图、HE染色(高倍放大)及平衡期光谱曲线 图 1, 2 粗梁实体型肝细胞癌(MTM-HCC)组与非MTM-HCC组光谱CT多参数图像及病理图像 |
2.4 logistic回归分析及ROC曲线分析
将单因素分析中差异有统计学意义的变量AFP≥ 400 μg/L、动脉期瘤内低强化区、门脉期及平衡期IC、Zeff、λ纳入多因素logistic回归分析中,结果显示动脉期瘤内低强化区[OR=5.494(95%CI 1.365~ 22.109),P=0.016]和平衡期IC[OR=21.071(95%CI 2.024~219.371),P=0.011]是预测MTM-HCC的独立危险因素。将两者联合构建联合模型,ROC曲线显示动脉期瘤内低强化区、平衡期IC和联合模型的AUC分别是0.714、0.761和0.829(表 2,图 3)。DeLong检验显示,联合模型预测MTM-HCC的AUC大于动脉期瘤内低强化区和平衡期IC,联合模型与动脉期瘤内低强化区的AUC差异有统计学意义(Z=2.259,P= 0.024),联合模型与平衡期IC的AUC差异无统计学意义(Z=1.338,P=0.181)。
| 表 2 各独立危险因素及联合模型对MTM-HCC的诊断效能 |
 |
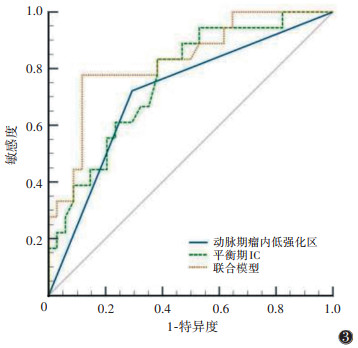 |
| 注:MTM-HCC为粗梁实体型肝细胞癌,IC为碘浓度 图 3 光谱CT参数诊断MTM-HCC的ROC曲线 |
3 讨论
MTM-HCC是肝细胞癌的一种特定亚型[16],其具有强大的血管生成能力,以及较高的血管侵袭和转移潜力,易导致术后复发风险增加和存活率降低[17]。MTM-HCC的微环境因为缺乏三级淋巴结构,可能不利于有效的抗肿瘤免疫[18]。在精准医学时代,区分MTM-HCC与其他亚型对预测预后及制订治疗方案至关重要。本研究利用光谱CT多参数特征来预测MTM-HCC,从而实现其早期无创预测,为治疗方案的选择和预后评估提供指导。
本研究显示,MTM-HCC组血清AFP水平明显高于非MTM-HCC组。Chen等[19-20]也发现血清AFP水平与MTM-HCC显著相关。AFP是肝细胞癌早期诊断的敏感标志物,其水平越高,肿瘤分化程度越差,复发率越高,同时免疫系统的抑制作用也越强[21]。
本研究采用动脉期40 keV单能量图像观察肿瘤内的低强化区,结果显示肿瘤内动脉期低强化区与MTM-HCC显著相关。这与Rhee等[6, 22]的研究结果相似。推测原因可能为:①与MTM-HCC的特殊结构有关,具有血流灌注功能的蜘蛛网状窦隙结构会降低血管的相对密度,窦隙会压迫周围的血管空间,导致局部血供不足[23];②蜘蛛网状的结构也会阻碍血液的流动,降低碘对比剂的流入和流出速度[24];③肿瘤内丰富的纤维化间质也是MTM-HCC动脉期出现大片低强化区的重要原因,纤维组织间质增强扫描后往往呈延迟渐进性强化,而早期强化反而不明显[6]。这也能解释本研究MTM-HCC组门脉期、平衡期IC均显著高于非MTM-HCC组的原因,MTM-HCC蜘蛛网状窦隙及肿瘤组织内丰富的纤维化间质表现为延迟增强。本研究发现平衡期NIC在MTM-HCC组与非MTM-HCC组间差异无统计学意义,推测原因可能是本研究是基于肝硬化、肝癌患者,入组时大多是肝硬化甚至失代偿期的患者,受肝硬化诸多并发症影响,在发生肝癌时易出现肝硬化合并的血流动力学紊乱或心衰等,这些因素均会影响NIC的准确性;另外,可能与样本量有限有关,存在一定数量的肝硬化失代偿合并肝癌样本时会影响整体结果。
既往研究报道瘤内动脉、包膜不完整、肿瘤边缘不光滑及瘤内坏死等特征可作为预测MTM-HCC的独立因素[6, 17, 25]。本研究结果与此不同,可能部分归因于不同研究中心样本的显著差异;同时,既往研究主要侧重于分析MRI特征,而本研究则主要基于CT特征,因此在对应特征的识别上可能存在一定偏差。
本研究进一步将2个独立的危险因素构建成联合预测模型,结果显示,与各独立危险因素相比,联合模型具有更好的预测性能,解决了单个因素预测MTM-HCC敏感度、特异度较低的问题,为患者提供更准确的风险评估,从而提高临床实践的可行性。
本研究存在的局限性:为单中心回顾性研究,可能存在选择性偏倚;光谱CT定性特征是基于视觉分析,人工智能可能会提高结果的稳定性和可重复性;目前关于光谱CT定量参数预测MTM-HCC的研究较少,研究结果很难得到外部验证。
综上所述,动脉期瘤内低强化区和平衡期IC可能是预测MTM-HCC的独立危险因素。两者的联合模型具有更高的诊断效能,可作为术前无创、定量预测MTM-HCC的有效手段。
| [1] |
SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. |
| [2] |
LIM K C, CHOW P K, ALLEN J C, et al. Microvascular invasion is a better predictor of tumor recurrence and overall survival following surgical resection for hepatocellular carcinoma compared to the Milan criteria[J]. Ann Surg, 2011, 254(1): 108-113. |
| [3] |
WANG M D, LI C, LIANG L, et al. Early and late recurrence of hepatitis B virus-associated hepatocellular carcinoma[J]. Oncologist, 2020, 25(10): e1541-e1551. |
| [4] |
GANESAN P, KULIK L M. Hepatocellular carcinoma: new developments[J]. Clin Liver Dis, 2023, 27(1): 85-102. |
| [5] |
NAULT J C, MARTIN Y, CARUSO S, et al. Clinical impact of genomic diversity from early to advanced hepatocellular carcinoma[J]. Hepatology, 2020, 71(1): 164-182. DOI:10.3969/j.issn.1001-5256.2020.01.037 |
| [6] |
RHEE H, CHO E S, NAHM J H, et al. Gadoxetic acidenhanced MRI of macrotrabecular-massive hepatocellular carcinoma and its prognostic implications[J]. J Hepatol, 2021, 74(1): 109-121. DOI:10.1016/j.jhep.2020.08.013 |
| [7] |
单钰莹, 汪春年, 毛书奇, 等. 粗梁实体型肝细胞癌的强侵袭性临床特征与不良预后分析[J]. 中华肝脏病杂志, 2023, 31(12): 1318-1325. DOI:10.3760/cma.j.cn501113-20230914-00105-1 |
| [8] |
冯智超. 智能影像预测肝细胞癌MTM侵袭亚型及靶向治疗响应的研究[D]. 长沙: 中南大学, 2022.
|
| [9] |
KUMAR D, HAFEZ O, JAIN D, et al. Can primary hepatocellular carcinoma histomorphology predict extrahepatic metastasis?[J]. Hum Pathol, 2021, 113: 39-46. DOI:10.1016/j.humpath.2021.04.008 |
| [10] |
ZIOL M, POTE N, AMADDEO G, et al. Macrotrabecularmassive hepatocellular carcinoma: a distinctive histological subtype with clinical relevance[J]. Hepatology, 2018, 68(1): 103-112. DOI:10.1002/hep.29762 |
| [11] |
SAUERBECK J, ADAM G, MEYER M. Spectral CT in oncology[J]. Rofo, 2023, 195(1): 21-29. DOI:10.1055/a-1902-9949 |
| [12] |
SO A, NICOLAOU S. Spectral computed tomography: fundamental principles and recent developments[J]. Korean J Radiol, 2021, 22(1): 86-96. DOI:10.3348/kjr.2020.0144 |
| [13] |
XU X, ZHANG H L, LIU Q P, et al. Radiomic analysis of contrast-enhanced CT predicts microvascular invasion and outcome in hepatocellular carcinoma[J]. J Hepatol, 2019, 70(6): 1133-1144. DOI:10.1016/j.jhep.2019.02.023 |
| [14] |
CHERNYAK V, FOWLER K J, KAMAYA A, et al. Liver Imaging Reporting and Data System (LI-RADS) Version 2018:imaging of hepatocellular carcinoma in at-risk patients[J]. Radiology, 2018, 289(3): 816-830. DOI:10.1148/radiol.2018181494 |
| [15] |
CHA H, CHOI J Y, PARK Y N, et al. Comparison of imaging findings of macrotrabecular-massive hepatocellular carcinoma using CT and gadoxetic acid-enhanced MRI[J]. Eur Radiol, 2023, 33(2): 1364-1377. |
| [16] |
LOY L M, LOW H M, CHOI J Y, et al. Variant hepatocellular carcinoma subtypes according to the 2019 WHO Classification: an imaging-focused review[J]. AJR Am J Roentgenol, 2022, 219(2): 212-223. DOI:10.2214/AJR.21.26982 |
| [17] |
CHENG J, LI X, WANG L, et al. Evaluation and Prognostication of Gd-EOB-DTPA MRI and CT in patients with macrotrabecular-massive hepatocellular carcinoma[J]. J Magn Reson Imaging, 2024, 59(6): 2071-2081. DOI:10.1002/jmri.29052 |
| [18] |
CALDERARO J, PETITPREZ F, BECHT E, et al. Intratumoral tertiary lymphoid structures are associated with a low risk of early recurrence of hepatocellular carcinoma[J]. J Hepatol, 2019, 70(1): 58-65. DOI:10.1016/j.jhep.2018.09.003 |
| [19] |
CHEN F M, DU M, QI X, et al. Nomogram estimating vessels encapsulating tumor clusters in hepatocellular carcinoma from preoperative gadoxetate disodiumenhanced MRI[J]. J Magn Reson Imaging, 2023, 57(6): 1893-1905. |
| [20] |
RENNE S L, WOO H Y, ALLEGRA S, et al. Vessels Encapsulating Tumor Clusters (VETC) is a powerful predictor of aggressive hepatocellular carcinoma[J]. Hepatology, 2020, 71(1): 183-195. |
| [21] |
AYOUB W S, STEGGERDA J, YANG J D, et al. Current status of hepatocellular carcinoma detection: screening strategies and novel biomarkers[J]. Ther Adv Med Oncol, 2019, 11: 432483136. |
| [22] |
CHA H, CHOI J Y, PARK Y N, et al. Comparison of imaging findings of macrotrabecular-massive hepatocellular carcinoma using CT and gadoxetic acid-enhanced MRI[J]. Eur Radiol, 2023, 33(2): 1364-1377. |
| [23] |
FANG J H, ZHOU H C, ZHANG C, et al. A novel vascular pattern promotes metastasis of hepatocellular carcinoma in an epithelial-mesenchymal transitionindependent manner[J]. Hepatology, 2015, 62(2): 452-465. |
| [24] |
蓝春勇, 凌冰, 郭文文, 等. VETC(+)肝癌内皮细胞中波形蛋白的表达及其与超声造影表现的关系[J]. 中华肿瘤杂志, 2018, 40(2): 105-109. |
| [25] |
GONG Q, ZHANG Y, WU T, et al. Comparison of computed tomography and magnetic resonance imaging findings and histopathological features of macrotrabecularmassive hepatocellular carcinoma[J]. Quant Imaging Med Surg, 2023, 13(7): 4633-4640. |
 2025, Vol. 23
2025, Vol. 23


