| 经皮耳迷走神经刺激治疗帕金森病抑郁的临床疗效及机制研究 |
2. 广州中医药大学第二附属医院影像医学部, 广东 广州 510000;
3. 广州中医药大学第二附属医院芳村医院脑病科, 广东 广州 510000
2. Department of Radiology, Second Affiliated Hospital of Guangzhou University of Chinese Medicine, Guangzhou 510000, China;
3. Department of Neurology, Fangcun Branch of Second Affiliated Hospital of Guangzhou University of Chinese Medicine, Guangzhou 510000, China
帕金森病(Parkinson disease,PD)是全球第二大神经退行性疾病,2030年我国将有约500万PD患者,约占全球总患病人数的50%[1-2]。抑郁是帕金森病最常见的非运动症状之一,PD伴抑郁(depression in Parkinson disease,DPD)患者较不伴抑郁(NDPD)患者生活质量显著下降,缺乏幸福感,康复效果更差,严重者可导致自杀[3-4]。积极治疗抑郁症状是PD临床管理的重要内容。普拉克索是当前指南推荐治疗DPD唯一的一线用药,但该药会显著增加患者出现其他神经精神障碍(幻觉、偏执、头晕、失眠等)和自主神经功能异常(恶心、低血压等)的风险[5]。经皮耳迷走神经刺激(transcutaneous auricular vagus nerve stimulation,taVNS)是基于中医耳穴理论、迷走神经刺激和解剖学研发的新型针灸技术[6]。多项研究表明,taVNS可改善抑郁症患者的情绪障碍[7-8]。本项目组前期发现taVNS可改善失眠患者的抑郁焦虑情绪[9],但其治疗DPD的临床疗效及其机制尚未完全明确。
静息态fMRI是一种非侵入性的脑成像方法,在神经科学研究中有重要作用。功能连接(functional connectivity,FC)是基于先验种子点有指向性地分析静息态fMRI的研究方法。国内外学者将FC广泛应用于DPD的发病机制研究,结果显示DPD患者存在广泛的FC变化[10-11]。后扣带回是默认网络重要组成成分,参与自我意识维持、认知控制及情绪处理[12]。有研究基于独立成分分析发现,后扣带回与角回之间的FC是导致抑郁症患者出现过度自传体记忆现象(仅回忆概象,而无法回忆具象,是功能性的表现)的重要原因,而后扣带回和前岛叶之间的FC与情绪调节疗法后去中心化的改善有关[13]。以往研究还发现,DPD较NDPD患者左背外侧前额叶皮质与后扣带回的FC增加,且与抑郁症状的严重程度呈负相关[14]。Lin等[15]使用机器学习结合全脑FC分析PD患者是否存在抑郁,结果显示后扣带回内FC变化是区分DPD与NDPD的重要生物标志物。然而后扣带回在taVNS干预中的具体作用目前尚缺乏相关研究。本研究拟观察taVNS干预对DPD患者抑郁症状的改善作用,并以后扣带回为种子点行FC分析,探讨taVNS的作用机制,以期为临床应用taVNS干预DPD提供神经影像学依据。
1 资料与方法 1.1 一般资料选择2021年4月至2022年9月在广州中医药大学第二附属医院总院帕金森病门诊和神经内科门诊、芳村医院神经内科门诊招募的DPD患者。本研究经医院伦理委员会批准(批准号:BF2020-112-01),受试者均自愿参加本试验,由患者或家属签署知情同意书。
纳入标准:符合英国帕金森病协会脑库的PD诊断标准[16];符合《精神障碍诊断与统计手册》[17]的抑郁症诊断标准;入组前已用规范的抗PD药物治疗,PD症状控制稳定;未行药物、心理、电休克等抗抑郁治疗;近1个月内未服用镇痛、安眠、麻醉类等药品;能配合完成相关抑郁、焦虑等量表;右利手。
排除标准:病因明确的继发性帕金森综合征或其他神经变性疾病伴发的帕金森综合征;有精神分裂症、抑郁症、躯体化障碍等精神病史,曾长期服用抗精神疾病药物;简易智能精神状态检查量表(mini-mental state examination,MMSE)提示存在认知功能受损(MMSE < 24分)者;既往MRI检查提示颅内有脑血管病、癫痫、肿瘤等器质性病变;体内有胰岛素泵、心脏起搏器等金属物品;已行伽马刀或脑深部毁损术、刺激术等治疗;心肺肝肾功能严重衰弱,合并恶性肿瘤,各种出血性疾病,急性传染病,高热或高热性疾病等;有药物滥用史;皮肤过敏,刺激部位有损伤或炎症;有MRI检查禁忌证;6个月内参与过其他临床试验的患者。
共纳入20例,其中男12例,女8例,年龄47~78岁,平均(64.05±2.02)岁;初中及以下学历4例,高中10例,大专及以上6例;平均病程(90.40±55.37)个月;MMSE评分平均(28.5±2.21)分。
1.2 仪器与方法选择耳甲腔内肝穴、肾穴,即耳廓迷走神经分布区进行干预。酒精消毒穴位及耳夹,将耳夹夹于耳部,金属电极正极接肝穴,负极接肾穴。使用电针治疗仪(华佗牌SDZ-ⅡB型),调节参数为疏密波(疏波20 Hz,密波100 Hz),输出强度以患者痛阈下刺激为宜。每次30 min,双耳交替治疗,1次/d,6次/周,治疗1个疗程(4周)。
1.3 疗效观察主要结局指标选择汉密尔顿抑郁量表(Hamilton depression scale,HAMD),HAMD评分≥8分为有抑郁症状[18]。次要结局指标选择统一帕金森量表(unified Parkinson disease rating scale,UPDRS)、非运动症状量表(non-motor symptom scale,NMSS)和帕金森生活质量量表(Parkinson disease questionnaire,PDQ),分别评价运动症状、非运动症状和生活质量。
1.4 数据处理使用Matlab 2017b平台的fMRI处理工具包conn 21.0[19]完成数据处理。具体步骤:①删除前10个时间点的数据;②时间和空间校正。对剩余230个时间点行时间和空间校正,完成校正后使用ART算法识别运动参数和全局信号强度中的离群时间点,并将其作为协变量在一阶分析中回归。③空间配准及标准化。将功能像先配准至对应的结构像后,再将结构相和功能相共同映射至蒙特利尔神经病学研究所(Montreal Neurological Institute,MNI)标准空间中,使患者的每个体素均处于相同的解剖位置。将功能像重新采样为2 mm×2 mm×2 mm。并将白质与脑脊液分割出来,仅保留灰质。④空间平滑。采用平滑核为6 mm×6 mm×6 mm半高全宽高斯核进行平滑。⑤去除线性漂移和协变量。将白质和脑脊液的信号、ART识别出的异常时间点及头动参数的一阶/二阶信号作为协变量进行回归。⑥低频滤波。选择0.01~0.08 Hz进行过滤。完成预处理后,将自动解剖标记(AAL)116模板中的双侧后扣带回作为种子点,以种子点内体素的平均时序与全脑所有体素的时序行Pearson相关分析,获得相关系数,并经Fisher变换获得符合正态分布的z值用于FC分析。
1.5 统计学方法使用SPSS 24.0软件进行数据分析。计量资料先行正态性检验,符合正态分布且方差齐的计量资料组间比较行配对t检验,不符合正态分布或方差不齐则行Wilcoxon秩和检验。检验水准采用α=0.05,以P < 0.05为差异有统计学意义。
使用MATLAB 2017b平台和Conn 21.0工具包对DPD患者治疗前后fMRI数据行配对t检验。使用高斯随机场(GRF)对结果进行校正,以体素水平P < 0.005,团块水平P < 0.05作为阈值。提取通过校正脑区的FC值。将治疗前后FC差值与临床量表评分差值输入SPSS 24.0软件中行Pearson相关性分析。
2 结果 2.1 taVNS治疗前后临床量表评分比较与治疗前相比,治疗后DPD患者HAMD、UPDRS、NMSS、PDQ评分均显著下降,差异均有统计学意义(均P < 0.05)(表 1)。
| 表 1 taVNS治疗前后DPD患者临床量表评分比较 |
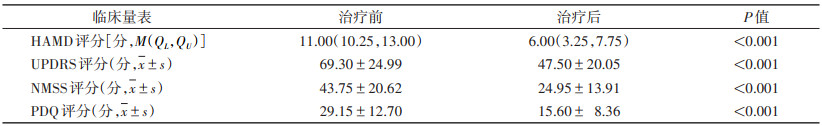 |
2.2 taVNS治疗前后FC变化
与治疗前相比,治疗后DPD患者左侧后扣带回与右侧额中回、右侧顶下小叶的FC值降低,左侧后扣带回与右侧枕下回的FC值升高,右侧后扣带回与右侧额中回的FC值降低(均P < 0.005,GRF校正)(表 2,图 1)。
| 表 2 taVNS治疗前后后扣带回FC改变显著的脑区 |
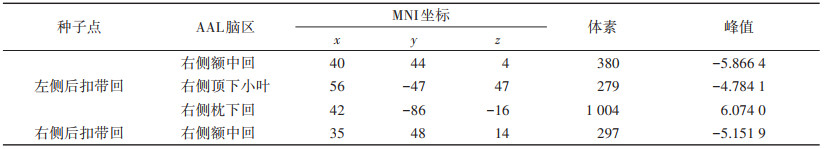 |
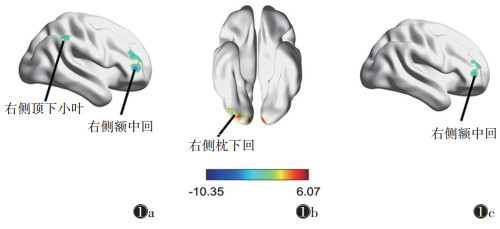 |
| 注:蓝色表示治疗后FC值下降,红色表示治疗后FC值上升。图 1a以左侧后扣带回为种子点,治疗后左侧后扣带回与右侧额中回、右侧顶下小叶的FC值下降;图 1b以左侧后扣带回为种子点,治疗后左侧后扣带回与右侧枕下回的FC值升高;图 1c以右侧后扣带回为种子点,治疗后右侧后扣带回与右侧额中回的FC值降低 图 1 帕金森病抑郁(DPD)患者治疗前后功能连接(FC)变化图 |
2.3 相关性分析
治疗前后DPD患者的左侧后扣带回与右侧额中回的FC差值与HAMD评分呈正相关(r=0.457,P=0.043,未校正)(图2)。
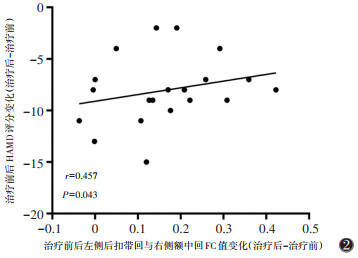 |
| 注:两者呈正相关 图 2 帕金森病抑郁(DPD)患者治疗前后差异脑区功能连接(FC)值变化与汉密尔顿抑郁量表(HAMD)评分相关性 |
3 讨论
taVNS是一种非侵入性、低成本的疾病治疗方法,被视为植入式迷走神经刺激术的替代方案[20]。taVNS可通过刺激内脏代表区,调节内脏功能。“耳者,宗脉之所聚也”。中医认为PD病位在肝与肾,肝肾亏虚为本,滋养肝肾是PD治本之法[21],耳穴宜选用肝、肾二穴。耳穴肝、肾穴均位于耳甲艇区,全部由迷走神经耳支支配,刺激肝、肾穴相当于直接刺激迷走神经[22]。
本研究选择未经抗抑郁药物治疗、抑郁症状较轻的DPD患者,且研究过程中未使用抗抑郁药物治疗,排除了药物对结果的影响。结果显示,taVNS治疗后DPD患者HAMD、UPDRS、NMSS、PDQ评分均显著下降,提示taVNS对DPD患者抑郁症状、运动症状、非运动症状和生活质量均有明显的改善作用。治疗前后静息态fMRI数据分析表明,治疗后DPD患者左侧后扣带回与右侧额中回、右侧顶下小叶的FC值降低,左侧后扣带回与右侧枕下回的FC值升高,右侧后扣带回与右侧额中回的FC值降低。进一步分析上述差异脑区的FC值与DPD患者HAMD评分的相关性,提示治疗前后左侧后扣带回与右侧额中回的FC差值与HAMD评分呈正相关。
额中回是背外侧前额叶的亚区,参与自下而上/刺激驱动的注意力定向,与后扣带回所属的默认网络在注意力控制方面具有拮抗关系。有研究发现,额中回可抑制默认网络活动,使抑郁症患者将注意力从当前事件上移开,破坏抑郁反刍,从而有可能缓解患者的悲伤情绪[13]。一项Meta分析也发现,抑郁症患者的后扣带回与右侧额中回的FC值升高,且与HAMD评分呈负相关[13]。而本研究发现taVNS干预可降低后扣带回与额中回的FC值,这可能有助于解释抑郁症患者发病及缓解状态的机制。此外,本研究还发现治疗后双侧后扣带回与右侧额中回的FC值均发生改变,而双侧后扣带回与左侧额中回的FC值无变化。与左侧额中回相比,右侧额中回还是背侧注意网络和腹侧注意网络的关键枢纽,负责2个网络间注意处理的相互作用,该区域的病变可能导致抑郁症患者的负向注意力偏差[23]。研究表明,右侧额中回的异常自发活动可预测抑郁症状的改善[24]。因此,推测右侧额中回与DPD的关系可能比左侧额中回更密切。
本研究中taVNS治疗后左侧后扣带回与右侧顶下小叶的FC值下降。以往研究发现顶下小叶功能异常会导致抑郁症患者缺乏快感,而难治性抑郁症患者在情绪处理过程中顶下小叶激活,并与抑郁症状改善相关,表明顶下小叶是参与情绪调节的核心脑区[25]。此外,后扣带回与顶下小叶同属于默认网络,默认网络功能活跃是导致抑郁症患者出现思维反刍的主要原因[26]。电休克或氯胺酮静脉滴注均可抑制默认网络,从而破坏抑郁症患者的思维反刍[25]。而默认网络又可根据不同的功能分为中线核心系统、背内侧前额叶皮质系统和内侧颞叶记忆系统。其中顶下小叶属于内侧颞叶记忆系统,参与情景记忆检索、自传体处理和未来决策;而后扣带回属于中线核心系统,主要参与整合另外2个系统的功能[27]。Lu等[26]的研究显示,相比于健康人,抑郁症患者后扣带回与顶下小叶的FC值显著升高,而治疗6周后患者后扣带回与顶下小叶的FC值下降,且与血清5-羟色胺水平变化显著相关。因此,taVNS改善DPD的抑郁症状与调节默认网络功能有关。
本研究存在的不足:采用自身前后对照,未设置假taVNS干预作为平行对照,不能排除安慰剂效应;样本量偏小;基于种子点的分析方法具有一定的主观性。今后研究中将优化方案,进一步揭示taVNS干预DPD的作用机制,以期为taVNS干预DPD提供更全面客观的证据支持。
| [1] |
中华医学会神经病学分会帕金森病及运动障碍学组, 中国医师协会神经内科医师分会帕金森病及运动障碍学组. 中国帕金森病治疗指南(第四版)[J]. 中华神经科杂志, 2020, 53(12): 973-986. DOI:10.3760/cma.j.cn113694-20200331-00233 |
| [2] |
GBD 2016 Parkinson's Disease Collaborators. Global, regional, and national burden of Parkinson's disease, 1990-2016: a systematic analysis for the global burden of disease study 2016[J]. Lancet Neurol, 2018, 17(11): 939-953. DOI:10.1016/S1474-4422(18)30295-3 |
| [3] |
ACCOLLA E A, POLLO C. Mood effects after deep brain stimulation for Parkinson's disease: an update[J]. Front Neurol, 2019, 10: 617. DOI:10.3389/fneur.2019.00617 |
| [4] |
KALINDERI K, PAPALIAGKAS V, FIDANI L. Current genetic data on depression and anxiety in Parkinson's disease patients[J]. Parkinsonism Relat Disord, 2024, 118: 105922. DOI:10.1016/j.parkreldis.2023.105922 |
| [5] |
WANG L L, SUN C J, WANG Y, et al. Effects of dance therapy on non-motor symptoms in patients with Parkinson's disease: a systematic review and meta-analysis[J]. Aging Clin Exp Res, 2022, 34(6): 1201-1208. DOI:10.1007/s40520-021-02030-7 |
| [6] |
陈茜茜, 周芷晴, 赵敬军, 等. 耳迷走神经刺激的作用机制与脑疾病临床应用研究进展[J]. 中国康复医学杂志, 2023, 38(10): 1474-1479. DOI:10.3969/j.issn.1001-1242.2023.10.026 |
| [7] |
LI S, RONG P, WANG Y, et al. Comparative effectiveness of transcutaneous auricular vagus nerve stimulation vs citalopram for major depressive disorder: a randomized trial[J]. Neuromodulation, 2022, 25(3): 450-460. DOI:10.1016/j.neurom.2021.10.021 |
| [8] |
马跃, 郭春蕾, 孙继飞, 等. 基于静息态fMRI探讨经皮耳迷走神经刺激对抑郁症患者相关脑区功能连接的影响[J]. 中国针灸, 2023, 43(4): 367-373. |
| [9] |
吴骁. 耳迷走神经刺激对原发性失眠症的疗效及脑功能调控机制研究[D]. 广州: 广州中医药大学, 2020.
|
| [10] |
LIANG L, WANG L L, JIANG X D, et al. Hippocampal volume and resting-state functional connectivity on magnetic resonance imaging in patients with Parkinson and depression[J]. Quant Imaging Med Surg, 2024, 14(1): 824-836. DOI:10.21037/qims-23-919 |
| [11] |
TIAN B, CHEN Q, ZOU M, et al. Decreased resting-state functional connectivity and brain network abnormalities in the prefrontal cortex of elderly patients with Parkinson's disease accompanied by depressive symptoms[J]. Glob Health Med, 2024, 6(2): 132-140. DOI:10.35772/ghm.2023.01043 |
| [12] |
LI W, WANG C, LAN X, et al. Aberrant dynamic functional connectivity of posterior cingulate cortex subregions in major depressive disorder with suicidal ideation[J]. Front Neurosci, 2022, 16: 937145. DOI:10.3389/fnins.2022.937145 |
| [13] |
ZHU Z, WANG Y, LAU W, et al. Hyperconnectivity between the posterior cingulate and middle frontal and temporal gyrus in depression: based on functional connectivity meta-analyses[J]. Brain Imaging Behav, 2022, 16(4): 1538-1551. |
| [14] |
LOU Y, HUANG P, LI D, et al. Altered brain network centrality in depressed Parkinson's disease patients[J]. Mov Disord, 2015, 30(13): 1777-1784. DOI:10.1002/mds.26321 |
| [15] |
LIN H, CAI X, ZHANG D, et al. Functional connectivity markers of depression in advanced Parkinson's disease[J]. Neuroimage Clin, 2020, 25: 102130. DOI:10.1016/j.nicl.2019.102130 |
| [16] |
MARTINEZ M, ARIZ M, ALVAREZ I, et al. Brainstem neuromelanin and iron MRI reveals a precise signature for idiopathic and LRRK2 Parkinson's disease[J]. NPJ Parkinsons Dis, 2023, 9(1): 62. DOI:10.1038/s41531-023-00503-2 |
| [17] |
American Psychiatric Association. Diagnostic and statistical manual of mental disorders fifth edition[M]. Arlington VA: American Pcychiatric Association, 2013.
|
| [18] |
ZIMMERMAN M, MARTINEZ J H, YOUNG D, et al. Severity classification on the Hamilton depression rating scale[J]. J Affect Disord, 2013, 150(2): 384-388. DOI:10.1016/j.jad.2013.04.028 |
| [19] |
ZHANG J, RAYA J, MORFINI F, et al. Reducing default mode network connectivity with mindfulness-based fMRI neurofeedback: a pilot study among adolescents with affective disorder history[J]. Mol Psychiatry, 2023, 28(6): 2540-2548. DOI:10.1038/s41380-023-02032-z |
| [20] |
ZHANG Y Z H, ZOU Y Y, RONG P J, et al. Transcutaneous auricular vagus nerve stimulation: clinical applications and mechanisms[J]. World J Acupunc Moxib, 2024, 34(2): 174-175, 194-195. DOI:10.1016/j.wjam.2024.03.007 |
| [21] |
杨宁, 刘卫国, 宁厚旭, 等. 帕金森病抑郁中西医结合诊断与治疗专家共识(2021年版)[J]. 中国现代神经疾病杂志, 2021, 21(12): 1027-1035. DOI:10.3969/j.issn.1672-6731.2021.12.002 |
| [22] |
王磊, 何家恺, 刘兵, 等. "耳脑脏腑相关"理论构建[J]. 世界科学技术-中医药现代化, 2021, 23(6): 2051-2057. |
| [23] |
GENG J, YAN R, SHI J, et al. Altered regional homogeneity in patients with somatic depression: a resting-state fMRI study[J]. J Affect Disord, 2019, 246: 498-505. DOI:10.1016/j.jad.2018.12.066 |
| [24] |
DU X, MAO Y, RAN Q, et al. Short-term group cognitive behavior therapy contributes to recovery from mild depression: evidence from functional and structural MRI[J]. Psychiatry Res Neuroimaging, 2016, 251: 53-59. DOI:10.1016/j.pscychresns.2016.04.010 |
| [25] |
YUN J Y, CHOI S H, PARK S, et al. Neural correlates of anhedonia in young adults with subthreshold depression: a graph theory approach for cortical-subcortical structural covariance[J]. J Affect Disord, 2024, 366: 234-243. DOI:10.1016/j.jad.2024.08.192 |
| [26] |
LU F, ZHANG J, ZHONG Y, et al. Neural signatures of default mode network subsystems in first-episode, drug-naive patients with major depressive disorder after 6-week thought induction psychotherapy treatment[J]. Brain Commun, 2024, 6(4): e263. DOI:10.1093/braincomms/fcae263 |
| [27] |
ZHOU H X, CHEN X, SHEN Y Q, et al. Rumination and the default mode network: meta-analysis of brain imaging studies and implications for depression[J]. Neuroimage, 2020, 206: 116287. DOI:10.1016/j.neuroimage.2019.116287 |
 2025, Vol. 23
2025, Vol. 23


