| CT血流储备分数联合斑块特征预测冠心病患者发生主要不良心脏事件的价值 |
2. 上海健康医学院附属嘉定区中心医院超声影像科,上海 201800
2. Department of Ultrasound, Jiading District Central Hospital Affiliated to Shanghai University of Medicine and Health Sciences, Shanghai 201800, China
冠状动脉粥样硬化性心脏病(冠心病)是临床发病率最高的心血管疾病,根据程度不同,治疗方法和临床预后差别很大[1],轻型只需改变饮食习惯和加强锻炼,重者可能导致不良心脏事件(major adverse cardiac events,MACE)的发生,甚至造成死亡。因此,早期诊断冠心病并准确判断其严重程度有助于选择合适有效的干预手段。冠脉CTA(coronary CTA,CCTA)无创、快捷,可对管壁斑块的位置、形态、密度和局部狭窄程度进行评估[2]。近年来,计算机算法技术日益成熟,可直接通过CCTA数据获得冠状动脉(冠脉)血流动力学参数——血流储备分数(fractional flow reserve derived from coronary CT angiography,FFRCT),其与有创性血流储备分数(FFR)有良好的相关性,在冠心病无创诊断中具有良好的应用前景[3]。冠状动脉(冠脉)轻、中度狭窄(25%~70%)病变,造影或CCTA最易出现狭窄程度与患者FFR缺血状态不匹配的情况,从而导致漏诊或进行不必要的侵入性检查[4]。因此,本研究采用CCTA评估轻中度冠脉狭窄冠心病患者的冠脉管腔狭窄程度、管壁斑块特征和FFRCT,并进行危险分级,比较综合CCTA评分、高危斑块特征、FFRCT及其联合应用对冠心病患者MACE发病风险的预测价值。
1 资料与方法 1.1 一般资料选择2020年10月至2021年9月在我院收治的冠心病患者339例,CCTA检查显示存在粥样硬化斑块及冠脉狭窄[1-2]。排除碘对比剂过敏、近1个月内发生急性心脏事件、既往心脏及冠脉有手术史、图像存在明显伪影影响诊断,以及心肌炎、心肌病、瓣膜病等心脏疾病患者。记录患者的年龄、性别、身高、体质量等一般资料,以及吸烟史、高血压史、高血脂史、糖尿病史和BMI升高(> 24 kg/m2)等冠心病危险因素。本研究经医院伦理委员会审核通过(编号:2020K14)。
1.2 仪器与方法采用320排CT扫描仪(联影,uCT960),扫描参数:100 kV,150~200 mAs,行前瞻性心电门控轴位扫描。增强扫描采用自动触发方式,触发监测点置于降主动脉内气管隆嵴下1 cm层面,触发阈值为120 HU。应用双筒高压注射器经肘静脉注射非离子型对比剂碘帕醇(碘浓度370 mg/mL),流率5.0 mL/s,剂量50~80 mL。患者心率 > 70次/min时,口服美托洛尔25~50 mg,待心率<70次/min再扫描,以保证图像质量。由2位高年资心血管影像诊断医师共同阅片。
1.3 冠脉狭窄分析及危险分级选取血管显示最清晰的期相,应用联影后处理工作站行图像后处理。以横断位为基础,综合VR、MIP、曲面重建图像分析冠脉三大主干及主要分支血管管壁斑块情况。综合CCTA评分计算方法[5]:冠脉树采用17段模型,确定各斑块所在的血管段,依据冠脉不同优势型,各节段的位置权重因子为0~6。测量斑块相应管腔狭窄程度,狭窄率 < 50%和≥50%的权重因子分别为1、1.4。分析斑块成分,钙化斑块、非钙化斑块和混合斑块的权重因子分别为1.1、1.2和1.3。每个斑块分别进行评分,得分=斑块位置权重因子×狭窄程度权重因子×斑块成分权重因子。各节段斑块得分累计即为综合CCTA评分,范围0~42分。对综合CCTA评分进行危险分级[5]:< 5分为1级,5~<20分为2级,≥20分为3级。
1.4 冠脉FFRCT分析及危险分级应用联影后处理工作站FFRCT模块进行图像分析。构建血流动力学模型,通过生理学参数和流体力学与解剖学模式结合,计算最大充血状态下冠脉的血流量和血压,获得各冠脉斑块对应的FFRCT值,以最低FFRCT值进行危险分级。分级标准[4]:FFRCT≥0.80为低危,FFRCT < 0.80为高危。
1.5 冠脉管壁高危斑块特征分析及危险分级选取FFRCT值最低的血管段斑块进行高危斑块特征分析。高危斑块特征包括:①正性重构,斑块处管腔横径与其周围正常血管横径的比值> 1.5;②低CT衰减,在斑块的非钙化区取3个随机点进行测量,平均CT值< 30 HU;③餐巾环征,低密度斑块周围可见环形稍高密度衰减环包绕。④点状钙化,斑块内可见微小钙化,CT值> 130 HU,直径 < 3 mm。以上特征 < 2个的斑块为低危斑块,≥2个为高危斑块。
1.6 随访以CCTA检查时间作为随访起点,每4个月随访1次,以发生MACE的时间为终点;如未发生MACE,至少随访1年,随访截止时间为2023年6月26日。随访内容包括心血管症状、治疗情况及MACE发生情况。MACE包括:不稳定心绞痛、非致死性心肌梗死、心源性猝死和非计划血运重建。
1.7 统计学分析采用SPSS 20.0和MedCalc 15.0软件进行分析。计量资料以x±s表示,组间比较行独立样本t检验。计数资料以%表示,等级资料比较采用非参数秩和检验,组间比较行χ2检验。采用Cox回归模型筛选MACE的独立预测因素。建立预测MACE的3个模型:模型1,基于综合CCTA评分危险分级;模型2,基于综合CCTA评分危险分级联合高危斑块危险分级;模型3,基于综合CCTA评分危险分级、高危斑块危险分级、FFRCT危险分级三者联合。绘制3个模型预测MACE的ROC曲线,比较3个模型的预测效能。以P < 0.05为差异有统计学意义。
2 结果 2.1 一般资料339例中,男174例,女165例;年龄32~75岁,平均(61.3±9.6)岁;随访时间127~965 d,中位随访时间665 d。随访期间87例(25.7%)发生MACE(MACE组),MACE最短发生时间为127 d;252例(74.3%)未发生MACE(非MACE组)。
2.2 2组冠心病危险因素比较MACE组的吸烟史、高血压史、高血脂史、糖尿病史、BMI升高百分比均明显高于非MACE组,差异均有统计学意义(均P < 0.05)(表 1)。
| 表 1 2组发生冠心病的危险因素比较 |
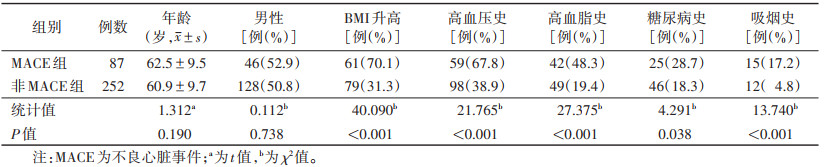 |
2.3 2组CCTA图像分析比较
MACE组综合CCTA评分危险分级以2、3级为主,非MACE组以1、2级为主,差异有统计学意义(Z=-12.784,P < 0.01),同一等级间2组比较差异均有统计学意义(均P < 0.05)。MACE组高危斑块危险分级高危百分比、FFRCT危险分级高危百分比均明显高于非MACE组,差异均有统计学意义(均P < 0.05)(表 2)。
| 表 2 2组CCTA图像分析比较 |
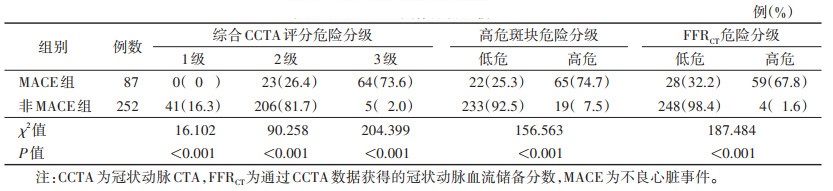 |
2.4 各危险因素对MACE的预测价值比较
Cox回归分析表明,综合CCTA评分危险分级、高危斑块危险分级、FFRCT危险分级预测MACE发生风险的HR值分别为25.17、15.52、22.08,高于冠心病临床危险因素,表明三者均可有效区分MACE和非MACE(均P < 0.001)(表 3),生存曲线见图 1~3。
| 表 3 冠心病临床危险因素、综合CCTA评分危险分级、高危斑块危险分级、FFRCT危险分级的Cox回归分析 |
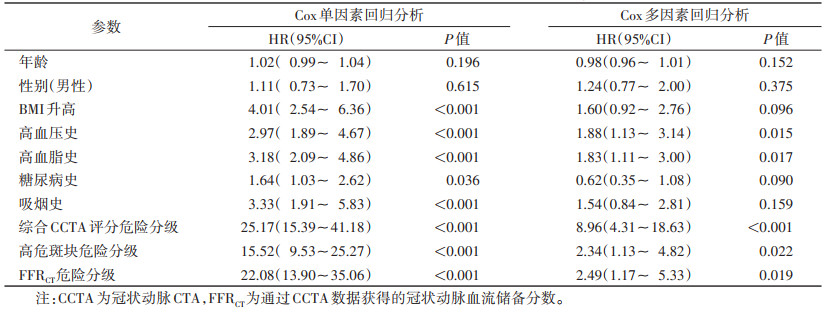 |
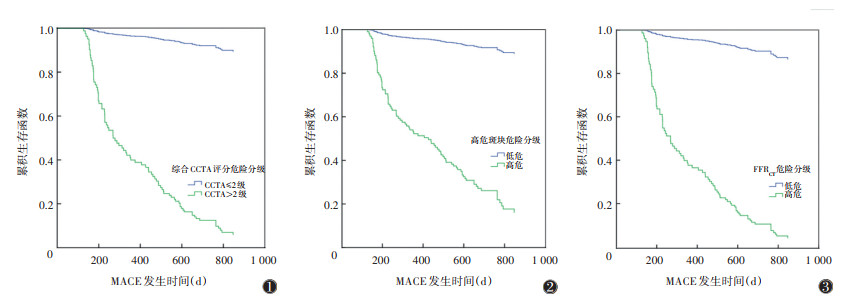 |
| 注:CCTA为冠状动脉CTA,FFRCT为通过CCTA数据获得的冠状动脉血流储备分数,MACE为不良心脏事件 图 1-3 综合CCTA评分危险分级、高危斑块危险分级、FFRCT危险分级预测MACE的生存曲线分析 |
2.5 3种模型预测MACE效能比较
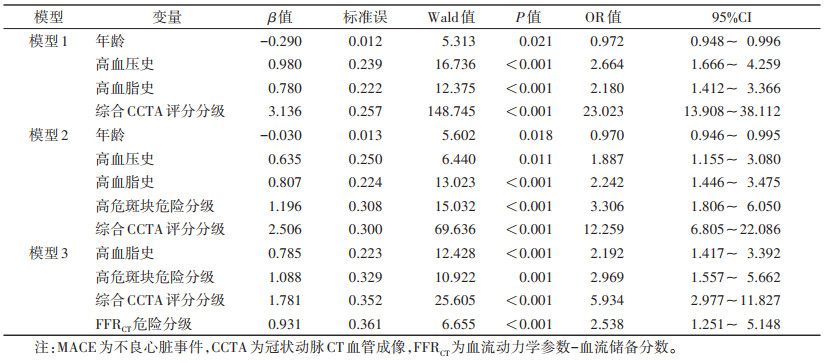
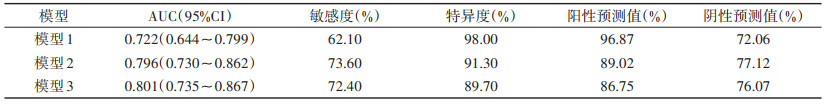
模型1:将年龄、性别、BMI升高、高血压史、高血脂史、糖尿病史、吸烟史和综合CCTA评分分级作为协变量,MACE发生作为结局变量,纳入Cox回归模型,结果显示:年龄、高血压史、高血脂史、综合CCTA评分危险分级是影响MACE发生的独立因素,其中年龄是保护因素,高血压史、高血脂史和综合CCTA评分危险分级是危险因素。模型2:将年龄、性别、BMI升高、高血压史、高血脂史、糖尿病史、吸烟史、综合CCTA评分分级、高危斑块危险分级作为协变量,MACE发生作为结局变量,纳入Cox回归模型,结果显示:吸烟史、高血脂史、综合CCTA评分分级、高危斑块危险分级是MACE发生的独立因素,均为危险因素。模型3:将年龄、性别、BMI升高、高血压史、高血脂史、糖尿病史、吸烟史、综合CCTA评分分级、高危斑块危险分级和FFRCT危险分级作为协变量,MACE发生作为结局变量,纳入Cox回归模型,结果显示:高血脂史、综合CCTA评分危险分级、高危斑块危险分级和FFRCT危险分级是MACE发生的独立因素,均为危险因素(表 4)。3种模型的ROC曲线见表 5、图 4。模型2预测MACE的AUC高于模型1,差异有统计学意义(P < 0.05)。模型3的AUC最大,与模型1、2比较差异均有统计学意义(均P < 0.05)。
| 表 4 3种模型预测MACE能力情况 |
 |
| 表 5 3种模型的ROC曲线比较 |
 |
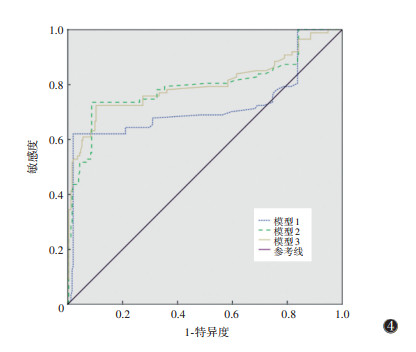 |
| 注:MACE为不良心脏事件 图 4 3种模型预测MACE的ROC曲线 |
3 讨论
冠脉粥样硬化斑块的形成和发展是一个与遗传相关、受多种环境因素影响的慢性进展过程,高血压、高脂血症、糖尿病等危险因素与冠心病在遗传上均有同源性[6],是冠心病的高危因素。随着人们对冠心病认识的提高,其高危因素越来越受到关注。本研究显示,MACE组和非MACE组高血压、高血脂、糖尿病、高BMI差异均有统计学意义,其中高血压、高血脂在多因素回归分析中仍明显相关,提示控制冠心病高危人群血压、血脂对预防可能发生的心血管事件具有重要意义。
近年来,CCTA以其便捷、无创的优势,成为冠心病筛查、诊断最常用的检查技术。既往研究发现CCTA可评估冠脉管壁斑块性质和管腔狭窄程度、预测冠心病患者的预后[7]。本研究采用综合CCTA评分方法进行危险分级,考虑了冠脉优势型、斑块位置、狭窄程度、斑块成分等信息,而非单纯根据狭窄程度最重的血管进行分级。文献显示,综合CCTA评分方法相比冠状动脉疾病报告和数据系统(coronary artery disease-reporting and data system,CAD-RADS)分级方法更全面客观,对MACE的预测价值更高[5, 8]。本研究中综合CCTA评分是MACE的独立危险因子,HR值为8.96,具有良好的预测价值。既往大量研究已证实,患者突发MACE并不完全依赖于冠脉狭窄程度,大多患者冠脉狭窄程度并不严重,其发生MACE更多的是因为高危斑块的破裂[9]。本研究也发现高危斑块是MACE的独立预测因素,早期发现和干预具有积极的临床意义。
FFR是指冠脉狭窄病变处的血流量与邻近无狭窄病变血管的最大血流量之比,用于评价冠脉血流动力学状态,是指导血运重建术的金标准[4],但常规FFR在侵入性冠脉造影(invasive coronary angiography,ICA)下才能完成,操作较繁琐,限制了其在临床上的推广使用。基于CCTA数据通过3D计算流体动力学模型获得的类似参数FFRCT是大部分未行ICA检查的患者,尤其是冠心病筛查患者很好的选择[10]。既往FFRCT未能广泛应用于临床主要是由于其对图像质量要求较高,在2015年PROMISE的研究中,FFRCT的计算成功率仅67%[11]。通过控制心率、缩短扫描时间、使用双源CT或具备宽体探测器的扫描设备优化扫描方案均可提高FFRCT的成功率[12]。本研究采用320排CT进行扫描,仅需1个心动周期即可完成整个心脏扫描,减少了心率对扫描的影响,且可进行全时相图像重建,获得高质量图像,成功率 > 90%。FFR ≤0.80是ICA判断心肌缺血的常用界值,FFRCT值< 0.80的冠脉病变可对血流动力学造成明显影响,导致供血区心肌供氧和需氧失衡,如未及时有效建立侧支循环,将进一步发展为MACE。研究显示,FFRCT在0.75~0.80内的诊断准确率最差,称为“灰色区域”[13],此时需结合患者的基本情况、临床症状、实验室指标等进行综合评估。本研究以FFRCT≤0.80作为判断界值,以保证较高的敏感度和较低的假阴性率。本研究Cox回归分析显示,FFRCT危险分级的HR值为2.49,表明FFRCT ≤0.80的患者发生MACE的风险约为FFRCT > 0.80患者风险的2.5倍,是预测MACE的独立危险因子。有专家提出,FFRCT > 0.80的患者可暂缓进行有创检查和治疗,建议直接药物治疗,从而减低了医疗负担[14]。
冠脉狭窄程度、高危斑块特征分析和血流动力学分析的评估角度不同。本研究显示,综合CCTA评分危险分级、高危斑块危险分级、FFRCT危险分级均为MACE发生的独立危险因素,三者联合可取长补短,在保证敏感度和特异度的前提下进一步提高预测能力,是一种方便实用的评估方法。存在高危斑块的患者即便狭窄程度为轻中度,也应通过评估FFRCT判定是否存在心肌缺血。当FFRCT值位于0.75~0.80的“灰色区域”时,若斑块具备高危特征,相应区域发生缺血的风险增大,需进行更积极的治疗。因此,对冠脉斑块造成的血管狭窄,整合高危斑块特征和无创性血流动力学评估可明显提高潜在罪犯斑块的识别[15]。在2016年版CAD-RADS分级基础上,2022年7月国际心血管CT协会发布的CAD-RADS 2.0分级标准[16]增加了斑块负荷指标,并纳入了CT血流动力学检查结果,通过FFRCT或心肌CT灌注进行缺血评估,为冠脉疾病的分级管理提供了标准化框架,增强了CCTA检查在患者后续治疗管理决策制订中的作用,促进了影像诊断医师与临床医师的有效沟通和多学科联合。但作为一个更加复杂的分级体系,从临床实践看,如何将解剖狭窄、斑块负荷和功能评估有机地融合成一个合理的、简化的分级体系更好地服务临床是今后努力的目标。
本研究存在的局限性:①样本来源和数量有限,且仅进行短期随访,评价意义受限。②选取FFRCT值最低的血管进行高危斑块特征分析,可能忽略其他高危斑块造成的血流动力学改变。③在随访过程中,CCTA检查结果一定程度上修正了病例的治疗方案,可能导致结果存在偏倚。今后需进行多中心队列研究,细化试验设计,延长随访时间,动态监测各指标变化及治疗情况,以获得更客观的研究结果。
综上所述,综合CCTA评分、高危斑块特征、FFRCT对冠心病患者MACE的发生均具有良好的预测价值,而三者联合能进一步提高预测效能,为临床医师判别潜在罪犯斑块提供参考,从而最大程度减少心脏事件的发生。
| [1] |
中华医学会心血管病学分会介入心脏病学组, 中华医学会心血管病学分会动脉粥样硬化与冠心病学组, 中国医师协会心血管内科医师分会血栓防治专业委员会, 等. 稳定性冠心病诊断与治疗指南[J]. 中华心血管病杂志, 2018, 46(9): 680-694. |
| [2] |
中国医师协会放射医师分会. 冠状动脉CT血管成像斑块分析和应用中国专家建议[J]. 中华放射学杂志, 2022, 56(6): 595-607. |
| [3] |
刘琪, 郝菲, 窦勇. CT血流储备分数在冠心病无创诊断中的应用价值[J]. 中国中西医结合影像学杂志, 2023, 21(3): 300-303. |
| [4] |
《中国冠状动脉血流储备分数测定技术临床路径专家共识》专家组. 中国冠状动脉血流储备分数测定技术临床路径专家共识[J]. 中国介入心脏病学杂志, 2019, 27(3): 121-133. |
| [5] |
VANROSENDAEL A R, SHAW L J, XIE J X, et al. Superior risk stratification with coronary computed tomography angiography using a comprehensive atherosclerotic risk score[J]. JACC Cardiovasc Imaging, 2019, 12(10): 1987-1997. DOI:10.1016/j.jcmg.2018.10.024 |
| [6] |
ARAGAM K G, JIANG T, GOEL A, et al. Discovery and systematic characterization of risk variants and genes for coronary artery disease in over a million participants[J]. Nat Genet, 2022, 54(12): 1803-1815. DOI:10.1038/s41588-022-01233-6 |
| [7] |
尹小花, 徐荣, 李春晨, 等. 冠状动脉CT血管成像预测冠状动脉斑块患者发生主要不良心脏事件的价值[J]. 中国医学影像技术, 2017, 33(10): 1506-1511. |
| [8] |
HOFFMANN U, FERENCIK M, UDELSON J E, et al. Prognostic value of noninvasive cardiovascular testing in patients with stable chest pain: insights from the PROMISE trial (prospective multicenter imaging study for evaluation of chest pain)[J]. Circulation, 2017, 135(24): 2320-2332. DOI:10.1161/CIRCULATIONAHA.116.024360 |
| [9] |
LIBBY P. Inflammation and the pathogenesis of atherosclerosis[J]. Vascul Pharmacol, 2024, 154: 107255. DOI:10.1016/j.vph.2023.107255 |
| [10] |
HUANG A L, MAGGIORE P L, BROWN R A, et al. CT-derived fractional flow reserve(FFRCT): from gatekeeping to roadmapping[J]. Can Assoc Radiol J, 2020, 71(2): 201-207. DOI:10.1177/0846537119893752 |
| [11] |
LU M T, FERENCIK M, ROBERTS R S, et al. Noninvasive FFR derived from coronary CT angiography: management and outcomes in the PROMISE trial[J]. JACC Cardiovasc Imaging, 2017, 10(11): 1350-1358. DOI:10.1016/j.jcmg.2016.11.024 |
| [12] |
TAKAGI H, IHDAYHID A R, LEIPSIC J A. Integration of fractional flow reserve derived from CT into clinical practice[J]. J Cardiol, 2023, 81(6): 577-585. DOI:10.1016/j.jjcc.2023.02.002 |
| [13] |
MATSUMURA-NAKANO Y, KAWAJI T, SHIOMI H, et al. Optimal cutoff value of fractional flow reserve derived from coronary computed tomography angiography for predicting hemodynamically significant coronary artery disease[J]. Circ Cardiovasc Imaging, 2019, 12(8): e008905. DOI:10.1161/CIRCIMAGING.119.008905 |
| [14] |
NORGAARD B L, FAIRBAIRN T A, SAFIAN R D, et al. Coronary CT angiography-derived fractional flow reserve testing in patients with stable coronary artery disease: recommendations on interpretation and reporting[J]. Radiol Cardiothorac Imaging, 2019, 1(5): e190050. DOI:10.1148/ryct.2019190050 |
| [15] |
LEE J M, CHOI G, KOO B K, et al. Identification of high-risk plaques destined to cause acute coronary syndrome using coronary computed tomographic angiography and computational fluid dynamics[J]. JACC Cardiovasc Imaging, 2019, 12(6): 1032-1043. DOI:10.1016/j.jcmg.2018.01.023 |
| [16] |
CURY R C, BLANKSTEIN R, LEIPSIC J, et al. CAD-RADSTM 2.0 - 2022 Coronary Artery Disease - Reporting and Data System an expert consensus document of the Society of Cardiovascular Computed Tomography (SCCT), the American College of Cardiology (ACC), the American College of Radiology (ACR) and the North America society of cardiovascular imaging (NASCI)[J]. J Cardiovasc Comput Tomogr, 2022, 16(6): 536-557. DOI:10.1016/j.jcct.2022.07.002 |
 2024, Vol. 22
2024, Vol. 22


