| CT心肌应变参数在肥厚型心肌病左心房功能评估与鉴别诊断中的应用 |
2. 空军军医大学附属西京医院放射科,陕西 西安 710032;
3. 陕西中医药大学附属医院医学影像科,陕西 咸阳 712000
2. Department of Radiology, Xijing Hospital of Air Force Military Medical University, Xi'an 710032, China;
3. Department of Medical Imaging, Affiliated Hospital of Shaanxi University of Chinese Medicine, Xianyang 712000, China
肥厚型心肌病(hypertrophic cardiomyopathy,HCM)是临床常见的心肌疾病,以心肌肥厚和左室功能不全为主要特征[1]。随病程进展,左心室过重的压力负荷传递到左心房,导致左心房进行性增大和功能障碍,使HCM患者心脏不良事件发生率显著增加[2]。既往研究认为左心房大小是HCM患者发生心脏不良事件的重要预后因素之一,但有学者认为这一参数缺乏敏感性,且在评估异常和预测患者预后方面常不准确[3-4]。因此,对于HCM患者,无创性定量评估左心房功能至关重要。同时,HCM与高血压性左心室肥厚(hypertensive left ventricular hypertrophy,HLVH)的鉴别也是临床工作中常面临的问题。虽然这2种疾病的影像学表现相似度较高,但在治疗手段和风险分层方面存在显著差异[5]。之前HCM与HLVH的鉴别主要依据左心室肥厚的差异,HCM通常以室间隔的非对称性肥厚为主要特征,而HLVH多为对称性肥厚[6]。但4%~47%的HLVH患者可能出现非对称性肥厚,31%的HCM患者则可能表现为对称性肥厚[7]。因此,需更多影像学新指标用于提高这2种疾病的鉴别准确率。基于计算机断层成像特征追踪(computer tomography-feature tracking,CT-FT)所获得的心肌应变参数可用于评估主动脉瓣狭窄所致的心功能障碍,并有望在心脏疾病的鉴别诊断中发挥作用[8]。本研究旨在探讨心肌应变参数用于评估HCM和HLVH左心房功能受损及其鉴别诊断的可行性,以期为临床提供更多参考。
1 资料与方法 1.1 一般资料回顾性分析2020年4月至2023年9月在空军军医大学附属西京医院行冠状动脉CTA且未发现冠状动脉狭窄、符合相应入选条件的患者。共纳入179例,其中HCM组88例、HLVH组91例。HCM组纳入标准:①影像学检查(如超声心动图和心脏MRI等)示左室壁最大厚度(maximum left ventricular wall thickness,MLVWT)≥15 mm;有家族史的患者,MLVWT ≥13 mm[9]。②左室射血分数(left ventricular ejection fraction,LVEF)≥50%。排除标准:由其他疾病所致的心肌肥厚,如代谢性疾病、瓣膜性心脏病等。HLVH组纳入标准:①符合动脉高血压管理指南的诊断标准[3],即连续3次测得动脉收缩压≥140 mmHg和/或舒张压≥90 mmHg(1 mmHg=0.133 kPa);②LVEF ≥50%。排除标准:①由其他因素所导致的左心室肥厚,如瓣膜性心脏病、遗传性心脏病等;②有其他心脏病病史者,如心律失常、心肌梗死等。另选择90例经问诊和检查确认无基础性疾病且LVEF ≥50%的健康人群为健康对照组。本研究已获医院伦理委员会批准(KY-20192138-4)。
1.2 仪器与方法使用Siemens第3代双源CT机(Somatom Force)。扫描范围:气管隆嵴下1~2 cm至心脏膈面水平。3组检查前2~3 min舌下喷洒硝酸甘油雾剂0.5 mg以扩张冠状动脉,并行吸气和屏气训练。扫描参数:100 kV,CARE Dose系统将根据管电压自动调节管电流(参考值300 mAs),重建层距0.50 mm,层厚0.75 mm。采用高压注射器注射非离子型对比剂碘佛醇(碘浓度370 mg/mL),剂量1 mL/kg体质量,流率4~6 mL/s,后以相同流率自动注射20~50 mL生理盐水。使用对比剂团注追踪法,设定降主动脉为对比剂监测区域,当ROI内CT值达到阈值(100 HU)时,停顿6 s开始采集图像。扫描过程中监测心率变化并自动调整螺距,将原始数据以10%的R-R间期进行重建,获得心脏全期相数据。
1.3 参数测量和图像分析参数测量和图像分析均由2位具有10年以上心血管CT诊断经验的医师完成(测量前均接受心内、外膜勾勒与心脏形态参数测量的标准化培训)。先由其中1位医师完成各项参数的测量。根据左心室16节段模型,选取左室舒张末期,分别在短轴基底层面、乳头肌层面及心尖层面手动测量MLVWT并记录。在左心房最大层面测量左房前后径(left atrial anterior-posterior diameter,LAAP)。使用MedisSuite(v4.0)后处理软件量化各项心功能参数,左室与左房功能参数需在所获取的各组图像中分别选择左室舒张、收缩末期和左房最大、最小容积层面进行心内膜和外膜边界的手动勾勒,勾勒完成后软件将自动识别其余图像特征,必要时可手动调整,后续软件将自动计算各项参数。包括:LVEF、左室质量指数(left ventricular mass index,LVMI)、左室收缩末期容积(left ventricular end-systolic volume,LVESV)、左室舒张末期容积(left ventricular end-diastolic volume,LVEDV)、左房射血分数(left atrial ejection fraction,LAEF)、左房最大容积(left atrial maximum volume,LAVmax)、左房最小容积(left atrial minimum volume,LAVmin)、左房周向应变(left atrium global circumferential strain,LAGCS)和左房纵向应变(left atrium global longitudinal strain,LAGLS)(图 1~3)。
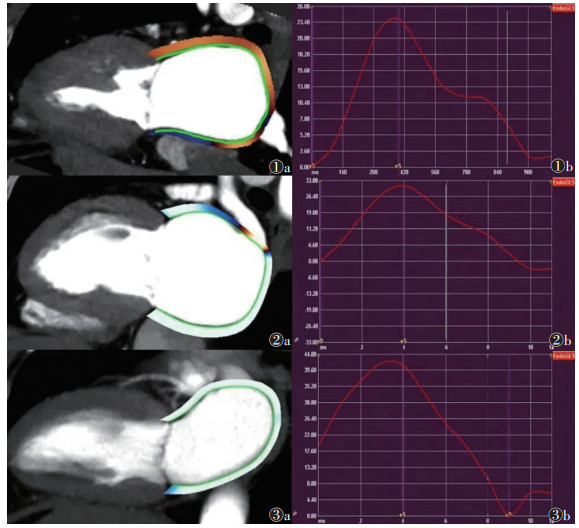 |
| 注:图 1患者,女,41岁,肥厚型心肌病;图 1a,1b分别为左心房心肌勾勒图像及时间-应变曲线,峰值为25.15%。图 2患者,女,45岁,高血压性左室肥厚;图 2a,2b分别为左心房心肌勾勒图像及时间-应变曲线,峰值为32.79%。图 3为健康受试者,女,42岁;图 3a,3b分别为左心房心肌勾勒图像及时间-应变曲线,峰值为41.88% 图 1-3 CT特征追踪所获左房纵向应变图 |
4周后由2位医师共同对随机抽取的90例受试者(HCM、HLVH、对照组各30例)重新分析,以确保数据的可重复性。结果存在较大差异时,由第3位具有15年以上心血管CT诊断经验的医师独立分析。
1.4 统计学方法采用SPSS 25.0进行数据处理和分析。计数资料以百分比(%)表示,组间差异行Fisher确切概率法检验。正态性检验使用Kolmogorov-Smirnov检验,符合正态分布的数据以x±s表示;方差齐性分析使用Levene检验。符合正态分布且方差齐的计量资料,组间差异采用单因素方差分析,事后比较使用Bonferroni法。采用二元logistic回归分析评估心功能参数鉴别HCM和HLVH的能力。通过ROC曲线得出各项参数鉴别HCM与HLVH的敏感度、特异度及截断值。AUC的比较行DeLong检验。参数的可重复性行ICC评估,当ICC > 0.75时为一致性良好。以P<0.05为差异有统计学意义。
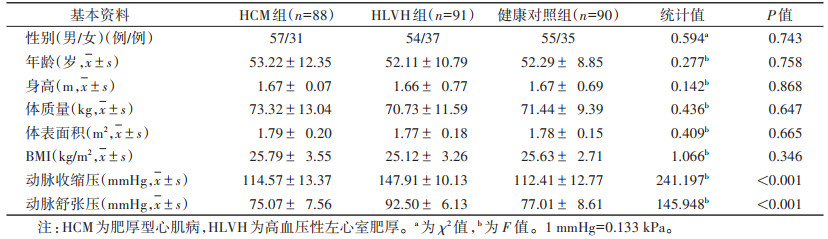
2 结果 2.1 3组基本资料比较3组性别、年龄、身高、体质量、体表面积及BMI差异均无统计学意义(均P > 0.05)。HLVH组的动脉舒张压和收缩压均显著高于HCM组和健康对照组(均P<0.001)(表 1)。
| 表 1 3组基本资料对比 |
 |
2.2 3组心功能参数比较
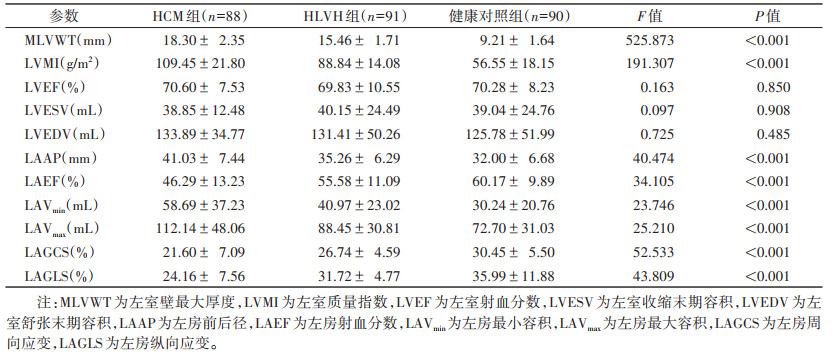
3组LVEF、LVESV与LVEDV比较,差异均无统计学意义(均P > 0.05)。相较于健康对照组,HCM组与HLVH组的MLVWT、LVMI、LAAP、LAVmax和LAVmin明显增高,LAEF、LAGCS和LAGLS均明显降低(均P<0.05)(表 2),但HCM组更显著。
| 表 2 3组心功能参数比较(x±s) |
 |
2.3 HCM和HLVH的鉴别诊断
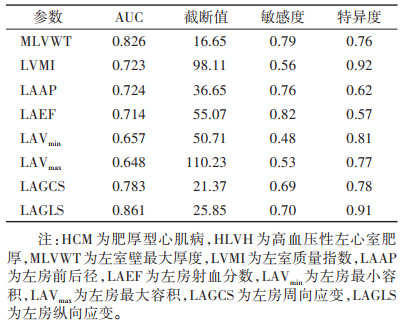
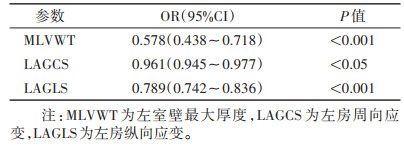
MLVWT、LVMI、LAAP、LAEF、LAVmin、LAVmax、LAGCS及LAGLS在HCM和HLVH的鉴别诊断方面效能不同(表 3)。DeLong检验表明,MLVWT、LAGCS和LAGLS的AUC高于其他参数(均P<0.05),而三者间的AUC差异均无统计学意义(均P > 0.05)。在二元logistic回归分析中,MLVWT、LAGCS和LAGLS组合模型(表 4)的AUC为0.925,敏感度为0.98,特异度为0.74;DeLong检验示该模型的AUC均显著高于MLVWT、LAGCS和LAGLS单独的AUC(均P<0.05)(图 4)。
| 表 3 心功能参数对HCM和HLVH的鉴别诊断效能 |
 |
| 表 4 心功能参数的二元logistic回归分析 |
 |
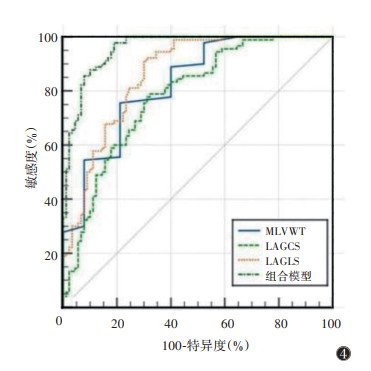 |
| 注:HCM为肥厚型心肌病,HLVH为高血压性左心室肥厚,MLVWT为左室壁最大厚度,LAGCS为左房周向应变,LAGLS为左房纵向应变 图 4 心功能参数与组合模型鉴别HCM与HLVH的ROC曲线 |
2.4 心功能参数的可重复性检验
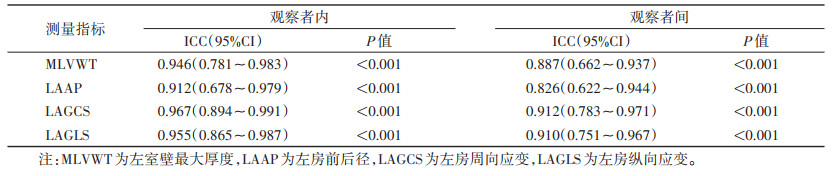
2位医师测量的MLVWT、LAAP、LAGCS和LAGLS在观察者内和观察者间的一致性良好,ICC值为0.826~0.967(均P<0.001)(表 5)。
| 表 5 心功能参数的可重复性 |
 |
3 讨论
传统的心肌应变参数获取方法主要通过心脏磁共振特征追踪(cardiac magnetic resonance-feature tracking,CMR-FT)与超声斑点追踪(speckle tracking imaging,STI)。尽管CMR-FT在心肌应变分析方面具有优势,但绝对禁忌证较多,而STI可能会受到声像质量的影响,导致分析精度下降[10]。CT-FT作为一种半自动心肌应变量化技术,弥补了传统CT在心肌应变测定中的不足。研究表明,CT-FT是可靠的心功能评估手段[11],与传统方法相比,其不仅操作简便且禁忌证少,还能在观察冠状动脉解剖结构的同时,实现对心功能的综合评估。
本研究中,3组LVEF、LVESV和LVEDV比较差异均无统计学意义,可能是由于HCM和HLVH患者早期主要表现为左心室舒张功能受损,心脏通过代偿机制来维持或增强收缩功能,因此LVEF通常在正常范围内[12]。相较于健康对照组,其余2组的MLVWT、LVMI、LAAP、LAVmax和LAVmin均不同程度增加,LAEF和心肌应变值则均不同程度降低,HCM组LAGLS降低最显著。尽管HCM和HLVH的病理基础不同(前者为肌小节蛋白编码基因变异,后者为心肌细胞对负荷的代偿性改变),但都可导致MLVWT和LVMI的升高[13]。左心房在左心室收缩期主要负责储存血液,在舒张早期发挥导管功能,并在舒张晚期通过主动收缩将血液泵入左心室,进一步使左心室充盈[14]。HCM和HLVH患者早期以左心室舒张功能受损为主,引起的左心室充盈压力升高被传递回左心房,而左心房壁相对较薄,心肌纤维较短,对压力和容量负荷承受能力较弱,因此,在左心室发生心肌重构前,LAAP、LAVmax、LAVmin及左心房功能参数可能已发生改变[15],且HCM为遗传性心肌疾病,病理过程较长,常伴随更严重的心功能障碍和心肌肥厚[16]。Hinojar等[17]研究发现,即使是LVEF正常的HCM患者,LAGLS、LAEF及左心房所有容积指数也有可能已出现明显异常。Li等[18]对比伴左心室肥厚和不伴左心室肥厚HLVH患者的左心房功能发现,与健康对照组相比,2组患者的LAEF和心肌应变值均显著降低。Zhou等[19]进一步对比了HCM与HLVH患者的左心房大小和功能参数,发现与健康对照组相比,2组患者不仅LAAP增大,且LAEF与LAGLS在储备期、导管期及收缩期均显著降低,与本研究基本一致。深入了解左心房功能在这2种疾病进展中的差异有助于更好地理解心脏疾病的发展,并为预后提供新线索。
有研究使用T1 mapping的影像组学来鉴别HCM和HLVH,AUC为0.862[20]。近年来,心肌应变参数逐渐被应用于HCM和HLVH的鉴别诊断中。Neisius等[21]研究显示,LVMI、左心室纵向应变、T1 mapping及心肌纤维化范围均可独立区分这2种疾病,其中T1 mapping的AUC最高,为0.718,但DeLong检验显示差异无统计学意义。Liu等[22]同样使用CMR-FT进行研究,结果表明,室间隔中部的心肌纤维化范围与左心室径向应变联合模型的AUC为0.835。在本研究中,MLVWT、LAGCS与LAGLS的AUC高于其他参数,分别为0.826、0.783、0.861,但DeLong检验显示三者AUC差异无统计学意义。而二元logistic回归分析显示,MLVWT、LAGCS与LAGLS组合模型的AUC为0.925(敏感度0.98,特异度0.74);DeLong检验表明其区分HCM和HLVH的能力显著优于单一参数。
本研究存在的局限性:①为单中心研究,需进一步纳入多中心病例以提高结果的可靠性;②扫描方法和后处理软件较单一,未与MRI、超声及其他后处理软件所得数据进行对比,后续研究需进一步拓展参数获取途径,以对比各种方法的适用条件,并继续探索CT-FT技术在其他疾病领域的应用。
总之,CT-FT所量化的心肌应变参数重复性较好,可用于评估HCM和HLVH患者的左心房功能障碍。在HCM患者中,相较于左心室,左心房更早表现出功能损伤,其显著降低的纵向应变为临床干预提供了更多参考。同时,MLVWT、LAGCS和LAGLS组模型诊断准确率较高,为HCM与HLVH的鉴别诊断提供了重要参考。
| [1] |
MARON B J, DESAI M Y, NISHIMURA R A, et al. Diagnosis and evaluation of hypertrophic cardiomyopathy: JACC state-of-the-art review[J]. J Am Coll Cardiol, 2022, 79(4): 372-389. DOI:10.1016/j.jacc.2021.12.002 |
| [2] |
JHAVERI S, KOMARLU R, WORLEY S, et al. Left atrial strain and function in pediatric hypertrophic cardiomyopathy[J]. J Am Soc Echocardiogr, 2021, 34(9): 996-1006. DOI:10.1016/j.echo.2021.04.014 |
| [3] |
WILLIAMS B, MANCIA G, SPIERING W, et al. 2018 ESC/ESH guidelines for the management of arterial hypertension: the task force for the management of arterial hypertension of the European Society of Cardiology (ESC) and the European Society of Hypertension (ESH)[J]. J Hypertens, 2018, 36(10): 1953-2041. DOI:10.1097/HJH.0000000000001940 |
| [4] |
YANG Y, YIN G, JIANG Y, et al. Quantification of left atrial function in patients with non-obstructive hypertrophic cardiomyopathy by cardiovascular magnetic resonance feature tracking imaging: a feasibility and reproducibility study[J]. J Cardiovasc Magn Reson, 2020, 22(1): 1-11. DOI:10.1186/s12968-019-0589-5 |
| [6] |
NWABUO C C, VASAN R S. Pathophysiology of hypertensive heart disease: beyond left ventricular hypertrophy[J]. Curr Hypertens Rep, 2020, 22: 1-18. DOI:10.1007/s11906-019-1005-0 |
| [7] |
KATO T S, NODA A, IZAWA H, et al. Discrimination of nonobstructive hypertrophic cardiomyopathy from hypertensive left ventricular hypertrophy on the basis of strain rate imaging by tissue Doppler ultrasonography[J]. Circulation, 2004, 110(25): 3808-3814. DOI:10.1161/01.CIR.0000150334.69355.00 |
| [8] |
MISKINYTE E, BUCIUS P, ERLEY J, et al. Assessment of global longitudinal and circumferential strain using computed tomography feature tracking: intra-individual comparison with CMR feature tracking and myocardial tagging in patients with severe aortic stenosis[J]. J Clin Med, 2019, 8(9): 1423-1440. DOI:10.3390/jcm8091423 |
| [9] |
OMMEN S R, MITAL S, BURKE M A, et al. 2020 AHA/ACC guideline for the diagnosis and treatment of patients with hypertrophic cardiomyopathy: executive summary: a report of the American college of cardiology/American heart association joint committee on clinical practice guidelines[J]. J Am Coll Cardiol, 2020, 76(25): 3022-3055. DOI:10.1016/j.jacc.2020.08.044 |
| [10] |
LI N, LIU T, LIU J, et al. Quantifying myocardial strain of the left ventricle in normal people using feature-tracking based on computed tomography imaging[J]. Diagnostics (Basel), 2022, 12(2): 329-341. DOI:10.3390/diagnostics12020329 |
| [11] |
XIE W H, CHEN L J, HU L W, et al. Postoperative evaluation of left ventricular global strain using cardiac computed tomography in pediatric patients with congenital heart disease: a comparison with echocardiography[J]. Eur J Radiol, 2021, 142: 1098-1128. |
| [12] |
CIKES M, SOLOMON S D. Beyond ejection fraction: an integrative approach for assessment of cardiac structure and function in heart failure[J]. Eur Heart J, 2016, 37(21): 1642-1650. DOI:10.1093/eurheartj/ehv510 |
| [13] |
ÖZER P K, GÖVDELI E A, ENGIN B, et al. Role of global longitudinal strain in discriminating variant forms of left ventricular hypertrophy and predicting mortality[J]. Anatol J Cardiol, 2021, 25(12): 863-881. DOI:10.5152/AnatolJCardiol.2021.21940 |
| [14] |
JAIN V, GHOSH R, GUPTA M, et al. Contemporary narrative review on left atrial strain mechanics in echocardiography: cardiomyopathy, valvular heart disease and beyond[J]. Cardiovasc Diagn Ther, 2021, 11(3): 924-938. DOI:10.21037/cdt-20-461 |
| [15] |
KARAKURT A, YILDIZ C, YILDIZ A, et al. Early detection strain/strain rate and time to strain/strain rate abnormalities for left atrial mechanical function in hypertensive patients[J]. Acta Cardiol, 2019, 74(2): 141-151. DOI:10.1080/00015385.2018.1475031 |
| [16] |
ROSA A, SHAH M, SHIOTA T, et al. Comparing echocardiographic characteristics in genotype positive-phenotype positive hypertrophic cardiomyopathy and hypertensive left ventricular hypertrophy[J]. Eur Heart J Cardiovasc Imaging, 2022, 23(3): 340-348. DOI:10.1093/ehjci/jeab217 |
| [17] |
HINOJAR R, ZAMORANO J L, FERNÁNDEZ-MÉNDEZ M A, et al. Prognostic value of left atrial function by cardiovascular magnetic resonance feature tracking in hypertrophic cardiomyopathy[J]. Int J Cardiovasc Imaging, 2019, 35: 1055-1065. DOI:10.1007/s10554-019-01534-8 |
| [18] |
LI L, CHEN X, YIN G, et al. Early detection of left atrial dysfunction assessed by CMR feature tracking in hypertensive patients[J]. Eur Radiol, 2020, 30: 702-711. DOI:10.1007/s00330-019-06397-0 |
| [19] |
ZHOU D, YANG W, YANG Y, et al. Left atrial dysfunction may precede left atrial enlargement and abnormal left ventricular longitudinal function: a cardiac MR feature tracking study[J]. BMC Cardiovasc Disord, 2022, 22(1): 99. DOI:10.1186/s12872-022-02532-w |
| [20] |
NEISIUS U, EL-REWAIDY H, NAKAMORI S, et al. Radiomic analysis of myocardial native T1 imaging discriminates between hypertensive heart disease and hypertrophic cardiomyopathy[J]. JACC Cardiovasc Imaging, 2019, 12(10): 1946-1954. DOI:10.1016/j.jcmg.2018.11.024 |
| [21] |
NEISIUS U, MYERSON L, FAHMY A S, et al. Cardiovascular magnetic resonance feature tracking strain analysis for discrimination between hypertensive heart disease and hypertrophic cardiomyopathy[J]. PLoS one, 2019, 14(8): 221-234. |
| [22] |
LIU S, LI Y, ZHAO Y, et al. The combination of feature tracking and late gadolinium enhancement for identification between hypertrophic cardiomyopathy and hypertensive heart disease[J]. Front Cardiovasc Med, 2022, 9: 865-885. |
 2024, Vol. 22
2024, Vol. 22


