| 高b值计算化DWI在前列腺癌诊断中的应用价值 |
2. 南京医科大学第二附属医院医学影像科,江苏 南京 210011
2. Department of Imaging, Second Affiliated Hospital of Nanjing Medical University, Nanjing 210011, China
前列腺癌是男性泌尿生殖系统常见的恶性肿瘤之一,发病率在男性恶性肿瘤中居第2位[1],且其发病率和死亡率呈逐年上升趋势[2-3]。前列腺癌的临床特征出现较晚且缺乏特异性,20%的患者确诊时已发生转移[4],失去手术机会。因此,早期准确诊断关乎前列腺癌临床决策及预后。DWI可无创反映水分子的扩散特征,对前列腺癌病灶内水分子的扩散受限较敏感,是多参数MRI诊断前列腺癌的重要序列。研究表明,高b值(>1 000 s/mm2)DWI能有效抑制正常前列腺组织的信号,增强前列腺癌病灶与周围正常前列腺组织的对比[5]。因此,在前列腺影像报告与数据系统(prostate imaging reporting and data system,PI-RADS)2.1版[6]中,推荐DWI序列使用的b值至少为1 400 s/mm2。但高b值DWI的应用由于图像SNR较低、形变、伪影严重,以及扫描时间较长等因素受到一定限制[7]。计算化扩散加权成像(computed DWI,cDWI)是一种数学成像技术,由Blackledge等[8]首次提出,其可从至少2个不同低b值DWI图像中计算出高b值图像,并以全身弥散方式应用于肿瘤转移灶的检出中。与扫描获得扩散加权成像(acquired DWI,aDWI)相比,cDWI图像能提高病变和正常组织间的对比度,有利于微小肿瘤病灶的检出,但目前国内相关研究较少。本研究通过对疑似前列腺癌患者的高b值aDWI和cDWI图像进行比较,评价高b值cDWI对前列腺癌的显示能力和诊断价值,并探讨高b值cDWI替代aDWI诊断前列腺癌的可行性。
1 资料与方法 1.1 一般资料回顾性分析2021年3月至2023年5月南京医科大学附属泰州人民医院前列腺特异性抗原(prostate specific antigen,PSA)筛查异常患者的MRI图像。纳入标准:①PSA≥4 μg/L;②行前列腺MRI检查,扫描序列包括T1WI、T2WI、DWI(b=0、800、1 500 s/mm2);③有手术或穿刺活检病理结果,且病理结果为前列腺癌的应行Gleason分级。排除标准:①MRI图像质量欠佳,导致参数无法测量;②MRI检查前已行手术治疗或放化疗;③MRI检查后1个月内未行手术或穿刺活检。共纳入56例,年龄55~88岁,平均(72.92± 7.87)岁;PSA 5.14~214.70 μg/L,平均(42.39±31.57)μg/L。56例中,前列腺癌33例,前列腺增生及其他良性病变23例。本研究经医院医学伦理委员会批准,且免除患者知情同意。
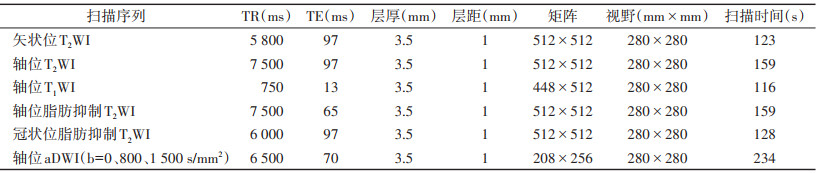
1.2 仪器与方法采用Siemens Skyra 3.0 T MRI扫描仪及16通道相控阵体部线圈扫描。嘱患者排便并适量留尿,以免膀胱过度充盈引起膀胱搏动伪影或肠道蠕动伪影影响前列腺的观察。扫描序列及具体参数见表 1。
| 表 1 各序列扫描参数 |
 |
1.3 图像重建和数据处理
在Siemens Syngo.viaVB20工作站上重建cDWI图像。在MRI Basic程序中,选择aDWI序列中的低b值(0、800 s/mm2)图像,重建出b值为1 500 s/mm2的cDWI图像。测量并计算aDWI800、aDWI1 500和cDWI1 500 3组图像中可疑病灶与正常实质背景区域的对比度。周围带DWI图像上信号强度局灶性增强或ADC图像上信号降低区域,以及移行带T2WI图像上的透镜状或边界不清的均匀、中等低信号的局灶性病变[9]定义为可疑病灶;避开坏死区域,在3组图像上病灶最大的2个层面勾画可疑病灶和正常背景组织的ROI,面积20~40 mm2。测量可疑病灶与正常前列腺实质背景区的平均信号强度Sca和Snormal,并用以下公式计算对比度(CR):CR=(Sca-Snormal)(/ Sca+Snormal)[10]。
1.4 图像质量主观评价及病变诊断由2位具有5年以上诊断经验的放射科医师分别采用5分Likert量表针对以下项目对每组图像质量进行评分:背景信号抑制(5分为最大信号抑制),解剖清晰度(5分为清晰度极佳),失真(5分为无失真),伪影(5分为无伪影)和整体图像质量(5分为最高质量)。分析2位医师评分的一致性,取2位医师评分结果均值作为最终分值。
由2位放射科医师基于3种诊断方案以盲法对所有患者进行回顾性诊断:方案1,T2WI+aDWI800+ADC;方案2,T2WI+aDWI1 500+ADC;方案3,T2WI+cDWI1 500+ADC。诊断结果以5分法记录,即5分为肯定恶性,4分为可能恶性,3分为不确定,2分为可能良性,1分为肯定良性。评分不一致时经协商达成一致,并作为最终的病变分值。诊断标准以PI-RADS V2.1[6, 9]为参考,T2WI上形态欠规则、边界不清的均匀低信号结节,前列腺包膜不完整/破坏、DWI上信号明显升高或ADC图上信号明显降低均为恶性病变特征。3种方案诊断时,每2种时间间隔≥3 d,以最大限度地减少学习偏差。
1.5 统计学方法采用SPSS 25.0和MedCalc 20.022软件分析数据。观察者之间的一致性比较采用Cohen’s Kappa检验,K < 0.4为一致性较差,0.4≤K < 0.75为一致性一般,K≥0.75为一致性较好。计量资料以 x±s表示;3组图像对比度比较采用配对样本方差分析,图像质量主观评分比较采用Friedman秩和检验,差异有统计学意义的数据两两比较采用Bonferroni校正检验。采用ROC曲线分析不同诊断方案对前列腺癌的诊断效能,并利用DeLong检验比较不同诊断方案AUC之间的差异性。以P < 0.05为差异有统计学意义。
2 结果 2.1 3组图像对比度比较aDWI800、aDWI1 500和cDWI1 500图像的平均对比度分别为0.18±0.10、0.22±0.11、0.39±0.12,差异有统计学意义(F=211.81,P < 0.01);两两比较,cDWI1 500组图像的对比度显著高于aDWI800组和aDWI1 500组(均P < 0.01)。
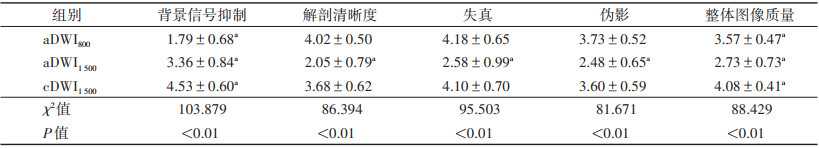
2.2 图像质量主观评分2位医师主观评分之间的一致性较好(K=0.767),5分Likert量表评分的平均值见表 2。在cDWI1 500组与aDWI1 500组图像之间,5个方面的主观评分比较,差异均有统计学意义(均P < 0.01)。aDWI800组与cDWI1 500组在背景信号抑制和整体质量评分方面的差异均有统计学意义(均P < 0.01),而在解剖清晰度、失真和伪影的主观评分上差异均无统计学意义(P=0.142,0.637,0.512);且cDWI1 500组的背景信号抑制和整体质量评分最高(图 1)。3组图像质量比较见图 2。
| 表 2 3组图像质量主观评分比较(分,x±s) |
 |
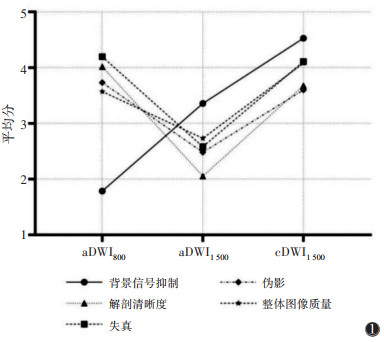 |
| 图 1 3组图像质量主观评分图 |
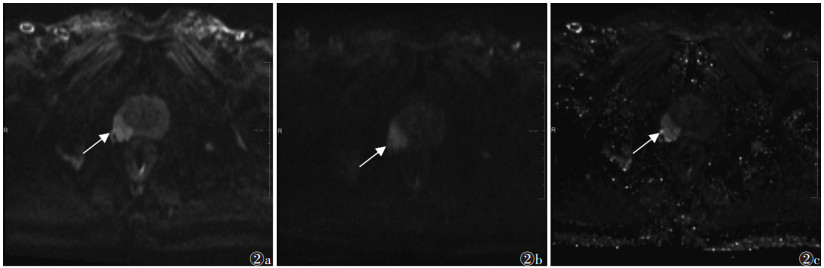 |
| 注:患者,男,84岁,图 2a为b=800 s/mm2的aDWI图像,显示前列腺右侧周围带稍高信号(白箭),病灶与正常组织对比较差;图 2b为b=1 500 s/mm2的aDWI图像,病灶对比增加但图像伪影失真严重(白箭),解剖清晰度和整体质量较差;图 2c为b=1 500 s/mm2的cDWI图像,在保证图像整体质量的基础上较好抑制了正常组织信号,病灶与周围正常组织对比较好(白箭) 图 2 前列腺癌患者aDWI800、aDWI1 500及cDWI1 500的图像质量比较 |
2.3 3种方案诊断效能的ROC曲线分析
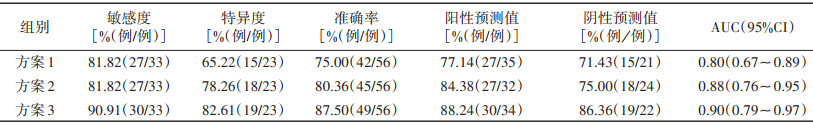
3种方案诊断前列腺癌的敏感度、特异度、准确率、阳性预测值、阴性预测值和AUC见表 3。用ROC曲线对3种方案的诊断结果进行分析,两两比较,方案2和方案3的AUC显著高于方案1(均P < 0.05),方案2和方案3之间差异无统计学意义(P=0.149)(图 3)。
| 表 3 3种方案对前列腺癌的诊断效能比较 |
 |
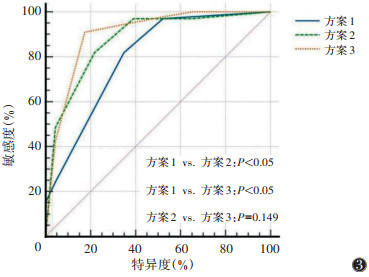 |
| 图 3 3种方案诊断前列腺癌的ROC曲线 |
3 讨论
前列腺癌常与前列腺增生同时发生,前列腺背景实质由于出血、炎症及增生而呈较高信号,导致病灶检出困难[11]。研究表明,与常规b值DWI图像相比,高b值图像能更好地抑制组织背景信号,提高病灶与正常实质背景之间的对比[12-14],但在实际应用中高b值DWI图像存在SNR低、失真形变的影响及设备场强和梯度性能限制等一系列问题。本研究利用aDWI序列中的低b值(0、800 s/mm2)图像重建出高b值(1 500 s/mm2)cDWI图像,并对aDWI800、aDWI1 500与cDWI1 500 3组图像中前列腺病灶与正常实质背景区域之间的对比度差异进行定量分析。结果表明,相对于aDWI1 500组的图像,cDWI1 500组图像能更好地抑制前列腺正常实质的背景信号,显著提高病灶对比度。
除病灶对比度外,图像的解剖清晰度、失真、伪影及整体质量在前列腺癌的诊断中也具有重要意义。高b值图像背景信号虽抑制更好,但由于梯度场的非均匀性,与低b值图像相比,高b值DWI的形变和伪影更严重,对解剖结构的显示也欠佳[15-16]。而cDWI图像由低b值图像重建获得,能减少不均匀梯度场所造成的形变和伪影的影响。本研究对aDWI800、aDWI1 500与cDWI1 500图像进行了5个方面的主观评价。除背景信号抑制外,aDWI1 500组图像其余4个方面的主观评分均低于aDWI800和cDWI1 500组,而aDWI800和cDWI1 500组图像在解剖清晰度、形变失真和伪影方面的主观评分差异无统计学意义,进一步证实了cDWI技术在提高病灶对比度和整体图像质量方面的优势。
在PI-RADS V2.1中,DWI图像中病灶与背景信号之间的对比差异是前列腺病变的重要诊断标准[6]。赵莲萍等[17]研究认为,cDWI1 400对前列腺癌的诊断效能显著优于DWI800,两者AUC分别为0.964和0.795。但其未进行cDWI与同b值aDWI的对比。本研究采用b值为1 500 s/mm2的cDWI和aDWI及b值为800 s/mm2的aDWI对患者进行回顾性诊断,并以病理结果为金标准进行ROC曲线分析。结果显示,高b值方案的诊断效能明显优于低b值方案。此结果与Kim等[18]的研究结果相似。
本研究从主观质量评分和客观定量参数两方面,对比cDWI与aDWI图像中前列腺癌病灶的显示效果及图像质量,并初步探讨cDWI代替aDWI进行前列腺癌诊断的可行性,但仍存在以下不足:①部分病理结果为超声引导下穿刺所得,而非根治性前列腺切除术后标本,受限于超声图像分辨力及穿刺水平,部分小病灶穿刺结果的准确性可能受到影响。②考虑b值≥2 000 s/mm2的aDWI图像扫描时间过长且图像质量欠佳,因此,本研究中为保证aDWI和cDWI序列的b值相同,仅评估了b值为1 500 s/mm2的图像,未对更高b值的图像进行分析。王伟等[19]的研究也表明,b值从1 400 s/mm2升高至2 000 s/mm2时,前列腺癌的PI-RADS评分无显著差别。③仅利用了单指数扩散模型生成cDWI图像,不同扩散模型是否会对cDWI的图像质量及诊断效能产生影响有待进一步研究。
总之,cDWI技术在前列腺癌的诊断上有一定优势。与常规b值aDWI相比,其对于背景信号的抑制能力更强、诊断效能更高。而在与相同高b值的aDWI比较中,尽管两者诊断效能相当,但cDWI的图像质量更优,且无需额外增加扫描时间,不受限于设备性能。因此,cDWI技术可作为高b值aDWI诊断前列腺癌的替代方法,适合临床推广使用。
| [1] |
SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
CHEN W, ZHENG R, BAADE P D, et al. Cancer statis- tics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [3] |
鲁欣, 蒋栋铭, 胡明, 等. 2004—2018年全国前列腺癌死亡率的流行特征及时间趋势[J]. 上海预防医学, 2021, 33(10): 899-904, 912. |
| [4] |
王睿, 任静, 杨如武, 等. IVIM在前列腺癌诊断中的价值及其与第八版AJCC临床病理分级的相关性研究[J]. 临床放射学杂志, 2020, 39(1): 86-90. |
| [5] |
WOO S, SUH C H, KIM S Y, et al. Head-to-head com- parison between high- and standard-b-value DWI for detecting prostate cancer: a systematic review and metaanalysis[J]. AJR Am J Roentgenol, 2018, 210(1): 91-100. DOI:10.2214/AJR.17.18480 |
| [6] |
TURKBEY B, ROSENKRANTZ A B, HAIDER M A, et al. Prostate imaging reporting and data system version 2.1:2019 update of prostate imaging reporting and data system version 2[J]. Eur Urol, 2019, 76(6): 340-351. |
| [7] |
TAMADA T, UEDA Y, UENO Y, et al. Diffusion-weighted imaging in prostate cancer[J]. MAGMA, 2022, 35(4): 533-547. |
| [8] |
BLACKLEDGE M D, LEACH M O, COLLINS D J, et al. Computed diffusion-weighted MR imaging may improve tumor detection[J]. Radiology, 2011, 261(2): 573-581. DOI:10.1148/radiol.11101919 |
| [9] |
王良, QIUBAIL, ALBERTOV H. 前列腺影像报告和数据系统(PI-RADS V2.1)解读[J]. 中华放射学杂志, 2020, 54(4): 273-278. DOI:10.3760/cma.j.cn112149-20190429-00382 |
| [10] |
JENDOUBI S, WAGNER M, MONTAGNE S, et al. MRI for prostate cancer: can computed high b-value DWI replace native acquisitions?[J]. Eur Radiol, 2019, 29(10): 5197-5204. DOI:10.1007/s00330-019-06085-z |
| [11] |
陈峻帆, 杨静, 黄豆豆, 等. 体素内不相干运动模型鉴别诊断移行带前列腺癌与基质型前列腺增生[J]. 中国医学影像技术, 2022, 38(10): 1534-1539. |
| [12] |
WETTER A, NENSA F, LIPPONER C, et al. High and ultra-high b-value diffusion-weighted imaging in pros- tate cancer: a quantitative analysis[J]. Acta Radiol, 2015, 56(8): 1009-1015. DOI:10.1177/0284185114547900 |
| [13] |
ROSENKRANTZ A B, PARIKH N, KIERANS A S, et al. Prostate cancer detection using computed very high bvalue diffusion-weighted imaging: how high should we go?[J]. Acad Radiol, 2016, 23(6): 704-711. DOI:10.1016/j.acra.2016.02.003 |
| [14] |
高益萍, 高宇, 沈志炜, 等. MRI高b值弥散成像技术在中央移行带早期前列腺癌诊断中的应用研究[J]. 医学影像学杂志, 2018, 28(11): 1942-1946. |
| [15] |
UENO Y R, TAMADA T, TAKAHASHI S, et al. Com- puted Diffusion-weighted imaging in prostate cancer: basics, advantages, cautions, and future prospects[J]. Korean J Radiol, 2018, 19(5): 832-837. DOI:10.3348/kjr.2018.19.5.832 |
| [16] |
王旭, 孟宪平, 费锋, 等. 高b值磁共振弥散加权成像诊断前列腺癌的临床价值[J]. 医学影像学杂志, 2017, 27(12): 2354-2356. |
| [17] |
赵莲萍, 张文文, 高鹏, 等. 计算机化DWI在前列腺良恶性病变的应用价值[J]. 临床放射学杂志, 2016, 35(11): 1698-1701. |
| [18] |
KIM Y J, KIM S H, BAEK T W, et al. Comparison of computed diffusion-weighted imaging b2000 and ac- quired diffusion-weighted imaging b2000 for detection of prostate cancer[J]. J Korean Soc Radiol, 2022, 83(5): 1059-1070. |
| [19] |
王伟, 邵志红, 曾嘉齐, 等. 不同计算化高扩散敏感系数对外周带前列腺癌第二版前列腺影像和数据报告系统中弥散加权成像评分的影响[J]. 中华医学杂志, 2017, 97(43): 3401-3405. |
 2024, Vol. 22
2024, Vol. 22


