| 超声和双源CT对甲状腺癌颈部淋巴结转移及转移负荷的诊断价值 |
近年来,甲状腺癌发病率显著增加,甲状腺疾病的检查及治疗也受到广泛关注[1]。其中,甲状腺乳头状癌的发病率及颈部淋巴结转移率均较高,占甲状腺癌的30%~80%;颈部淋巴结转移情况与手术计划的制订及患者预后密切相关[2-3]。高负荷淋巴结转移会增加甲状腺乳头状癌远处转移的风险,尤其是那些分化潜能尚未明确及具有高柱状亚型特征的甲状腺肿瘤[4]。因此,术前准确评估颈部淋巴结非常必要。超声因具有组织分辨力高、无辐射、廉价和便捷等优点,是目前术前评估颈部淋巴结的首选方法。但其对操作者的主观依赖性较强,且无法评估咽后、胸骨后和纵隔等区域的淋巴结转移[5]。有研究表明,CT在颈部淋巴结转移的术前评估中,可发挥补充作用[6-8]。因此,本研究旨在探讨超声和双源CT对甲状腺癌患者颈部淋巴结转移的诊断价值。
1 资料与方法 1.1 一般资料回顾性分析2020年12月至2022年1月我院收治的甲状腺癌患者的影像及病理资料。纳入标准:①术前同时行超声、双源CT检查;②甲状腺全切或半切,并行淋巴结清扫;③术后病理诊断明确。排除标准:①甲状腺良性结节;②病理、临床资料不完整。最终纳入186例,男52例,女134例;年龄17~78岁,平均(40.20±11.04)岁。186例中,乳头状癌183例、髓样癌3例。恶性结节伴颈部淋巴结转移121例(65.1%),以术后病理证实转移淋巴结数目分为高转移负荷组52例(淋巴结≥5个)和低转移负荷组69例(淋巴结 < 5个)[9]。本研究已获得医院伦理委员会批准(批文号:2022-SR-171)。
1.2 仪器与方法 1.2.1 超声检查使用Philips EPIQ5及Siemens Acuson S3000超声诊断仪,高频线阵探头频率为7~12 MHz,调节超声诊断仪(模式、深度、焦点、增益等),使图像显像至最佳效果。患者取仰卧位,颈部轻度后仰,充分暴露颈部。将探头置于颈部,横向及纵向多切面扫查甲状腺,观察甲状腺结节特征,大范围扫查甲状腺周围区域(尤其是颈部III~V区),仔细评估颈部淋巴结形态及回声特点,并用CDFI观察其血流。
1.2.2 CT检查采用第3代双源CT(Siemens Force,德国),先自颅底至主动脉弓水平平扫,后行双期双能量扫描。扫描参数:探测器准直128×0.6 mm,球管旋转时间0.5 s/r,螺距0.7,矩阵256×256,视野252 mm× 252 mm,层厚、层距均为1.5 mm。两球管管电压分别为80 kV、Sn150 kV,管电流分别为118、59 mAs,开启自动管电流调制技术。采用高压注射器注射75 mL非离子型对比剂(碘普罗胺),流率3.5 mL/s,后以相同流率注射生理盐水50 mL,于对比剂注射后25、50 s采集动、静脉期图像。
1.3 图像分析由2位工作8年以上的高年资医师在不知晓病理结果的情况下共同读片,意见有分歧时协商解决。颈部淋巴结异常超声征象:短长径之比 > 0.5,钙化灶,囊性变,皮质内团状高回声,淋巴门结构不清晰,非门型(边缘型或混合型)血流信号[10](图 1a~1d)。CT检查的异常征象:钙化,囊性变,高强化(增强扫描后CT值高于同层面肌肉30 HU以上)或不均匀强化[11](图 1e~1h)。如超声或CT未发现异常,则结果为阴性。如其中一项检查为阳性,则联合超声和CT检查视为阳性。为方便统计,双侧颈部VI区(喉前)划分为中央区,双侧颈II~V区划分为颈侧区。
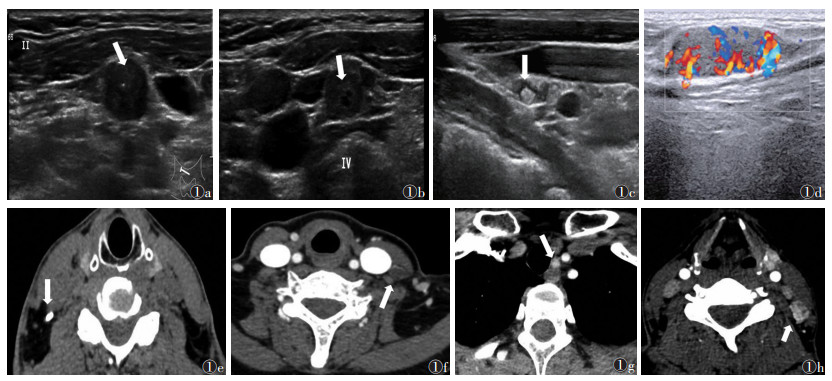 |
| 注:图 1a~1d为淋巴结转移的超声特征,依次为点状钙化灶、囊性变、团状高回声、非门型(边缘型)血流信号(白箭);图 1e~1h为淋巴结转移的CT特征,依次为钙化灶、囊性变、高强化、不均匀强化(白箭) 图 1 甲状腺癌患者淋巴结转移的影像特征 |
1.4 统计学方法
采用SPSS 25.0及Jamovi软件进行统计分析。计量资料以x±s表示,组间比较采用t检验;计数资料以%表示,组间比较采用χ2检验(Pearson法和McNemar法)。以术后病理结果为金标准,绘制超声、双源CT及两者联合诊断颈部中央区、颈侧区淋巴结转移的ROC曲线,计算敏感度、特异度。各检查方法的敏感度、特异度比较行χ2检验,AUC间比较行DeLong检验。采用Spearman检验评估超声及双源CT与淋巴结转移负荷间的相关性。以P < 0.05为差异有统计学意义。
2 结果 2.1 2组一般资料比较2组性别差异有统计学意义(P=0.022)。颈部淋巴结转移121例中,颈侧区及中央区均转移44例(36.4%),其中5例伴上纵隔VII区转移,1例伴随咽后间隙转移;仅中央区转移77例(63.6%)。
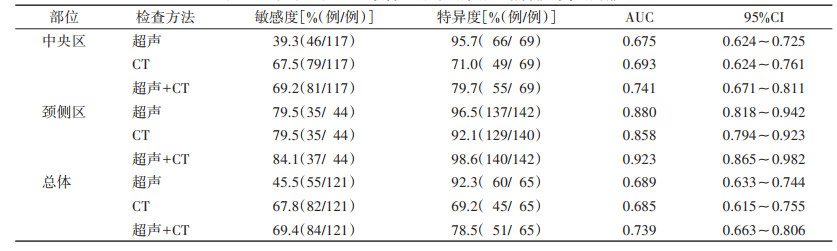
2.2 各检查方法对颈部淋巴结转移的诊断效能超声及双源CT在中央区的敏感度均偏低(39.3% vs. 67.5%),双源CT优于超声检查(P < 0.05);在颈侧区两者的敏感度相同(均为79.5%);超声在颈侧区和中央区的特异度均更高(均P < 0.05)。超声联合CT弥补了超声对中央区淋巴结转移诊断敏感度低的缺陷,提升了CT对颈侧区淋巴结转移诊断的特异度;此外,两区的AUC均得到了提高(均P < 0.05)(表 1,图 2)。
| 表 1 超声、双源CT及联合应用对颈部淋巴结转移的诊断效能 |
 |
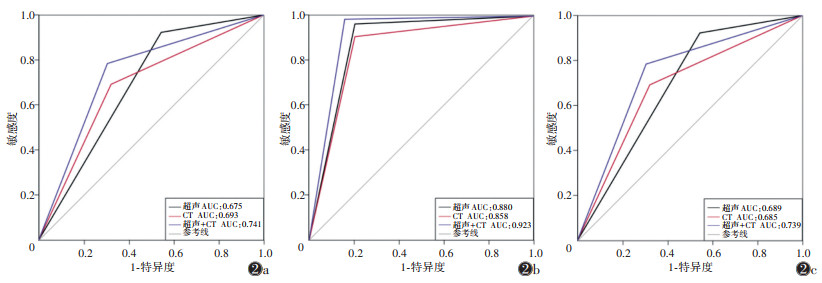 |
| 注:图 2a~2c分别为中央区、颈侧区及总体 图 2 超声、双源CT及联合应用对颈部不同区域淋巴结转移评估的ROC曲线 |
2.3 相关性分析
通过相关性分析发现,超声及双源CT对转移性淋巴结的诊断结果均与淋巴结转移负荷增加密切相关(r=0.541,P < 0.05;r=0.401,P < 0.05),其中超声诊断结果与肿瘤负荷的相关性更显著。
3 讨论高频超声因其无辐射、可重复性高和操作便捷等特点,成为浅表小器官疾病的首选检查方法,在评估甲状腺结节和颈部淋巴结转移方面,高频超声发挥着至关重要的作用。据统计,60%~70%的甲状腺恶性结节会发生颈部淋巴结转移[12],且以中央区淋巴结转移为主,这与本研究的统计数据相吻合。然而,由于胸骨、肺部、食管和气管等器官的阻挡作用,高频超声常无法观察到甲状腺后VI区、前上纵隔VII区及深部咽后淋巴结的情况,导致其在淋巴结转移诊断方面的敏感性较低。本研究中,超声诊断中央区淋巴结转移的敏感度仅为39.3%;此外,5例伴上纵隔淋巴结转移、1例伴咽旁间隙转移,超声均无法探查。CT检查具有高穿透性,虽然软组织分辨力低于超声检查,导致诊断特异度较低,但其不受淋巴结位置的影响,与超声检查相结合,两者优势互补,可帮助医师明确患者颈部淋巴结转移情况,并制订个体化的手术方案。此外,双源CT相较于普通单源CT,在2套射线发生装置及探测系统的使用下,扫描速度大大提高。双源CT还采用了能谱纯化技术,并在高电压的球管处安装滤过板,最大限度地过滤掉低能射线,从而更好地分离低kV和高kV光谱;这不仅降低了辐射剂量,还提高了能量分辨力[13-14]。由于双源CT利用低kV图像具有高对比度的特点,更易发现颈部淋巴结转移的高强化区域和钙化灶,使其在甲状腺及颈部淋巴结检查中逐渐得到广泛应用[11]。
本研究发现,尽管双源CT在颈部中央区淋巴结转移的诊断敏感度优于超声检查(67.5% vs. 39.3%),但数据也不理想。这可能是因为中央区淋巴结位置较深,易受气管、食管、纤维脂肪组织等结构的影响,有时难以与周边其他软组织区分开;该区域部分转移性淋巴结常表现为回声不均匀、体积较小,通常不具备典型的甲状腺癌转移征象——液化、团状高回声等,难以与桥本甲状腺炎所致的炎性淋巴结相鉴别,这些均是漏诊的重要原因[15-16]。此外,超声因软组织分辨力较高,其在颈侧区和中央区的特异度均高于双源CT(96.5% vs. 92.1%,95.7% vs. 71.0%)。可见,超声检查特异度高但敏感度低,而双源CT的敏感度较高但特异度较低;两者联合应用后,诊断效能显著提升,尤其对于中央区淋巴结的检测敏感度有所增加,与以往研究[8, 17]基本一致。本研究表明,术前联合使用超声和双源CT,可更全面地评估颈部淋巴结情况,有助于实现精准、个体化的治疗,从而使患者获益。此外,超声检查结果与淋巴结肿瘤负荷密切相关,如果超声检查显示存在转移淋巴结,提示淋巴结转移负荷较高,反之亦然,这为临床进一步选择治疗方案提供了更多依据[9, 18-19]。
本研究存在的不足:为单中心小样本研究,需进一步扩大样本量,并行前瞻性的多中心研究进行验证;但由于实际操作困难,超声、双源CT和病理检查所示的淋巴结未一一对应,特别是对颈部整体情况的评估可能在一定程度上影响了结果的特异性。研究表明,联合使用双能量CT定量参数和CT图像特征可进一步提高淋巴结转移的诊断准确性[11, 20]。本研究仅使用了CT图像特征进行诊断,还需进一步探究这种联合方法的效果。
综上所述,对于颈部淋巴结转移的诊断,超声检查具有高特异度,双源CT则具有较高的敏感度。因此,CT可作为超声检查的辅助诊断方法,两者联合应用能为临床提供更多信息,进一步指导诊疗决策。
| [1] |
DAVIES L, HOANG J K. Thyroid cancer in the USA: current trends and outstanding questions[J]. Lancet Dia-betes Endocrinol, 2021, 9(1): 11-12. DOI:10.1016/S2213-8587(20)30372-7 |
| [2] |
LEE D W, JI Y B, SUNG E S, et al. Roles of ultraso-nography and computed tomography in the surgical man-agement of cervical lymph node metastases in papillary thyroid carcinoma[J]. Eur J Surg Oncol, 2013, 39(2): 191-196. DOI:10.1016/j.ejso.2012.07.119 |
| [3] |
CONZO G, DOCIMO G, MAURIELLO C, et al. The cur-rent status of lymph node dissection in the treatment of papillary thyroid cancer. a literature review[J]. Clin Ter, 2013, 164(4): e343-e346. |
| [4] |
HO A S, LUU M, SHAFQAT I, et al. Predictive impact of metastatic lymph node burden on distant metastasis across papillary thyroid cancer variants[J]. Thyroid, 2021, 31(10): 1549-1557. |
| [5] |
MOON H J, KIM E K, YOON J H, et al. Differences in the diagnostic performances of staging US for thy-roid malignancy according to experience[J]. Ultrasound Med Biol, 2012, 38(4): 568-573. DOI:10.1016/j.ultrasmedbio.2012.01.002 |
| [6] |
LEE Y, KIM J H, BAEK J H, et al. Value of CT added to ultrasonography for the diagnosis of lymph node metastasis in patients with thyroid cancer[J]. Head Neck, 2018, 40(10): 2137-2148. DOI:10.1002/hed.25202 |
| [7] |
YANG S Y, SHIN J H, HAHN S Y, et al. Comparison of ultrasonography and CT for preoperative nodal assess-ment of patients with papillary thyroid cancer: diagnos-tic performance according to primary tumor size[J]. Acta Radiol, 2020, 61(1): 21-27. DOI:10.1177/0284185119847677 |
| [8] |
SUH C H, BAEK J H, CHOI Y J, et al. Performance of CT in the preoperative diagnosis of cervical lymph node metastasis in patients with papillary thyroid can-cer: a systematic review and meta-analysis[J]. AJNR Am J Neuroradiol, 2017, 38(1): 1541-161. |
| [9] |
JIN L, SUN H L, ZHOU L, et al. Prediction mode of more than 5 central lymph nodes metastases in clini-cally node-negative ipsilateral papillary thyroid carci-noma with tumor size 1 to 4 cm[J]. Medicine (Balti-more), 2020, 99(16): e19809. DOI:10.1097/MD.0000000000019809 |
| [10] |
HAUGEN B R, ALEXANDER E K, BIBLE K C, et al. 2015 American thyroid association management guide-lines for adult patients with thyroid nodules and differ-entiated thyroid cancer: the American thyroid associa-tion guidelines task force on thyroid nodules and dif-ferentiated thyroid cancer[J]. Thyroid, 2016, 26(1): 1-133. DOI:10.1089/thy.2015.0020 |
| [11] |
LIU X, OUYANG D, LI H, et al. Papillary thyroid can-cer: dual-energy spectral CT quantitative parameters for preoperative diagnosis of metastasis to the cervical lymph nodes[J]. Radiology, 2015, 275(1): 167-176. DOI:10.1148/radiol.14140481 |
| [12] |
QIU Y, FEI Y, LIU J, et al. Prevalence, risk factors and location of skip metastasis in papillary thyroid carcinoma: a systematic review and meta-analysis[J]. Cancer Manag Res, 2019, 11: 8721-8730. DOI:10.2147/CMAR.S200628 |
| [13] |
张丁哲, 于小利. 大螺距和双能量肺灌注肺动脉成像的对比研究[J]. 临床放射学杂志, 2018, 37(3): 514-517. |
| [14] |
SCHMIDT B, FLOHR T. Principles and applications of dual source CT[J]. Phys Med, 2020, 79: 36-46. DOI:10.1016/j.ejmp.2020.10.014 |
| [15] |
王晓庆, 魏玮, 魏玺, 等. 甲状腺乳头状癌的超声表现及其与颈部中央区淋巴结转移的关系[J]. 中华肿瘤杂志, 2018, 40(3): 196-200. |
| [16] |
洪珈, 章想, 邵静涛, 等. 彩色多普勒超声联合二维超声对甲状腺乳头状癌颈部中央区淋巴结转移的诊断价值[J]. 医学影像学杂志, 2023, 33(12): 2293-2295.. |
| [17] |
XING Z, QIU Y, YANG Q, et al. Thyroid cancer neck lymph nodes metastasis: meta-analysis of US and CT diagnosis[J]. Eur J Radiol, 2020, 129: 109103. DOI:10.1016/j.ejrad.2020.109103 |
| [18] |
SHAGHAGHI A, SALARI A, JALAEEFAR A, et al. Management of lymph nodes in medullary thyroid car-cinoma: a review[J]. Ann Med Surg (Lond), 2022, 81: 104538. |
| [19] |
MENG K, LUO H, CHEN H, et al. Prognostic value of numbers of metastatic lymph node in medullary thy-roid carcinoma: a population-based study using the SEER 18 database[J]. Medicine (Baltimore), 2019, 98(1): e13884. DOI:10.1097/MD.0000000000013884 |
| [20] |
周燕, 许晓泉, 苏国义, 等. 双能CT动静脉期加权融合图像影像组学对甲状腺乳头状癌颈部淋巴结转移的诊断价值[J]. 中华放射学杂志, 2021, 55(7): 703-709. |
 2024, Vol. 22
2024, Vol. 22


