| CT对微小甲状腺乳头状癌与微小结节性甲状腺肿的鉴别诊断价值 |
甲状腺结节性病变为常见颈部疾病,成人发生率约8%,以结节性甲状腺肿和甲状腺癌最常见,2种病变性质及治疗方法有很大差异,准确诊断结节良恶性具有重要临床意义[1]。微小甲状腺乳头状癌(papillarythyroid microcarcinoma,PTMC)是直径≤1.0 cm的甲状腺结节恶性病变,约占甲状腺癌的30%,手术切除预后良好,但由于其病灶隐匿,且与微小结节性甲状腺肿(micronodular goiter,MNG)在病理类型、临床症状及影像学表现等方面相似,易出现误、漏诊,导致PTMC术前检出率较低[2]。超声对甲状腺癌患者颈部淋巴结转移的术前诊断准确率较高,但对微小恶性结节的检出及观察有一定困难和局限性[3]。CT因具有良好的空间重建能力及组织对比度,可从不同方位对病变部位进行快速扫描,为术前病理分期的诊断提供较全面的信息,逐渐成为肿瘤患者的术前常用检查手段[4]。近年来,对直径 > 1.0 cm甲状腺癌CT征象的文献报道较多,但对PTMC的CT表现及其与MNG的鉴别诊断报道较少[5-6]。本研究通过对比分析PTMC与MNG的CT征象,评估其对两者的鉴别诊断价值,以期提高PTMC早期检出率。
1 材料与方法 1.1 一般资料回顾性分析我院2018年6月至2023年6月经病理证实的45例PTMC(PTMC组)和63例MNG(MNG组)的临床资料。
PTMC组中,男18例,女27例;年龄42~81岁,平均(61.76±9.19)岁;结节单发42例,多发3例,共48个结节;结节位于左叶19个,右叶22个,峡部7个。MNG组中,男27例,女36例;年龄40~82岁,平均(60.15±9.03)岁;结节单发54例,多发9例,共72个结节;结节位于左叶27个,右叶34个,峡部11个。2组性别、年龄、结节数目及位置等比较差异均无统计学意义(均P > 0.05),具有可比性。
纳入标准:符合甲状腺结节与分化型甲状腺癌诊治指南相关标准[7];经细针或手术病理活检确诊;入院后均完成CT平扫及增强扫描;患者知情并同意研究内容。排除标准:合并甲状腺其他病变或其他部位恶性肿瘤;伴心脑血管病变或严重肝肾功能障碍;有自身免疫性疾病;存在CT检查禁忌证;CT资料模糊或缺失。本研究已获医院伦理委员会批准(伦理审查批件号:ER-XXM-LWTG-2023-040)。
1.2 仪器与方法使用Philips Brilliance iCT 256排CT,患者取仰卧位,颈部尽可能仰伸,扫描范围自颌下至主动脉弓上缘。扫描参数:120 kV,80~230 mAs,视野330 mm×330 mm,螺距0.86,图像重建层厚0.5 mm,轴位矩阵256×256,冠状位矩阵512×512。增强扫描使用高压注射器经肘前静脉注入对比剂碘帕醇(碘浓度300 mg/mL,上海博莱科信谊药业有限责任公司,国药准字H20053385),剂量2 mL/kg体质量,流率3 mL/s,行双期扫描,扫描延迟时间分别为30、60 s,图像重建层厚均为3.75 mm,层距均为0.625 mm。
1.3 图像分析由2位影像学诊断医师采取双盲法阅片并进行图像处理,选择最大扫描层面勾画ROI,找出结节位置,评估结节最大径、形态、有无钙化、钙化形态、密度、强化方式、增强扫描结节轮廓清晰性、假包膜及颈部淋巴结增大情况,测量平扫CT值、动脉期及静脉期CT值增加幅度。病灶钙化类型评估标准[8]:以钙化病灶最大直径进行判定,直≤0.2 cm为细颗粒状钙化,> 0.2 cm为粗颗粒状钙化。
1.4 统计学方法采用SPSS 22.0软件分析数据。以病理诊断结果为金标准,四格表法计算CT诊断甲状腺良恶性结节的准确性。计量资料以x±s表示,组间比较行t检验;计数资料以%表示,组间比较行χ2检验。绘制ROC曲线评估CT征象对PTMC的诊断效能。采用Kappa检验评估2种方法一致性,K > 0.75为一致性良好;0.40≤K≤0.75为一致性较好;K < 0.40为一致性一般。以P < 0.05为差异有统计学意义。
2 结果 2.1 CT对甲状腺良恶性结节的诊断结果(表 1)以病理诊断结果为金标准,CT诊断甲状腺良恶性结节的准确率为92.50%,其中正确诊断111个,误诊9个,与病理诊断一致性良好(K=0.842)。
| 表 1 CT对甲状腺良恶性结节的诊断结果 |
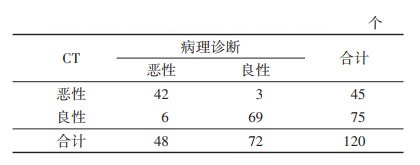 |
2.2 2组CT征象比较(表 2)
PTMC组细颗粒状钙化、增强扫描结节轮廓模糊、边缘中断征出现率均高于MNG组(均P < 0.05);2组结节最大径、形态、有无钙化、密度、强化方式、假包膜及颈部淋巴结肿大方面比较,差异均无统计学意义(均P > 0.05)。典型病例见图 1~5
| 表 2 2组CT特征比较 |
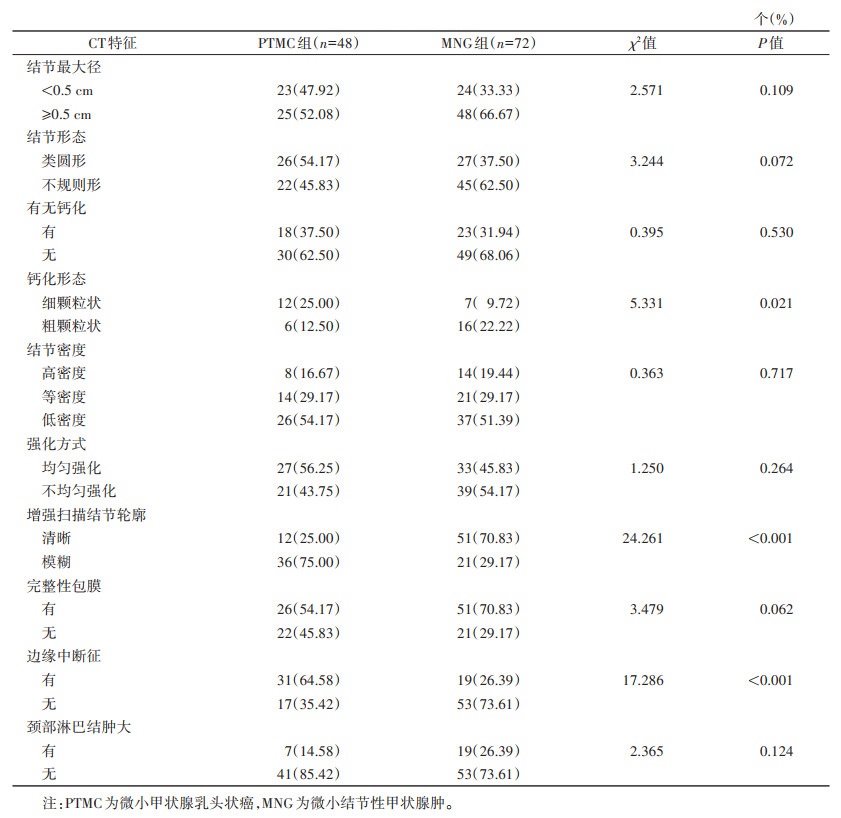 |
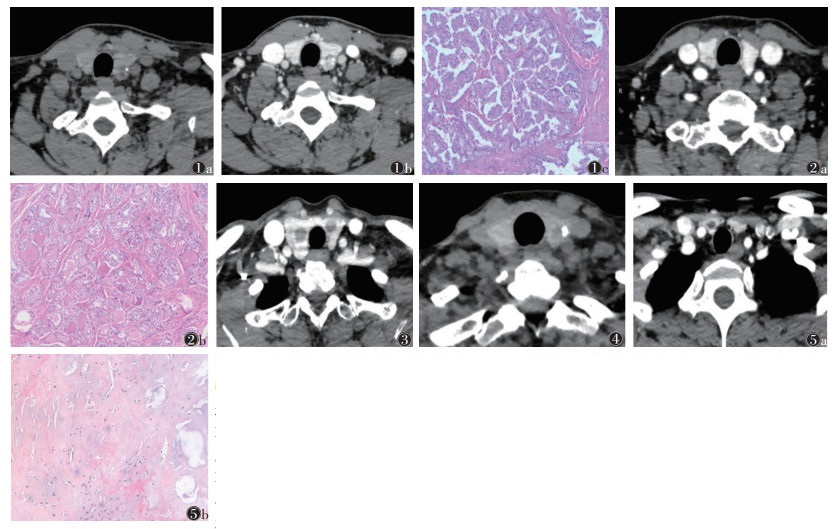 |
| 注:图 1患者,女,62岁,PTMC位于左叶;图 1a为CT平扫示瘤体呈类圆形,边缘模糊,瘤体旁微小钙化灶;图 1b为CT增强扫描示瘤体边缘模糊,包膜不完整,瘤体内实性成分明显强化;图 1c为病理切片(HE,高倍放大),镜下提示PTMC。图 2患者,男,67岁,PTMC位于双侧叶;图 2a为CT增强扫描示瘤体包膜不完整,强化程度低于周围正常甲状腺组织,呈边缘中断征样改变;图 2b为病理切片(HE,低倍放大),镜下提示PTMC。图 3患者,女,56岁,PTMC位于双侧叶,CT增强扫描示病灶轮廓清晰,包膜光整 图 4,5微小结节性甲状腺肿(MNG)CT及病理图片 注:图 4患者,女,49岁,MNG位于左叶,CT增强扫描示病灶轮廓清晰,结节边缘粗颗粒型钙化灶。图 5患者,女,47岁,MNG位于右叶,图 5a为CT增强扫描示瘤体呈类圆形,形态规则,轮廓清晰光整图 5b为病理切片(HE,低倍放大),镜下提示结节性甲状腺肿伴胶原化 图 1-3 微小甲状腺乳头状癌(PTMC)CT及病理图片 |
2.3 2组平扫CT值、动脉期及静脉期CT值增加幅度比较(表 3)
PTMC组动脉期及静脉期CT值增加幅度均高于MNG组(均P < 0.05);2组平扫CT值比较,差异无统计学意义(P > 0.05)。
| 表 3 2组平扫CT值、动脉期及静脉期CT值增加幅度比较(HU,x±s) |
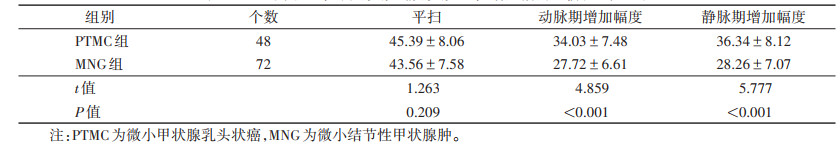 |
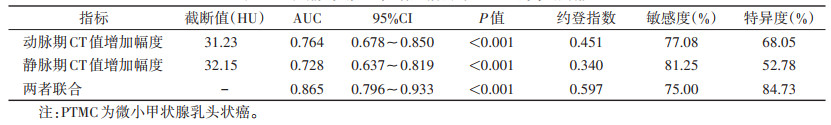
2.4 动、静脉期CT值增加幅度对PTMC的诊断效能(表 4,图 6)
ROC曲线显示,动脉期及静脉期CT值增加幅度分别为1.23、32.15 HU时,诊断PTMC的AUC分别为0.764(95%CI 0.678~0.850)和0.728(95%CI 0.637~0.819);两者联合诊断PTMC的AUC为0.865(95%CI0.796~0.933),诊断效能最高(P < 0.05)。
| 表 4 动、静脉期CT值增加幅度对PTMC的诊断效能 |
 |
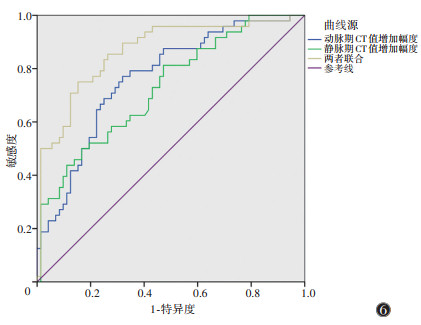 |
| 图 6 CT征象诊断微小甲状腺乳头状癌的ROC曲线 |
3 讨论
近年来,PTMC发病率在全球范围内呈持续上升趋势,由于其早期病情隐匿,与MNG相似度较高,易发生漏、误诊,两者的鉴别诊断是目前甲状腺病变诊断的研究热点[9]。彩色多普勒超声、CT扫描是目前常用于甲状腺结节性病变的检查方法。超声和常规CT检查虽能充分反映甲状腺病变位置、大小及数目,但常因检查者主观因素、甲状腺覆盖、周围骨骼及气体影响等,对微小病灶的鉴别诊断欠佳,恶性病变误诊率高[10]。因此,本研究对比分析PTMC与MNG病灶的CT征象,以提高两者的鉴别诊断准确率。
CT空间分辨力较高,可从不同方位对病变进行薄层图像重建,克服CT平扫中因消化吞咽及呼吸造成的伪影、漏扫和重叠扫描,对良恶性肿瘤诊断敏感度较高[11]。研究报道,CT可清晰显示肺部≤1.0cm的微小磨玻璃结节病灶内部细微结构及周围组织架构,有利于临床对肺腺癌病理亚型进行诊断[12]。本研究显示,CT诊断甲状腺良恶性结节的准确率为92.50%,与病理诊断结果一致性良好(K=0.842),说明CT在鉴别诊断甲状腺微小结节方面的应用价值较高。本研究显示,PTMC患者多存在结节细颗粒状钙化、增强扫描结节轮廓模糊、边缘中断征,而MNG患者结节形态多呈不规则形,钙化病灶较少,增强扫描后结节轮廓更清晰,与李雪菲等[13]研究相符。国内外研究普遍认为,位于结节内部中心区域的沙砾体是甲状腺乳头状癌的特征性表现,这种细颗粒状钙化主要由于肿瘤细胞快速增殖及其内微血管与纤维组织过度增生、钙盐沉积所致[14-15]。也有研究认为,尽管细颗粒状钙化有利于鉴别甲状腺乳头状癌与良性结节,但因PTMC病灶微小,钙化发生率较低,影像学诊断时不建议过度依赖此征象[16]。PTMC病灶与甲状腺交界区血供较丰富,增强扫描病灶周围轮廓模糊,边缘不光整,而MNG病灶边缘有胶原纤维增生,血供降低,增强扫描轮廓更清晰且边缘光整[17]。边缘中断征是甲状腺癌特征性征象,研究发现该征象可能与浅表处瘤体突破包膜向外生长,部分边缘组织被瘤体取代有关[18]。另外,薄层重建图像能显著降低容积效应对结节与周围组织密度差的影响,因此,CT在评估PTMC边缘中断征时准确性更高[19]。张艾红等[20]认为完整性包膜是结节性甲状腺肿的特征性征象;而本研究中PTMC组与MNG组有完整性包膜征象患者分别占54.17% 和70.83%,两者差异无统计学意义,与姜慧等[21]研究类似,其认为PTMC生长过程中侵犯甲状腺包膜,引起周围胶原纤维增生而形成假包膜,假包膜可完整或不完整,因此包膜征象并非MNG特征性征象,需结合其他CT表现综合判断。
本研究显示:PTMC组动脉期及静脉期CT值增加幅度均高于MNG组,这可能与PTMC患者肿瘤新生微血管更密集,结构复杂,增强扫描病灶强化程度更高有关。相较于MNG结节内血供较少、胶样成分较多,增强扫描强化程度低,不同扫描时期CT值增加幅度较小,PTMC结节内新生血管结构不完整,基底膜异常,病变组织细胞的通透性增大更易于被碘对比剂渗透,不同扫描时期反映的强化程度越高,CT值增加幅度更大[22-23]。本研究ROC曲线显示,动脉期及静脉期CT值增加幅度联合诊断PTMC的AUC为0.865,诊断效能最高,因此,临床可通过2期CT值增加幅度辅助鉴别PTMC与MNG。但由于本研究为单中心研究且样本量较小,后续研究需行更大样本量的前瞻性、多中心研究来评估CT征象对甲状腺良恶性微小结节的诊断效能。
综上所述,CT征象在PTMC与MNG鉴别诊断方面具有较高的价值,临床可根据结节细颗粒状钙化、增强扫描边界模糊、边缘中断征、增强扫描CT值增加幅度辅助鉴别甲状腺微小结节。
| [1] |
张海明, 郑海格, 李振宇, 等. 结节性甲状腺肿与甲状腺乳头状癌CT征象的Logistic回归分析模型的建立及其预测价值[J]. 临床放射学杂志, 2021, 40(7): 1282-1286. |
| [2] |
QIAN B, HU L, ZHANG S, et al. Comparison of clinico pathological features and prognosis of papillary thyroid carcinoma and microcarcinoma: a population-based pro-pensity score matching analysis[J]. Front Endocrinol (Lausanne), 2022, 13(1): 944758. |
| [3] |
JIWANG L, YAHONG L, KAI L, et al. Clinicopathologic factors and preoperative ultrasonographic characteristics for predicting central lymph node metastasis in papil-lary thyroid microcarcinoma: a single center retrospec-tive study[J]. Braz J Otorhinolaryngol, 2022, 88(1): 36-45. DOI:10.1016/j.bjorl.2020.05.004 |
| [4] |
KIM S K, SEO H S, LEE Y H, et al. Thyroid isthmus agenesis and its clinical significance in a large-scale multidetector CT-based study[J]. Clin Imaging, 2020, 66: 106-110. DOI:10.1016/j.clinimag.2020.04.038 |
| [5] |
蔡德松. 多层螺旋CT与高频超声检查诊断甲状腺癌的临床价值分析[J]. 医学影像学杂志, 2022, 32(8): 1399-1401. |
| [6] |
黄东琼, 许林, 邱冬梅, 等. 多层螺旋CT和核素扫描对结节性甲状腺肿诊断的临床价值对比[J]. 实用放射学杂志, 2021, 37(1): 34-37. |
| [7] |
HAUGEN B R, ALEXANDER E K, BIBLE K C, et al. 2015 American thyroid association management guide-lines for adult patients with thyroid nodules and differ-entiated thyroid cancer: the American thyroid associa-tion guidelines task force on thyroid nodules and differ-entiated thyroid cancer[J]. Thyroid, 2016, 26(1): 1-133. DOI:10.1089/thy.2015.0020 |
| [8] |
中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)持续/复发及转移性分化型甲状腺癌诊疗指南2019[J]. 肿瘤预防与治疗, 2019, 32(12): 1051-1079. |
| [9] |
DAVIES T, ROYCE W, CROSBIE R, et al. Investigation and management of papillary thyroid microcarcinoma-a Scottish regional case series and literature review[J]. Scott Med J, 2021, 66(4): 191-196. DOI:10.1177/00369330211032352 |
| [10] |
LI J W, CHANG C, CHEN J Y, et al. Nodule size ef-fect on diagnostic performance of ultrasonography and computed tomography for papillary thyroid carcinoma[J]. Curr Med Imaging Rev, 2019, 15(5): 489-495. DOI:10.2174/1573405614666180425142141 |
| [11] |
WANG J, TANG L, LIN L, et al. Imaging characteris-tics of esophageal cancer in multi-slice spiral CT and barium meal radiography and their early diagnostic value[J]. J Gastrointest Oncol, 2022, 13(1): 49-55. DOI:10.21037/jgo-22-36 |
| [12] |
陈琦, 朱全新, 郁义星, 等. 肺部单发微小磨玻璃结节(< 10 mm)MSCT特征对肺腺癌病理亚型的诊断价值[J]. 放射学实践, 2019, 34(7): 778-783. |
| [13] |
李雪菲, 王桂东, 李劲浩, 等. HR-CT鉴别结节性甲状腺肿与微小甲状腺乳头状瘤的价值[J]. 中国CT和MRI杂志, 2023, 21(6): 41-43. |
| [14] |
LI Q, SONG Z, ZHANG D, et al. Diagnostic accuracy of dual-energy computed tomography-based nomogram for differentiating papillary thyroid microcarcinomas from micronodular goiters[J]. Quant Imaging Med Surg, 2023, 13(6): 3428-3440. DOI:10.21037/qims-22-698 |
| [15] |
童永秀, 陈永钦, 张惠娟. 基于MSCT的纹理分析对钙化在鉴别结节性甲状腺肿和甲状腺乳头状癌中的价值研究[J]. 临床放射学杂志, 2023, 42(5): 728-732.. |
| [16] |
LEWIŃSKI A, ADAMCZEWSKI Z, ZYGMUNT A, et al. Correlations between molecular landscape and sono-graphic image of different variants of papillary thyroid carcinoma[J]. J Clin Med, 2019, 8(11): 1916. DOI:10.3390/jcm8111916 |
| [17] |
LEE D H, KIM Y K, YU H W, et al. Computed tomog-raphy for detecting cervical lymph node metastasis in patients who have papillary thyroid microcarcinoma with tumor characteristics appropriate for active surveil-lance[J]. Thyroid, 2019, 29(11): 1653-1659. DOI:10.1089/thy.2019.0100 |
| [18] |
LI S, YUN M, HONG G, et al. Development and valida-tion of a nomogram for preoperative prediction of level VII nodal spread in papillary thyroid cancer: Radiologic-pathologic correlation[J]. Surg Oncol, 2021, 37: 101520. DOI:10.1016/j.suronc.2021.101520 |
| [19] |
DEBNAM J M, GUHA-THAKURTA N, SUN J, et al. Distinguishing recurrent thyroid cancer from residual nonmalignant thyroid tissue using multiphasic multide-tector CT[J]. AJNR Am J Neuroradiol, 2020, 41(5): 844-851. DOI:10.3174/ajnr.A6519 |
| [20] |
张艾红, 岳松伟, 巴建, 等. MSCT检查对结节性甲状腺肿、乳头状甲状腺癌的鉴别诊断价值对比[J]. 中国CT和MRI杂志, 2022, 20(6): 39-41. |
| [21] |
姜慧, 胡春峰, 王元伟, 等. 基于超声造影参数构建列线图模型对甲状腺微小乳头状癌颈部淋巴结转移评估效能[J]. 临床军医杂志, 2022, 50(11): 1174-1176, 1179. |
| [22] |
DEBNAM J M, CHI T L, KWON M, et al. Distinguish-ing intrathyroid parathyroid adenoma from colloid nod-ules and papillary thyroid carcinomas using multipha-sic multidetector computed tomography[J]. J Comput Assist Tomogr, 2022, 46(5): 808-814. DOI:10.1097/RCT.0000000000001359 |
| [23] |
成建明, 杨玉婵, 黄俊, 等. 甲状腺微小乳头状癌CT强化方式与病理对照研究[J]. 医学影像学杂志, 2021, 31(9): 1479-1483. |
 2024, Vol. 22
2024, Vol. 22


