| CT平扫影像组学预测甲状腺乳头状癌中央区隐匿性淋巴结转移的价值 |
2. 浙江省影像诊断与介入微创研究重点实验室,浙江 丽水 323000;
3. 浙江省丽水市人民医院放射科,浙江 丽水 323000
2. Zhejiang Key Laboratory of Imaging Diagnosis and Interventional Minimally Invasive Research, Lishui 323000, China;
3. Department of Radiology, Lishui People's Hospital, Lishui 323000, China
甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是甲状腺恶性肿瘤中最常见的病理类型,其发病率在过去10年中迅速增加[1]。尽管PTC是一种惰性肿瘤,但极易发生颈淋巴结转移,尤其在中央区[2]。研究证实,中央区淋巴结转移是导致肿瘤局部复发和不良预后的高危因素[3-4]。目前,对术前可疑颈淋巴结转移患者,国内外指南均推荐常规治疗性中央区淋巴结清扫;而对术前颈淋巴结未转移者,其隐匿性淋巴结转移(occult lymph node metastasis,OLNM)风险及是否行预防性中央区淋巴结清扫仍存在争议[5-6]。中央区淋巴结清扫可能会引起甲状旁腺功能损害、喉返神经损伤等一系列并发症[7]。据报道,中央区OLNM在PTC患者中的发生率>30%[8],说明对大多数患者而言,常规行中央区淋巴结清扫可能存在过度治疗。临床上由于骨骼和空气的影响,超声检出中央区淋巴结转移的敏感度较低;而CT具有较高的空间分辨力,是超声的重要补充。但超声、CT检查均依赖于医师的主观经验,通常难以发现潜在的OLNM[9]。影像组学通过从医学图像中高通量地提取定量特征,可为分析肿瘤表型和异质性提供更全面准确的信息[10]。本研究旨在探讨基于CT平扫的影像组学在术前预测PTC患者中央区OLNM的价值。
1 资料与方法 1.1 一般资料回顾性收集2015年1月至2024年2月在温州医科大学附属第五医院(中心1)及2018年12月至2024年1月在丽水市人民医院(中心2)行外科治疗的PTC患者的临床及CT资料。纳入标准:①经术后病理学证实为PTC;②术中行中央区淋巴结清扫,且中央区淋巴结状态明确;③术前2周内行颈部CT平扫;④术前临床触诊、超声和CT检查均未发现颈部淋巴结转移[11];⑤临床和病理资料完整。排除标准:①既往头颈部放疗史;②合并其他恶性肿瘤;③CT图像存在严重运动伪影图像质量差。最终中心1纳入394例,以7∶3的比例随机分为训练集276例和内部测试集118例;中心2纳入143例作为外部测试集。本研究得到医院伦理委员会批准。
1.2 仪器与方法所有患者均行颈部CT平扫,取仰卧位,头先进,扫描范围从颅底至胸廓入口。具体扫描参数见表 1。
| 表 1 不同中心CT设备的扫描参数 |
 |
1.3 图像分析
由2位分别具有5、9年头颈部影像诊断经验的主治医师以盲法评价病灶的CT特征,包括肿瘤最大径、位置和腺外侵犯。2位医师意见不一致时,由另1位具有21年头颈部影像诊断经验的主任医师最终决定。
1.4 数据预处理和图像分割在影像组学特征提取前对所有图像进行预处理:①行重采样(体素大小为1 mm×1 mm×1 mm),以消除不同CT扫描仪之间的分辨率差异;②行Z-score归一化,以消除不同CT扫描仪之间的灰度差异;③使用标准差为0.8 mm的高斯核对图像进行平滑处理并去除噪声。将预处理后的CT平扫图像上传至Radcloud平台(版本7.1,http://Radcloud.cn/)进行病灶分割:由1位具有5年头颈部影像诊断经验的主治医师在不知晓患者分组的情况下沿病灶边缘逐层勾画ROI,最终融合全部ROI生成VOI(图 1);当病灶边界不清时,参考对应的超声图像进行勾画,以确保精准定位;由另1位具有21年颈部影像诊断经验的主任医师进行复阅;对VOI勾画不一致的病灶,2位医师通过协商达成一致。
 |
| 注:患者,女,46岁;图 1a为横断面CT平扫图像,肿瘤最大径约2.13 cm(蓝箭);图 1b~1d分别为横断面、冠状面、矢状面勾画图像;蓝色区域为病灶最大层面ROI 图 1 病灶ROI的勾画示例 |
1.5 影像组学特征筛选及模型构建
从每个VOI提取1 688个影像组学特征,依次采用方差阈值、单变量选择,以及最小绝对值收缩和选择算子算法(least absolute shrinkage and selection operator,LASSO)回归对数据进行降维。其中,方差阈值>0.80的特征,单变量选择P < 0.05的特征,LASSO回归依据最佳alpha时的系数,选择最有意义的特征。基于筛选后的特征建立5种机器学习分类器,包括K近邻(K nearest neighbors,KNN)、支持向量机(support vector machine,SVM)、逻辑回归(logisticregression,LR)、随机森林(random forest,RF)和极端梯度提升(extreme gradient boosting,XGBoost)。选择内部测试集和外部测试集中平均AUC最高的分类器作为最佳影像组学模型,并将其结果转换为影像组学评分。
1.6 临床模型与联合模型构建将单因素分析中P < 0.05的临床和常规CT特征纳入到多因素logistic回归分析中,获得临床危险因素,并建立临床模型。基于临床危险因素和影像组学评分建立联合模型,并绘制列线图。
1.7 统计学分析所有统计分析均使用R软件(版本4.1.2,https://www.r-project.org/)完成。符合正态分布的定量资料以 x±s表示,使用独立样本t检验进行比较;计数资料以频数表示,使用χ2检验或Fisher确切概率法进行比较。采用ROC曲线评价不同模型的预测性能。不同模型间AUC的比较采用DeLong检验。采用校准曲线和决策曲线分析(decision curve analysis,DCA)评价列线图的稳定性和临床实用性。以P < 0.05为差异有统计学意义。
2 结果 2.1 各数据集有无OLNM患者的临床和CT特征比较(表 2)| 表 2 训练集、内部测试集和外部测试集中有无OLNM患者的临床、CT特征比较 |
 |
共纳入PTC患者537例,其中训练集276例,年龄21~74岁,平均(45.25±11.12)岁;内部测试集118例,年龄21~66岁,平均(44.65±9.90)岁;外部测试集143例,年龄25~75岁,平均(47.06±9.69)岁。在训练集中,OLNM与非OLNM患者性别和肿瘤最大径之间差异均有统计学意义(均P < 0.05),并在内部测试集和外部测试集中得到验证(均P < 0.05)。其他特征在2组间差异均无统计学意义(均P > 0.05)。
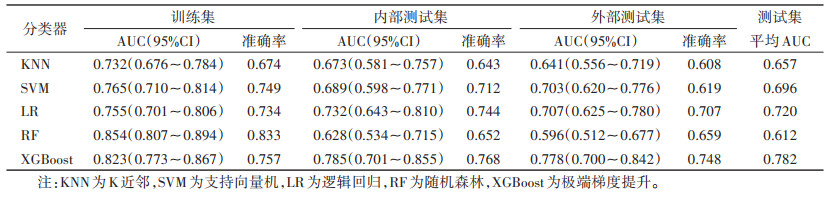
2.2 影像组学特征提取和影像组学模型建立从每个VOI中提取1 688个影像组学特征,经方差阈值保留438个特征,单变量选择保留149个特征。最终,经LASSO回归筛选获得10个与中央区OLNM显著相关的影像组学特征(图 2)。后建立5种机器学习分类器用于预测PTC患者OLNM情况。结果显示,在内部测试集和外部测试集中,5种机器学习分类器的AUC分别为0.628~0.785、0.596~0.778,其中XGBoost具有最佳的预测性能(平均AUC为0.782),因此选择其作为最佳影像组学模型(表 3,图 3)。
 |
| 图 2 经筛选获得的10个最佳影像组学特征 |
| 表 3 训练集、内部测试集和外部测试集中5种机器学习分类器的预测性能 |
 |
 |
| 注:图 3a代表训练集,图 3b代表内部测试集,图 3c代表外部测试集。PTC为甲状腺乳头状癌,OLNM为隐匿性淋巴结转移,KNN为K近邻,SVM为支持向量机,LR为逻辑回归,RF为随机森林,XGBoost为极端梯度提升 图 3 5种机器学习分类器预测PTC患者OLNM的ROC曲线 |
2.3 临床模型、联合模型的构建与验证
多因素logistic回归分析显示,性别(OR=3.452,P < 0.001)、肿瘤最大径(OR=2.292,P < 0.001)是预测中央区OLNM的独立危险因素,并建立临床模型。将影像组学评分和临床危险因素相结合构建联合模型,并绘制列线图(图 4)。校准曲线显示,联合模型在不同数据集中的预测概率和实际结果一致性均较好(图 5)。
 |
| 注:PTC为甲状腺乳头状癌,OLNM为隐匿性淋巴结转移 图 4 联合模型预测PTC患者中央区OLNM的列线图 |
 |
| 图 5 联合模型在训练集、内部测试集和外部测试集的校准曲线 |
ROC曲线示:在训练集中,临床模型、影像组学模型和联合模型的AUC分别为0.741、0.823、0.869;在内部测试集中,3种模型的AUC分别为0.697、0.785、0.823;在外部测试集中,3种模型的AUC分别为0.678、0.778、0.802(表 4,图 6)。DeLong检验示:在训练集中,联合模型的AUC明显高于临床模型或影像组学模型(Z=4.304、2.781,均P < 0.05);在内部测试集与外部测试集中,联合模型的AUC仅明显高于临床模型(Z=2.341,2.669,均P < 0.05),而与影像组学模型之间差异无统计学意义(Z=1.503,0.978,均P>0.05)。DCA示:联合模型比临床模型或影像组学模型具有更好的临床实用性(图 7)。
 |
| 注:图 6a代表训练集,图 6b代表内部测试集,图 6c代表外部测试集 图 6 临床模型、影像组学模型和联合模型的ROC曲线 |
 |
| 注:图 7a代表训练集,图 7b代表内部测试集,图 7c代表外部测试集 图 7 临床模型、影像组学模型和联合模型的决策曲线 |
| 表 4 训练集、内部测试集和外部测试集中临床模型、影像组学模型及联合模型的预测性能 |
 |
3 讨论
术前准确识别OLNM可为PTC患者个性化手术方式的制订提供重要参考。目前,超声引导下的细针穿刺活检和颈淋巴结清扫术后的组织病理学检查被认为是诊断转移淋巴结的金标准[12],但其均为侵入性检查,患者接受度差。因此,迫切需要一种新的非侵入性方法为临床治疗提供准确信息。影像组学从医学图像中提取大量定量特征,能够客观地反映肿瘤的微观生物学特性。有研究表明,基于超声的影像组学模型可有效识别PTC患者的颈部转移淋巴结状态,其AUC可达0.858[13]。但超声图像的采集易受周围邻近组织(如气管、血管等)的影响,且高度依赖操作者的技术水平。相比之下,CT扫描更加标准化,不易受医师操作影响,不仅能提取单一层面的组学特征,还能通过连续层面分割出病灶的立体形态,从而获得更多的潜在信息。因此,本研究建立了基于CT平扫的影像组学模型预测PTC患者的OLNM情况,结果表明,XGBoost的稳定性和准确性优于其他分类器。此外,结合其影像组学评分和临床危险因素建立的联合模型可进一步提升预测性能。
本研究将年龄、性别、肿瘤最大径、位置和腺外侵犯等多个临床及常规CT特征纳入分析,将单因素分析中差异有统计学意义的特征行多因素logistic回归分析。结果显示,性别(OR=3.452,P < 0.001)和肿瘤最大径(OR==2.292,P < 0.001)是预测中央区OLNM的独立危险因素,这与既往多数报道[14-16]相符。文献证实,在cN0期PTC患者中,男性发生中央区OLNM的风险为女性的1.79倍[17]。推测这可能与生活环境有关,即男性更易接触某些致癌物质或应激源,而这些环境因素可能促进肿瘤侵袭性行为的发生。同时,由于男性的保护机制使甲状腺癌的发病率较低,一旦保护机制受损,甲状腺癌进展较快,更易发生颈部淋巴结转移。此外,肿瘤直径越大,说明其生长速度越快、恶性程度越高,且浸润深度和范围越广,患者发生颈部淋巴结转移的风险也随之升高[18]。然而,进一步基于两者建立的临床模型仅表现出较低的预测性能,训练集、内部测试集和外部测试集的AUC分别为0.741、0.697、0.678。推测原因可能是这些宏观信息仅提供病灶的形态学特征,无法捕捉肿瘤在细胞层面上的异质性。因此,有必要在临床实践中寻找一种更客观、准确的方式辅助诊断。
由于正常甲状腺组织富含碘,而肿瘤组织碘含量减少,两者在CT平扫时通常能形成良好的对比。因此,本研究提取CT平扫图像上病灶的影像组学特征用于构建中央区OLNM的预测模型。研究显示,在建立的5种机器学习分类器中,XGBoost的预测性能最稳定,其在内部测试集和外部测试集中的AUC分别为0.785、0.778。一种可能的解释是XGBoost结合了多个决策树模型的预测能力,并通过引入正则化项减少过拟合,从而在多个数据集上保持了较高和一致的预测准确性[19]。相比之下,尽管RF在训练集的AUC高达0.854,但其在内部测试集和外部测试集中的AUC仅为0.628、0.596。分析可能是该分类器发生了过拟合现象,即模型过度学习了训练数据中的细节和噪声,从而没有从中提取出足够泛化的特征来有效预测未知的数据集。此前Peng等[20]研究表明,基于CT平扫、动脉期及静脉期图像影像组学特征的组合模型可在术前有效预测PTC患者的中央区OLNM情况,这一结论为本研究的设计提供了重要基础。然而,与Peng等[20]研究不同的是,本研究仅提取了CT平扫的影像组学特征,主要基于以下两点考虑:CT平扫在临床上的应用更广泛,普适性更高,尤其是对于碘对比剂过敏的患者;与多期扫描相比,仅采用CT平扫可有效降低辐射剂量,减少对患者健康的潜在危害。此外,本研究采用的多中心队列能在更大范围内验证模型的稳定性和泛化能力。因此,本研究建立的影像组学模型不仅具有高度的临床适用性,还能更安全、准确地评估PTC患者的中央区OLNM情况。
为进一步提升模型的预测性能,本研究基于影像组学评分和临床危险因素建立了一个列线图模型,实现了对中央区OLNM发生概率的可视化评估。研究表明,在训练集、内部测试集及外部测试集中,联合模型的AUC均显著优于临床模型(均P < 0.05)。这提示相较于传统的临床信息,影像组学特征能更好地反映肿瘤内部的异质性改变。然而,在内部测试集和外部测试集中,联合模型的AUC与影像组学模型相比,差异无统计学意义(均P > 0.05)。推测原因可能是由于本研究收集的临床特征种类有限,这导致在加入影像组学评分后对联合模型预测性能的提升不显著。因此,在今后的研究中将更广泛地纳入血液学指标、超声特征等,进一步优化模型的整体性能。
本研究的局限性:为回顾性研究,病例选择时可能存在偏倚;VOI尚未实现自动化,需手动分割;仅纳入2个中心的病例,未来应进一步通过设计多中心、前瞻性研究以验证模型的泛化性能。
综上所述,基于CT平扫图像的影像组学模型在预测PTC患者中央区OLNM方面中具有良好的应用价值,进一步结合临床危险因素构建的联合模型能实现对中央区OLNM的无创精准化评估。
| [1] |
SIEGEL R L, MILLER K D, FUCHS H E, et al. Cancer statistics, 2021[J]. CA Cancer J Clin, 2021, 71(1): 7-33. |
| [2] |
SAWKA A M, CARTY S E, HAUGEN B R, et al. American thyroid association guidelines and statements: past, present, and future: American thyroid association guidelines policy and procedures task force[J]. Thyroid, 2018, 28(6): 692-706. |
| [3] |
ONUMA A E, BEAL E W, NABHAN F, et al. Long term efficacy of lymph node reoperation for persistent papillary thyroid cancer: 13-year follow-up[J]. Ann Surg Oncol, 2019, 26(6): 1737-1743. |
| [4] |
TUFANO R P, CLAYMAN G, HELLER K S, et al. Management of recurrent/persistent nodal disease in patients with differentiated thyroid cancer: a critical review of the risks and benefits of surgical intervention versus active surveillance[J]. Thyroid, 2015, 25(1): 15-27. |
| [5] |
HUANG C, YAN W, ZHANG S, et al. Real-time elastography: a web-based nomogram improves the preoperative prediction of central lymph node metastasis in cN0 PTC[J]. Front Oncol, 2021, 11: 755273. |
| [6] |
PARVATHAREDDY S K, SIRAJ A K, AHMED S O, et al. Risk factors for central lymph node metastases and benefit of prophylactic central lymph node dissection in middle eastern patients with cN0 papillary thyroid carcinoma[J]. Front Oncol, 2021, 11: 819824. |
| [7] |
中国抗癌协会甲状腺癌专业委员会. 中国抗癌协会甲状腺癌整合诊治指南(2022精简版)[J]. 中国肿瘤临床, 2023, 50(7): 325-330. |
| [8] |
XU S Y, YAO J J, ZHOU W, et al. Clinical characteristics and ultrasonographic features for predicting central lymph node metastasis in clinically node-negative papillary thyroid carcinoma without capsule invasion[J]. Head Neck, 2019, 41(11): 3984-3991. |
| [9] |
赵雯, 董珍林, 单海燕, 等. 双能CT碘图预测甲状腺乳头状癌颈部中央区隐匿性淋巴结转移的价值[J]. 中国医学影像学杂志, 2023, 31(10). |
| [10] |
BI W L, HOSNY A, SCHABATH M B, et al. Artificial intelligence in cancer imaging: clinical challenges and applications[J]. CA Cancer J Clin, 2019, 69(2): 127-157. |
| [11] |
许思哲, 贺功建, 曾黎, 等. 超声联合肿瘤标记物对cN0期甲状腺微小乳头状癌中央区淋巴结隐匿性转移的预测价值[J/CD]. 中华普外科手术学杂志(电子版), 2021, 15(3): 314-318.
|
| [12] |
马伟琼, 陈康胤, 杨宁, 等. 多参数MRI影像组学对甲状腺乳头状癌颈部淋巴结的术前评估价值[J]. 磁共振成像, 2022, 13(10): 108-113. |
| [13] |
ZHOU S C, LIU T T, ZHOU J, et al. An ultrasound ra? diomics nomogram for preoperative prediction of cen? tral neck lymph node metastasis in papillary thyroid carcinoma[J]. Front Oncol, 2020, 10: 1591. |
| [14] |
WANG J B, SUN Y Y, SHI L H, et al. Predictive factors for non-small-volume central lymph node metastases (more than 5 or ≥ 2 mm) in clinically nodenegative papillary thyroid carcinoma[J]. Medicine (Baltimore), 2019, 98(1): e14028. |
| [15] |
WANG Y, DENG C, SHU X, et al. Risk factors and a prediction model of lateral lymph node metastasis in CN0 papillary thyroid carcinoma patients with 1-2 central lymph node metastases[J]. Front Endocrinol (Lausanne), 2021, 12: 716728. |
| [16] |
章彤, 田敏, 曹慧君, 等. 单灶甲状腺乳头状癌中央区淋巴结转移临床风险因素预测研究[J]. 中华内分泌外科杂志, 2024, 18(1): 83-87. |
| [17] |
MA B, WANG Y, YANG S, et al. Predictive factors for central lymph node metastasis in patients with cN0 papillary thyroid carcinoma: a systematic review and meta-analysis[J]. Int J Surg, 2016, 28: 153-161. |
| [18] |
YANG G, YANG F, ZHANG F, et al. Radiomics profiling identifies the value of CT features for the preoperative evaluation of lymph node metastasis in papillary thyroid carcinoma[J]. Diagnostics (Basel), 2022, 12(5): 1119. |
| [19] |
SHI Y, ZOU Y, LIU J, et al. Ultrasound-based radiomics XGBoost model to assess the risk of central cervical lymph node metastasis in patients with papillary thyroid carcinoma: individual application of SHAP[J]. Front Oncol, 2022, 12: 897596. |
| [20] |
PENG Y, ZHANG Z T, WANG T T, et al. Prediction of central lymph node metastasis in cN0 papillary thyroid carcinoma by CT radiomics[J]. Acad Radiol, 2023, 30(7): 1400-1407. |
 2024, Vol. 22
2024, Vol. 22


