| 实时剪切波弹性成像及超微血管成像联合D-二聚体在下肢深静脉血栓分期中的应用 |
2. 山东第一医科大学第二附属医院全科医学科,山东 泰安 271000
2. Department of General Medicine, Second Affiliated Hospital of Shandong First Medical University, Taian 271000, China
下肢深静脉血栓(deep vein thrombosis,DVT)是深静脉内血液异常凝结,少数可自行消融或局限于发生部位,若不及时诊疗,轻者遗留血栓后静脉瓣功能不全,造成下肢DVT形成后综合征,重者可并发肺栓塞,甚至死亡。与磁共振静脉成像、CT静脉成像、超声及血管造影相比,超声检查相对廉价、重复性好、无副作用及绝对禁忌证,且准确率高。虽然DSA仍是诊断DVT的金标准,但存在有创性、对比剂过敏、肾毒性,以及对比剂对血管壁可能造成损伤等局限性,限制了其在临床的广泛应用。因此,部分传统的静脉造影技术已被超声检查所逐渐替代[1]。
治疗DVT需了解血栓形成时间及血栓性质的改变等。2020年10月,美国血液病学会发布的《静脉血栓栓塞治疗指南:深静脉血栓和肺栓塞的治疗》[2]指出,对新发静脉血栓栓塞(venous thromboembolism,VTE)的治疗管理也强调分期治疗,说明正确合理的分期具有重要意义。以往临床医师主要是通过经验及症状出现时间大致评价分期,将血栓分为急性期、亚急性期和慢性期[1],这种分期方法主观性强、缺乏量化指标,且对既往慢性期血栓再发新鲜血栓敏感性差。
常规超声对鉴别新旧血栓及血栓时间有局限性[3]。而剪切波弹性成像(shear wave elastography,SWE)及超微血管成像(superb microvascular imaging,SMI)可为血栓硬度及新生血管的程度判定及准确判断血栓的性质提供帮助。D-二聚体是胶原纤维蛋白纤溶酶降解的产物,被临床广泛用于下肢DVT的筛查。本研究探讨SWE及SMI技术联合D-二聚体用于下肢DVT分期诊断的价值。
1 资料与方法 1.1 一般资料本研究采用前瞻性盲法观察性研究。收集我院2020年6月至2023年5月因颅脑外伤或骨折就诊的259例患者,术后48~72 h内均行下肢深静脉彩色多普勒超声(彩超)或介入造影,确诊DVT 109例,男55例,女54例;年龄36~72岁,平均(47.03±5.30)岁;病程2 d至1年,平均(0.45±0.98)年;BMI 20.10~29.50 kg/m2,平均(25.40±3.21)kg/m2。
纳入标准:①经彩超及术中介入血管造影确诊;②均接受下肢静脉彩超及SWE、SMI检查;③入院时完善检查,未发现下肢血栓者。排除标准:入院时存在DVT或既往血栓病史者;合并精神疾病或伴痴呆性疾病,无法配合检查者;血栓位置深、过度肥胖及下肢水肿明显影响测量者;伴全身性感染疾病等引起D-二聚体升高的疾病。
根据《深静脉血栓形成的诊断和治疗指南(第三版)》[1],将109例分为急性期15例(病程≤14 d),亚急性期26例(病程15~30 d),以及慢性期68例(病程>30 d)。超声医师检查前不知道所有患者DVT的具体分期。本研究经过医院伦理委员会批准,患者均签署知情同意书。
1.2 仪器与方法使用Canon Aplio i700超声诊断仪,PLT-1005BT线阵探头,频率5~14 MHz。患者取仰卧位(必要时头高脚底斜卧位充盈静脉),充分暴露下肢。首先行常规超声检查,记录血栓灰阶及超声表现,并存储图像。后启动SMI功能,多切面对栓塞静脉行SMI成像,取样框大于ROI 2~3倍,侧动探头多角度检测管腔内部微血流分布模式,存储包含典型特征的动态图像至本地硬盘。再次切换至SWE模式,量程为0~180 kPa,取目标管腔长轴切面,不施压,嘱患者制动,静置3 s,图像稳定后冻结,选取ROI,在ROI内采取圆圈式多点采样方式(≥5次),采集相关部位的弹性模量参数(弹性模量峰值与均值),记录存档。数据采集均由2位具有5~10年诊断经验的主治医师完成。
1.3 灰阶图像、SMI评分判定标准以周围肌组织回声作为参照,血栓低于肌组织回声者,为低回声;回声相仿者为等回声,高于肌组织者为高回声。SMI血流分布模式采用评分制:未见血流者,为1分;血栓周边有血流分布,为2分;血栓内部血流分布<50%,部分血流信号呈动脉频谱改变,为3分;血栓内血流分布≥50%,呈静脉频谱,为4分。
1.4 统计学方法采用SPSS 22.0软件行数据分析。计量资料经Kolmogorov-Smirnov(K-S)检验不符合正态分布,以M(QL,QU)表示,多组间比较行非参Kruskal-Wallis H检验,后行Dunn’s事后检验,以P<0.05为差异有统计学意义。计数资料比较行χ2检验或采用Fisher确切概率法。以血栓(急性期+亚急性期,病程≤30 d)及(慢性期,病程>30 d)为因变量,弹性模量均值、D-二聚体、回声分类及SMI评分为自变量,行logistic单因素及多因素回归分析,构建诊断慢性期血栓的logistic回归模型(P<0.10),计算模型最佳截断值及其敏感度、特异度,绘制ROC曲线。采用DeLong检验比较各指标AUC,以P<0.05为差异有统计学意义。
2 结果 2.1 超声结果急性期15例中,低回声9例,等回声6例;亚急性期26例中,低回声15例,等回声11例;慢性期68例中,低回声32例,等回声20例,高回声16例;不同分期两两比较,差异均无统计学意义(均P>0.05)。不同血栓分期DVT患者SMI评分、弹性模量均值、弹性模量峰值及D-二聚体比较,差异均有统计学意义(均P<0.01);亚急性期与慢性期之间差异无统计学意义(P>0.05)(表 1)。
| 表 1 不同分期下肢深静脉血栓微血流评分、弹性模量值及D-二聚体比较[M(QL,QU)] |
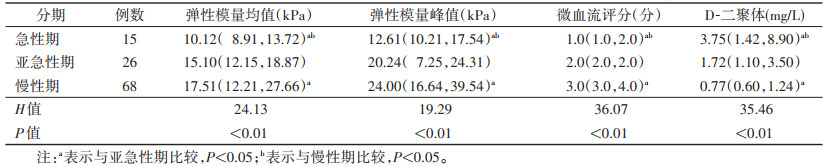 |
不同分期SMI血流分布比较,急性期血栓以无血流分布、周边血流分布为主(1、2分,86.67%),亚急性期血栓以周边血流及内部稀疏血流(<50%)为主(2、3分,96.15%),而慢性期血栓血流分布明显增多,内部稀疏血流及较多血流分布者(3、4分,>50%)占比76.47%,血流分布模式差异有统计学意义(P<0.05)(表 2)。同时,在38例SMI(亚急性期5例,慢性期32例)评分3分患者中,SMI微动脉血流频谱发现率的比较,差异无统计学意义(3/5 vs. 13/32,P>0.05)。
| 表 2 不同分期下肢深静脉血栓SMI分布模式对比 |
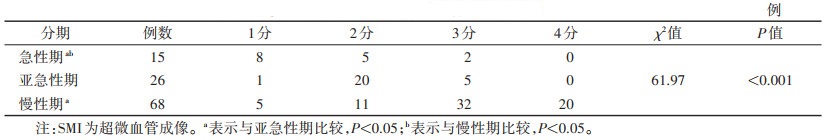 |
2.2 诊断效能
以血栓病程>30 d为诊断标准,分别绘制弹性模量均值、弹性模量峰值及SMI评分的ROC曲线,结果显示,以弹性模量均值16.65 kPa为截断值,SWE诊断慢性期血栓敏感度为55.2%,特异度为82.5%,AUC为0.72(P<0.01);以弹性模量峰值24.85 kPa为截断值,SWE诊断慢性期血栓敏感度为47.8%,特异度为90.0%,AUC为0.68(P<0.01);以SMI 3分为截断值,SMI诊断慢性期血栓敏感度为75.4%,特异度为82.5%,AUC为0.81(P<0.01)(图 1)。
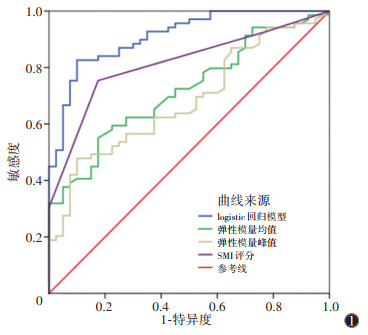 |
| 注:SMI为超微血管成像 图 1 慢性期血栓的相关预测因子及logistic回归模型的ROC曲线比较 |
以血栓病程>30 d为诊断标准,弹性模量均值、D-二聚体、回声分类及SMI评分为自变量,行二元logistic单因素及多因素回归分析示(表 3),弹性模量均值、D-二聚体及SMI评分(≥3分)是血栓慢性期的独立预测因子(OR=1.16,0.62,2.48)。利用弹性模量均值、D-二聚体及SMI(≥3分)构建慢性期血栓诊断的logistic回归模型的敏感度为84.1%,特异度为87.5%,AUC为0.89(P<0.01)(图 1)。DeLong检验提示三者联合预测的AUC较单一弹性模量峰值及均值AUC明显提高(P=0.026,0.037)。
| 表 3 基于血栓分期的logistic回归分析 |
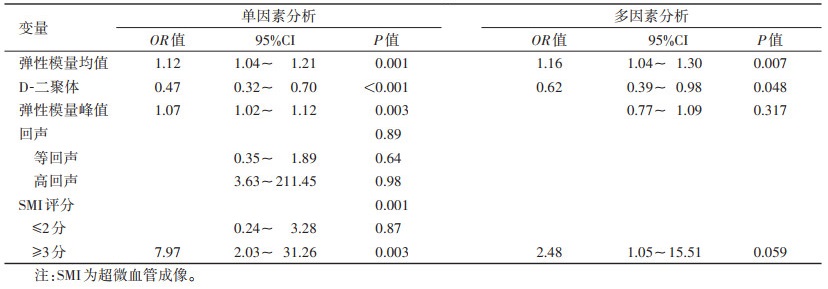 |
3 讨论
超声SWE技术利用聚焦的声辐射脉冲在介质中产生的横向剪切波,无需施加额外压力,客观上避免了加压血栓脱落的风险,量化指标更具客观性[4]。本研究将血栓病程>30 d作为慢性期血栓的标准,其截断值为16.65 kPa,与洪登科等[5-8]的研究结果一致,可重复性较好,国外学者普遍认为血栓硬度的超声测量具有生物学合理性[7-8, 15]。本研究对比观察不同分期血栓的二维超声表现,发现血栓回声不是判断血栓形成时间的可靠指标[9],与相关研究[10]结果一致。
SMI通过自适应算法消除运动伪像,在低速血流和细微血管的检出上较彩色及能量多普勒更敏感[11]。动物静脉模型实验结果揭示了血栓从急性期向亚急性期及慢性期过渡的关键特征:最初由血细胞组成的松散血栓,随着时间的推移,逐渐演变为由血管壁向血栓内部生长的肉芽组织[12-15]。在此过程中,血栓与血管壁之间的黏附作用也持续增强。本研究在创伤后下肢DVT中发现,亚急性期(图 2),部分患者SMI可探及血管壁向血栓内延展的微动脉血流信号,提示肉芽组织生长,与动物静脉血栓模型结论[12-15]相似。本研究还发现,慢性期患者中部分血栓内也存在微动脉血流频谱,但其在慢性期及亚急性期的分布差异无统计学意义。
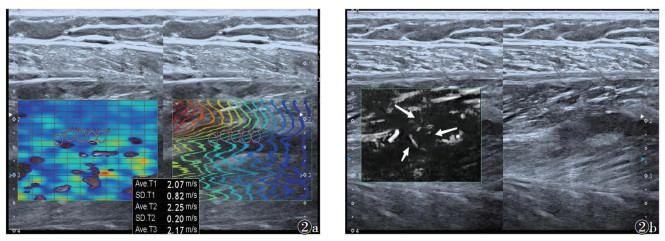 |
| 注:患者,男,46岁,因外伤后胫腓骨骨折急诊入院,入院时完善下肢静脉彩超未见血栓,骨折术后1 d发现肌间静脉血栓。图 2a,2b为血栓后第15天的SWE及SMI图像,弹性模量均值10.6 kPa,峰值14.9 kPa,SMI示血栓内开始出现垂直于管壁的纤细血流信号(<50%),部分血流信号呈动脉频谱,SMI评分3分(箭) 图 2 亚急性期肌间静脉血栓的微血流成像(SMI)及剪切波弹性成像(SWE) |
血浆D-二聚体因简单、快速、可重复,临床多应用在疑似早期DVT评估中。急性期DVT触发纤溶系统,血栓越严重,D-二聚体水平越高;进入亚急性期及慢性期后,血栓逐渐纤维化,质地变硬,新生肉芽组织内毛细血管增多后,血栓缩小,D-二聚体水平降低[16]。因此,D-二聚体在DVT进展中有预测价值。本研究通过随访不同分期的DVT患者,发现D-二聚体、弹性模量均值及SWI评分(≥3分)为血栓急慢性分期的独立预测因素;DeLong检验显示,3种指标联合预测得到的AUC较单一指标显著提升,表明联合指标在判断血栓病程是否进展至慢性期方面具有更高的价值,对指导临床中血栓分期的诊断和治疗策略具有重要意义。
本研究具有一定的局限性:未入组慢性血栓急性发作的患者;未对不同部位血栓的弹性值差异及重度肥胖、严重水肿患者的差异进行分析;样本量较小,ROC曲线仅对血栓病程是否为慢性期进行了分析,缺少对亚急性期及急性期的分析,后续仍需进一步扩大样本量深入研究。
综上所述,SWE及SMI联合D-二聚体对下肢DVT分期的诊断有一定的指导意义,可帮助临床调整溶栓诊疗策略。
| [1] |
李晓强, 张福先, 王深明. 深静脉血栓形成的诊断和治疗指南(第三版)[J/CD]. 中国血管外科杂志(电子版), 2017, 9(4): 250-257.
|
| [2] |
ORTEL T L, NEUMANN I, AGENO W, et al. American Society of Hematology 2020 guidelines for management of venous thromboembolism: treatment of deep vein thrombosis and pulmonary embolism[J]. Blood Adv, 2020, 4(19): 4693-4738. DOI:10.1182/bloodadvances.2020001830 |
| [3] |
KARPIOUK A B, AGLYAMOV S R, MALLIDI S, et al. Combined ultrasound and photoacoustic imaging to detect and stage deep vein thrombosis: phantom and ex vivo studies[J]. J Biomed Opt, 2008, 13(5): 054061. DOI:10.1117/1.2992175 |
| [4] |
王真, 张军, 李民, 等. 超声弹性成像实时及半定量评价不同阶段下肢深静脉血栓的初步临床研究[J]. 第二军医大学学报, 2010, 31(12): 1323-1325. |
| [5] |
洪登科, 杨嘉嘉, 薛恩生, 等. 实时剪切波弹性成像应用于股总静脉血栓临床分期[J]. 中国医学影像技术, 2019, 35(8): 1200-1204. |
| [6] |
宋晓乐, 唐力, 杨军. 实时剪切波弹性成像技术评价下肢深静脉血栓[J]. 中国医学影像技术, 2013, 29(12): 1957-1959. |
| [7] |
DURMAZ F, GULTEKIN M A. Efficacy of shear wave elastography in the differentiation of acute and subacute deep venous thrombosis[J]. Ultrasound Q, 2021, 37(2): 168-172. DOI:10.1097/RUQ.0000000000000563 |
| [8] |
SANTINI P, ESPOSTO G, AINORA M E, et al. Ultrasound elastography to assess age of deep vein thrombosis: a systematic review[J]. Diagnostics (Basel), 2023, 13(12): 2075. DOI:10.3390/diagnostics13122075 |
| [9] |
NEEDLEMAN L, CRONAN J J, LILLY M P, et al. Ultrasound for lower extremity deep venous thrombosis multidisciplinary recommendations from the society of radiologists in ultrasound consensus conference[J]. Circulation, 2018, 137(14): 1505-1515. DOI:10.1161/CIRCULATIONAHA.117.030687 |
| [10] |
上海市肺栓塞与深静脉血栓防治联盟. 下肢孤立性远端深静脉血栓超声检查实践: 上海专家建议[J]. 中华超声影像学杂志, 2021, 30(12): 1013-1017. DOI:10.3760/cma.j.cn131148-20211013-00726 |
| [11] |
黄于洁, 黄晓玲. 超微血流成像技术鉴别甲状腺肿块良恶性的临床价值[J]. 临床超声医学杂志, 2017, 19(11): 748-750. DOI:10.3969/j.issn.1008-6978.2017.11.008 |
| [12] |
沈涛, 李娜, 刘晓娜, 等. 超声剪切波弹性成像定量指标对深静脉血栓分期价值的实验研究[J]. 医学影像学杂志, 2018, 28(4): 683-685. |
| [13] |
MFOUMOU E, TRIPETTE J, BLOSTEIN M, et al. Time-dependent hardening of blood clots quantitatively measured in vivo with shear-wave ultrasound imaging in a rabbit model of venous thrombosis[J]. Thromb Res, 2014, 133(2): 265-271. DOI:10.1016/j.thromres.2013.11.001 |
| [14] |
DIAZ J A, OBI A T, MYERS DD J R, et al. Critical review of mouse models of venous thrombosis[J]. Arterioscler Thromb Vasc Biol, 2012, 32(3): 556-562. DOI:10.1161/ATVBAHA.111.244608 |
| [15] |
BOSIO G, ZENATI N, DESTREMPES F, et al. Shear wave elastography and quantitative ultrasound as biomarkers to characterize deep vein thrombosis in vivo[J]. J Ultrasound Med, 2022, 41(7): 1807-1816. DOI:10.1002/jum.15863 |
| [16] |
OSUAFOR C N, OLAWUNI A, SAVAGE M, et al. An assessment of deep venous thrombosis in Irish older adults in an acute medical assessment unit[J]. Ir J Med Sci, 2018, 187(4): 1107-1108. DOI:10.1007/s11845-018-1766-5 |
 2024, Vol. 22
2024, Vol. 22


