| Gd-EOB-DTPA增强MRI对肝肿瘤术前肝储备功能评估的临床价值 |
2. 江苏省苏北人民医院医学影像科,江苏 扬州 225001;
3. 大连医科大学扬州临床医学院,辽宁 大连 116031
手术切除是肝肿瘤重要的治疗手段,术前肝储备功能的准确定量评估将大大降低围手术期的死亡率,改善患者预后[1]。吲哚菁绿(indocyanine green,ICG)清除试验是肝储备功能及肝切除范围评估的金标准[2]。但ICG仅通过胆汁排泄,当胆道系统发生梗阻时,血清胆红素的升高会竞争性地抑制ICG在体内的运输过程,使滞留率存在偏差。钆塞酸二钠(Gd-EOB-DTPA)是一种肝细胞特异性对比剂,其通过肝细胞膜表面的有机阴离子转运多肽(OATP)被正常肝细胞特异性摄取; MRI肝胆特异期成像不仅有利于肝肿瘤的定性诊断,理论上还可反映肝功能情况[3]。本研究收集行Gd-EOB-DTPA增强MRI的肝肿瘤患者,以期定量测定术前肝储备功能,为临床肝肿瘤切除术提供重要依据。
1 资料与方法 1.1 一般资料回顾性分析2020年9月至2021年12月就诊于江苏省苏北人民医院行术前ICG清除试验及Gd-EOB-DTPA增强MRI检查的肝肿瘤患者74例。收集患者在行ICG清除试验前后1周内的实验室检查指标,即血小板(PLT)、凝血酶原时间(PT)、总胆红素(TBIL)、血清白蛋白(ALB)、丙氨酸转氨酶(ALT)、天门冬氨酸转氨酶(AST)。
纳入标准: ①肝脏肿瘤病变且病灶大小不超过2个肝段; ②术前均行ICG清除试验及Gd-EOB-DTPA增强MRI,且间隔时间≤1周; ③MRI图像质量满足定量、定性分析; ④临床及实验室资料完整。排除标准: ①肝内多发肿瘤病灶; ②病灶范围过大或肝内弥漫性非肿瘤性病变影响定量测量者; ③有肝肿瘤切除病史或介入栓塞治疗病史; ④肝门区胆道系统梗阻; ⑤Child-Pugh分级C级[4]。本研究经医院伦理委员会批准(批准文号: 2021ky219),免除受试者知情同意。
74例患者排除肝内多发转移瘤3例、肝肿瘤术后复发6例、介入栓塞手术史7例、肝门区胆道梗阻5例,最终纳入研究53例,包括肝细胞癌42例、周围型胆管细胞癌8例、单发肝转移瘤2例和上皮样血管平滑肌脂肪瘤1例。
1.2 ICG清除试验清晨患者安静、空腹(禁食6~8 h、禁饮4 h),按剂量0.5 mg/kg体质量配置ICG溶液,以无菌注射用水5 mL溶解稀释ICG 25 mg,于肘正中静脉一次性快速注入; 15 min后,将从对侧肘静脉抽出的血液进行分光光度计比色,测定并计算此时血液中的ICG滞留率,即ICG 15 min滞留率(ICG R15)。根据《肝切除术前肝脏储备功能评估的专家共识(2011版)》[5]及以往文献中肝切除安全限量的评估标准[6],滞留率<10%认为肝脏储备功能基本正常,患者可耐受大范围的肝切除; 滞留率 > 20%则认为超过2个肝段的大范围肝切除后,肝功能衰竭风险较大; 滞留率越高,说明肝储备功能越差。
1.3 MRI检查采用GE Discovery 750 3.0 T MRI扫描仪,扫描前患者空腹6~8 h。采用呼吸门控技术,扫描范围从膈顶至双肾下缘。扫描序列及参数: T1WI及增强扫描采用肝脏容积加速采集(liver acquisition with volume acceleration,LAVA)序列,TR 3.7 ms,TE 1.7 ms,层厚5.0 mm,层距2.5 mm,矩阵256×224,视野40 cm×40 cm; T2WI采用轴位呼吸门控脂肪抑制序列,TR 6 600.0 ms,TE 64.0 ms,层厚5.0 mm,层距6.5 mm,矩阵320×320,视野38 cm×38 cm; DWI采用轴位呼吸门控脂肪抑制序列,TR 6 300.0 ms,TE 52.0 ms,层厚5.0 mm,层距6.0 mm,矩阵160×160,视野38 cm×38 cm,b=0、800 s/mm2。对比剂采用Gd-EOB-DTPA(德国拜耳),剂量0.025 mmol/kg体质量,注射流率2.0 mL/s,后以相同流率注射20 mL生理盐水进行冲洗,分别于注射对比剂后20 s、60 s、3 min及20 min行动脉期、门静脉期、移行期及肝胆特异期扫描。
1.4 图像分析由2名分别有3、5年腹部影像诊断经验的放射科医师采用双盲法在T1WI及增强扫描肝胆期图像上,分别在增强扫描前后对应层面的肝脏尾状叶、左叶、右前叶、右后叶及右侧竖脊肌手动勾画圆形ROI(50~100 mm2)(图 1)。避开肿瘤实质部分、血管、胆管、呼吸和/或心脏搏动所致的运动伪影区。肝脏4个叶T1WI信号值的平均值记为SL0,肝胆期记为SL1; 右侧竖脊肌T1WI平扫信号值记为SM0,肝胆期记为SM1。计算肝胆期经竖脊肌校正后的肝实质相对强化程度(relative enhancement,RE),公式为RE=(SL1/SM1-SL0/SM0)/(SL0/SM0)×100%[7]。
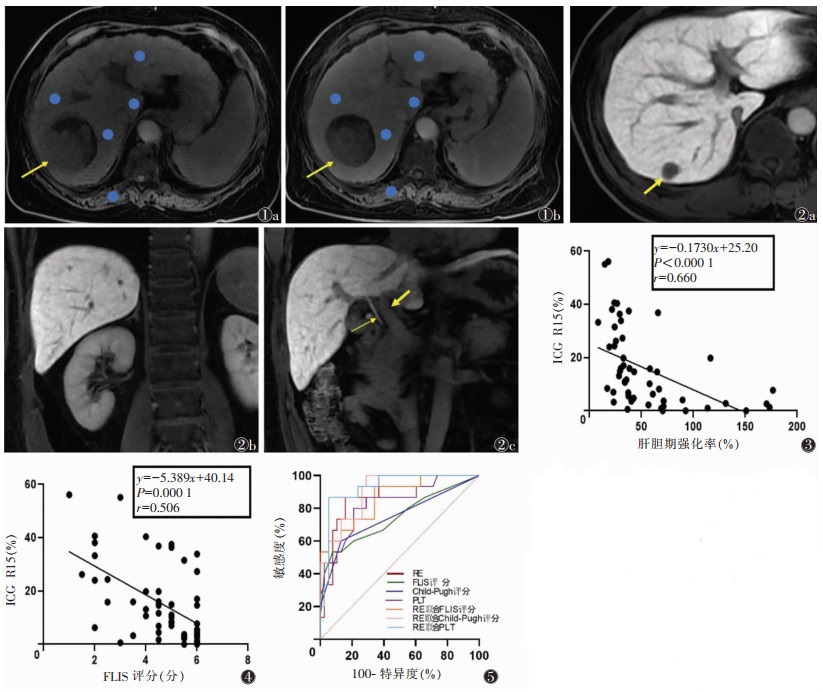 |
| 图 1 女,68岁,肝右叶占位性病变,手术病理为肝细胞癌,MRI示肝硬化征象 图 1a T1WI平扫轴位图像上勾画肝脏5个ROI(尾状叶、左叶、右前叶、右后叶及右侧竖脊肌)(箭头) 图 1b Gd-EOB-DTPA增强扫描肝胆特异期对应的5个ROI。肝实质相对强化程度(RE)为19.1%。T1WI平扫示肿瘤边界部分显示不清,肝胆特异期清楚显示肿瘤假包膜(箭头) 图 2 男,49岁,肝右叶包膜下占位性病变,手术病理为肝细胞癌,图 2a~图 2c均为肝胆特异期图像 图 2a 病灶未见对比剂摄取(箭头) 图 2b 肝实质信号强度高于右肾,记2分 图 2c 门静脉信号强度低于肝实质,记2分(粗箭);胆总管内见对比剂,记2分(细箭)。功能性肝脏影像评分(FLIS)6分 图 3,4 分别为吲哚菁绿15 min滞留率(ICG R15)与RE、FLIS评分之间的相关线性图,r值分别为-0.660、-0.506 图 5 ICG R15以20%为界分组的影像学及临床定量数据的ROC曲线,RE联合血小板(PLT)的AUC最高,为0.928 |
由上述2名医师采用双盲法分别对肝胆期图像进行功能性肝脏影像评分(functional liver imaging score,FLIS)标准[8]: ①肝实质增强得分,肝胆期肝实质信号强度低于右肾实质为0分,等于为1分,高于为2分; ②肝胆期门静脉信号得分,肝胆期门静脉信号强度高于肝实质为0分,等于为1分,低于为2分; ③胆道对比剂排泄速率得分,注射对比剂20 min后胆道无对比剂为0分,对比剂排泄至外周肝内胆管或左/右肝管为1分,排泄至肝总管、胆总管或十二指肠为2分。2名医师分别对3个征象进行视觉评估。FLIS评分为3项得分之和,总分为6分,分值越低,表示患者肝功能受损越严重(图 2)[9]。
1.5 统计学方法采用SPSS 23.0软件进行数据分析。采用组内相关系数(ICC)分析,检验2名医师对RE的测定及FLIS评分之间的一致性,如一致性良好(ICC > 0.75),则使用测量的平均水平进一步分析。ICG R15与影像学定量参数、实验室指标之间的相关性行Spearman相关分析。分别以ICG R15 10%及20%为界限分组,2组间影像学与临床实验室定量参数之间的比较行非参数秩和检验或χ2检验; 连续性定量数据以M(IQR)或x±s表示。对差异有统计学意义的连续性定量数据绘制ROC曲线并分析其诊断效能,采用MedCalc 19.5.6软件Z检验对AUC进行两两比较。以P<0.05为差异有统计学意义,P<0.001为差异有显著统计学意义。
2 结果 2.1 患者的临床特征53例中,男35例,女18例; 年龄27~81岁,中位年龄65(15.5)岁。经实验室检查、病理和/或影像学判定,乙型肝炎51例,丙型肝炎1例,肝硬化31例。Child-Pugh评分及分级: A级39例,B级14例。
2.2 影像及实验室定量指标与ICG R15的相关性2名医师对RE的测定和FLIS评分的评估一致性良好,ICC分别为0.889、0.921(均P<0.001)。ICG R15与RE、FLIS评分及Child-Pugh评分之间r值分别为-0.660、-0.506、0.510(均P<0.001)(图 3,4),均有较强的正或负相关性,且其中RE具有最强负相关性; ICG R15与实验室指标PLT、ALT、AST的r值分别为-0.421(P=0.002)、-0.064(P=0.651)、0.080(P=0.570)。
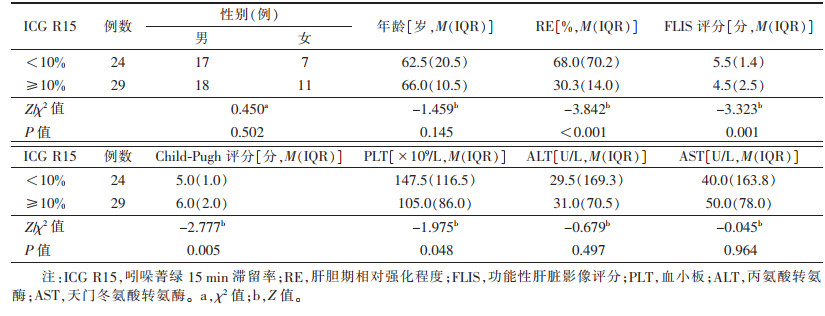
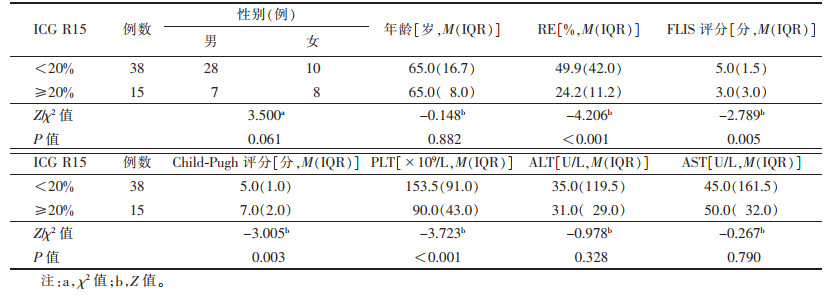
2.3 不同分组间影像、临床及实验室定量参数比较以ICG R15 10%分组后,24例<10%,29例≥10%;以ICG R15 20%分组后,38例<20%,15例≥20%。分别以10%及20%分组的RE、FLIS评分、Child-Pugh评分、PLT比较,差异均有统计学意义(均P<0.05);ICG R15<10%组与ICG R15≥10%组及ICG R15<20%组与ICG R15≥20%组患者的性别、年龄和临床常用肝功能实验室指标ALT、AST差异均无统计学意义(均P>0.05,表 1、2)。
| 表 1 以ICG R15 10%为界分组肝肿瘤患者的临床及影像特征比较 |
 |
| 表 2 以ICG R15 20%为界分组肝肿瘤患者的临床及影像特征比较 |
 |
2.4 影像及临床定量指标对肝储备功能的诊断效能
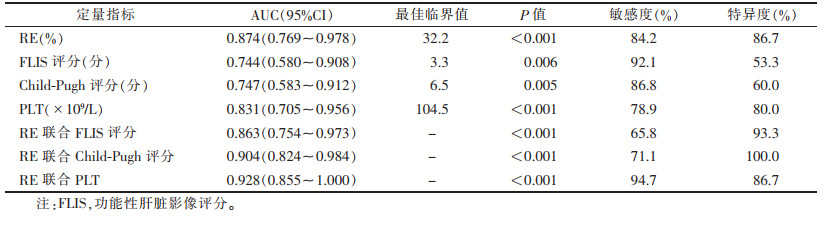
以ICG R15 10%为界分组时,RE的AUC为0.809,对应的最佳截断值为36.1%;以ICG R15 20%为界分组时,RE的AUC为0.874,对应最佳截断值为32.2%。2组的其余单因素定量指标的AUC均小于RE(以10%为界分组FLIS评分、Child-Pugh评分及PLT的AUC值分别为0.763、0.707、0.659;以20%为界分组见表 3)。以20%为界分组时,RE联合PLT的AUC为0.928,具有最佳诊断效能(图 5);RE联合Child-Pugh评分与Child-Pugh评分、FLIS评分的诊断效能比较,差异均有统计学意义(均P<0.001),RE联合PLT与Child-Pugh评分之间差异有统计学意义(Z=2.157,P<0.05),其余差异均无统计学意义(均P > 0.05)。
| 表 3 影像学及临床定量指标的诊断效能(ICG R15以20%为界分组) |
 |
3 讨论
本研究分析了ICG R15与RE、FLIS评分、Child-Pugh评分、PLT、ALT及AST之间的相关性。结果显示,RE与ICG R15相关性最高,与文献[10]报道一致,较其他定量指标评估肝功能储备的意义更大,而与临床常用的肝功能实验室指标ALT、AST并无相关性。相关线性图显示,肝胆期RE较高患者ICG R15较低,表明有正常功能的肝细胞数量越多,肝储备功能越好。本研究以ICG R15 10%与20%分组时,对应的肝胆期RE截断值分别为36.1%、32.2%,这为术前定量评估肝储备功能提供了定量参考指标。
Gd-EOB-DTPA是肝细胞特异性对比剂,其中的乙氧基苯甲基(EOB)基团可被肝细胞特异性地摄取,约50%通过肝细胞窦间隙膜上的OATP 1B1和OATP 1B3从细胞外间隙转运至正常肝细胞,以胆汁的形式排出,约50%经肾脏排泄[11]。肝功能障碍不仅影响肝细胞对对比剂的摄取,还影响其在胆道系统的排泄。Bastati等研究出了一种简易快捷评估肝功能的方法--FLIS评分,包括3个肝胆期特征征象: 肝实质对比肾增强、胆道对比剂排泄和门静脉征[12]。文献证实,FLIS评分及其3个评分参数与临床Child-Pugh评分之间均有很强的相关性,并有助于预测首次肝失代偿的发生,与其他评估肝储备功能的方法相比,通过这3个参数可更简单、更直观地对肝功能进行分级[13]。由于其评分标准涉及胆道排泄,因此针对胆系扩张疾病的评估存在一定的局限性。而肝胆期肝实质RE可更详细、准确地对肝储备功能作出量化评估,具有更大的临床价值。有文献指出,Gd-EOB-DTPA增强扫描前及肝胆期的T1 mapping图像甚至可对乙型病毒性肝炎各期肝纤维化进行评估[14]。
研究表明,PLT与肝再生关系密切,输注PLT有助于慢性肝病患者的肝功能恢复及肝再生[15]。因此,有学者认为术前PLT的数值可在一定程度上预测患者术后发生肝功能不全的概率[16]。有学者认为,PLT单因素确实对肝癌患者肝功能的预测有一定意义,联合ICG R15后预测价值进一步提高[17]。本研究显示,RE联合PLT后诊断评估效能达0.928,较RE、PLT单因素的AUC值高,进一步说明肝胆期RE在评估肝肿瘤患者术前肝储备功能方面,具有和ICG R15相似的作用。
本研究存在的局限性: ①仅对肝癌患者肝切除术前的肝储备功能评估,通过Gd-EOB-DTPA增强MRI进行定量分析,而能否适用于所有肝肿瘤患者尚未可知[18]; 本研究除肝细胞癌外的肝肿瘤患者例数较少,RE是否适用于其他肝肿瘤患者,还需进一步研究。②未能纳入肝肿瘤的大小及肿瘤切除术后的残余体积,仅限制了肝脏肿瘤病变的多少及范围。③RE为手动勾画肝脏4个叶ROI信号值的平均值,为肝肿瘤患者总体的肝储备功能评估; 而文献指出肝肿瘤患者肝功能的分布是不均匀的[19],需据此进行更详细的肝功能的分段或分叶研究。
综上所述,Gd-EOB-DTPA增强MRI的肝胆期肝实质RE可定量测定肝肿瘤患者的肝储备功能。通过定量比较肝胆期不同患者的肝实质的RE,有利于术前筛选出肝储备功能较差的患者,通过MRI一站式检查为肝肿瘤切除术提供重要信息,对肝肿瘤患者的诊疗具有重要的临床意义。
| [1] |
SØREIDE J A, DESHPANDE R. Post hepatectomy liver failure (PHLF)-Recent advances in prevention and clinical management[J]. Eur J Surg Oncol, 2021, 47(8): 2204-2205. DOI:10.1016/j.ejso.2021.03.255 |
| [2] |
MØLLER S, HENRIKSEN J H, SJOSTEDT S, et al. Determination of hepatic clearance by derivations of the indocyanine green retention test in cirrhosis[J]. J Gastroenterol Hepatol, 2022, Online ahead of print.
|
| [3] |
白婷婷, 周慧, 冯赟, 等. 钆塞酸二钠MRI增强扫描与IVIM-DWI预测肝细胞癌微血管侵犯的应用价值[J]. 中国中西医结合影像学杂志, 2021, 19(3): 237-241, 266. DOI:10.3969/j.issn.1672-0512.2021.03.008 |
| [4] |
ABBASI A, BHUTTO A R, ALAM M T, et al. Frequency of hepatic hydrothorax and its association with Child Pugh Class in liver cirrhosis patients[J]. J Coll Physicians Surg Pak, 2016, 26(7): 566-569. |
| [5] |
董家鸿, 郑树森, 陈孝平, 等. 肝切除术前肝脏储备功能评估的专家共识(2011版)[J]. 中华消化外科杂志, 2011, 10(1): 20-25. |
| [6] |
余伟, 黄长山, 王谦, 等. 术前改善ICGR15对肝癌术后并发症及近期肝功能的影响[J]. 中国普通外科杂志, 2021, 30(8): 949-954. |
| [7] |
杨睿, 张洪波, 樊中营, 等. Gd-EOB-DTPA肝脏MRI动态增强扫描评估肝功能的可行性[J]. 医学影像学杂志, 2019, 29(6): 969-972. |
| [8] |
BASTATI N, BEER L, MANDORFER M, et al. Does the functional liver imaging score derived from gadoxetic acid-enhanced MRI predict outcomes in chronic liver disease?[J]. Radiology, 2020, 294(1): 98-107. DOI:10.1148/radiol.2019190734 |
| [9] |
杜艳妮, 吕志彬, 关春爽, 等. 基于Gd-EOB-DTPA增强MRI FLIS分析对预测肝功能的价值研究[J]. 生物医学工程与临床, 2020, 24(6): 682-686. |
| [10] |
刘矿, 施建芳, 周玮. 钆塞酸二钠增强MRI结合体积测算在评估肝癌患者肝脏储备功能中的应用[J]. 中国现代医生, 2019, 57(32): 93-96, 100. |
| [11] |
LEONHARDT M, KEISER M, OSWALD S, et al. Hepatic uptake of the magnetic resonance imaging contrast agent Gd-EOB-DTPA: role of human organic anion transporters[J]. Drug Metab Dispos, 2010, 38(7): 1024-1028. DOI:10.1124/dmd.110.032862 |
| [12] |
BASTATI N, WIBMER A, TAMANDL D, et al. Assessment of orthotopic liver transplant graft survival on gadoxetic acid-enhanced magnetic resonance imaging using qualitative and quantitative parameters[J]. Invest Radiol, 2016, 51(11): 728-734. DOI:10.1097/RLI.0000000000000286 |
| [13] |
LEE H J, HONG S B, LEE N K, et al. Validation of functional liver imaging scores (FLIS) derived from gadoxetic acid-enhanced MRI in patients with chronic liver disease and liver cirrhosis: the relationship between Child-Pugh score and FLIS[J]. Eur Radiol, 2021, 31(11): 8606-8614. DOI:10.1007/s00330-021-07955-1 |
| [14] |
徐晓莉, 冯峰, 张涛, 等. Gd-EOB-DTPA增强MRI对慢性乙型病毒性肝炎肝纤维化分期的评估价值[J]. 中国中西医结合影像学杂志, 2021, 19(6): 568-571. |
| [15] |
AMYGDALOS I, CZIGANY Z, BEDNARSCH J, et al. Low post- operative platelet counts are associated with major morbidity and Inferior survival in adult recipients of orthotopic liver transplan- tation[J]. J Gastrointest Surg, 2020, 24(9): 1996-2007. DOI:10.1007/s11605-019-04337-3 |
| [16] |
CHOI J, KIM SH, HAN S, et al. A simple and clinically appli- cable model to predict liver-related morbidity after hepatic resec- tion for hepatocellular carcinoma[J]. PLoS One, 2020, 15(11): 0241808. |
| [17] |
刘宇开, 欧阳高雄, 陈可新, 等. 肝癌肝切除术后ICGR15和PLT对发生肝功能不全预测价值研究[J]. 中华肿瘤防治杂志, 2020, 27(3): 224-229. |
| [18] |
HUANG M, SHEN S, CAI H, et al. Regional liver function analysis with gadoxetic acid-enhanced MRI and virtual hepatec- tomy: prediction of postoperative short-term outcomes for HCC[J]. Eur Radiol, 2021, 31(7): 4720-4730. |
| [19] |
WANG Y, ZHANG L, NING J, et al. Preoperative remnant liver function evaluation using a routine clinical dynamic Gd-EOB-DTPA-Enhanced MRI protocol in patients with hepatocellular carcinoma[J]. Ann Surg Oncol, 2021, 28(7): 3672-3682. |
 2022, Vol. 20
2022, Vol. 20


