| 从TLR4信号通路探讨电针减轻小鼠脑缺血再灌注损伤的炎症反应机制 |
2. 西门子医疗系统有限公司上海分部,上海 200120
近年来,我国脑血管疾病的发病率呈上升趋势[1]。脑卒中根据病因分为缺血性脑卒中和出血性脑卒中2种,前者约占70%[2]。缺血性脑卒中在中老年患者中呈高发状态,其致残率、致死率较高,且发病年龄越来越年轻化,不仅给社会、家庭带来沉重的经济负担,而且影响患者的身心健康和生活质量。本研究通过炎症反应结合现代MRI分子影像技术观察电针减轻小鼠脑缺血再灌注损伤的炎性反应信号机制,以帮助临床有效治疗缺血性脑卒中,并为今后的研究提供一定理论支持。
1 材料与方法 1.1 一般材料选择野生型健康成年C57BL/6n小鼠30只,雄性,体质量20~25 g,SPF级,购自北京维通利华实验动物公司,许可证号:SCXK(京)2016- 0011,由上海中医药大学实验动物中心饲养,环境设施动物许可证号:SYXK(沪)2014-0008。实验动物中心无菌饲养,实验室温度22 ℃,空气湿度75%。所有实验和程序均通过上海中医药大学动物伦理委员会批准(伦理登记号:SZY201712006)。
1.2 仪器与方法 1.2.1 造模及分组30只小鼠随机分为假手术组、大脑中动脉栓塞缺血再灌注组(MCAO缺血再灌注组)、电针组各10只。沿用传统改良Longa式栓线法制备小鼠右侧MCAO缺血再灌注损伤模型[1]。术前禁食24 h,于腹腔注射4%水合氯醛,剂量35 mg/kg体质量。待麻醉后,在颈部正中间偏右少许纵行切开皮肤,长度约1 cm。按解剖顺序轻柔钝性分离肌肉及筋膜,见右侧颈外动脉及颈动脉鞘后,将鞘内颈总动脉、迷走神经及颈内动脉依次分开,夹闭颈外动脉一端使其处于游离状态。将2根缝线放置于右侧颈总动脉,1根在靠近分叉1 cm处结扎,另外1根备用。将预先准备好的线栓放入对应型号医用针头中,头端以不露出为准,将针头从颈总动脉结扎处前端刺入,用镊子轻轻推动线栓尾部,不断调整位置使其顺利进入颈内动脉,再用镊子夹住针头前方血管及线栓顶部,迅速退出针头。右手将线栓继续推入颈内动脉,待感觉到对抗力时,再轻微向前推动少许,此时线栓顶部已处于大脑中动脉起始处,血流阻止,插线停止前进。插线成功后结扎颈总动脉固定线栓,滴2~3滴青霉素粉剂稀释液,分层逐步缝合手术切口,清洁步骤完成后放入笼中,单个保温喂养。缺血30 min后,插入线栓使用血管钳缓慢往外拉出,待退至颈内外动脉分叉处时,剪断线栓,实现血流再灌注。假手术组造模时仅分离颈总动脉、颈外动脉及颈内动脉,即刻缝合切口。
1.2.2 电针干预电针组小鼠在清醒后2 h取患侧足三里穴及百会穴透刺患侧太阳穴行电针治疗,针刺穴位的定位标准按照《实验针灸学》[4]制订的实验动物穴位图谱;连接电针治疗仪,疏密波轮换刺激:疏波4 Hz,密波20 Hz,0.5 mA,输出电压强度1~3 V,电针时间30 min,以相应干预刺激腧穴出现轻度颤动为度。假手术组及MCAO缺血再灌注组均不予电针治疗,每日与电针组同时固定捆绑刺激,以排除小鼠应激反应出现的结果误差。
1.3 取材及处理再灌注48 h后小鼠神经功能活动情况选择Longa 5分法评分标准评价[5];造模成功后所有小鼠均行尾静脉超微超顺磁氧化铁颗粒(USPIO)注射,MRI扫描横轴位和冠状位T1WI、T2WI及SWI结束后取血、取脑。图像上传至后处理工作站,测量T2WI及SWI冠状位梗死侧与正常侧信号值比值。室温下,先眼眶取血,待全血静置30 min后离心,取上层血清,行相关炎症信号指标(IL-1β、TNF-α)酶联免疫(ELISA)法检测。将脑组织浸入4%多聚甲醛溶液中,后在分级系列的乙醇中脱水并包埋于石蜡中。石蜡切片,脑组织神经元结构破坏情况采取病理HE染色观察;免疫组化染色观察脑组织梗死区域铁粒子的吞噬情况;实时定量聚合酶链式反应(PCR)法测量脑组织梗死区域TLR4的mRNA表达量。
1.4 统计学方法采用SPSS 21.0软件对数据进行统计分析,计量资料以x±s表示;采用单因素方差分析及秩转换的非参数检验(Mann-Whitney U检验法),以P<0.05为差异有统计学意义。
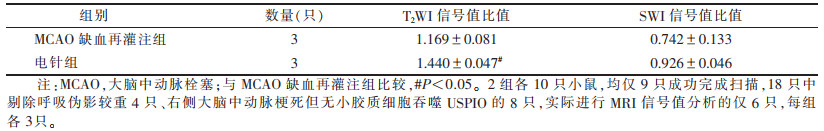
2 结果 2.1 3组MRI信号与HE染色、免疫组化染色对照假手术组(图 1a~1e)于再灌注后48 h行MRI扫描,MRI图像未见异常信号,对应右侧脑组织细胞形态正常,无明显病理改变,相应免疫组化中有极少活化小胶质细胞且无铁染色颗粒。MCAO缺血再灌注组(图 2a~2e)、电针组(图 3a~3e)于再灌注后48 h行MRI扫描,T1WI、T2WI及SWI均可见分布不均的斑片状及斑点状异常信号,部分沿大脑边缘位置走行;相对MCAO缺血再灌注组,电针组T2WI信号值比值明显降低(P<P<0.05)(表 1);对应右侧脑组织病理结构变化明显,活化小胶质细胞增加,数量丰富,可见蓝色铁颗粒散在显示,部分显示阳性小胶质细胞吞噬铁颗粒,以上电针组均较MCAO缺血再灌注组减少。
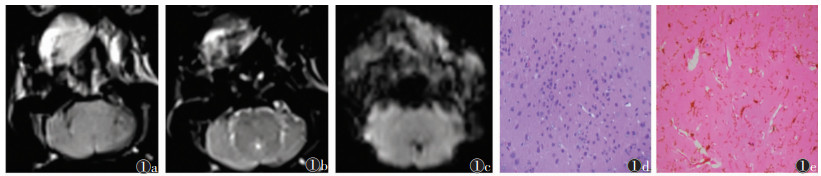 |
| 图 1 假手术组 图 1a~1c 分别为横轴位T1WI、T2WI、SWI,均未见明显异常 图 1d 小鼠右侧大脑中动脉供血区脑组织未观察到明显病理形态变化(HE×400) 图 1e Iba-1+Fe免疫组化套染(×400),显示有极少活化小胶质细胞且无铁染色颗粒(箭) |
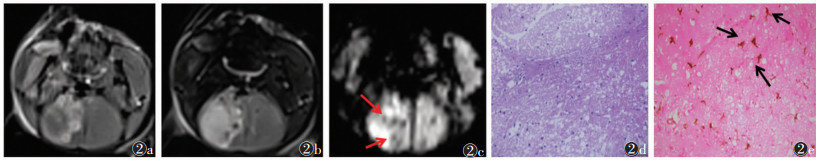 |
| 图 2 大脑中动脉栓塞(MCAO)缺血再灌注组 图 2a~2c 分别为横轴位T1WI、T2WI、SWI,均可见斑片状及斑点状异常负性信号,分布不均匀 图 2d 小鼠右侧大脑中动脉供血区脑组织,出现显著的病理形态改变,水肿加重(HE×400) 图 2e Iba-1+Fe免疫组化套染(×400),活化小胶质细胞明显增加,蓝色铁颗粒散在显示(箭) |
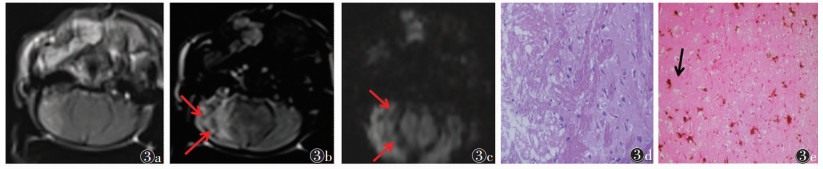 |
| 图 3 电针组 图 3a~3c 分别为横轴位T1WI、T2WI、SWI,均可见斑片状及斑点状异常负性信号,程度较轻 图 3d 小鼠右侧大脑中动脉供血区脑组织,病理形态改变较小,水肿减轻(HE×400) 图 3e Iba-1+Fe免疫组化套染(×400),活化小胶质细胞增加减少,蓝色铁颗粒显示较少 |
| 表 1 2组小鼠再灌注后48 h的T2WI、SWI冠状位最低信号值比值比较(x±s) |
 |
2.2 3组小鼠再灌注后48 h血清炎性因子IL-1β、TNF-α表达水平比较(图 4)
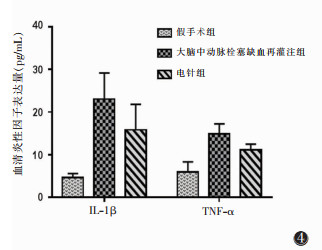 |
| 图 4 3组小鼠再灌注后48 h血清炎性因子IL-1β、TNF-α表达水平 |
IL-1β、TNF-α数值假手术组分别为(4.657±0.921)、(4.900±1.202)pg/mL,MCAO缺血再灌注组分别为(23.022±6.114)、(16.703±2.886)pg/mL,电针组分别为(14.975±6.209)、(10.618±1.248)pg/mL,MCAO缺血再灌注组与其他2组比较,差异均有统计学意义(均P<0.01)。
2.3 3组小鼠再灌注后48 h脑组织梗死区域TLR4 mRNA相对表达量比较(图 5)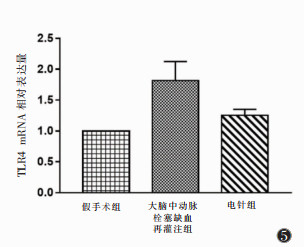 |
| 图 5 3组小鼠再灌注后48 h的TLR4 mRNA相对表达量 |
TLR4 mRNA相对表达量假手术组为10,MCAO缺血再灌注组为1.817±0.308,电针组为1.254±0.097,MCAO缺血再灌注组与其他2组比较,差异均有统计学意义(均P<0.01)。
3 讨论 3.1 电针后各组T2WI信号值变化结合免疫组化、HE染色结果MCAO缺血再灌注组右侧大脑半球中动脉供血区可见T2WI高亮度区域信号值部分散在缺失,T1WI呈高信号,免疫组化上有散在蓝色铁颗粒显示,分析可能是缺血再灌注小鼠成模后,炎性反应加重,梗死区低信号处有更多活化的小胶质细胞和持续外源性吞噬细胞的聚集进入,吞噬USPIO所致。而本研究选用的MRI对比剂是一种超微超顺磁氧化铁颗粒,既能下降T2WI信号,又可升高T1WI信号值。MCAO缺血再灌注组梗死区域T2WI最低信号强度比值在电针刺激右侧足三里穴及百会穴透刺太阳穴后显著升高,其机制可能是由于电针刺激抑制了病灶区小胶质细胞的活化,导致其吞噬USPIO的数量明显减少,说明电针治疗后炎症信号下降,水肿减轻,炎性反应降低,脑神经功能改善;相较于MCAO缺血再灌注组,电针组SWI最低信号比值升高,但差异无统计学意义(P > 0.05),原因可能是各组样本量小,统计数据受个体差异的影响,误差增大,以及USPIO在SWI序列中的放大作用。
3.2 电针对脑缺血再灌注损伤小鼠TLR4信号通路相关炎性细胞因子的调节作用脑缺血再灌注后的炎症损伤早期主要由促炎指标TNF-α引起,这种细胞因子被巨噬细胞合成,尤其是活化的小胶质细胞是其最重要的来源之一[5]。此过程的炎症效应和免疫应答均由TNF-α诱导[6-7],一系列局部脑组织损伤加重效应形成:激活中性粒细胞和淋巴细胞,促进黏附分子及IL-1β、IL-6等其他炎症介质的合成[8],进而加剧过氧化损伤,神经细胞终末归宿为变性坏死[9]。本实验各组小鼠于灌注后48 h其IL-1β表达趋势与TNF-α基本一致,均在MCAO缺血再灌注组表达量最多,说明小鼠在缺血再灌注后脑组织损伤加剧。电针组两者表达量均较模型组明显下降,且IL-1β降低更明显,说明电针干预后可明显减少TNF-α、IL-1β的过量分泌,且IL-1β更敏感。
3.3 电针对脑缺血再灌注损伤小鼠TLR4信号通路TLR4 mRNA的调节作用Toll样受体(Toll-like receptors,TLRs)是一类保守模式识别受体家族,可识别所谓的损伤相关分子模式内源性配体,并介导宿主对损伤和应激的炎性反应[10]。TLRS与同源配体的绑定通过信号通路引起细胞的活化,包括衔接体的招募,其下游产物包括骨髓分化因子88、TIR结构域-衔接蛋白-诱导干扰素、TIR结构域-衔接蛋白和TRIF相关衔接分子及MyD88-和/或TRIF依赖通路中炎性介质和I型干扰素的相关产物[11-12]。其中部分TLRs(TLR2、TLR4和TLR6)的活化间接产生MyD88,后启动一系列信号的连结反应,导致转录因子-κB、干扰素调节因子等的激活,接着促炎细胞因子、黏附因子、Ⅰ型干扰素和协同刺激分子及趋化因子表达。TLR4是由脑内小胶质细胞表达的主要TLRs蛋白,TLR4信号通路成为小胶质细胞活化和调节其功能的重要开关[13]。因此,机体在缺血再灌注损伤发生后,电针干预可调节自身TLR4 mRNA的表达,使其含量下降,从而降低其自身炎症反应,实现保护脑功能作用。这一结果与吴明娟[14]的研究结果基本一致,其研究表明TLR4表达含量在脑缺血再灌注后呈升高趋势,说明TLR4 mRNA的表达可被脑缺血炎症损伤激活,电针刺激可能通过降低TLR4 mRNA含量,进而降低其引导的炎症因子分泌来减轻脑缺血再灌注炎症损伤级联反应。
综上所述,采用Longa式线栓改良法成功建立小鼠MCAO栓塞缺血再灌注损伤模型并观察到神经功能缺损症状,梗死面积稳定可靠。电针能够改善小鼠神经功能缺损症状、减少活化的小胶质细胞数量、升高冠状位T2WI负性强化信号,缩小脑梗死面积;可能机制为下调了TLR4信号通路中TLR4 mRNA及信号相关下游促炎细胞因子IL-1β、TNF-α的表达。
| [1] |
MILLER E C, BLUM C, ROSTANSKI S K. Developing a Stroke Center[J]. Stroke, 2017, 48(7): e155-e156. |
| [2] |
WANG Y, CUI L, JI X, et al. The China National Stroke Registry for patients with acute cerebrovascular events:design, rationale, and baseline patient characteristics[J]. Int J Stroke, 2011, 6(4): 355-361. DOI:10.1111/j.1747-4949.2011.00584.x |
| [3] |
SUN H, ZOU X, LIU L. Epidemiological factors of stroke:a survey ofthe current status in China[J]. J Stroke, 2013, 15(2): 109-111. |
| [4] |
李忠仁. 实验针灸学[M]. 北京: 中国中医药出版社, 2007: 359-362.
|
| [5] |
LONGA E Z, WEINSTEIN P R, CARLSON S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91. |
| [6] |
GREGERSEN R, LAMBERTSEN K, FINSEN B. Microglia and macrophages are the major source of tumor necrosis factor in permanent middle cerebral artery occlusion in mice[J]. J Cereb Blood Flow Metab, 2000, 20(1): 53-65. DOI:10.1097/00004647-200001000-00009 |
| [7] |
刘坤, 姚阳, 商丽宏, 等. 促红细胞生成素对大鼠脑缺血再灌注后claudin-5和TNF-α表达的影响[J]. 中风与神经疾病杂志, 2015, 32(6): 484-486. |
| [8] |
AMANTEA D, TASSORELLI C, PETRELLI F, et al. Understanding the multifaceted role of inflammatory mediators in ischemic stroke[J]. Curr Med Chem, 2014, 21(18): 2098-2117. DOI:10.2174/0929867321666131227162634 |
| [9] |
TAKEUCHI H, JIN S, WANG J, ZHANG G, et al. Tumor necrosis factor-alpha induces neurotoxicity via glutamate release from hemichannels of activated microglia in an autocrine manner[J]. J Biol Chem, 2006, 28(30): 21362-21368. |
| [10] |
PICCININI A M, MIDWOOD K S. DAMPening inflammation by modulating TLR signalling[J]. Mediators Inflamm, 2010, 2010: 672395. |
| [11] |
KENNY E F, O'NEILL L A. Signalling adaptors used by Toll-like receptors:an update[J]. Cytokine, 2008, 43(3): 342-349. DOI:10.1016/j.cyto.2008.07.010 |
| [12] |
WEST A P, KOBLANSKY A A, GHOSH S. Recognition and signaling by toll-like receptors[J]. Annu Rev Cell Dev Biol, 2006, 22(7): 409-437. |
| [13] |
KONG Y, LE Y. Toll-like receptors in inflammation of the central nervous system[J]. Int Immunopharmacol, 2011, 11(10): 1407-1414. DOI:10.1016/j.intimp.2011.04.025 |
| [14] |
吴明娟, 赵岩, 孙晓伟, 等. 头穴透刺对脑缺血再灌注大鼠脑组织TLR-4蛋白表达的影响[J]. 针灸临床杂志, 2018, 34(4): 67-69, 81. |
 2020, Vol. 18
2020, Vol. 18


