| 甲基丙二酸血症患儿的临床表现及脑部MRI征象分析 |
2. 河南中医药大学第一附属医院磁共振科, 河南 郑州 450000
甲基丙二酸血症(methylmalonic academia,MMA)为有机酸尿症的一种,是多因素常染色体隐性遗传性疾病[1-2]。该病属于罕见且无法根治的严重疾病,致死、致残率极高[3],极易累及中枢神经系统导致神经元损伤[4],严重影响患儿的生长及智力发育,给患儿及家庭带来沉重的负担,因此早期诊断、尽早干预对改善预后尤为重要。MMA的临床表现缺乏特异性,极易误诊、延误病情[5-6]。MRI可客观反映脑部损伤情况,指导诊断和治疗。然而前期文献报道MMA影像学征象特异性不强[7]。本文通过半定量评估11例MMA患儿的颅脑MRI征象,以提高对该病的认识,为早期诊断及干预提供客观依据。
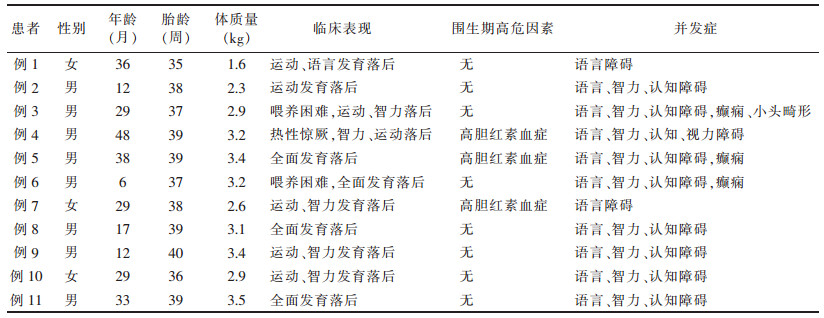
1 资料与方法 1.1 一般资料回顾性分析2015年3月至2019年9月于我院确诊为MMA的患儿11例,其中男8例,女3例;年龄6~48个月,平均(23.7±14.0)个月。早产1例(< 37周),低体质量2例(< 2.5 kg),11例均表现为不同程度的发育落后,合并喂养困难2例,热性惊厥1例。3例围生期有高胆红素血症,9例存在语言、智力、认知障碍,1例合并视力障碍,3例合并癫痫,2例仅存在语言障碍(表 1)。所有患儿均行颅脑MRI检查,排除继发性维生素B12(VB12)、叶酸缺乏者。11例中,单纯型MMA 8例(72.7%)(单纯型MMA组),MMA合并同型半胱氨酸血症(methylmalonic aciduria and homocystinuria,MMA-HC)3例(27.3%)(MMA-HC组)。本研究获医院伦理委员会批准(HNZY1AF2019LSK-172),所有患儿家长均签署知情同意书。
| 表 1 11例患儿的临床资料 |
 |
1.2 MMA的诊断标准[8]
所有患儿的尿有机酸分析(气相色谱-质谱联用分析),均显示甲基丙二酸(> 3.6 mmol/mmol肌酐)及甲基枸橼酸水平明显升高(> 1.1 mmol/mmol肌酐),且血清VB12浓度正常。MMA-HC患儿血液中同型半胱氨酸含量增加(> 16 μmol/L);单纯型MMA的同型半胱氨酸含量正常(正常参考值:6~16 μmol/L)。
1.3 仪器与方法采用Philips Ingenia 3.0 T MRI扫描仪和8通道头颅联合线圈进行图像采集。对不能配合的患儿进行镇静,以减少运动伪影。扫描序列及参数:轴位T1WI,TR 2 000 ms,TE 20 ms;轴位T2WI,TR 2 104 ms,TE 80 ms;轴位T2 FLAIR,TR 11 000 ms,TE 120 ms;矢状位T2WI,TR 2 500 ms,TE 80 ms;层厚5 mm,层距1 mm,视野220 mm×220 mm。
1.4 图像分析MRI图像由2名影像科医师(分别具有6、10年儿科神经影像诊断经验)在不知道患儿临床资料及诊断结果的情况下进行独立分析,意见不一致时经讨论达成一致。
联合各个序列半定量评估病灶信号的特点,包括以下几个方面:室周白质T2WI高信号(轻、中、重度);白质减少(轻、中、重度);侧脑室扩张(轻、中、重度);侧脑室壁不整;胼胝体变薄(局部变薄、整体变薄);豆状核信号异常(苍白球、壳核);皮质信号异常;海马及小脑信号异常。
室周白质高信号程度诊断标准[9]:轻度,侧脑室前后角及三角区周围白质出现T2WI异常高信号;中度,在轻度基础上,侧脑室体部周围白质出现异常高信号;重度,在中度基础上,半卵圆中心出现异常高信号。白质减少程度诊断标准[9]:轻度,白质减少局限在侧脑室前后角及三角区周围;中度,放射冠及半卵圆中心白质减少,脑沟变宽,外侧裂池扩张,灰质接近侧脑室;重度,半卵圆中心白质接近消失。侧脑室扩张程度诊断标准[10-11]:轻度,Evans’指数>0.3,且10 mm < 侧脑室三角直径≤15 mm;中度,Evans’指数>0.3,且15 mm < 侧脑室三角直径≤20 mm;重度,Evans’指数>0.3,且侧脑室三角直径>20 mm;Evans’指数=侧脑室前角最宽直径/同层面脑实质最大直径。
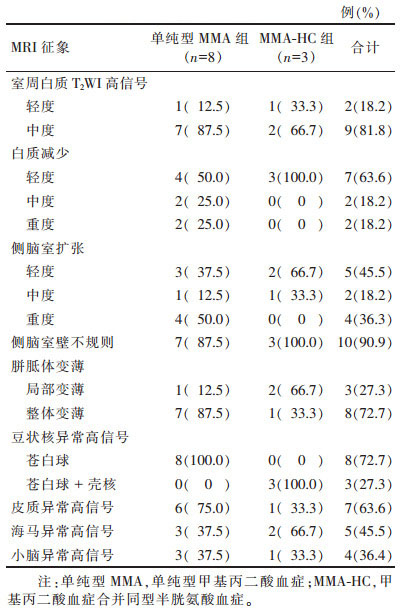
2 结果2组MRI征象分析见表 2。11例均出现室周白质T2WI高信号、白质减少、侧脑室扩张、胼胝体变薄、双侧豆状核信号异常;侧脑室壁不规则10例(90.9%)、皮质信号异常7例(63.6%)、双侧海马信号异常5例(45.6%)、小脑信号异常4例(36.4%)(图 1~8)。MMA-HC组较单纯MMA组的室周白质高信号、白质减少、侧脑室扩张、胼胝体变薄程度轻;单纯MMA组豆状核损伤均位于苍白球,MMA-HC组同时累及苍白球+壳核。
| 表 2 2组的MRI征象 |
 |
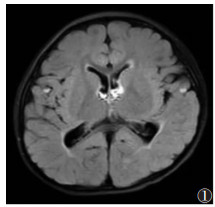 |
| 图 1 男,23个月,甲基丙二酸血症(MMA)。T2FLAIR示双侧侧脑室前后角区白质信号异常 |
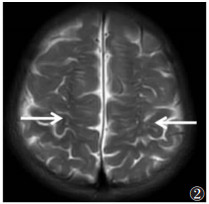 |
| 图 2 男,12个月,MMA合并同型半胱氨酸血症(MMA-HC)。T2WI示双侧半卵圆中心区白质重度减少,接近消失(白箭) |
 |
| 图 3 男,12个月,MMA-HC。T2WI示双侧侧脑室扩张,Evans’指数 > 0.3 |
 |
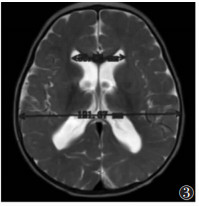
| 图 4 男,29个月,MMA。T2WI示双侧侧脑室壁不规则,呈波浪状改变 |
 |
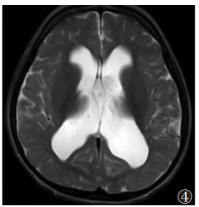
| 图 5 女,36个月,MMA。T2WI示双侧苍白球对称异常高信号(白箭) |
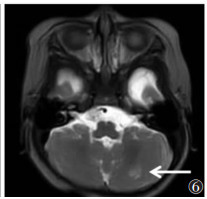 |
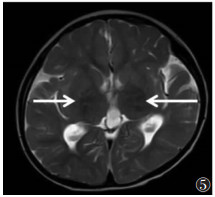
| 图 6 女,6个月,MMA。T2WI示左侧小脑半球异常高信号(白箭) |
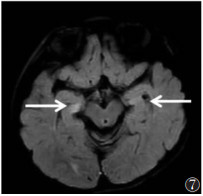 |
| 图 7 女,36个月,MMA-HC。T2 FLAIR示双侧海马对称高信号(白箭) |
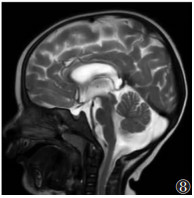 |
| 图 8 男,29个月,MMA。矢状位T2WI示胼胝体整体变薄 |
3 讨论 3.1 MMA的发病机制及临床表现
MMA是一种有机酸代谢障碍性疾病,主要因甲基丙二酰辅酶A变位酶(methylmalonyl-CoA-mutase,MCM)缺陷或其辅酶钴氨素(VB12)代谢障碍致病[12]。根据同型半胱胺酸的含量,分为单纯型MMA和MMA-HC。文献报道MMA-HC在我国较多见[13-14],本研究MMA-HC仅3例(27.3%),考虑与样本量较小有关。
MCM或VB12异常引起线粒体功能异常,导致三羧酸循环障碍,肉碱类物质(丙酰肉碱/乙酰肉碱)、丙酸、甲基丙二酸、甲基枸橼酸等代谢物大量堆积,造成多系统损伤(神经、肝脏、肾脏、骨髓等)[12]。异常代谢物导致血氨升高,氨的神经毒性作用可引起脑水肿和细胞死亡[15];同时氨还可过度活化N-甲基-D-天冬氨酸受体(NMDA)介导细胞死亡[16]。本组11例患儿颅脑MRI均表现为异常,证明均有神经系统的损伤。
MMA在各个年龄段均可发病,根据发病时间临床分为早发型和迟发型[17]:早发型通常在1岁前就表现出严重的多器官损害症状;而迟发型症状较轻,主要表现为神经系统损害[18],本组10例为迟发型。MMA临床症状常表现为反应弱、喂养困难、惊厥、智力运动发育迟缓等,本组11例均有不同程度的语言、智力认知发育落后,2例合并喂养困难,1例合并热性惊厥,然而这些表现均无特异性,为混杂因素[18]。本组男性多于女性,说明男性患儿为易感人群;胎龄及体质量大部分正常,说明此病可能不会导致早产和宫内体格发育异常;患儿无明显高危因素。因此,MMA患儿的临床表现无特异性,在实际临床工作中,对慢性起病、不明原因的喂养困难及发育落后为主要表现的患儿,应警惕MMA,并及时行生化、颅脑MRI检查及基因检测。
3.2 MMA的颅脑MRI表现MMA最常引起神经系统损伤,常见的MRI征象有髓鞘化发育不良、脑萎缩、侧脑室扩张、双侧苍白球对称性信号异常等[7, 19],然而以上征象特异度低,仅苍白球信号异常具有相对特异性,但相关文献未对病灶进行半定量评估,对其相关病理生理学机制未阐述清楚。
本研究11例均见室周脑白质T2WI异常高信号,病灶主要对称分布于侧脑室前后角、三角区及侧脑室体部旁白质。笔者对白质异常信号的程度进行了半定量评估,发现MMA及MMA-HC均以白质中度损伤为主。室周脑白质高信号考虑与白质损伤或髓鞘化发育不良有关,病理生理学改变主要是以血管损伤或代谢异常导致的脑内S-腺苷甲硫氨酸缺乏有关[20],白质损伤或髓鞘化不良最终会导致白质体积减小,表现为大脑和小脑脑沟加深、皮质萎缩,脑萎缩可直接影响婴幼儿大脑神经系统的发育[5]。MMA-HC组3例白质减少均为轻度,较单纯型MMA组程度轻。本研究11例均出现不同程度的侧脑室扩张并侧脑室壁不规则,MMA-HC组扩张程度较单纯型MMA组轻,重度扩张仅出现在单纯型MMA组。侧脑室扩张的形成机制与白质体积减少造成的被动扩张、高浓度半胱氨酸代谢产物造成脑内血管僵硬、血管顺应性下降导致脑积水有关[7, 20]。本组11例均出现胼胝体变薄征象,单纯型MMA组损伤较MMA-HC组重。胼胝体变薄是MMA患者的脑白质损伤或髓鞘化发育不良的一种表现,或为获得性或遗传性病变所致。胼胝体为人脑最大的联络纤维,研究认为其与认知及智力有关[21],本组11例均存在不同程度的智力障碍。
文献报道基底节区是MMA患儿最常受累的部位,特别是苍白球[7, 14]。本研究11例均出现豆状核T2WI高信号,单纯型MMA组均位于苍白球,MMA-HC组同时累及苍白球+壳核。可能由于MMA的毒性有机酸代谢物过度蓄积导致能量需求较高的基底节区,尤其是苍白球和壳核更易受损[3]。文献报道苍白球异常仅出现在单纯型MMA中,很少出现在MMA-HC中[14]。本研究MMA-HC患儿同时累及苍白球和壳核,该征象具有鉴别单纯型MMA和MMA-HC的意义,但具体机制尚不清楚,有待大样本的进一步研究;除以上征象外,还可见海马、小脑、皮质异常高信号,但无特异性。
综上所述,MMA最常见的影像学表现为室周白质T2WI异常高信号、白质减少、侧脑室扩张并壁不规则、胼胝体变薄、双侧豆状核信号异常。MMA-HC组较单纯型MMA组的室周白质T2WI高信号、白质减少、侧脑室扩张、胼胝体变薄程度轻,且重度侧脑室扩张仅存在于单纯型MMA组;单纯MMA组豆状核损伤均位于苍白球,MMA-HC组同时累及苍白球+壳核。虽然MMA影像学表现缺乏一定特异性,但侧脑室扩张程度及豆状核损伤的部位有助于提示MMA的诊断及鉴别诊断,对该病的早期干预有重要作用。
| [1] |
NOGUEIRA C, MARCAO A, ROACHA H, et al. Molecular picture of cobalamin C/D defects before and after newborn screening era[J]. J Med Screen, 2017, 24(1): 6-11. DOI:10.1177/0969141316641149 |
| [2] |
YANG L, GUO B, LIU X, et al. Brain MRI features of methylmalonic acidemia in children: the relationship between neuropsychological scores and MRI findings[J]. Sci Rep, 2020, 10(1): 13099. DOI:10.1038/s41598-020-70113-y |
| [3] |
BAKER E H, SLOAN J L, HAUSER N S, et al. MRI characteristics of globus pallidus infarcts in isolated methylmalonic acidemia[J]. AJNR Am J Neuroradiol, 2015, 36(1): 194-201. DOI:10.3174/ajnr.A4087 |
| [4] |
LI Q L, SONG W Q, WANG Q, et al. Predictors of survival in children with methymalonic acidemia with homocystinuria in Beijing, China: a prospective cohort study[J]. Indian Pediatr, 2015, 52(2): 119-124. DOI:10.1007/s13312-015-0584-3 |
| [5] |
FRASER J L, VENDITTI C P. Methylmalonic and propionic acidemias: clinical management update[J]. Curr Opin Pediatr, 2016, 28(6): 682-693. DOI:10.1097/MOP.0000000000000422 |
| [6] |
HAN B, CAO Z, TIAN L, et al. Clinical presentation, gene analysis and outcomes in young patients with early-treated combined methylmalonic acidemia and homocysteinemia (cblC type) in Shandong province, China[J]. Brain Dev, 2016, 38(5): 491-497. DOI:10.1016/j.braindev.2015.10.016 |
| [7] |
刘玥, 阴捷, 彭芸, 等. 56例儿童甲基丙二酸血症的脑改变影像学特点[J]. 医学影像学杂志, 2013, 23(2): 165-169. DOI:10.3969/j.issn.1006-9011.2013.02.001 |
| [8] |
BAUMGARTNER M R, HORSTER F, DIONISI-VICI C, et al. Proposed guidelines for the diagnosis and management of methylmalonic and propionic academia[J]. Orphanet J Rare Dis, 2014, 9(1): 130. |
| [9] |
WOODWARD L J, ANDERSON P J, AUSTIN N C, et al. Neonatal MRI to predict neurodevelopmental outcomes in preterm infants[J]. N Engl J Med, 2006, 355(7): 685-694. DOI:10.1056/NEJMoa053792 |
| [10] |
MAUNU J, LEHTONEN L, LAPINLEIMU H, et al. Ventricular dilatation in relation to outcome at 2 years of age in very preterm infants: a prospective Finnish cohort study[J]. Dev Med Child Neurol, 2011, 53(1): 48-54. DOI:10.1111/j.1469-8749.2010.03785.x |
| [11] |
BENACERRAF B R, SHIPP T D, BROMLEY B, et al. What does magnetic resonance imaging add to the prenatal sonographic diagnosis of ventriculomegaly?[J]. J Ultrasound Med, 2007, 26(11): 1513-1522. DOI:10.7863/jum.2007.26.11.1513 |
| [12] |
HAN L S, HUANG Z, HAN F, et al. Clinical features and MUT gene mutation spectrum in 43 Chinese patients with isolated methylmalonic acidemia: identification of 10 novel allelic variants[J]. World J Pediatr, 2015, 11(4): 358-365. DOI:10.1007/s12519-015-0043-1 |
| [13] |
毕志超. 甲基丙二酸血症伴高同型半胱氨酸血症的临床表型和基因型特点分析[D]. 济南: 山东大学, 2016.
|
| [14] |
程爱兰, 初曙光, 曹雯君. 常见有机酸血症患者的脑磁共振表现及临床特点分析[J]. 医学影像学杂志, 2020, 30(10): 1775-1780. |
| [15] |
GROPMAN A L, SUMMAR M, LEONARD J V. Neurological implications of urea cycle disorders[J]. J Inherit Metab Dis, 2007, 30(6): 865-879. DOI:10.1007/s10545-007-0709-5 |
| [16] |
ZHOU X, CUI Y, HAN J. Methylmalonic academia: current status and research priorities[J]. Intractable Rare Dis Res, 2018, 7(2): 73-78. DOI:10.5582/irdr.2018.01026 |
| [17] |
郭斌, 杨林峰, 曹维金, 等. 甲基丙二酸血症的神经影像学研究进展[J]. 医学影像学杂志, 2019, 29(9): 1575-1577. |
| [18] |
陈萧群, 周熙惠, 雷玲霞. cblC型甲基丙二酸血症合并同型半胱氨酸血症临床资料分析[J]. 中国妇幼健康研究, 2017, 28(9): 1133-1136. DOI:10.3969/j.issn.1673-5293.2017.09.031 |
| [19] |
WEISFELD-ADAMS J D, BENDER H A, MILEY-AKERSTEDT A, et al. Neurologic and neurodevelopmental phenotypes in young children with early treated combined methylmalonic acidemia and homocystinuria, cobalamin C type[J]. Mol Genet Metab, 2013, 110(3): 241-247. DOI:10.1016/j.ymgme.2013.07.018 |
| [20] |
裴晓蕊, 马敬红. 11例晚发型甲基丙二酸血症的临床分析[J]. 中风与神经疾病杂志, 2019, 36(4): 342-343. |
| [21] |
KRASNOSHCHEKOVA E I, ZYKIN P A, TKACHENKO L A, et al. Age-specific dynamics of corpus callosum development in children and its peculiarities in infantile cerebral palsy[J]. Bull Exp Biol Med, 2016, 161(6): 853-857. DOI:10.1007/s10517-016-3528-6 |
 2021, Vol. 19
2021, Vol. 19


