| 超声引导在兔膝关节出血模型建立中的应用 |
2. 山东中医药大学第一临床医学院,山东 济南 250014
关节出血,又称关节血症,是多种疾病重要的临床表现,如关节内骨折、血友病、关节炎、色素沉着绒毛结节性滑膜炎等[1],也是导致关节炎的具体病理因素之一,其与一系列的物理(负荷与运动)和化学(各种细胞因子与酶等)过程相关[2],故建立恰当的关节出血模型对于相关基础或临床研究具有重要价值。本研究设计应用超声引导下关节腔注射含有肝素的兔心脏血建立兔膝关节出血模型,旨在为今后研究膝关节病变提供切实可行且有效的动物模型,现报道如下。
1 材料与方法 1.1 实验动物健康级别成年新西兰大白兔8只,3月龄,性别不限,体质量2.0~2.5 kg,平均(2.29±0.15) kg,由济南西岭角养殖繁育中心提供,实验动物许可证号:SCXK(鲁)20150001。在湿度45%、室温25 ℃的屏障级实验室饲养,自由饮水,标准饮食。动物饲养及实验均在山东大学齐鲁医院实验动物室完成。
1.2 方法 1.2.1 兔心脏血的配制取兔称重后用木制兔盒将其固定,经耳缘静脉缓慢注射10%水合氯醛(3 mL/kg体质量),流率2~3 mL/min,待达到有效麻醉状态停止注射;注射过程中注意观察睫毛、角膜反射和呼吸频率;麻醉成功后,将其仰卧固定于手术台,胸部备皮后予皮肤消毒剂安尔碘消毒,采用含1 mL肝素的10 mL注射器于兔心脏取血液10 mL,备用。
1.2.2 关节出血模型的制备方法启动Terason t3000超声诊断仪,探头频率12 MHz,选用骨骼、肌肉低速血流条件,脉冲多普勒取样容积为1 mm。取兔膝关节伸直位,超声探头延长轴在膝关节内外滑动时,探查髌上囊部位,确定髌上囊后,在探头边缘外侧进行皮肤消毒,带无菌手套,采取平面内进针技术,由外向内,将穿刺针置入膝关节腔内,再次超声确定后,注入上述10 mL含肝素兔心脏血液,每3 d注射1次,2周后对模型进行指标检测及评价。分别于第1、4、7天对全部动物左膝注射兔心脏血,注射后即刻行超声检查,所有兔髌上囊均出现液性暗区。第10、14天不进行关节注射,仅行超声检查。
1.2.3 分组与造模动物适应性喂养1周后,采用自身对照,共8只。其中左膝关节按照上述步骤进行关节出血模型制备;右膝关节采用同样方式注射等量的注射用生理盐水;未设空白对照组。
1.3 模型评价观察动物基本情况、死亡数量。观察并记录2组动物患肢的局部情况、体温、体质量变化,以及动物活动及摄食饮水情况等。将全部动物处死,取材,取双膝关节置于10%甲醛溶液中固定48 h,冲洗后置复合脱钙液中脱钙24 h,脱水、石蜡包埋切片(纵切厚度5 μm),HE染色,光镜下观察新骨形成及骨缺损处血管化情况。
1.4 统计学方法采用SPSS 19.0统计软件进行数据处理,计量资料以x±s表示,组间数据比较采用配对样本t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 一般情况评价全部动物均未死亡,造模后兔下肢膝关节可见不同程度的软组织肿胀,跛行、活动较前明显迟缓,但未出现食欲减退、小便清长、大便稀溏等不良症状和感染等严重并发症。
兔体温和体质量检查结果见图 1,2。在造模过程中体温较前未见明显差异(P>0.05),但体质量较前有所增加(P < 0.05)。
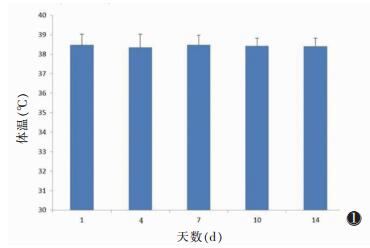 |
| 图 1 实验动物体温变化情况 |
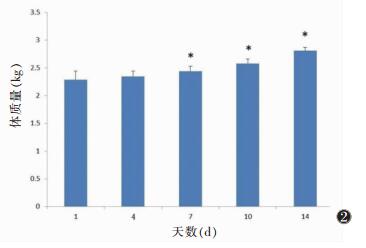 |
| 图 2 实验动物体质量变化情况,与第1天比较,*P < 0.05 |
2.2 超声检查结果
兔髌上囊可见液性暗区(图 3);3 d后,兔髌上囊液性暗区消失或明显缩小(图 4)。
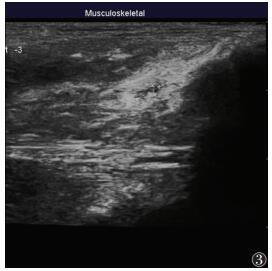 |
| 图 3 关节注射后兔髌上囊声像图,可见液性暗区 |
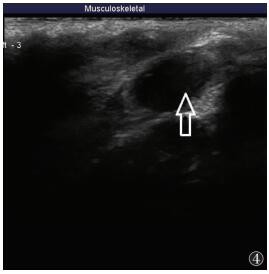 |
| 图 4 关节注射3 d后兔髌上囊声像图,液性暗区明显缩小(箭头) |
动物第1次注射兔心脏血或生理盐水后可见膝关节髌上囊充盈,超声探查示髌上囊5~9 mm深的液性暗区;第4天第2次注射前膝关节无明显肿胀,超声探查示髌上囊未见明显液性暗区;第7天第3次注射前膝关节无明显肿胀,超声探查示1只兔左膝可见深1.4 mm液性暗区,1只兔右膝可见深1.2 mm液性暗区;第10天超声探查示2只兔左膝可见深1.6 mm、1.8 mm液性暗区,1只兔右膝见深1.6 mm液性暗区,余兔膝关节髌上囊未见液性暗区;第14天超声探查,全部兔膝关节髌上囊均未见液性暗区。
2.3 病理学检查结果滑膜组织切片HE染色结果见图 5~7。光镜下观察,右侧膝关节未见滑膜组织。左侧膝关节滑膜局灶性轻度增生;血管扩张,血管周围浆细胞、肥大细胞、嗜酸性粒细胞及单核样巨细胞灶性浸润;间质内小淋巴细胞、浆细胞、嗜酸性粒细胞弥漫性浸润并伴含铁血黄素沉积[(5~15)/40 HPF],淋巴滤泡形成。
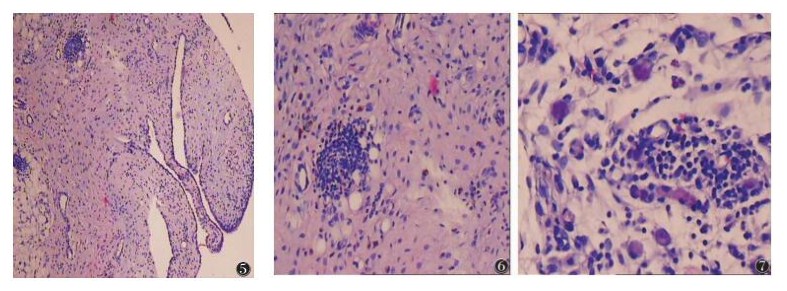 |
| 图 5~7 分别为HE×10、HE×20滑膜组织切片图像 |
3 讨论
关节出血可导致关节腔的物理容积增加而出现关节囊扩张,关节囊内压力增高使毛细血管和淋巴管回流受阻、关节肿胀,还可引起关节腔内的炎性细胞的应答,并产生多种细胞因子。研究[3]表明,A型滑膜细胞和巨噬细胞约1周可对新鲜出血进行清除,同时,红细胞中的铁(即含铁血黄素)也沉积在滑膜中,而含铁血黄素可进一步加重滑膜增生及滑膜内毛细血管增生,最终形成出血—炎症—更易出血的恶性循环。另外,增生滑膜内炎性细胞产生的酶和多种细胞因子可造成或加重关节软骨的破坏,加重骨的病变,甚至导致关节强直、变形,严重影响关节功能。关节腔内出血可造成软骨细胞凋亡,其发生甚至早于滑膜炎症[4-9]。高频超声可显示关节腔内滑膜病变情况,如滑膜增生、关节积液及软骨损伤等[10],有利于动态观察和评价关节软组织的改变。
本研究采用超声引导下关节注射建立兔膝关节出血模型。人类的膝关节较表浅且解剖结构易于触摸,盲法穿刺易实施。然而在兔膝关节中,由于关节液相对较少,几乎无法抽到关节液,若仅依靠穿刺进针时的突破感和注射器推注阻力大小来判断,将影响模型的顺利建立,也难以保证其重复性[11-12]。本研究在超声引导下于膝关节伸直位从髌骨外侧缘进针,成功率100%,并运用超声进行注射后再评估,使用超声观察注射的液体量并留存图像,便于后期更直观地观察和对比积液的吸收程度及周围软组织的改变,还可观察、评价滑膜增生程度和滑膜内毛细血管增生情况[13]。
本实验在讨论兔膝关节注射量时考虑兔关节腔小,单次注射量不易过多,所以选定注射10 mL观察实验效果。从实验中3次注射后超声下观察可见,75%的兔关节液性暗区消失较快,考虑与兔代谢较快、吸收能力强有关。本实验未能在兔膝关节髌上囊内造成持续性积液,后期将设计多个注射间隔,并考虑增加注射量以观察其对结果的影响。
本研究病理切片染色显示,兔心脏血注射侧兔病理组织形态学变化存在滑膜局灶性轻度增生且含铁血黄素沉积,而生理盐水注射侧未见明显滑膜增生,说明本方法造成关节出血模型是切实可行的。另外,本研究旨在建立有效的关节出血动物模型,观察关节滑膜的病理改变,故仅设计注入等量兔心脏血与生理盐水进行对比观察,未设立空白对照。
目前临床上对关节出血性疾病的诊断主要依靠MRI检查[14]、关节液穿刺培养检查及术中取病灶组织行组织病理学检查,缺乏对其发病机制、病因和治疗效果相关指标的评价,因此,建立切实可行且稳定性好的关节出血动物模型至关重要。本实验通过超声引导下兔心脏血关节注射进行关节出血动物模型的研究,并于超声下观察注射及吸收情况、滑膜增生情况,完善模型验证指标,具有较好的重复性,特别是使用高频超声动态、对比观察,可为今后关节出血类疾病的病理改变、实验干预及后期疗效评价提供参考。
| [1] |
薛必永, 吴志刚. CT与MRI应用于色素沉着绒毛结节性滑膜炎的诊断价值比较[J]. 中国乡村医药, 2014, 21(20): 55-56. DOI:10.3969/j.issn.1006-5180.2014.20.029 |
| [2] |
方拥军, 洪恺. 关节出血对血友病关节的影响[J]. 中国实用儿科杂志, 2017, 32(1): 70-75. |
| [3] |
张学增, 张育. A型滑膜细胞与类风湿关节炎血管新生[J]. 国际内科学杂志, 2008, 35(11): 680-682. |
| [4] |
Raffini L, Manno C. Modern management of haemophilic arthropathy[J]. Br J Haematol, 2007, 136: 777-787. DOI:10.1111/bjh.2007.136.issue-6 |
| [5] |
Letizia G, Piccione F, Ridola C, et al. Ultrastructural appearance of human synovial membrane in the reabsorption phase of acute haemarthrosis[J]. Ital J Orthop Traumatol, 1980, 6: 275-277. |
| [6] |
Roosendaal G, Lafeber FP. Pathogenesis of haemophilic arthropathy[J]. Haemophilia, 2006, 12: 117-121. DOI:10.1111/hae.2006.12.issue-s3 |
| [7] |
Valentino LA, Hakobyan N, Rodriguez N, et al. Pathogenesis of haemophilic synovitis:experimental studies on blood-induced joint damage[J]. Haemophilia, 2007, 13: 10-13. |
| [8] |
Lafeber FP, Miossec P, Valentino LA. Physiopathology of haemophilic arthropathy[J]. Haemophilia, 2008, 14: 3-9. |
| [9] |
Ng WH, Chu WC, Shing MK, et al. Role of imaging in management of hemophilic patients[J]. AJR Am J Roentgenol, 2005, 184: 1619-1623. DOI:10.2214/ajr.184.5.01841619 |
| [10] |
马玉峰, 祁印泽, 贺立娟, 等. 膝骨性关节炎肌骨超声滑膜病变与Lysholm评分的相关性分析[J]. 中国中医骨伤科杂志, 2016, 24(11): 19-23. |
| [11] |
McGarry JG, Daruwalla ZJ. The efficacy, accuracy and complications of corticosteroid injections of the knee joint[J]. Knee Surg Sports Traumatol Arthrosc, 2011, 19: 1649-1654. DOI:10.1007/s00167-010-1380-1 |
| [12] |
Jones A, Regan M, Ledingham J, et al. Importance of placement of intra-articular steroid injections[J]. BMJ, 1993, 307: 1329-30. DOI:10.1136/bmj.307.6915.1329 |
| [13] |
莫杨帆, 刘翔, 洪海潮. 透明质酸钠治疗后膝骨性关节炎滑膜病理改变[J]. 实用临床医学, 2013, 14(5): 42-43. DOI:10.3969/j.issn.1009-8194.2013.05.017 |
| [14] |
李美霞, 葛英辉, 张玉霞, 等. 血友病性关节病的MRI表现及其与出血和病程的相关性[J]. 中国医学影像学杂志, 2012, 20(11): 819-822. |
 2018, Vol. 16
2018, Vol. 16


