| 耳甲电针治疗轻度认知障碍脑机制静息态fMRI研究的试验方案 |
2. 中国中医科学院针灸研究所,北京 100700
轻度认知障碍(mild cognitive impairment,MCI)是一种介于正常衰老与痴呆之间的状态。2021年,WHO发布的《公共卫生领域应对痴呆症全球状态报告》显示,2019年全球约5 500万痴呆患者,预计到2050年,将达1.39亿,其中主要为阿尔茨海默病患者[1]。MCI是阿尔茨海默病的临床前或前驱阶段[2],治疗MCI对延缓其向阿尔茨海默病进展非常必要,特别是对中、低收入国家获益更大[3]。但目前尚无明确证据支持MCI的药物治疗,胆碱酯酶抑制剂、维生素E等药物不推荐用于治疗MCI[4]。越来越多证据表明,非药物治疗方法可能对改善认知功能有作用[5-7]。但目前耳甲电针[经皮耳迷走神经刺激术(transcutaneous auricular vagus nerve stimulation,taVNS)]用于认知调节的研究较少且治疗机制不明。因此,本研究旨在设计一个试验方案,探究taVNS治疗MCI的机制。
1 试验设计 1.1 病例收集从首都医科大学宣武医院神经内科,中国中医科学院广安门医院老年门诊、针灸科门诊,以及北京慈爱嘉养老服务有限公司负责管理的50家社区居家养老服务中心招募40例MCI患者。基线评估后,独立统计学家使用SAS 9.4产生随机数,将患者随机分配为2组,即taVNS组和假taVNS组各20例。治疗将根据招募顺序使用密封信封分配。同时招募20例性别、年龄、受教育程度与MCI患者相匹配的健康志愿者为对照组。本研究为taVNS治疗MCI机制的探索性研究,根据脑功能成像既往研究经验[8]和《针灸影像学》[9]的建议,临床样本量每组20例可达到统计学分析的要求。因此,本研究3组均排除头动过大、本人自愿退出等不可预知因素导致剔除者,观察24周。
1.2 MCI诊断标准根据Jak/Bondi(2014)标准[10],满足以下条件之一即可诊断MCI:①至少同一个认知域(记忆、语言、执行功能)中的2个神经心理检查测试损害程度均大于1.0 SD(经年龄校正的常模);②每一个认知域(记忆、语言、执行功能)中有1个神经心理检查测试损害程度均大于1.0 SD(经年龄校正的常模);③功能活动问卷评分为9分,即至少独立完成3项及以上的日常活动能力受损。
1.3 患者纳入与排除标准纳入标准:①符合MCI诊断标准;②年龄65~85岁;③汉族,右利手;④同意签署知情同意书。排除标准:①各种痴呆(阿尔茨海默病、路易体痴呆、额颞叶痴呆等);②神经系统疾病,如脑血管病、脑炎、脑肿瘤、脑外伤、癫痫、帕金森病等其他导致认知功能下降的神经系统疾病;③代谢性疾病,如贫血、甲状腺功能异常、叶酸及维生素B12缺乏等导致认知功能下降的代谢性疾病;④严重的精神疾病,如重度抑郁等;⑤一氧化碳中毒病史;⑥全身麻醉病史;⑦患有急性或严重威胁生命的疾病;⑧严重的视力、听力或语言问题无法完成神经心理评估;⑨服用精神类药物或药物滥用;⑩有MRI检查禁忌证(安装心脏起搏器、金属关节、幽闭恐惧症等)。
1.4 对照组纳入与排除标准纳入标准:①年龄65~85岁,汉族,右利手,无认知缺陷,符合正常老龄化的标准;②身体健康,无任何明显的神经、精神或医学疾病,特别是脑血管性中风、血管性痴呆、抑郁症或亚临床甲状腺功能减退症;③无药物滥用;④同意签署知情同意书。排除标准:①神经、精神或其他医学疾病及其家族史;②有MRI检查禁忌证;③过敏体质。
1.5 干预措施taVNS组与假taVNS组均行耳迷走神经刺激术,采用电子针疗仪(华佗牌,SDZ-ⅡB型,苏州医疗用品厂有限公司)。taVNS组刺激部位为双侧耳甲部(图 1),早晚各1次,每次30 min,每周5 d,持续24周;使用疏密波,20 Hz/4 Hz,强度以患者无不适为宜,基于本团队前期研究经验刺激强度设置为4~6 mA。假taVNS组刺激部位为双侧上耳舟及耳轮下行中段(图 1),方法和参数同前。对照组不予干预。
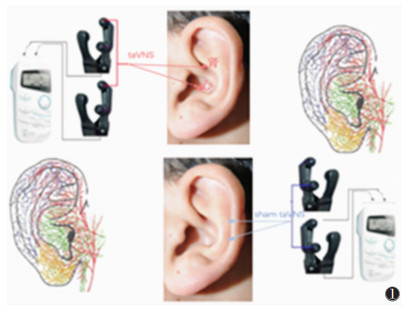 |
| 图 1 耳甲电针(taVNS)组的刺激部位为双侧耳甲部(红箭),假taVNS组的刺激部位为双侧上耳舟及耳轮下行中段(蓝箭) |
1.6 观测指标及疗效判定
taVNS组和假taVNS组在入组(第0周)和出组(第24周)时进行蒙特利尔认知评估量表基础版(Montreal cognitive assessment-basic,MoCA-B)、华山版听觉词语学习测验(auditory verbal learning test-huashan version,AVLT-H)、形状连线测验A和B(shape trails test A&B,ATT A&B)、动物词语流畅性(animal fluency test,AFT)及波士顿命名测试(Boston naming test,BNT)评估。
1.7 静息态fMRI扫描采用Siemens 3.0 T Skyra MRI扫描仪,标准20通道头部线圈。所有受试者在入组(第0周)和出组(第24周)时均行常规平扫T1WI与静息态BOLD成像。治疗前后2次扫描序列相同。扫描参数:①T1WI,TE 2.98 ms,TR 2 530 ms,视野256 mm×256 mm,翻转角7°,层厚1 mm,48层,用时6 min 3 s,体素大小1.0 mm×1.0 mm×1.0 mm。②静息态fMRI扫描,采用EPI序列,全脑平行于AC-PC线行轴位扫描,TE 30 ms,TR 2 000 ms,视野224 mm×224 mm,翻转角90°,层厚3.5 mm,32层,用时6 min 46 s,前6 s空扫,体素大小3.5 mm×3.5 mm×3.5 mm。
1.8 统计学分析 1.8.1 临床数据分析采用SPSS 23.0统计软件,对taVNS组、假taVNS组治疗前后的临床量表评分差值行统计学分析,比较各指标的组间、组内疗效差异。采用双侧检验,以P≤0.05为差异有统计意义。计量资料组间比较行t检验,不符合正态分布时,采用Wilcoxon秩和检验。组内治疗前后比较采用配对t检验,不符合正态分布时,行Wilcoxon符号秩和检验。计数资料采用χ2检验、校正χ2检验、Fisher精确检验等进行组间比较。等级资料组间比较采用Wilcoxon秩和检验,组内前后比较采用Wilcoxon符号秩和检验。
1.8.2 fMRI数据预处理方法fMRI数据预处理使用DPABI软件。步骤如下:去除前10个时间点、层面时间差校正、头动校正、空间标准化到蒙特利尔神经病学研究所(MNI)标准空间、用高斯核函数半高全宽6 mm进行空间平滑、带通滤波(0.01~0.08 Hz)、去线性漂移、回归无关信号(包括全脑信号、白质和脑脊液的时间序列和6个仿射运动参数)。过度头动的排除标准:任何方向平移 > 2.0 mm或旋转 > 2.0°者。
1.8.3 fMRI数据分析方法功能连接:利用DPABI预处理功能数据时,行基于体素的全脑相关分析方法。重点研究前岛叶、楔前叶、背外侧前额叶等关键脑区。观察脑功能区分布及脑功能连接的异常部位、MCI患者与正常人间脑功能连接的差异及其治疗前后脑功能连接的变化。
2 预期结果治疗前(0周),与对照组相比,taVNS组与假taVNS组静息态脑功能有异常。治疗后(24周),与假taVNS组和对照组相比,taVNS组前岛叶-楔前叶-背外侧前额叶环路发生显著改变,且此改变与认知量表MoCA-B、AVLT-H、ATT A&B、AFT及BNT相关。
3 讨论随着全球人口老龄化加快,老年痴呆的患病率逐年增加,由于该病中晚期治疗效果不佳,MCI为正常老化与痴呆之间的过渡阶段,已成为人们关注的焦点。Rong等[11-12]先后在难治性癫痫和抑郁症的临床研究中发现,taVNS在改善症状的同时,也能改善伴随的认知障碍。目前尚未发现有关taVNS治疗MCI的临床随机对照试验的报道。因此,在设计试验时,笔者立足试验方案设计的“PICOS”原则,参照既往阿尔茨海默病和MCI的非药物治疗临床随机对照试验[13-15],充分借鉴随机双盲设计的循证方法,设计了taVNS治疗MCI机制研究的随机双盲平行对照试验方案,以期获得高质量的循证医学小样本证据。本研究方案遵循随机、对照和重复的三原则,消除医师和患者对干预措施及疗效的主观影响,进行相对客观的评价,分别从确定研究对象和诊断标准、制订干预方案、选择对照措施等方面,深入思考taVNS治疗MCI临床试验在设计时的关键问题,使试验方案更加精确合理。
本研究通过对受试者的静息态fMRI扫描,阐明taVNS组患者静息态脑功能的部分异常,初步探索taVNS组患者前岛叶-楔前叶-背外侧前额叶环路发生显著改变假说的相关机制,使用临床量表评价taVNS治疗MCI的临床疗效,为taVNS防治MCI、改善认知功能的临床应用及推广提供科学依据。
[Trial registration] ChiCTR2100049940
| [1] |
World Health Organization. Global status report on the public health response to dementia[EB/OL]. 2021-09-01[2021-09-18]. https://apps.who.int/iris/bitstream/handle/10665/344701/9789240033245-eng.pdf.
|
| [2] |
ALBERT M S, DEKOSKY S T, DICKSON D, et al. The diagnosis of mild cognitive impairment due to Alzheimer's disease: recommendations from the National Institute on Aging-Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease[J]. Alzheimers Dement, 2011, 7(3): 270-279. DOI:10.1016/j.jalz.2011.03.008 |
| [3] |
LIVINGSTON G, HUNTLEY J, SOMMERLAD A, et al. Dementia prevention, intervention, and care: 2020 report of the Lancet Commission[J]. Lancet, 2020, 396(10248): 413-446. |
| [4] |
PETERSEN R C, LOPEZ O, ARMSTRONG M J, et al. Practice guideline update summary: mild cognitive impairment. Report of the Guideline Development, Dissemination, and Implementation Subcommittee of the American Academy of Neurology[J]. Neurology, 2018, 90(3): 126-135. DOI:10.1212/WNL.0000000000004826 |
| [5] |
KARSSEMEIJER E G A, AARONSON J A, BOSSERS W J, et al. Positive effects of combined cognitive and physical exercise training on cognitive function in older adults with mild cognitive impairment or dementia: a meta-analysis[J]. Ageing Research Reviews, 2017, 40(2017): 75-83. |
| [6] |
MCGRATTAN A M, MCEVOY C T, MCGUINNESS B, et al. Effect of dietary interventions in mild cognitive impairment: a systematic review[J]. Br J Nutr, 2018, 120(12): 1388-1405. DOI:10.1017/S0007114518002945 |
| [7] |
XIE Y, LI Y, NIE L, et al. Cognitive enhancement of repetitive transcranial magnetic stimulation in patients with mild cognitive impairment and early Alzheimer's Disease: a systematic review and meta-analysis[J]. Front Cell Dev Biol, 2021, 9(10): 734046. |
| [8] |
DESMOND J E, GLOVER G H. Estimating sample size in functional MRI (fMRI) neuroimaging studies: statistical power analyses[J]. J Neurosci Methods, 2002, 118(2): 115-128. DOI:10.1016/S0165-0270(02)00121-8 |
| [9] |
许能贵, 方继良. 针灸影像学[M]. 北京: 人民卫生出版社, 2018.
|
| [10] |
BONDI M W, EDMONDS E C, JAK A J, et al. Neuropsychological criteria for mild cognitive impairment improves diagnostic precision, biomarker associations, and progression rates[J]. J Alzheimers Dis, 2014, 42(1): 275-289. DOI:10.3233/JAD-140276 |
| [11] |
RONG P, LIU A, ZHANG J, et al. Transcutaneous vagus nerve stimulation for refractory epilepsy: a randomized controlled trial [J/OL]. Clinical Science (London, England: 1979), 2014. 2021-09-01[2021-09-18]. https://doi.org/10.1042/CS20130518.
|
| [12] |
RONG P, LIU J, WANG L, et al. Effect of transcutaneous auricular vagus nerve stimulation on major depressive disorder: a nonrandomized controlled pilot study[J]. J Affect Disord, 2016, 195: 172-179. DOI:10.1016/j.jad.2016.02.031 |
| [13] |
SOLE-PADULLES C, BARTRES-FAZ D, JUNQUE C, et al. Repetitive transcranial magnetic stimulation effects on brain function and cognition among elders with memory dysfunction. a randomized sham-controlled study[J]. Cerebral Cortex, 2006, 16(10): 1487-1493. DOI:10.1093/cercor/bhj083 |
| [14] |
WU Y, XU W, LIU X, et al. Adjunctive treatment with high frequency repetitive transcranial magnetic stimulation for the behavioral and psychological symptoms of patients with Alzheimer's disease: a randomized, double-blind, sham-controlled study[J]. Shanghai Arch Psychiatry, 2015, 27(5): 9. |
| [15] |
PARK H, PARK J H, NA H R, et al. Combined intervention of physical activity, aerobic exercise, and cognitive exercise intervention to prevent cognitive decline for patients with mild cognitive impairment: a randomized controlled clinical study[J]. J Clin Med, 2019, 8(7): 940. |
 2022, Vol. 20
2022, Vol. 20


