| DTI评价肛瘘活动性的可行性研究 |
1b. 山东中医药大学附属医院肛肠科,山东 济南 250011;
2. 山东省医学影像学研究所,山东 济南 250021
肛瘘是肛肠外科常见病,其临床发病率实际高于文献[1]报道。准确评估肛瘘的活动性是治疗成功与否的一个重要因素[2]。MRI既对肛周疾病患者的原发瘘管和脓肿形成的检测非常准确[3],又可评估肛瘘的活动性,这是决定治疗方案的重要因素[4-5]。较多文献[6-10]报道了DWI对肛瘘和肛周脓肿等疾病的诊断和鉴别诊断作用,也论述了DWI评价肛瘘活动性的价值。但尚无文献报道DTI在评价肛瘘活动性方面的应用。本研究回顾性分析肛瘘的影像学特点,探讨DTI在评价肛瘘活动性方面的价值。
1 资料与方法 1.1 一般资料选取2016年7月至2017年7月山东中医药大学附属医院临床确诊的肛瘘34例,其中男29例,女5例;年龄18~60岁,平均39.6岁。临床表现为肛周肿胀、发热或疼痛,肛门附近有瘘口,有时可见脓性分泌物,持续时间10 d~4个月。所有患者均于术前1周内行MRI检查,并经手术和病理证实为肛瘘。排除标准:①合并其他肛周疾病,如直肠肿瘤;②既往有保守治疗史或手术治疗史;③有心脏起搏器植入史或其他MRI扫描禁忌证。34例均在检查前签署知情同意书,本研究经医院伦理委员会同意。
1.2 分组标准根据术前检查及手术要求,将患者分为活动性炎症(positive inflammation activity,PIA)组和非活动性炎症(negative inflammation activity,NIA)组。标准如下:①PIA,若肛周见瘘管外口时开时闭,有排脓,局部皮肤红肿热痛,血清C-反应蛋白(C-reactive protein,CRP)水平≥5 mg/L。临床检查见瘘口开放,可扪及皮下纤维索条;术中证实有脓液,则属于活动期。②NIA,若肛周见闭合的瘘管外口,局部无明显自觉症状或仅有轻微不适,CRP水平 < 5 mg/L。临床检查皮下可扪及硬结,术中未发现脓液,则属于非活动期。
1.3 仪器与方法所有患者均于术前行MRI常规序列和DTI序列扫描。采用Philips 3.0 T MRI扫描仪(Intera,Philips Medical Systems,Best,the Netherlands),体部线圈。患者于检查前空腹6 h以减轻肠蠕动伪影,检查前30 min排空膀胱使膀胱处于半充盈状态。患者取仰卧位,头先进,以耻骨联合为中心定位,双腿放松。扫描序列:横轴位快速自旋回波(TSE)T1WI:TR 600 ms,TE 10 ms,层厚5 mm,20层;横轴位快速自旋回波(TSE)T2WI和脂肪抑制T2WI TR 1 560 ms,TE 80 ms,层厚5 mm,20层;矢状位脂肪抑制T2WI FOV 152 mm×179 mm,层厚5 mm,20层。DTI采用横轴位单次激发的SE-EPI序列:TR 3 250 ms,TE 48 ms,32个弥散方向,b值取0、600 s/mm2,层厚5 mm,20层,扫描时间5 min 47 s。
1.4 图像后处理和测量图像传输至影像工作站,由2位经验丰富的腹部MRI诊断医师在不知道手术结果的前提下进行双盲法阅片,意见分歧则讨论解决。DTI数据由后处理软件处理得到各向异性分数(FA)图和ADC图,选择患者病变主瘘管进行测量,先在DTI(b=0 s/mm2)图像上的病变中心手动划出ROI,面积均>10 mm2,后将ROI复制到同层面的FA图和ADC图上,即得到病变的FA值和ADC值,测量3次取平均值。
1.5 统计学分析采用医学统计软件包MedCalc 15.6进行数据分析。所有的FA、ADC值均以x±s表示。采用独立样本t检验对各组的DTI值进行统计,以P < 0.05为差异有统计学意义。采用ROC曲线分析DTI参数评价肛瘘活动性的诊断效能。
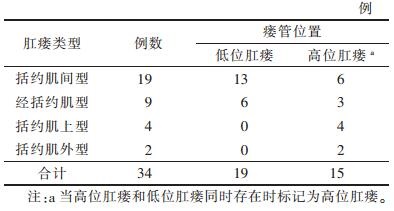
2 结果 2.1 肛瘘的一般情况和MRI表现34例按Parks系统[11]进行分类,见表 1。瘘管T1WI呈略低信号,T2WI呈高信号,FS T2WI及DTI高信号,FA图及ADC图为低信号。
| 表 1 根据Parks系统对肛瘘进行分类 |
 |
2.2 2组DTI参数值比较
PIA组的FA值为0.134±0.046,ADC值为(0.979±0.441)×10-3 mm2/s;NIA组的FA值为0.183±0.057,ADC值为(1.393±0.256)×10-3 mm2/s。PIA组FA、ADC值均低于NIA组(P=0.009,0.004)。
2.3 ROC曲线分析FA值、ADC值对肛瘘活动性的判断价值为获得FA值、ADC值对肛瘘活动性鉴别诊断的临界值,行ROC分析,同时测定敏感度和特异度。FA值判断肛瘘活动性的ROC曲线下面积(AUC)为0.753(95% CI为0.575~0.884),差异有统计学意义(P=0.005 2),FA值的截断值为0.15,敏感度为69.23%,特异度为76.19%,Youden指数为0.454 2;ADC值的AUC为0.751(95%CI为0.573~0.883),差异有统计学意义(P=0.002 8),ADC值的截断值为1.069×10-3 mm2/s,敏感度为100.00%,特异度为57.14%,Youden指数为0.571 4(图 1,2)。
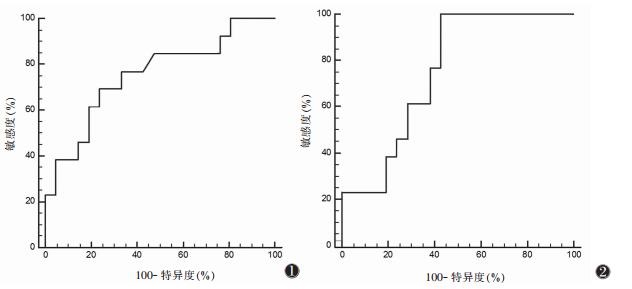 |
| 图 1 基于各向异性分数(FA)值的ROC曲线对肛瘘活动性的评价,ROC曲线下面积约0.753 图 2 基于ADC值的ROC曲线对肛瘘活动性的评价,ROC曲线下面积约0.751 |
3 讨论
DTI是一个在DWI基础上的功能成像序列,原本主要应用于中枢神经系统[12-13],显示白质纤维束的病理和生理学变化。目前,DTI序列越来越多地应用于除中枢神经系统之外的结构,如肾小管[14-15]和肌肉组织[16-17]。此外,还有DTI在正常女性盆底结构[18-19]和盆底功能障碍[20]方面的应用研究。本研究对DTI在肛瘘的活动性方面的应用进行了尝试性研究。
DTI可表示人体中水分子随机布朗运动的程度和方向,常用的指标是FA值和ADC值。FA值反映水分子的运动方向,从0到1不等。0反映了水的扩散是各向同性的,即在各个方向上扩散幅度均相同,越接近1,代表水分子在不同方向上的扩散异性越强。由于不同组织的微观结构不同,水分子的扩散运动也不同,表现为扩散的各向异性,在结构排列规律的组织中尤为明显。肛周结构两侧对称,肛瘘破坏肛周肌肉结构时,水分子的扩散也发生变化,导致肛周结构紊乱、不规则,FA值下降。Zijta等[17]报道,正常的盆底肌肉的FA值范围为(0.23±0.02)~(0.30±0.04),肛瘘的FA值尚未见到报道,本研究中PIA组的FA值为0.134±0.046,NIA组为0.183±0.057,均低于正常结构。FA的减小意味着炎症细胞对局部结构的破坏程度。ADC值是组织中水分子不规则布朗运动的指标。ADC值越大,说明运动能力越强,单位时间内不规则运动的范围越大。肛瘘瘘管内是黏稠的脓液,含有大量炎性细胞、细菌、坏死组织和蛋白分泌物,高黏度和大量炎症细胞限制了水分子的扩散,导致ADC值降低。本研究中PIA组的ADC值为(0.979±0.441)×10-3 mm2/s,接近文献[4]报道的(0.908±0.171)×10-3 mm2/s;NIA组的ADC值为(1.393±0.256)×10-3 mm2/s,较文献[4]报道的(1.124±0.244)×10-3 mm2/s略高。由于不同病原菌感染产生不同浓度的炎性细胞和细菌,患者自身免疫反应和病程等均会影响肛瘘脓液的黏度、瘘管成分,在一定程度上改变了水分子扩散的相对稳定性;宏观分子黏度和细胞间隙减小等及其对周围结构的破坏作用,都是FA值和ADC值均较正常组织下降的原因。
本研究不足之处:①样本量相对较小;②男性患者多于女性,因为男性肛瘘发病率高于女性,但这是否影响研究结果也需大样本量验证。
综上所述,DTI参数可反映组织的定量信息,FA值和ADC值可作为肛肠外科医师评价肛瘘活动性的参考,对手术时机的选择有一定的指导意义。
| [1] |
Herand Abcarian. Anal Fistula:Principles and Management[M]. Springer New York, 2014: 103-106.
|
| [2] |
Keshaw H, Foong KS, Forbes A, et al. Perianal fistulae in Crohn's Disease:current and future approaches to treatment[J]. Inflamm Bowel Dis, 2010, 16: 870-880. DOI:10.1002/ibd.21137 |
| [3] |
Villa C, Pompili G, Franceschelli G, et al. Role of magnetic resonance imaging in evaluation of the activity of perianal Crohn's disease[J]. Eur J Radiol, 2012, 81: 616-622. DOI:10.1016/j.ejrad.2011.01.046 |
| [4] |
Yoshizako T, Wada A, Takahara T, et al. Diffusion-weighted MRI for evaluating perianal fistula activity:feasibility study[J]. Eur J Radiol, 2012, 81: 2049-2053. DOI:10.1016/j.ejrad.2011.06.052 |
| [5] |
Yoshizako T, Kitagaki H. A pictorial review of the impact of adding diffusion-weighted MR imaging to other MR sequences for assessment of anal fistulae[J]. Jpn J Radiol, 2013, 31: 371-376. DOI:10.1007/s11604-013-0204-x |
| [6] |
Guo AC, Provenzale JM, Cruz LC Jr, et al. Cerebral abscesses:investigation using apparent diffusion coefficient maps[J]. Neuroradiology, 2001, 43: 370-374. DOI:10.1007/s002340000519 |
| [7] |
Chan JH, Tsui EY, Luk SH, et al. Diffusion-weighted MR imaging of the liver:distinguishing hepatic abscess from cystic or necrotic tumor[J]. Abdom Imaging, 2001, 26: 161-165. DOI:10.1007/s002610000122 |
| [8] |
Hori M, Oto A, Orrin S, et al. Diffusion-weighted MRI:a new tool for the diagnosis of fistula in ano[J]. J Magn Reson Imaging, 2009, 30: 1021-1026. DOI:10.1002/jmri.v30:5 |
| [9] |
Dohan A, Eveno C, Oprea R, et al. Diffusion-weighted MR imaging for the diagnosis of abscess complicating fistula-in-ano:preliminary experience[J]. Eur Radiol, 2014, 24: 2906-2915. DOI:10.1007/s00330-014-3302-y |
| [10] |
Bakan S, Olgun DC, Kandemirli SG, et al. Perianal fistula with and without abscess:assessment of fistula activity using diffusi on-weighted magnetic resonance imaging[J]. Iran J Radiol, 2015, 12: 29084. |
| [11] |
Parks AG, Gordon PH, Hardcastle JD. A classification of fistula inano[J]. Br J Surg, 1976, 63: 1-12. DOI:10.1002/(ISSN)1365-2168 |
| [12] |
De Beler FE, Oot AR, Van Hecke W, et al. Diffusion tensor imaging provides an insight into the microstructre of meningio mas, high-grade gliomas, and peritumoral edema[J]. J Comput Assist Tomogr, 2012, 36: 577-582. DOI:10.1097/RCT.0b013e318261e913 |
| [13] |
Filippi M, Preziosa P, Rocca MA. Microstructural MR imaging techniques in multiple sclerosis[J]. Neuroimaging Clin N Am, 2017, 27: 313-333. DOI:10.1016/j.nic.2016.12.004 |
| [14] |
Ries M, Jones RA, Basseau F, et al. Diffusion Tensor MRI of the human kidney[J]. J Magn Reson Imaging, 2001, 14: 42-49. DOI:10.1002/(ISSN)1522-2586 |
| [15] |
Wang WJ, Pui MH, Guo Y, et al. 3T magnetic resonance diffu sion tensor imaging in chronic kidney disease[J]. Abdom Ima ging, 2014, 39: 770-775. DOI:10.1007/s00261-014-0116-y |
| [16] |
Steidle G, Schick F. Echoplanar diffusion tensor imaging of the lower leg musculature using eddy current nulled stimulated ec ho preparation[J]. Magn Reson Med, 2006, 55: 541-548. DOI:10.1002/(ISSN)1522-2594 |
| [17] |
顾青平. 3.0T磁共振扩散张量纤维束示踪在下肢正常肌肉及骨骼与软组织肿瘤诊断中的价值[D].济南: 山东大学, 2012.
|
| [18] |
Zijta FM, Froeling M, Van dPMP, et al. Feasibility of diffusion tensor imaging (DTI) with fibre tractography of the normal fe male pelvic floor[J]. Eur Radiol, 2011, 21: 1243-1249. DOI:10.1007/s00330-010-2044-8 |
| [19] |
蔡香然, 刘琼, 罗新, 等. 静动态MRI及DTI对盆腔器官脱垂患者肛提肌形态和功能的评估[J]. 临床放射学杂志, 2013, 32(8): 1128-1133. |
| [20] |
Zijta FM, Lakeman MM, Froeling M, et al. Evaluation of the fe male pelvic floor in pelvic organ prolapse using 3.0-Tesla diff usion tensor imaging and fibre tractography[J]. Eur Radiol, 2012, 22: 2806-2813. DOI:10.1007/s00330-012-2548-5 |
 2018, Vol. 16
2018, Vol. 16


