| 肺炎克雷伯菌肝脓肿的MRI表现 |
2. 吉林省长春市绿园区卫生监督所,吉林 长春 130062;
3. 内蒙古通辽市中医院肿瘤科,内蒙古 通辽 028000;
4. 吉林省肿瘤防治研究所,吉林 长春 130012
近年来,肺炎克雷伯菌已成为细菌性肝脓肿的主要病原菌[1],其引起的肝脓肿逐渐增多。高毒力型肺炎克雷伯菌导致肝脓肿耐药性高、侵袭性强[2],以及细菌培养存在易受时间、环境及抗生素影响等固有缺陷,因此在细菌培养结果阳性前即通过完备的临床及影像学资料对该病进行早期诊断尤为重要。既往的影像学研究大多集中于CT及彩色多普勒超声,但部分学者[3]认为,MRI在早期诊断该病方面较CT及超声更具优势。本研究拟对肺炎克雷伯菌肝脓肿的MRI表现进行分析、总结,以期为临床诊断提供可靠依据。
1 资料与方法 1.1 一般资料回顾性分析2015年8月至2018年10月在吉林省肿瘤医院就诊并经影像分析及细菌培养确诊的肺炎克雷伯菌肝脓肿患者30例,其中男22例,女8例;年龄28~60岁,平均45岁;既往有糖尿病史22例。纳入标准:①具有发热、寒颤、右上腹压痛等临床症状;②腹部MRI检查提示肝脓肿;③静脉血培养或肝脓肿穿刺脓液培养出肺炎克雷伯菌,并进一步经聚合酶链式反应实验证实;④临床资料及MRI资料完整。排除标准:①由其他病原菌引起的肝脓肿,如阿米巴肝脓肿、真菌性肝脓肿;②误诊为肝脓肿,经影像学、肝脏穿刺病理等检查确诊为其他疾病,如肝转移瘤等。
1.2 仪器与方法采用Philips 3.0 T超导型MRI扫描仪,16通道数字化腹部相控阵线圈。患者均行腹部MRI平扫、3期增强扫描及DWI检查。扫描范围从膈顶至肝下缘,必要时向上下延伸。MRI平扫包括轴位T1WI、轴位快速自旋回波T2WI;DWI为自旋平面回波成像序列,并行轴位扫描;矩阵96×128,TR/TE 4 200 ms/80 ms,层距2 mm,层厚6 mm,b值取0、800 s/mm2。动态增强扫描采用高分辨力压脂肝脏容积扫描成像(THRIVE)序列轴位及冠状位延迟扫描,矩阵256×256,翻转角为10°、TR/TE为5.43 ms/2.32 ms,屏气时间15~20 s;使用高压注射器以3.0 mL/s的流率,按0.1 mmol/kg体质量注射Gd-DTPA,后注入12~20 mL生理盐水冲洗,注射开始后16~20 s时行第1次扫描(动脉期),50~60 s行第2次扫描(门静脉期),90 s行平衡期扫描,3~4 min后行冠状位延迟扫描。
1.3 图像分析由2位有经验的放射科副主任医师分别行独立双盲法阅片,分析病灶的部位、大小、数目、分布、结构、性质及强化特点。
2 结果30例共发现病灶65个,其中高毒力型16例(53.3%);单发19例(63.3%),多发11例(36.7%);规则圆型或类圆型病灶45个(69.2%),不规则型病灶20个(30.8%);病灶最大径0.6~12.0 cm;分布在肝脏单叶26例(86.7%),双叶4例(13.3%);单房脓肿5例(16.7%),多房25例(83.3%);实性脓肿18例(60.0%),脓肿伴液化坏死12例(40.0%);薄壁脓肿(脓肿壁厚度≤2 mm)24例(80.0%),厚壁脓肿(脓肿壁厚度>2 mm)6例(20.0%)。
30例脓肿呈明显T1WI低信号,T2WI高信号,24例DWI呈高信号、ADC图呈低信号,6例DWI呈低信号、ADC图呈高信号(图 1,2)。
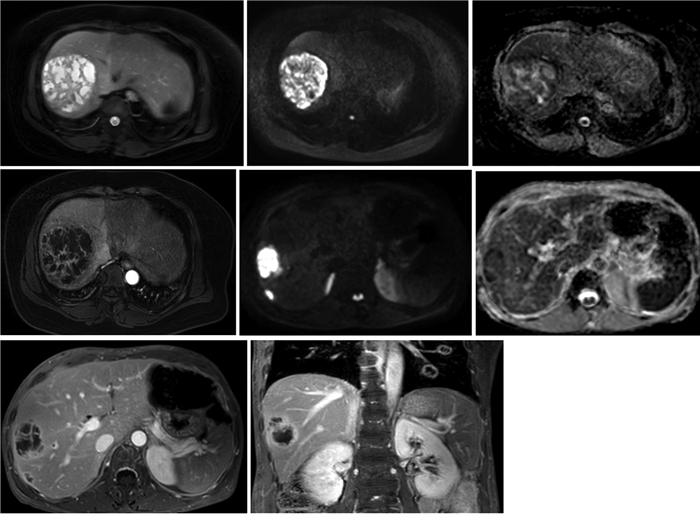 |
| 图 1 女,51岁,肝右叶单发肺炎克雷伯菌肝脓肿 图 1a T2WI压脂示病灶呈高信号伴低信号分隔 图 1b DWI示病灶呈混杂明显高信号 图 1c ADC图示对应DWI高信号区为低信号 图 1d 增强扫描动脉期可见病灶周围一过性异常灌注 |
 |
| 图 1 女,62岁,肝右叶高毒力型肺炎克雷伯菌肝脓肿肝内及肺内播散 图 2a DWI示病灶呈混杂明显高信号 图 2b ADC图可见对应DWI高信号区为低信号 图 2c 增强扫描平衡期可见病灶内分隔强化,外缘薄壁强化 图 2d 冠状位延迟期见远处肺内多发播散环形强化病 |
30例中,18例出现一过性灌注异常(图 1d,2d),可见动脉期肝段异常强化,其中12例呈楔形分布,6例呈三角形分布,均靠近肝脏边缘,病灶边缘清晰;17例肝脓肿内可见气体信号影,与腔内液体形成气-液平面,13例未出现积气;18例出现分隔强化(图 2c);8例出现脓肿周围强化。
3 讨论肺炎克雷伯菌为革兰阴性杆菌兼性厌氧,荚膜丰富,寄殖于肠道等处,在人体免疫力下降或有胆道疾病时,可穿过肠道屏障进入肝脏引起脓肿。近年来,肺炎克雷伯菌肝脓肿在糖尿病患者中高发[4],本研究中人群分布与之相符(22/30),糖尿病患者更易发生胸腹腔积液、脓毒血症等并发症,也易发生脓肿转移,因此糖尿病成为该病预后不良的危险因素[5]。该病症状体征包括发热、寒颤、右上腹压痛、腹痛、乏力、黄疸、恶心呕吐、意识改变、腹泻、腹直肌紧张等,实验室检查无特异性,可见白细胞计数及中性粒细胞比例升高、血小板减少、白蛋白降低、肝功能受损等,病原微生物检查为确诊标准。目前,肺炎克雷伯菌肝脓肿尤其是高毒力型发病率日趋升高,延误治疗可导致预后极差,甚至死亡,早期诊治是改善预后的关键。
MRI能获得肝脏任意部位的体层图像,提供大量组织病变细节和解剖信息,且对炎症更敏感,对肺炎克雷伯菌肝脓肿的诊断价值较大。本研究中脓肿均呈明显T1WI低信号,T2WI高信号,而DWI多呈高信号、对应ADC图呈低信号;少数DWI呈低信号,对应ADC图呈高信号,与文献[6]报道一致。其机制主要与脓肿形成的分期及液化程度有关,前者是由于脓肿早期及成熟期,富含细胞的高黏稠度脓液使水分子弥散运动受限;后者是由于脓肿吸收期,脓肿液化以稀薄的浆液或黏液为主,使水分子弥散运动不再受限,因此DWI表现随脓肿各期的演变而变化。有学者[6]发现DWI诊断肝脓肿的敏感性明显高于MRI增强扫描。DWI结合ADC图量化分析可在分子水平提供诊断信息,对该病的早期定位、定性诊断具有重要意义。
通过探讨肺炎克雷伯菌肝脓肿的MRI的特征性表现,可在未获得细菌培养结果时为其早期诊断提供帮助。结合文献[7]报道及本研究结果分析得出,肺炎克雷伯菌肝脓肿在MRI上多表现为单发、单叶、实性、多房、薄壁、脓肿周围无强化、一过性灌注异常、脓腔积气及分隔强化等。本研究中,18例出现一过性灌注异常,T2WI呈高或等信号,动脉期表现为一过性强化,门静脉期消失。有学者[8]指出该现象存在多种机制,包括肝脓肿累及Glisson鞘引起门静脉炎性浸润导致门静脉狭窄甚至闭塞,引发门静脉血流减少,以及炎症充血、肝动脉-门静脉短路开放等因素,皆可造成肝动脉血流继发性增多。该病此现象发生率显著高于肝癌及肝转移瘤,可作为辅助鉴别的依据之一[9]。本研究中脓腔积气多发生于糖尿病患者,其机制是肺炎克雷伯菌在高糖及免疫缺陷环境下大量繁殖,产生甲酸氢化酶,进而产酸、产气[10]。肺炎克雷伯菌肝脓肿中脓腔积气的比例明显高于其他类型的肝脓肿,且该征象预示死亡率较高[11]。本研究18例出现分隔环形强化,强化的环壁完整、光滑、厚度均匀,延迟期伴病灶缩小,有学者[12]发现部分有糖尿病病史、近期使用抗生素或白细胞计数升高不明显患者环形强化不典型。
本研究中16例分离出血清型K1和K2,其中毒力基因aerobactin和rmpA总检出率高达88%和75%,属高毒力型。高毒力型肺炎克雷伯菌肝脓肿具有极强的侵袭性,明显超过普通型肺炎克雷伯菌。其高毒力的物质基础普遍认为主要是K抗原,以K1和K2为主[13],此外,毒力因子还包括黏附因子及铁载体,但由此引起的详细致病过程仍未明确。16例中,10例伴肝外脓肿,多为肺脓肿。研究[14]表明,由K1和K2引起的肺炎克雷伯菌肝脓肿常伴随肝外感染并发症,如肺部感染、中枢神经系统感染、眼内感染等,称为肺炎克雷伯菌肝脓肿侵袭性综合征,高毒力型肝脓肿病灶的MRI典型表现多于普通型。
肺炎克雷伯菌肝脓肿需与以下疾病相鉴别:①非肺炎克雷伯菌肝脓肿,肺炎克雷伯菌肝脓肿MRI表现具有壁薄、多有脓腔积气、部分脓肿内可见坏死碎片等特点,患者多有糖尿病基础,而非肺炎克雷伯菌肝脓肿则多有壁较厚、脓腔积气较少、无肝外转移感染、伴胆道疾病及腹腔肿瘤等特点,患者多有腹部手术史。②肝脏恶性肿瘤坏死或囊变,肺炎克雷伯菌肝脓肿除脓肿吸收期脓液与肝脏恶性肿瘤坏死或囊变的ADC值部分重叠外,早期及成熟期ADC值均明显低于后者。③胆管细胞癌和转移瘤,其分隔环形强化的环壁完整光滑、厚度均匀,延迟期伴病灶缩小,而胆管细胞癌的环形强化呈向心性充填,可见回缩的肝包膜及局限性增厚的胆管壁,转移瘤则见环壁中断或环壁结节强化。但在MRI常规序列,仍存在鉴别难点,如不典型肝脓肿与不典型周围型胆管细胞癌等,需进一步研究有关序列或结合其他诊断手段,必要时行穿刺活检定性。
综上所述,如MRI上发现肝脓肿病灶具有单发、单叶、实性、多房、薄壁、脓肿周围无强化、脓腔积气及分隔强化等特征,应首先考虑肺炎克雷伯菌肝脓肿的可能,且以上特征具备越多,该病的可能性越大。
| [1] |
Luo M, Yang XX, Ta B, et al. Distribution of commonpathogens in patients with pyogenic liver abscess in China:a meta-analysis[J]. Eur J Clin Microbiol Infect Dis, 2016, 35: 1557-1565. DOI:10.1007/s10096-016-2712-y |
| [2] |
Qian Yun, Wong Chi Chun, LaiSanchuan, et al. A retrospective study of pyogenic liver abscess focusing on Klebsiella pneumoniae as a primary pathogen in China from 1994 to 2015[J]. Sci Rep, 2016, 6: 1-12. DOI:10.1038/s41598-016-0001-8 |
| [3] |
熊勇. CT动态增强和MRI判断肝脓肿病理分期的作用[J]. 影像研究与医学应用, 2018, 2(13): 35-36. DOI:10.3969/j.issn.2096-3807.2018.13.019 |
| [4] |
Kong H, Yu F, Zhang W, et al. Clinical and microbiological characteristics of pyogenic liver abscess in a tertiary hospital in East China[J]. Medicine Baltimore, 2017, 96: e8050. DOI:10.1097/MD.0000000000008050 |
| [5] |
李文娟, 丁军, 邓大勇, 等. 克雷伯杆菌所致肝脏巨大气性脓肿一例报告[J]. 现代生物医学进展, 2013, 13(5): 876-878. |
| [6] |
应明亮, 许顺良, 肖文波, 等. 弥散加权成像对肝脏脓肿及坏死囊变肿瘤的鉴别诊断价值[J]. 医学影像学杂志, 2015, 25(1): 102-106. |
| [7] |
Mortelé KJ, Segatto E, Ros PR. The infected liver:radiologic-pathologic correlation[J]. Radiographics, 2004, 24: 937-955. DOI:10.1148/rg.244035719 |
| [8] |
Bachler P, Baladron MJ, Menias C, et al. Multimodality imaging of liver infections:differential diagnosis and potential pitfalls[J]. Radiographics, 2016, 36: 1001-1023. DOI:10.1148/rg.2016150196 |
| [9] |
袁雁雯, 祁永爱. 肝脏异常灌注在肝脓肿磁共振成像中的价值[J]. 山西医药杂志, 2015, 44(2): 158-160. |
| [10] |
王京.引起肝脓肿的肺炎克雷伯菌毒力基因分析与分子流行特征研究[D].北京: 中国人民解放军医学院, 2013: 22-23.
|
| [11] |
吴常明, 邱跃灵, 殷建团, 等. 肺炎克雷伯菌肝脓肿并脓毒性肺栓塞的临床特点、影像学特征及治疗预后分析[J]. 中国呼吸与危重监护杂志, 2017, 16(6): 599-605. |
| [12] |
王帅, 沙钧平, 丁锋, 等. 肝脏多房环形强化病变的影像分析[J]. CT理论与应用研究, 2016, 25(4): 463-470. |
| [13] |
Chen N, Ling ZX, Jin TT, et al. Altered profiles of gut microbiota in klebsiella pneumoniae-induced pyogenic liver abscess[J]. Curr Microbiol, 2018, 75: 952-959. DOI:10.1007/s00284-018-1471-7 |
| [14] |
Alsaif HS, Venkatesh SK, Chan DS, et al. CT appearance of pyogenic liver abscesses caused by Klebsiella pneumoniae[J]. Radiology, 2011, 260: 129-138. DOI:10.1148/radiol.11101876 |
 2020, Vol. 18
2020, Vol. 18


