| 胸主动脉供血与腹主动脉供血肺隔离症的影像学表现对比分析 |
1b. 河北医科大学第三医院放射科, 河北 石家庄 050011;
2. 河北省中医院放射科, 河北 石家庄 050011
2. Department of Radiology of the Third Hospital of Hebei Medical University, Shijiazhuang 050051, China
肺隔离症是临床先天性肺发育畸形中较少见的一种类型,是指与正常肺组织相分离的无功能肺组织,由体循环动脉分出的异常分支血管供血[1]。其病因尚不明确,被广泛接受的假说为副肺芽迁移异常形成肺隔离症[2]。肺隔离症的体循环供血动脉多包括胸主动脉及腹主动脉发出的异常分支血管,其中以胸内降主动脉最常见。回顾性分析2013年5月至2019年12月河北省中医院24例经术后病理证实的胸主动脉供血及腹主动脉供血的肺隔离症患者,对比分析其影像学特征,现报道如下。
1 资料与方法 1.1 一般资料本组24例中,男6例,女18例;年龄18~59岁,平均(44.1±13.5)岁。19例表现为反复咳嗽、咳痰及发热,1例间断咯血,4例无明显临床症状、经体检发现。根据供血血管来源不同,分为胸主动脉供血组16例,男2例,女14例,平均年龄(42.5±15.4)岁;腹主动脉供血组8例,男4例,女4例,平均年龄(47.4±9.9)岁。
1.2 仪器与方法24例均行CT平扫及增强扫描,并对病灶行薄层扫描。采用Siemens Somatom Definition AS+ 128层螺旋CT扫描仪。扫描参数:120 kV,200 mA,螺距1.0,矩阵512×512。增强扫描采用碘海醇60 mL(碘浓度300 mg/mL),注射流率3.0 mL/s;于注射对比剂20 s后行动脉期扫描,延迟15 s行静脉期扫描。重建图像层厚1.0 mm,采用肺及标准重建算法,工作站后处理包括二维MPR、MIP、CPR及三维重建VR等。
1.3 图像分析CT平扫及增强扫描图像由2位工作5年以上胸部放射专家独立阅片,分别记录病变的部位、形态、大小、密度、强化方式及特征,以及供血动脉的特征、异常静脉引流的途径等。2组供血血管直径、供血血管长度及病变体积的比较均采用两独立样本的Wilcoxon秩和检验。双供血动脉肺隔离症的供血血管直径(R0)和长度(L0)的计算公式如下: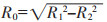
采用SPSS 23.0统计学软件。分别对2组病变的位置、体积、密度、供血血管直径及长度进行对比分析。
连续变量表示为x±s。2组影像学参数间的差异行独立样本Wilcoxon和χ2检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 供血动脉起源及病变部位胸主动脉供血16例中,病变位于左肺下叶后基底段14例,右肺下叶内基底段2例;腹主动脉供血8例中,病变位于右肺下叶内基底段5例,左肺下叶后基底段3例;2组肺隔离症的分布差异有统计学意义(χ2=6.455,P < 0.05)。
2.2 影像表现① 肺部软组织肿块影21例,囊实性病变密度不均2例,单纯肺内血管粗大征1例。②隔离肺组织大小、供血动脉直径与长度见表 1。胸主动脉供血组供血动脉长度、供血隔离肺组织体积均小于腹主动脉供血组,而供血动脉直径大于腹主动脉供血组,2组差异均有统计学意义(均P < 0.05)。③单支供血动脉15例(图 1),双支供血动脉7例(均起源于胸主动脉)(图 2),单支供血动脉在进入隔离肺组织前分成2支供血动脉2例(均起源于胸主动脉)(图 3,4)。④进入隔离肺组织的供血动脉途径一种为胸主动脉分支直接进入隔离肺组织,另一种为腹主动脉分支穿过横膈进入隔离肺组织。⑤2组均经过同侧下肺静脉回流。⑥5例伴病变周围肺组织炎性改变,3例伴肺气肿,3例伴支气管扩张症;13例未伴肺内其他病变。⑦21例呈不均匀强化,2例呈均匀强化,1例仅显示为粗大供血动脉强化。⑧24例均为肺叶内型。
| 表 1 2组隔离肺组织体积、供血动脉的直径及长度比较[M(P25,P75)] |
 |
 |
| 图 1 女,59岁,腹主动脉供血肺隔离症,CTA的MIP图像,隔离肺组织位于左肺下叶,供血动脉起源于胃左动脉 |
 |
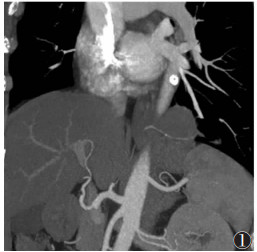
| 图 2 女,15岁,胸主动脉供血肺隔离症,CTA的MIP图像,隔离肺组织位于左肺下叶,供血动脉为胸主动脉的2个分支 |
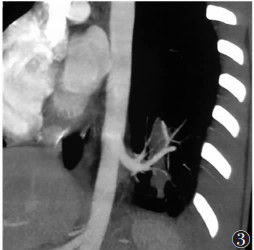 |
| 图 3 男,16岁,胸主动脉供血肺隔离症,CTA的MIP图像,降主动脉供血,供血动脉在发出后进入隔离肺组织前分为2支 |
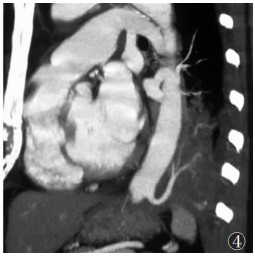 |
| 图 4 女,52岁,胸主动脉供血肺隔离症,CTA的MIP图像,降主动脉供血,供血动脉在发出后进入隔离肺组织前分为2支 |
3 讨论
肺隔离症是指局部发育异常的肺组织不具有呼吸功能,缺乏与支气管树的正常交通;其特点主要是发育异常的肺组织由体动脉供血(胸内降主动脉、腹主动脉或其分支),且与正常肺组织分离;发现肺内病变由体循环的动脉供血是诊断该病的重要特征。目前大多数学者支持的肺隔离症的发生机制假说是1946年Pryce提出的“血管牵引学说”,即在胚胎发育初期,肺组织发生脱离时,牵引了部分胚胎肺组织,导致血管残留,形成了主动脉的异常分支[3]。
肺隔离症主要发生在双肺下叶,以左肺下叶常见,右肺中叶罕有发生,供血动脉多起源于胸内降主动脉或腹主动脉[4-5],双肺同时发生罕见[6-7]。部分病例报道提示肺隔离症供血动脉可发自肋间动脉、胸廓内动脉或右冠状动脉[8-10]。本研究24例中,17例位于左肺下叶后基底段,7例位于右肺下叶内基底段,其中胸主动脉供血的肺隔离症好发于左肺下叶,而腹主动脉供血的肺隔离症例数较少,左右分布差异不明显。
肺隔离症根据与胸膜的关系(有无独立的脏层胸膜)分为肺叶内型和肺叶外型2种类型,前者多见。肺叶内型肺隔离症由于与周围正常肺组织之间无胸膜相隔,易发生感染,与周围组织黏连。而肺叶外型肺隔离症与周围正常肺组织间存在胸膜相隔,多无临床症状,常在体检时偶然发现[4]。本研究24例均为肺叶内型,19例主要临床症状为反复咳嗽和发热,4例无明显临床症状、体检发现。肺隔离症的主要影像学征象为异常的体循环动脉供血。动脉造影一直被认为是诊断该病的金标准,但随着无创性CTA及MRA等检查特异度及敏感度的明显提高,目前动脉造影已很少应用于肺隔离症的检查,无创性检查成为肺隔离症的首选检查手段[11-15]。
肺隔离症的临床治疗多为择期手术,尤其是伴反复发作的肺部感染或有恶变倾向的患者[16]。肺隔离症的形态学特点,如体积、供血动脉的长度和直径等对手术方案的制订非常重要。本研究胸主动脉供血组隔离肺组织体积及供血动脉长度小于腹主动脉供血组,但血管直径大于腹主动脉供血组。24例中双支起源供血动脉7例,单支起源15例,其中2例单支供血动脉在进入隔离肺组织前分成2支供血动脉。对上述差异,应进行很好的术前评估,避免手术复杂化。
总之,胸主动脉供血的肺隔离症多位于左肺下叶,与腹主动脉供血的肺隔离症比较,其体积多较小、供血动脉的直径较大、长度多较短。应用无创性检查(CTA、MRA等)可很好地诊断该病及其供血动脉特点。
| [1] |
LANDING B H, DIXON L G. Congenital malformations and genetic disorders of the respiratory tract (larynx, trachea, bronchi, and lungs)[J]. Am Rev Respir Dis, 1979, 120(1): 151-185. |
| [2] |
CLEMENTS B S, WARNER J O. Pulmonary sequestration and related congenital bronchopulmonary-vascular malformations: nomenclature and classification based on anatomical and embryological considerations[J]. Thorax, 1987, 42(6): 401-408. DOI:10.1136/thx.42.6.401 |
| [3] |
PRYCE D M. Lower accessory pulmonary artery with intralobar sequestration of lung; a report of seven cases[J]. J Pathol Bacteriol, 1946, 58(3): 457-467. DOI:10.1002/path.1700580316 |
| [4] |
WEI Y, LI F. Pulmonary sequestration: a retrospective analysis of 2625 cases in China[J]. Eur J Cardiothorac Sur, 2011, 40(1): 39-42. DOI:10.1016/j.ejcts.2011.01.080 |
| [5] |
田丽, 郝娟娟, 张静玉, 等. 胸主动脉供血与腹主动脉供血肺隔离症的对比分析[J]. 放射学实践, 2014, 29(11): 1289-1292. |
| [6] |
OLIVERI ARUETE F, CANDELARIO CACERES A, ALONSO MALLO E. Bilateral intralobar pulmonary sequestration in a young adult[J]. Arch Bronconeumol, 2017, 53(5): 281-282. DOI:10.1016/j.arbres.2016.09.008 |
| [7] |
WU L, LIN L, JIANG L, et al. Bilateral intralobar pulmonary sequestration with a bridging isthmus in a young adult[J]. Ann Thorac Surg, 2016, 102(3): 257. DOI:10.1016/j.athoracsur.2016.04.002 |
| [8] |
XIE D, XIE H, YOU X, et al. Pulmonary sequestration with aberrant arteries arising from the renal artery and the internal thoracic artery[J]. Ann Thorac Surg, 2013, 96(5): 131. DOI:10.1016/j.athoracsur.2013.08.018 |
| [9] |
LABORDA ARUIZ J R, DE GREGORIO M A. Congenital pulmonary sequestration supplied by the right coronary artery[J]. Arch Bronconeumol, 2016, 52(7): 389. DOI:10.1016/j.arbres.2015.03.014 |
| [10] |
VAN LANGENHOVE G, CONVENS C, SEYNAEVE P, et al. Intralobar pulmonary sequestration supplied by the right coronary artery[J]. Catheter Cardiovasc Interv, 1999, 47(2): 218-220. DOI:10.1002/(SICI)1522-726X(199906)47:2<218::AID-CCD21>3.0.CO;2-5 |
| [11] |
AU V W, CHAN J K, CHAN F L. Pulmonary sequestration diagnosed by contrast enhanced three-dimensional MR angiography[J]. Br J Radiol, 1999, 72(859): 709-711. DOI:10.1259/bjr.72.859.10624331 |
| [12] |
俞福华, 沈星, 屠建春. CTA在肺隔离症诊断中的应用[J]. 中国中西医结合影像学杂志, 2016, 14(3): 307-308. DOI:10.3969/j.issn.1672-0512.2016.03.025 |
| [13] |
XU H B, JIANG D L, KONG X Q, et al. Pulmonary sequestration: three dimensional dynamic contrast-enhanced MR angiography and MRI[J]. J Tongji Med Univ, 2001, 21(4): 345-348. DOI:10.1007/BF02886576 |
| [14] |
梁艳山. MSCT血管成像对肺隔离症的诊断价值[J]. 中国中西医结合影像学杂志, 2019, 17(3): 287-289. DOI:10.3969/j.issn.1672-0512.2019.03.021 |
| [15] |
ZHANG M, ZHU J, WANG Q, et al. Contrast enhanced MR angiography in pulmonary sequestration[J]. Chin Med J (Engl), 2001, 114(12): 1326-1328. |
| [16] |
BRATU I, FLAGEOLE H, CHEN M F, et al. The multiple facets of pulmonary sequestration[J]. J Pediatr Surg, 2001, 36(5): 784-790. DOI:10.1053/jpsu.2001.22961 |
 2021, Vol. 19
2021, Vol. 19


