


2. 重庆医科大学生物化学与分子生物学教研室,重庆 400016;
3. 重庆医科大学附属第一医院麻醉科,重庆 400016
2. Dept of Biochemistry and Molecular Biology, College of Basic Medical Sciences, Chongqing Medical University, Chongqing 400016, China;
3. Dept of Anesthesiology, the First Affiliated Hospital of Chongqing Medical University, Chongqing Medical University, Chongqing 400016, China
糖尿病因胰岛素分泌不足或胰岛素抵抗引起体内糖代谢紊乱,包括Ⅰ型糖尿病(T1DM)和Ⅱ型糖尿病(T2DM)。糖尿病机体代谢紊乱引发许多并发症,如心血管疾病、糖尿病肾病、糖尿病视网膜病变以及严重的糖尿病骨丢失。机体长期暴露于高血糖环境会导致骨代谢改变和骨微结构受损[1],骨折风险增加,骨愈合受损,并且高血糖、晚期糖基化终末产物形成增加、活性氧(reactive oxygen species,ROS)生成和炎症等因素会阻碍成骨细胞和破骨细胞的分化[2]。
骨在整个生命过程中不断重塑,为身体和运动提供机械支持,保护重要器官。骨重塑是旧的或受损的骨被破骨细胞移除,成骨细胞形成新骨的过程[3]。成骨细胞是由间充质前体通过转录因子的连续作用向骨祖细胞谱系分化产生[4],产生骨钙素(osteocalcin,OCN)、碱性磷酸酶(alkaline phosphatase,ALP)和Ⅰ型胶原蛋白等成骨标志性的细胞外蛋白。成骨细胞也表达钙信号通道,如电压门控通道、瞬时受体电位通道等。有研究表明,成骨细胞中钙离子(Ca2+)振荡刺激基质囊泡从细胞中释放促进成骨分化[5],这表明钙信号与成骨分化关系密切。
蛋白KIAA0753(moonraker或OFIP)是中心体和中心粒周围卫星蛋白,与原纤毛(primary cilia)形成、中心粒复制和微管稳定相关[6],KIAA0753定位原纤毛的顶端,KIAA0753与Joubert综合征、热纳综合征(Jeune syndrome,JS)以及口-面-指综合征(oral-facial-digital syndrome,OFDS)等原纤毛疾病有关。蛋白CCSAP又叫做C1orf96或CSAP,它定位于原纤毛中心粒以及于纤毛轴突的基体和沿着微管的长轴中,是原纤毛、中心粒和纺锤体的相关蛋白[7]。原纤毛是从细胞膜上突出的毛发状的细胞器,感知细胞内外环境的变化,并向细胞传递信号,调节细胞的增殖,分化,凋亡,稳态,信号转导等过程。糖尿病引起原纤毛形态变异甚至缺失[8],并且糖尿病小鼠的成骨细胞原纤毛丢失,骨折愈合延迟,骨密度和机械强度显著降低,成骨细胞标志蛋白表达减少[9],这些研究都表明原纤毛与糖尿病骨丢失有关联,而蛋白KIAA0753和CCSAP都定位于原纤毛上,它们是否与糖尿病骨丢失有联系,需进一步探究。
本研究利用不同葡萄糖浓度的成骨培养基诱导小鼠胚胎成骨细胞前体细胞MC3T3-E1成骨分化,过表达KIAA0753质粒、过表达CCSAP质粒来阐明KIAA0753和CCSAP对糖尿病骨丢失的作用机制。
1 材料与方法 1.1 材料 1.1.1 实验动物、细胞及主要试剂SD大鼠,重庆医科大学实验动物中心,许可证编号:SYXK(渝)2022-0016;小鼠胚胎成骨细胞前体细胞(MC3T3-E1,中国上海细胞库,货号:SCSP-5218);人胚肾细胞(HEK-293T,中国上海细胞库,货号:GNHu44)。主要试剂:pcDNA3.1-Flag、pcDNA3.1-KIAA0753-Flag、pcDNA3.1-CCSAP-Myc等质粒均设计购自长沙优宝公司;α-MEM培养基(Gibco,12571063);DMEM培养基(Gibco,11965092);磷酸盐缓冲液(PBS,Gibco,10010023);脂质体lipo2000(Invitrogen,11668019);胎牛血清(fetal bovine serum,FBS)(ExCell Bio,FSD500);链脲霉素(Sigma,S0130);青霉素-链霉素双抗(penicillin-streptomycin)(Sigma,P4458);抗坏血酸(ascorbic acid)(Sigma,A5960);地塞米松(Sigma,D4902);β-甘油磷酸(Sigma,35675);Protein A+G Agarose琼脂糖珠(Beyotime,P2055);RIPA裂解液(Beyotime,P0013B);PMSF蛋白酶抑制剂(Beyotime,ST506);BCA蛋白浓度检测试剂盒(Beyotime,P0010S);碱性磷酸酶试剂盒(中生北控,3300)。实验所用抗体:KIAA0753(Invitrogen,PA5-54809);CCSAP(Immunoway,YN3925);GAPDH(上海生工,D110016);Flag(上海生工,D110005);IgG山羊抗兔(上海生工,D110121);钙离子-钙调蛋白依赖性蛋白激酶Ⅱ(calcium/calmodulin-dependent protein kinase Ⅱ beta,CAMK2B)(上海生工,D264502);受磷蛋白(phospholamban,PLN)(上海生工,D163942);HRP偶联的山羊抗兔IgG抗体(上海生工,D110058);骨桥蛋白(osteopontin,OPN)(Proteintech,22952-1-AP);OCN(Proteintech,23418-1-AP)。
1.1.2 主要仪器细胞培养箱(Thermo Fisher,美国),超净工作台(Thermo Fisher,美国),蛋白垂直电泳仪及转膜仪(Bio-Rad,美国)、光学显微镜(Leica,德国),酶标仪(Thermo Fisher,美国),ChemiDocTM凝胶成像系统(Bio-Rad,美国),超声破碎仪(Thermo Fisher,美国),组织匀浆仪(奥盛,中国),DNA混合仪(宁波新芝,中国)。
1.2 方法 1.2.1 细胞培养及成骨诱导将小鼠胚胎成骨前体细胞(MC3T3-E1)以4×106的密度接种于6孔板中,用α-MEM完全培养基(包含10%胎牛血清(FBS),1%的青霉素-链霉素双抗)置于37 ℃,潮湿且含5%CO2的细胞培养箱中培养12 h细胞,待完全贴壁后,分别用含有不同葡萄糖浓度的成骨培养基(OS培养基:α-MEM+10% FBS+1%青霉素-链霉素+50 g·L-1抗坏血酸+10 mmol·L-1 β-甘油磷酸+10-8 mol·L-1地塞米松)继续诱导不同的时间。
1.2.2 细胞质粒转染及免疫共沉淀将人胚肾细胞(HEK-293T)以4×106的密度接种于6孔板中,用DMEM完全培养基培养,待细胞融合度达70%~90%时,弃掉培养基,PBS清洗两次,每孔加入1 mL无血清培养基。配制转染试剂A:2 μL Lipo2000+100 μL Opti-DMEM;转染试剂B:2.4 μg质粒+100 μL Opti-MEM。将转染试剂A与B混匀,室温静置5 min。将转染试剂逐滴加入6孔板中,轻轻摇匀,置于37 ℃,CO2培养箱中培养,转染5 h后,补加2 mL DMEM完全培养基,继续转染48~72 h后,收集细胞蛋白。取1 μL Flag抗体与20 μL蛋白原液混合,置于混合仪中在4 ℃下缓慢旋转混合24 h,然后向其中加入50 μL Protein A+G Agarose,再置于混合仪中在4 ℃下缓慢旋转混合24 h,然后用4 ℃,12 000 r·min-1,离心5 min,弃上清液。紧接着用PBS进行清洗,在4 ℃,12 000 r·min-1,离心5 min,弃上清液,重复洗10次,将沉淀物与蛋白Loading buffer混合均匀,100 ℃煮10 min,冷却后,4 ℃,12 000 r·min-1离心,然后利用Western blot检测目的蛋白之间的相互作用,用IgG抗体作为阴性对照。
1.2.3 动物模型的构建对6周龄大的SD大鼠喂饲高糖高脂饲料4~8周,诱发胰岛素抵抗。4~8周后,SD大鼠的质量出现明显上升,然后腹腔注射链脲霉素(STZ)连续低剂量注射5 d。注射完成后,每隔3 d检测1次血糖,当空腹血糖≥11 mmol·L-1,证明糖尿病鼠模型成功。SD大鼠采购于重庆医科大学实验动物中心,饲养于重庆医科大学实验动物中心SPF级动物房中,所有的动物实验遵循实验相关规定,经过重庆医科大学动物伦理委员会批准(No IACUC-CQMU-2023-0461)。
1.2.4 ALP活性测定配制ALP活性检测工作液,将试剂R1与10 mL试剂R2混合均匀,使R1完全溶解。取200 μL的ALP活性检测工作液加入到96孔板中,样品取2 μL的蛋白原液和18 μL的PBS溶液混合均匀,空白孔中加入20 μL的PBS溶液,将加完样的96孔板置于酶标仪中37 ℃孵育,测定时间为T0 min、T1 min、T2 min、T3 min、T4 min、直至T60 min时A405 nm的值,然后按照[(2757×A/min)×稀释倍数]的公式计算出样品ALP的活性(U·L-1),其中A/min指吸光度变化率,实验重复3次。
1.2.5 蛋白质印迹及结果分析收集各种不同处理后细胞的蛋白,加入RIPA(RIPA∶PMSF=100∶1)裂解液,超声破碎后,置于冰上裂解30 min,12 000 r·min-1,4 ℃,离心10 min,取上清液,采用BCA法测量蛋白浓度。加入1 × Loading buffer煮蛋白10 min。然后15% SDS-PAGE凝胶分离,25 mmol·L-1 Tris,192 mmol·L-1甘氨酸和20%甲醇的缓冲液中,将蛋白质转移到PVDF膜上,5%的脱脂牛奶封闭,在4 ℃的条件下过夜孵育一抗,使用GAPDH作为内参,次日用TBST洗膜3次,每次10 min,采用HRP偶联二抗在室温孵育1 h,再用TBST洗膜3次,然后用ECL化学发光试剂在成像系统中检测目标蛋白信号。蛋白表达水平分析采用ImageJ软件分析条带灰度值,用目标蛋白/GAPDH的灰度值来表示蛋白表达水平。
1.2.6 生物信息学分析利用在线的基因/蛋白质相互作用检索工具(STRING,https://cn.string-db.org/)采用交互评分0.4构建蛋白质相互作用网络。利用高通量基因表达数据库(GEO,https://www.ncbi.nlm.nih.gov/gds)筛选糖尿病模型数据集,运用R语言(R版本4.3.3)软件进行差异基因的筛选,满足P valves < 0.05且|log2(Fold Change)|>0.5为差异基因,其中log2(Fold Change)>0.5为上调基因(Up);log2(Fold Change) < -0.5为下调基因(Down)。然后将差异基因放入在线数据库OmicsBean(http://www.omicsbean.cn/)进行基因本体论(gene ontology,GO)和京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)分析。
1.2.7 统计学方法采用GraphPad Prism 9统计学软件对数据进行处理分析。所有数据均以x±s表示。对两组数据采用Student t检验进行比较分析,对两组以上数据采用单因素方差进行比较分析。检验水准α=0.05。
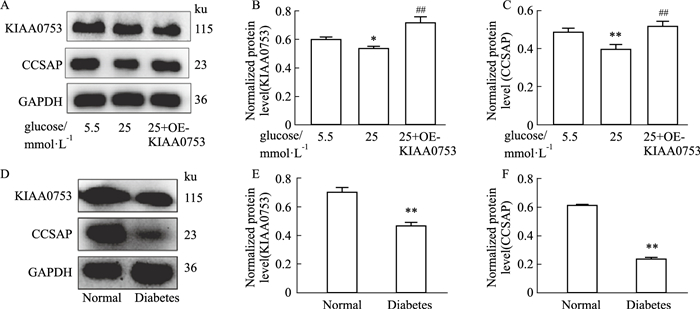
2 结果 2.1 高糖抑制成骨细胞中蛋白KIAA0753和CCSAP的表达用5.5和25 mmol·L-1葡萄糖浓度的成骨培养基诱导MC3T3-E1成骨细胞3 d,分别提取细胞总蛋白进行Western blot分析,与5.5 mmol·L-1浓度相比,25 mmol·L-1葡萄糖浓度下蛋白KIAA0753和CCSAP的表达降低(Fig 1A);同时在25 mmol·L-1葡萄糖浓度的条件下过表达KIAA0753发现,CCSAP的蛋白表达量出现明显的上调(Fig 1A-1C)。利用链脲霉素(STZ)构建SD糖尿病大鼠模型,分别提取正常鼠与糖尿病鼠的股骨蛋白进行Western blot分析,与正常鼠相比,糖尿病鼠中KIAA0753和CCSAP的表达量均降低(Fig 1D-1F)。
|
| Fig 1 Expression of high glucose inhibitory protein KIAA0753 and CCSAP (x±s, n=3) A: Western blot detection of KIAA0753 and CCSAP expression in osteoblasts under high glucose conditions; B, C: Quantitative analysis of the protein expression levels of KIAA0753 and CCSAP in cells. *P < 0.05, **P < 0.01 vs 5.5 mmol·L-1, ##P < 0.01 vs 25 mmol·L-1; D: Western blot detection of KIAA0753 and CCSAP protein expression in the femur of the rat model of a diabetic animal; E, F: Quantitative analysis of the expression levels of KIAA0753 and CCSAP in diabetic rat femur. **P < 0.01 vs Normal group. |
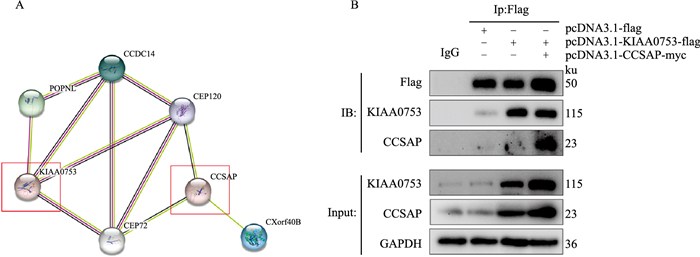
利用在线的基因/蛋白质相互作用检索工具(STRING)构建蛋白KIAA0753和蛋白CCSAP的蛋白质相互作用网络,可看出蛋白KIAA0753和蛋白CCSAP之间存在着间接的相互作用(Fig 2A)。
|
| Fig 2 Interaction between KIAA0753 and CCSAP A: STRING database prediction of the interaction between KIAA0753 and CCSAP; B: Co-immunoprecipitation (Co-IP) assay confirmation of the interaction between KIAA0753 and CCSAP (IgG as a negative control and Input as a positive control). |
分别对HEK-293T细胞进行4组处理,对照组HEK-293T细胞转染pcDNA3.1-Flag,只用IgG抗体pulldown,其余3组细胞分别转染pcDNA3.1-Flag,pcDNA3.1-KIAA0753-Flag,pcDNA3.1-KIAA0753-Flag+pcDNA3.1-CCSAP-Myc质粒,这3组均用Flag抗体pulldown。用Flag抗体通过Western blot检测发现IgG抗体pulldown组无Flag蛋白,其余3组均有Flag蛋白;用KIAA0753抗体Western blot检测结果显示,用IgG抗体pulldown的对照组和仅转染pcDNA3.1-Flag组无KIAA0753蛋白表达,而转染pcDNA3.1-KIAA0753-Flag质粒组以及转染pcDNA3.1-KIAA0753-Flag+pcDNA3.1-CCSAP-Myc质粒组都有KIAA0753蛋白表达;用CCSAP抗体Western blot检测发现,IgG抗体pulldown的对照组,转染pcDNA3.1-Flag,pcDNA3.1-KIAA0753-Flag的3组中均无CCSAP蛋白,与理论预测一致,但转染pcDNA3.1-KIAA0753-Flag+pcDNA3.1-CCSAP-Myc质粒组出现CCSAP蛋白,而质粒pcDNA3.1-CCSAP-Myc带有Myc标签蛋白,不是Flag标签蛋白,所以证明KIAA0753蛋白与CCSAP蛋白相互作用(Fig 2B)。
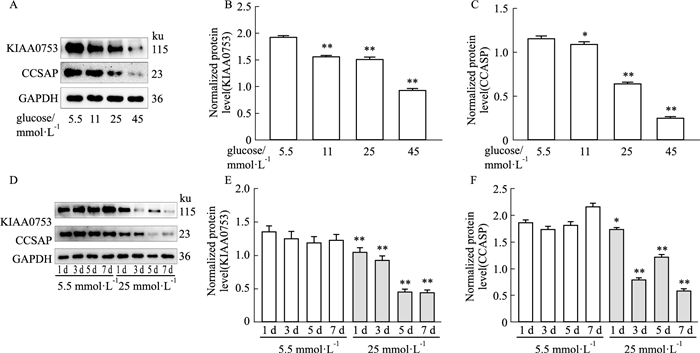
2.3 成骨细胞中KIAA0753和CCSAP蛋白的表达量随着葡萄糖浓度的提高和诱导时间的增加而降低分别用5.5、11、25、45 mmol·L-1葡萄糖浓度的成骨培养基诱导MC3T3-E1成骨细胞3 d,分别提取细胞总蛋白进行Western blot分析,与正常糖5.5 mmol·L-1组相比,随着葡萄糖浓度的提高,KIAA0753和CCSAP的表达量也逐渐降低,且在45 mmol·L-1葡萄糖浓度时,对KIAA0753和CCSAP的抑制作用最强(Fig 3A-3C)。用5.5 mmol·L-1和25 mmol·L-1葡萄糖浓度的成骨培养基分别诱导MC3T3-E1成骨细胞1、3、5、7 d,提取细胞总蛋白进行Western blot分析,与正常糖5.5 mmol·L-1组相比,25 mmol·L-1葡萄糖浓度下,KIAA0753和CCSAP的表达量都下降,并且高糖对KIAA0753和CCSAP的抑制作用随着诱导时间的增加而增强(Fig 3D-3F)。
|
| Fig 3 Effects of different glucose concentrations and different time gradients of normal and high glucose on KIAA0753 and CCSAP expression (x±s, n=3) A: Western blot analysis of the expressions of KIAA0753 and CCSAP in osteoblasts under different glucose concentrations; B, C: Quantitative analysis of the expression levels of KIAA0753 and CCSAP in osteoblasts at different glucose concentrations; D: Western blot analysis of KIAA0753 and CCSAP expression in osteoblasts under different time gradients of normal glucose and 25 mmol·L-1 high glucose; E, F: Quantitative analysis of the expression levels of KIAA0753 and CCSAP in osteoblasts under different time gradients of normal glucose and 25 mmol·L-1 high glucose.*P < 0.05, **P < 0.01 vs 5.5 mmol·L-1. |
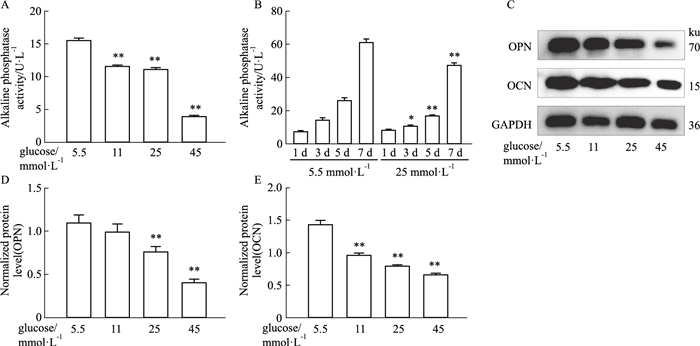
分别用5.5、11、25、45 mmol·L-1葡萄糖浓度的成骨培养基诱导MC3T3-E1成骨细胞3 d,分别提取细胞总蛋白,利用ALP活性试剂盒检测每组ALP活性,与正常糖5.5 mmol·L-1组相比,随着葡萄糖浓度的提高,ALP的活性也逐渐被抑制(Fig 4A),其中45 mmol·L-1葡萄糖浓度对ALP的抑制作用最强。用5.5 mmol·L-1和25 mmol·L-1葡萄糖浓度的成骨培养基分别诱导MC3T3-E1成骨细胞1、3、5、7 d,提取细胞总蛋白进行ALP检测,随着成骨诱导的时间增加,ALP的活性在逐渐增强,但与正常糖5.5 mmol·L-1组相比,25 mmol·L-1葡萄糖浓度下ALP活性都降低(Fig 4B)。
|
| Fig 4 Effects of different glucose concentration gradients and time gradients on ALP enzyme activity and different glucose concentrations on OPN and OCN genes related to osteogenic differentiation (x±s, n=3) A: Alkaline phosphatase assay kit detection of the activity of ALP enzyme under different glucose concentration gradients; B: Alkaline phosphatase assay kit detection of the activity of ALP enzyme under different time gradients of normal glucose and 25 mmol·L-1glucose condition; C: Western blot detection of OPN and OCN protein expressions in osteoblasts under different glucose concentrations; D, E: Quantitative analysis of OPN and OCN protein expression levels in osteoblasts under different glucose concentrations. *P < 0.05, **P < 0.01 vs 5.5 mmol·L-1. |
分别用5.5、11、25、45 mmol·L-1葡萄糖浓度的成骨培养基诱导MC3T3-E1成骨细胞3 d,利用Western blot检测每个处理组中成骨分化标志蛋白OPN、OCN的表达情况,与正常糖5.5 mmol·L-1组相比,随着葡萄糖浓度的提高,OPN和OCN蛋白的表达量逐渐降低(Fig 4C-4E),即高糖抑制成骨细胞中OPN、OCN蛋白的表达,抑制成骨分化。
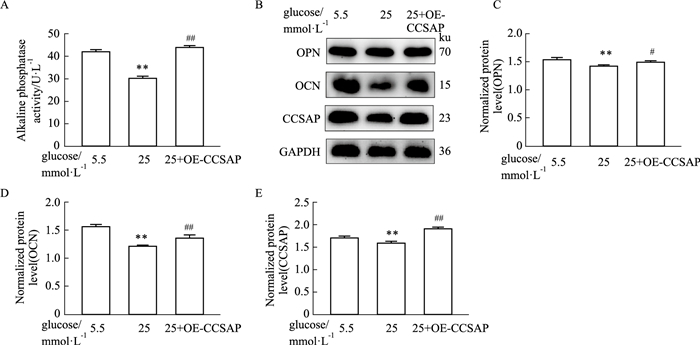
2.5 过表达CCSAP可以挽救高糖对成骨分化的抑制作用,促进成骨分化分别用5.5 mmol·L-1葡萄糖成骨培养基、25 mmol·L-1葡萄糖成骨培养基和25 mmol·L-1葡萄糖成骨培养基+过表达CCSAP的条件分别诱导MC3T3-E1成骨细胞,3 d后提取各组细胞总蛋白,利用ALP试剂盒检测ALP活性和用Western blot检测蛋白CCSAP、OPN、OCN的表达,发现与25 mmol·L-1组相比,在25 mmol·L-1葡萄糖浓度的条件下过表达CCSAP,成骨细胞中ALP的活性以及OPN、OCN的表达均出现上调,说明过表达CCSAP可以挽救高糖对成骨分化的抑制作用,促进ALP、OPN和OCN等成骨标记物的表达,进而促进成骨分化(Fig 5)。
|
| Fig 5 Effect of overexpression of CCSAP on osteogenic markers such as ALP, OPN, and OCN (x±s, n=3) A: The alkaline phosphatase assay kit detection of ALP activity in 5.5, 25, and 25 mmol·L-1+OE-CCSAP groups; B: Western blot detection of the protein expressions of CCSAP and osteoblast markers OPN and OCN in osteoblasts under conditions of 5.5, 25, and 25 mmol·L-1+OE-CCSAP; C, D, E: Quantitative analysis of the expression levels of OCN, OPN, and CCSAP proteins in osteoblasts in groups 5.5, 25, and 25 mmol·L-1+OE-CCSAP. **P < 0.01 vs 5.5 mmol·L-1, #P < 0.05, ##P < 0.01 vs 25 mmol·L-1. |
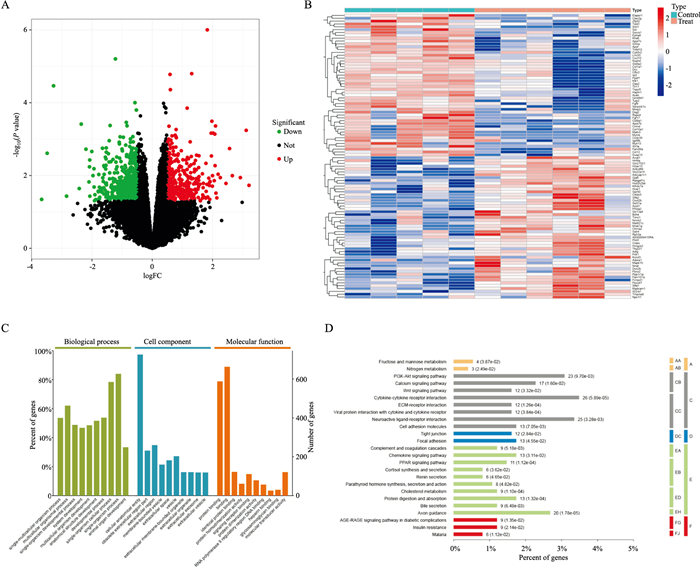
利用高通量基因表达数据库(GEO)筛选糖尿病模型,筛选获得GSE252292数据集[从野生型小鼠和Ⅰ型糖尿病(T1DM)小鼠的股骨和胫骨中提取的RNA进行RNA-seq测序]。将该数据集放入R语言(R版本4.3.3)中进行差异基因的筛选,本数据集共获得872个差异表达基因(Fig 6A-6B),上、下调基因分别为356个和516个。使用在线数据库OmicsBean对差异基因进行GO和KEGG分析,GO分析发现,相关的GO条目(P < 0.05)(Fig 6C)在生物学过程主要与组织、细胞、系统发育和器官发育有关;细胞组成主要与细胞外基质、细胞本体、囊泡等有关;分子功能主要与蛋白结合、分子传感器、信号受体结合等有关。KEGG分析得出,差异表达基因大部分集中于人体的胰岛素调控、离子调控以及细胞因子调控等相关通路(Fig 6D),如PI3K-AKT信号通路、钙信号通路、Wnt信号通路等。
|
| Fig 6 Analysis of gene expression difference in diabetes model in GEO database A: Scatter map of differential gene expression analysis, with red representing up-regulated genes and green representing down-regulated genes; B: Cluster analysis of all differential genes in the control and diabetes groups; C: GO enrichment analysis of differential genes (P < 0.05); D: KEGG enrichment analysis of differential genes (P < 0.05). |
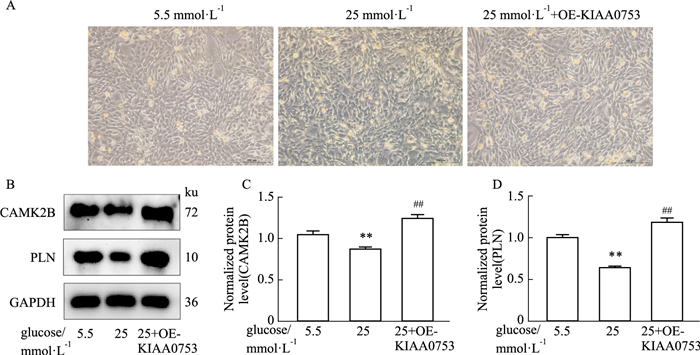
分别用5.5 mmol·L-1、25 mmol·L-1葡萄糖成骨培养基和25 mmol·L-1葡萄糖成骨培养基+过表达KIAA0753的条件诱导MC3T3-E1成骨细胞,3 d后拍照记录成骨细胞生长的状态(Fig 7A),并且提取细胞的总蛋白进行Western blot分析,与5.5 mmol·L-1组相比,25 mmol·L-1葡萄糖条件下成骨细胞中钙信号通路相关蛋白CANK2B、PLN的表达量降低(Fig 7B);同时在25 mmol·L-1葡萄糖成骨培养基+过表达KIAA0753组中,钙信号通路相关蛋白CANK2B、PLN的表达量比25 mmol·L-1葡萄糖组明显增强(Fig 7B-7D)。
|
| Fig 7 Effects of high glucose and overexpression of KIAA0753 on calcium signal-related proteins CAMK2B and PLN in osteoblasts (x±s, n=3) A: In the microscope cell graph (×100, Scale bar=100 μm), MC3T3-E1 was cultured with 5.5, 25, and 25 mmol·L-1glucose+overexpressed-KIAA0753 osteogenic medium, respectively; B: Western blot detection of calcium signal-related proteins CAMK2B and PLN expression in osteoblasts under5.5, 25, and 25 mmol·L-1glucose+overexpressed-KIAA0753; C, D: Quantitative analysis of the expression levels of calcium signal-related proteins CAMK2B and PLN in osteoblasts under 5.5, 25, and 25 mmol·L-1glucose+overexpressed-KIAA0753 conditions.**P < 0.01 vs 5.5 mmol·L-1, ##P < 0.05 vs 25 mmol·L-1. |
糖尿病患者的病程是一个长期而又缓慢的过程,机体在长期维持在这种高血糖的水平下,容易造成机体内的各种代谢紊乱。糖尿病骨丢失就是由于这种长期的高血糖水平使得机体内骨代谢发生紊乱,进而使得患者体内晚期糖基化终末产物(advanced glycosylation end products,AGEs)的形成增加、ROS生成增多以及并发炎症,这些症状会影响成骨细胞和破骨细胞,导致破骨细胞增加,成骨细胞和骨形成数量减少,从而使糖尿病患者逐渐发展为骨丢失。糖尿病会使原纤毛形态变异甚至缺失,原纤毛缺失严重时会导致一系列的严重原纤毛疾病,最为典型的如:口-面-指综合征(OFDS)。本研究将小鼠胚胎成骨细胞前体细胞MC3T3-E1分别用5.5 mmol·L-1和25 mmol·L-1葡萄糖浓度的成骨培养基诱导3 d,通过Western blot检测到KIAA0753和CCSAP的蛋白表达量在高糖条件下均下调(Fig 1),而KIAA0753和CCSAP都定位于原纤毛上,表明高糖扰乱原纤毛的生物合成和维持;同时也发现过表达KIAA0753可以挽救高糖对CCSAP的抑制,进一步验证了过表达KIAA0753可以挽救高糖对原纤毛的抑制。本研究也发现KIAA0753与CCSAP蛋白之间存在着相互作用(Fig 2)。
糖尿病骨丢失主要是因为骨重塑过程被抑制,骨的重塑是一个动态的过程,在整个生命过程中骨都在不停的重塑,旧的或受损的骨被破骨细胞移除,取而代之的是由成骨细胞形成的新骨[10]。而糖尿病抑制了骨重塑,骨重塑功能障碍会引起骨量低、骨组织微结构改变、骨强度下降和骨脆性增加,导致骨折的高风险[11]。糖尿病引起的骨丢失主要是成骨分化被抑制,成骨细胞分化会产生ALP、OCN和OPN等标志物。ALP是一种是固定在成骨细胞和基质囊泡(MVs)膜上的同源二聚体[12],在矿化组织细胞中高度表达,在硬组织的形成中起着至关重要的作用,可以作为骨形成的生物标志物[13]。OCN是成熟成骨细胞表达的一种成骨细胞特异性分泌蛋白,是骨基质中含量最丰富的非胶原蛋白[14]。骨OPN是一种分泌磷蛋白,参与许多生物活性,它不仅是神经介导和内分泌调节的骨量的重要因素,而且还参与多种骨相关细胞的生物活动[15]。本研究中将小鼠胚胎成骨细胞前体细胞MC3T3-E1利用5.5、11、25和45 mmol·L-1葡萄糖浓度的成骨培养基诱导3 d,通过Western blot分析,再次发现高糖降低蛋白KIAA0753和CCSAP的表达(Fig 3),利用ALP试剂盒检测ALP的活性以及利用Western blot分析成骨分化相关蛋白OPN、OCN的表达,发现高糖会使得ALP的活性、OPN蛋白、OCN蛋白的表达量下调(Fig 4),进一步说明高糖抑制了成骨分化;并且进一步分析也发现在4种不同葡萄糖浓度的条件下蛋白KIAA0753、蛋白CCSAP和成骨分化相关蛋白ALP活性、OPN蛋白、OCN蛋白的表达情况一致,都是随着葡萄糖浓度的升高而逐渐下调,也表明高糖抑制成骨分化,同时我们继续在25 mmol·L-1葡萄糖浓度的条件下过表达CCSAP发现,过表达CCSAP可以逆转高糖对ALP、OPN、OCN的抑制作用(Fig 5),表明过表达CCSAP具有逆转高糖抑制成骨分化的作用。
Ca2+是细胞中主要的第二信使,对所有高等生物的命运和生存至关重要,Ca2+是骨细胞对外部物理刺激做出反应的最早信号之一[16]。骨细胞中机械诱导的Ca2+振荡调节多种骨细胞相关细胞因子,如osteoprotegerin(OPG)、receptor activator for nuclear factor-κbligand(RANKL)和sclerostin的分泌以及随后的破骨细胞和成骨细胞活性[5]。本研究通过对GEO数据库中的糖尿病鼠模型数据集GSE252292进行差异基因表达分析,从GO和KEGG分析结果中可看出这些差异基因主要富集在“信号受体、信号调控”等方面(Fig 6),说明糖尿病对机体内的多条信号通路都能产生明显的影响,其中包括钙信号通路。钙信号通路是机体内骨生成息息相关,CAMK2B是一种钙调素依赖性蛋白激酶,对细胞中的钙信号传导是必需的[17]。PLN是一种位于心肌肌浆网(sarcoplasmic reticulum,SR)的可逆磷酸化的跨膜蛋白[18],其磷酸化后与Ca2+泵结合并调节Ca2+泵的活性。本研究用5.5和25 mmol·L-1葡萄糖浓度的成骨培养基诱导小鼠胚胎成骨细胞前体细胞成骨分化3 d,通过Western blot检测到钙信号通路相关蛋白CAMK2B和PLN的表达量在25 mmol·L-1葡萄糖浓度下出现下调(Fig 7),表明高糖抑制了钙信号的转导;并且在25 mmol·L-1高糖的条件下过表达KIAA0753,蛋白CAMK2B和PLN的表达量比25 mmol·L-1组明显的上调,这充分说明过表达KIAA0753可以解除高糖对钙信号通路的抑制作用。
综上所述,本研究结果证明高糖抑制蛋白KIAA0753和CCSAP的表达,说明高糖可以抑制原纤毛,从而抑制成骨分化和钙信号通路,也间接表明了原纤毛与成骨分化之间的联系;过表达CCSAP可以逆转高糖对成骨分化的抑制作用以及过表达KIAA0753可以解除高糖对钙信号通路的抑制,且蛋白KIAA0753和CCSAP之间存在相互作用,综上所述,探究原纤毛、成骨分化和钙信号之间的联系,为糖尿病骨丢失的治疗提供一条新的治疗思路,开辟了一条新的糖尿病药理学治疗思路。
| [1] |
Schwartz A V, Backlund J C, Deboer I H, et al. Risk factors for lower bone mineral density in older adults with type 1 diabetes: a cross-sectional study[J]. Lancet Diabetes Endocrinol, 2022, 10(7): 509-18. doi:10.1016/S2213-8587(22)00103-6 |
| [2] |
Jiao H, Xiao E, Graves D T. Diabetes and its effect on bone and fracture healing[J]. Curr Osteoporos Rep, 2015, 13(5): 327-35. doi:10.1007/s11914-015-0286-8 |
| [3] |
任明诗, 丁羽, 李子涵, 等. 成骨细胞与破骨细胞相互调节作用的研究进展[J]. 中国药理学通报, 2022, 38(6): 822-7. Ren M S, Ding Y, Li Z H, et al. Research progress on interaction between osteoblast and osteoclasts[J]. Chin Pharmacol Bull, 2022, 38(6): 822-7. |
| [4] |
Plotkin L I, Bellido T. Osteocytic signalling pathways as therapeutic targets for bone fragility[J]. Nat Rev Endocrinol, 2016, 12(10): 593-605. doi:10.1038/nrendo.2016.71 |
| [5] |
Liu X, Yan Z, Cai J, et al. Glucose- and glutamine-dependent bioenergetics sensitize bone mechanoresponse after unloading by modulating osteocyte calcium dynamics[J]. J Clin Invest, 2023, 133(3): e164508. doi:10.1172/JCI164508 |
| [6] |
Chevrier V, Bruel A L, Vandam T J, et al. OFIP/KIAA0753 forms a complex with OFD1 and FOR20 at pericentriolar satellites and centrosomes and is mutated in one individual with oral-facial-digital syndrome[J]. Hum Mol Genet, 2016, 25(3): 497-513. doi:10.1093/hmg/ddv488 |
| [7] |
Backer C B, Gutzman J H, Pearson C G, et al. CSAP localizes to polyglutamylated microtubules and promotes proper cilia function and zebrafish development[J]. Mol Biol Cell, 2012, 23(11): 2122-30. doi:10.1091/mbc.e11-11-0931 |
| [8] |
Gerdes J M, Christou-savina S, Xiong Y, et al. Ciliary dysfunction impairs beta-cell insulin secretion and promotes development of type 2 diabetes in rodents[J]. Nat Commun, 2014, 5: 5308. doi:10.1038/ncomms6308 |
| [9] |
Chinipardaz Z, Yuan G, Liu M, et al. Diabetes impairs fracture healing through foxo1 mediated disruption of ciliogenesis[J]. Cell Death Discov, 2023, 9(1): 299-307. doi:10.1038/s41420-023-01562-3 |
| [10] |
Karsenty G, Khosla S. The crosstalk between bone remodeling and energy metabolism: a translational perspective[J]. Cell Metab, 2022, 34(6): 805-17. doi:10.1016/j.cmet.2022.04.010 |
| [11] |
Hofbauer L C, Busse B, Eastell R, et al. Bone fragility in diabetes: novel concepts and clinical implications[J]. Lancet Diabetes Endocrinol, 2022, 10(3): 207-20. doi:10.1016/S2213-8587(21)00347-8 |
| [12] |
Schini M, Vilaca T, Gossiel F, et al. Bone turnover markers: basic biology to clinical applications[J]. Endocr Rev, 2023, 44(3): 417-73. doi:10.1210/endrev/bnac031 |
| [13] |
Haarhaus M, Brandenburg V, Kalantar-zadeh K, et al. Alkaline phosphatase: a novel treatment target for cardiovascular disease in CKD[J]. Nat Rev Nephrol, 2017, 13(7): 429-42. doi:10.1038/nrneph.2017.60 |
| [14] |
Smith C, Voisin S, Alsaedi A, et al. Osteocalcin and its forms across the lifespan in adult men[J]. Bone, 2020, 130: 115085. doi:10.1016/j.bone.2019.115085 |
| [15] |
Dai B, Xu J, Li X, et al. Macrophages in epididymal adipose tissue secrete osteopontin to regulate bone homeostasis[J]. Nat Commun, 2022, 13(1): 427. doi:10.1038/s41467-021-27683-w |
| [16] |
Lewis K J. Osteocyte calcium signaling - a potential translator of mechanical load to mechanobiology[J]. Bone, 2021, 153: 116136. doi:10.1016/j.bone.2021.116136 |
| [17] |
Takarada T, Hinoi E, Nakazato R, et al. An analysis of skeletal development in osteoblast-specific and chondrocyte-specific runt-related transcription factor-2 (Runx2) knockout mice[J]. J Bone Miner Res, 2013, 28(10): 2064-9. doi:10.1002/jbmr.1945 |
| [18] |
Dave J, Raad N, Mittal N, et al. Gene editing reverses arrhythmia susceptibility in humanized PLN-R14del mice: modelling a European cardiomyopathy with global impact[J]. Cardiovasc Res, 2022, 118(15): 3140-50. doi:10.1093/cvr/cvac021 |

