

2. 河南中医药大学第一临床医学院,河南 郑州 450000
2. First Clinical Medical College, Henan University of Chinese Medicine, Zhengzhou 450000, China
脑卒中已经成为中国最严重的公共卫生问题之一,影响人们的健康,其中缺血性卒中占80%~85%[1]。脑缺血/再灌注损伤(cerebral ischemia reperfusion injury,CIRI)是指脑组织血供恢复后发生的继发性脑损伤,其病理生理过程主要与细胞凋亡、神经炎症、铁自噬和钙超载等有关[2]。环鸟苷酸-腺苷酸合成酶(cyclic GMP-AMP synthase,cGAS)-干扰素基因刺激因子(stimulator of interferon genes,STING)信号通路参与中枢神经损伤过程[3],抑制该信号通路可以维持组织细胞内稳态,减轻CIRI。同时,了解CIRI发生的生理病理过程,制定有效的治疗方法对于CIRI及损伤后的康复和生活质量的提高至关重要。
1 cGAS-STING信号通路概述cGAS是一种在天然免疫信号通路中起到重要作用的模式识别受体(pattern recognition receptor,PRR),可以识别各种来源的双链DNA(double-stranded DNA,dsDNA),例如病毒中的致病DNA、逆转录病毒、细菌和寄生虫及染色体或线粒体的自身DNA,当结合双链DNA时被激活。激活后的cGAS将底物ATP和GTP催化成2′3′-cGAMP[4],作为第二信使,被内质网膜上的STING识别。STING是一种跨膜蛋白,以二聚体形式存在于细胞内质网中,识别cGAMP后,构象发生改变,形成寡聚体,从内质网经内质网-高尔基体中间体运输到高尔基体,在高尔基体上招募并结合TANK结合激酶1(TANK-binding kinase 1,TBK1)和IKB激酶(IKB kinase,IKK)。TBK1介导干扰素调节因子3(interferon regulatory factor 3,IRF3)磷酸化,触发Ⅰ型干扰素的产生,启动细胞自主防御措施。被TKB1磷酸化激活的IRF3和促凋亡蛋白Bax结合形成复合物,将会直接诱导细胞凋亡[5-6]。STING结合并激活IKK,从而激活转录因子核因子κB(nuclear factor kappa B,NF-κB),调控下游促炎因子的表达[7]。但目前关于TBK1和NF-κB作为cGAS-SITNG信号通路下游转录因子的具体调控尚不清楚,需要进一步的研究来阐明这一途径中调节TBK1和NF-κB活性的确切作用机制和因素。STING在多个生物学和病理过程中起着关键作用,包括衰老、内质网应激、脂肪酸代谢、氧化应激及细胞死亡过程,参与多种疾病的进展[8]。cGAS会被自身DNA激活,如线粒体DNA(mitochondrial DNA,mtDNA),因线粒体应激或基因组不稳定性DNA损伤等病理因素,使cGAS异常定位在胞质中,导致与各种疾病相关的无菌炎症和组织器官的损伤[9](Fig 1)。
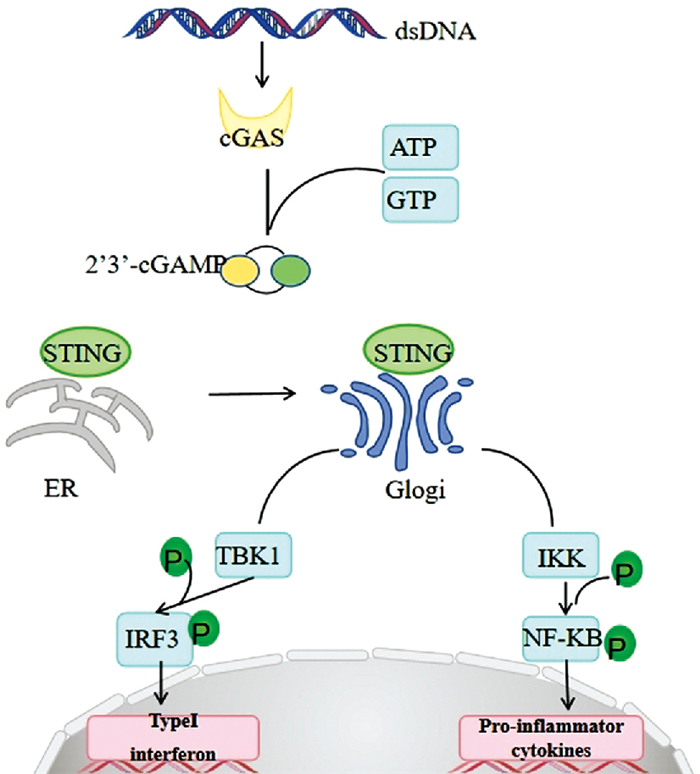
|
| Fig 1 cGAS-STING pathway mechanism |
脑缺血后,血流量严重降低会加重脑组织损伤,然而通过Willis环的侧支血液供应可以使一部分细胞在一定时间段内保持活力,这段可以挽救的大脑区域被称为缺血半暗带。恢复缺血半暗带血流的再灌注治疗,虽然可以挽救因缺血缺氧即将死亡的细胞,但也可以释放炎症因子,加重细胞损伤,导致脑组织进一步受损。CIRI涉及多个病理过程,其中细胞凋亡、神经炎症、铁自噬、钙超载等被认为在CIRI中发挥关键作用[10]。研究表明,cGAS-STING信号通路参与了缺血/再灌注的病理过程[11]。cGAS是核苷酸转移酶家族成员,对DNA具有识别作用,在脑缺血期间,胞质内自源性dsDNA释放,被cGAS所捕获识别,进而通过结合STING增加炎性细胞因子的产生,并促进细胞凋亡。有临床卒中模型研究表明,通过药理学或遗传学方法阻断cGAS-STING信号可以减少凋亡、神经炎症、铁自噬、钙超载等细胞过程,进而改善CIRI,靶向cGAS-STING信号通路可能是治疗缺血性脑卒中的一种有前途的治疗方法[8]。
2.1 cGAS-STING信号通路激活Bak、Bax参与CIRI细胞凋亡细胞凋亡是细胞死亡的一种调节形式,在再灌注过程中会被触发或加速,加重脑梗死患者的神经损伤,因此,及时干预细胞凋亡有利于CIRI的预后。在先天免疫细胞中,cGAS-STING信号通路可以感知胞质DNA的存在,从而启动细胞因子的产生和诱导凋亡[12]。刺激STING通路可以直接激活内皮细胞,导致炎性细胞因子和趋化因子的产生,促进细胞凋亡。细胞凋亡与线粒体解体关系密切,mtDNA完整性、复制和修复过程的破坏,可激活cGAS-STING信号通路。Bcl-2家族蛋白通过调节线粒体外膜通透性,在细胞内凋亡信号转导中发挥重要作用,激活下游caspase级联反应,启动细胞凋亡,促使凋亡细胞产生Ⅰ型干扰素[13]。
Bax和Bak是Bcl-2家族的两个接受执行器,主要作用是破坏线粒体外膜,将促凋亡因子释放到细胞质中。有研究发现,cGAS-STING信号通路可以激活促凋亡蛋白Bax、Bak,介导干细胞及内皮细胞的凋亡。cGAS可通过降低Bcl-2表达和增加Bax表达,介导caspase-3依赖性细胞凋亡程序的激活[14]。Bax、Bak诱导的线粒体损伤在caspase沉默的情况下也会触发mtDNA的释放,激活cGAS-STING通路,导致Ⅰ型干扰素的产生,并导致促炎类型的细胞死亡,加重缺血/再灌注神经细胞损伤。Li等[15]通过缺血/再灌注诱导的心肌损伤小鼠模型研究表明,野黄芩苷(scutellarin,SCU)可以通过抑制cGAS-STING信号通路的激活、下调Bax和caspase-3的表达水平、促进Bcl-2的表达,抑制细胞凋亡,改善缺血再灌注诱导的心肌损伤小鼠的心脏功能,SCU在CIRI中也具有抗凋亡,保护神经的作用。申明琪等[16]通过对缺血缺氧性脑损伤大鼠模型给予脑苷肌肽治疗后,发现cGAS-STING信号通路被激活,脑苷肌肽可以有效抑制cGAS-STING信号通路,抑制细胞凋亡,减轻缺血缺氧造成的脑组织损伤。细胞凋亡是CIRI后神经元死亡的主要模式,阻断神经元凋亡是缓解CIRI最重要的步骤,因此,通过抑制cGAS-STING信号通路可减少细胞凋亡,从而改善CIRI。
2.2 cGAS-STING信号通路参与CIRI小胶质细胞介导的神经炎症脑缺血/再灌注后炎症细胞迅速被激活,受损组织产生大量活性氧(reactive oxygen species,ROS)和促炎介质,如炎性细胞因子、趋化因子,并介导血脑屏障的破坏和一系列炎症级联反应的产生。神经炎症涉及中央系统的所有细胞,小胶质细胞激活在中枢神经损伤中发挥作用[17],通过调节小胶质细胞的表型可以减轻脑缺血损伤引起的神经炎症和细胞焦亡。cGAS是一种关键的细胞质DNA传感器,在缺血性卒中后,与STING相互作用,并随着小胶质细胞的激活和细胞焦亡而明显上调,而cGAS拮抗剂A151可以通过抑制cGAS-STING信号通路,有效减弱这些反应过程,表明抑制cGAS的激活可以减轻脑损伤炎症负担,为脑卒中提供潜在的治疗机会[18]。
组蛋白去乙酰化酶3(histone deacetylase 3,HDAC3)是炎症的积极调节因子,小胶质细胞中的HDAC3缺失可以抑制cGAS-STING介导的自身免疫性反应。Liao等[19]通过采用细胞生物学、分子和生化方法发现,p65蛋白作为NF-κB信号通路的一个重要调节因子,可能以非规范的方式调节cGAS的转录。p65的敲低导致cGAS的表达降低,从而破坏下游Ⅰ型干扰素通路的激活,表明p65可能是cGAS转录的上游调控因子。小胶质细胞中HDAC3缺失使p65的核定位降低,从而下调cGAS的表达和cGAS-STING信号通路的激活,说明HDAC3-p65-cGAS-STING信号通路可能是缺血性卒中的一个新的治疗途径。另外,除了对cGAS表达的转录调控外,发现HDAC3也可作用于cGAS的下游,因为HDAC3的敲低和抑制明显降低了cGAS激活的效应物cGAMP对STING和IRF3的磷酸化,但此通路的确切机制还需要进一步研究。
2.3 cGAS-STING信号通路激活核受体共激活因子4(nuclear receptor coactivator 4,NCOA4)介导的铁自噬加重CIRI铁自噬通过靶向铁蛋白维持细胞内铁代谢稳态,生理水平上适度的铁蛋白自噬维持了铁代谢的平衡,但在CIRI的早期阶段,铁蛋白自噬过度被激活,大量不稳定的铁被释放,激活氧化应激反应,导致脑损伤加重。NCOA4是一种铁蛋白自噬受体,通过自噬体-溶酶体途径结合铁蛋白并介导其降解,释放游离铁,与细胞膜脂质过氧化,引发炎症反应,加重CIRI。这表明NCOA4介导的铁蛋白自噬在CIRI中发挥重要作用,可成为预防和治疗CIRI的靶点之一。cGAS-STING信号通路在CIRI早期被激活,可通过调节细胞程序(如自噬)参与缺血/再灌注损伤过程。研究表明,cGAS和STING过表达均可触发自噬,将受损的线粒体和病原体从细胞质中清除[20]。STING可直接与NCOA4相互作用,驱动细胞死亡,释放游离亚铁并导致脂质过氧化级联反应。同时,NCOA4和STING之间相互作用增强了STING二聚体的形成,降低细胞核内NCOA4的水平[21]。
有研究表明,再灌注开始后的6 h是铁蛋白降解最明显的时候,cGAS-STING信号通路被迅速激活[22],在这一阶段进行有效的干预以减少损伤的操作具有重要的临床价值。Li等[20]建立脑缺血/再灌注NCOA4沉默小鼠模型,发现脑缺血再灌注早期NCOA4介导的铁自噬会加重脑组织损伤。为研究cGAS-STING信号通路是否能调节NCOA4介导的铁自噬,进一步通过建立CIRI和过表达NCOA4的小鼠模型,给予cGAS抑制剂,发现当cGAS-STING信号通路被抑制时,铁蛋白自噬、氧化应激和细胞凋亡也受到抑制,CIRI得到改善。综上表明,cGAS-STING信号通路通过激活NCOA4介导的铁自噬,加重CIRI。cGAS-STING信号通路与NCOA4介导的铁蛋白自噬之间的关系在脓毒症和细胞衰老中也得到了类似的验证,可作为脓毒症和细胞衰老相关疾病的有效靶点[21]。
铁和氧化氢通过芬顿反应促进脂质氧化,是引起铁死亡脂质ROS积累的主要途径。大量实验研究表明抑制铁死亡,可以减轻CIRI,因此抑制铁死亡也是保护CIRI的一个重要途径。有研究表明,STING的下游靶点IRF3参与脂质过氧化和铁死亡[23]。另外,谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)可维持细胞氧化还原稳态,促进STING的激活,而GPX4的失活增加脂质过氧化的产生,诱导STING羰基化并抑制其从内质网到高尔基体的运输,从而抑制cGAS-STING信号通路的激活[24]。因此,抑制cGAS-STING信号通路可以有效降低脑缺血/再灌注后铁死亡反应,从而减轻神经元损伤。
2.4 mtDNA激活cGAS-STING信号通路参与CIRI钙超载钙是调节许多细胞生理和生物功能的第二信使。CIRI发生后,氧化应激等各种损伤会破坏细胞膜离子通道和膜通透性,导致大量的钙离子向内流动,引起神经元结构损伤、脑血管功能障碍等多种异常,最终激活缺血区神经元的凋亡通路。钙超载会导致线粒体稳态失衡,线粒体膜发生破裂,从而释放易受核酸内切酶消化的mtDNA。mtDNA在细胞质中会被cGAS识别,继而激活干扰素刺激因子,促进Ⅰ型干扰素的释放。mtDNA到达细胞质的通道主要有两个:一种是通过线粒体内膜中的Bak/Bax大孔逃逸到细胞质中;另一种可能经过线粒体通透性转换孔(mitochondrial permeability transition pore,mPTP)到达细胞质中,被cGAS识别。外源性Bak/Bax介导的细胞凋亡的激活会导致mtDNA触发cGAS-STING信号通路,导致死亡的细胞产生Ⅰ型干扰素,而抑制caspase-3、caspase-7和caspase-9能有效阻断mtDNA诱导cGAS-STING信号通路激活,减少Ⅰ型干扰素和炎症反应的发生。在氧化应激状态下,线粒体通透性过渡孔瞬间打开,位于线粒体基质中的mtDNA可通过mPTP穿过线粒体内膜和线粒体外膜到达细胞质中,被cGAS识别并诱导第二信使cGAMP的产生,激活STING-IRF3信号转导,促进Ⅰ型干扰素刺激反应,增加炎症因子的释放,加重CIRI。此外,关于mtDNA释放到细胞质的过程目前仍存在一些争议,如mPTP是否足以允许mtDNA从线粒体基质易位到细胞质中,因此还需更多的相关研究。
缺血后再灌注可引起内质网损伤和功能障碍,激活下游信号通路,促进CIRI,mtDNA-cGAS-STING-IRF3信号通路已被证明可增强内质网应激和细胞死亡。关于cGAS-STING和钙稳态之间的发生过程,以及mtDNA-cGAS-STING信号通路与钙稳态在缺血/再灌注中的作用机制尚不明确,缺乏动物模型实验研究。综上,通过抑制mtDNA的释放,抑制cGAS-STING信号通路的激活,从而减少脑缺血/再灌注神经元损伤,可能为CIRI的临床治疗提供新的思路。
3 总结与展望近来年,相关学者对cGAS-STING信号通路的信号转导产生极大的兴趣,进行了许多相关研究,如文中讨论的,cGAS-STING信号通路是先天免疫的一个核心危险感知机制,可识别多种来源的DNA,被激活后在多种疾病中发生作用。在CIRI过程中,释放的dsDNA或mtDNA在胞质中被cGAS识别,进而激活STING通路,促进神经级联反应的发生,加重损伤。因此,可以通过破坏cGAS与dsDNA/mtDNA的结合,抑制cGAS-STING信号通路的激活,改善脑组织病理损伤和神经功能缺损。综上,cGAS-STING信号通路可以作为治疗CIRI的有效靶点之一。
尽管cGAS-STING信号通路的作用机制已经取得了很大的进展,但仍有尚不明确的问题:(1)因CIRI发生的生理病理过程较为复杂,关于此信号通路在CIRI中的作用机制尚未阐明,还需进一步探索,进行更多关于cGAS-STING信号通路参与CIRI发病机制的相关研究。(2)目前关于cGAS-STING的研究,主要以动物实验为主,缺乏相关临床试验验证和分子生物学研究等,未来应进一步深入研究,以期为临床中CIRI及其他疾病的治疗提供更多方案。(3)许多研究表明cGAS-STING信号通路的激活会增加疾病的严重程度,但cGAS-STING对疾病的发展是否也具有积极作用,尚未有定论,这需要更多的研究去验证。
| [1] |
GBD 2016 Neurology Collaborators. Global, regional, and national burden of stroke, 1990-2016:a systematic analysis for the Global Burden of Disease Study 2016[J]. Lancet Neurol, 2019, 18(5): 439-58. doi:10.1016/S1474-4422(19)30034-1 |
| [2] |
Zeng X, Zhang Y D, Ma R Y, et al. Activated Drp1 regulates p62-mediated autophagic flux and aggravates inflammation in cerebral ischemia-reperfusion via the ROS-RIP1/RIP3-exosome axis[J]. Mil Med Res, 2022, 9(1): 25. |
| [3] |
Hu X, Zhang H, Zhang Q, et al. Emerging role of STING signaling in CNS injury: inflammation, autophagy, necroptosis, ferroptosis and pyroptosis[J]. J Neuroinflammation, 2022, 19(1): 242. doi:10.1186/s12974-022-02602-y |
| [4] |
Hopfner K P, Hornung V. Molecular mechanisms and cellular functions of cGAS-STING signalling[J]. Nat Rev Mol Cell Biol, 2020, 21(9): 501-21. doi:10.1038/s41580-020-0244-x |
| [5] |
Ablasser A, Chen Z J. cGAS in action: expanding roles in immunity and inflammation[J]. Science, 2019, 363(6431): e8657. doi:10.1126/science.aat8657 |
| [6] |
Chen C, Xu P. Cellular functions of cGAS-STING signaling[J]. Trends Cell Biol, 2023, 33(8): 630-48. doi:10.1016/j.tcb.2022.11.001 |
| [7] |
Zhang D, Liu Y, Zhu Y, et al. A non-canonical cGAS-STING-PERK pathway facilitates the translational program critical for senescence and organ fibrosis[J]. Nat Cell Biol, 2022, 24(5): 766-82. doi:10.1038/s41556-022-00894-z |
| [8] |
Chauhan C, Kaundal R K. Understanding the role of cGAS-STING signaling in ischemic stroke: a new avenue for drug discovery[J]. Expert Opin Drug Discov, 2023, 18(10): 1133-49. doi:10.1080/17460441.2023.2244409 |
| [9] |
Motwani M, Pesiridis S, Fitzgerald K A. DNA sensing by the cGAS-STING pathway in health and disease[J]. Nat Rev Genet, 2019, 20(11): 657-74. doi:10.1038/s41576-019-0151-1 |
| [10] |
Li Y, Sun J, Gu L, et al. Protective effect of CTRP6 on cerebral ischemia/reperfusion injury by attenuating inflammation, oxidative stress and apoptosis in PC12 cells[J]. Mol Med Rep, 2020, 22(1): 344-52. doi:10.3892/mmr.2020.11108 |
| [11] |
Lei C, Tan Y, Ni D, et al. cGAS-STING signaling in ischemic diseases[J]. Clin Chim Acta, 2022, 531: 177-82. doi:10.1016/j.cca.2022.04.003 |
| [12] |
Gulen M F, Koch U, Haag S M, et al. Signalling strength determines proapoptotic functions of STING[J]. Nat Commun, 2017, 8(1): 427. doi:10.1038/s41467-017-00573-w |
| [13] |
Volkmann N, Marassi F M, Newmeyer D D, et al. The rheostat in the membrane: BCL-2 family proteins and apoptosis[J]. Cell Death Differ, 2014, 21(2): 206-15. doi:10.1038/cdd.2013.153 |
| [14] |
Heidegger S, Haas T, Poeck H. Cutting edge in IFN regulation: inflammatory caspases cleave cGAS[J]. Immunity, 2017, 46(3): 333-5. doi:10.1016/j.immuni.2017.03.004 |
| [15] |
Li J K, Song Z P, Hou X Z. Scutellarin ameliorates ischemia/reperfusion injury-induced cardiomyocyte apoptosis and cardiac dysfunction via inhibition of the cGAS-STING pathway[J]. Exp Ther Med, 2023, 25(4): 155. doi:10.3892/etm.2023.11854 |
| [16] |
申明琪, 张丁宁. 脑苷肌肽对缺氧缺血性脑病新生大鼠cGAS/STING通路及海马神经元凋亡的影响[J]. 现代药物与临床, 2020, 35(10): 1943-9. Shen M Q, Zhang D N. Effect of encephaloside on cGAS/STING pathway and hippocampal neuron apoptosis in newborn rats with hypoxic ischemic encephaiopathy[J]. Drugs Clin, 2020, 35(10): 1943-9. |
| [17] |
魏晓佟, 郭瑞, 张启春. 小胶质细胞表型和功能研究进展[J]. 中国药理学通报, 2024, 40(3): 410-5. Wei X T, Guo R, Zhang Q C. Progress in research on the phenotype and function of small glial cells[J]. Chin Pharmacol Bull, 2024, 40(3): 410-5. |
| [18] |
Li Q, Cao Y, Dang C, et al. Inhibition of double-strand DNA-sensing cGAS ameliorates brain injury after ischemic stroke[J]. EMBO Mol Med, 2020, 12(4): e11002. doi:10.15252/emmm.201911002 |
| [19] |
Liao Y, Cheng J, Kong X, et al. HDAC3 inhibition ameliorates ischemia/reperfusion-induced brain injury by regulating the microglial cGAS-STING pathway[J]. Theranostics, 2020, 10(21): 9644-62. doi:10.7150/thno.47651 |
| [20] |
Li B, Wang W, Li Y, et al. cGAS-STING pathway aggravates early cerebral ischemia-reperfusion injury in mice by activating NCOA4-mediated ferritinophagy[J]. Exp Neurol, 2023, 359: 114269. doi:10.1016/j.expneurol.2022.114269 |
| [21] |
Wu J, Liu Q, Zhang X, et al. The interaction between STING and NCOA4 exacerbates lethal sepsis by orchestrating ferroptosis and inflammatory responses in macrophages[J]. Cell Death Dis, 2022, 13(7): 653. doi:10.1038/s41419-022-05115-x |
| [22] |
Li C, Sun G, Chen B, et al. Nuclear receptor coactivator 4-mediated ferritinophagy contributes to cerebral ischemia-induced ferroptosis in ischemic stroke[J]. Pharmacol Res, 2021, 174: 105933. doi:10.1016/j.phrs.2021.105933 |
| [23] |
Chen Y, Fang Z M, Yi X, et al. The interaction between ferroptosis and inflammatory signaling pathways[J]. Cell Death Dis, 2023, 14(3): 205. doi:10.1038/s41419-023-05716-0 |
| [24] |
Jia M, Qin D, Zhao C, et al. Redox homeostasis maintained by GPX4 facilitates STING activation[J]. Nat Immunol, 2020, 21(7): 727-35. doi:10.1038/s41590-020-0699-0 |

