

姜昊(1999-),男,硕士生,研究方向:中药防治代谢性疾病,共同第一作者,E-mail:18264308803@163.com。
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是肝病最常见的原因之一,常伴有肥胖、糖尿病、血脂异常、血压异常等代谢紊乱。在我国,NAFLD的患病率为20%~30%,并且患病率呈逐年上升趋势[1]。NAFLD不仅可以引起肝脏的脂肪变性,还会引起代谢综合征,严重时甚至会引起肝硬化和肝癌。
降脂理肝汤(Jiangzhi Ligan decoction,JZLGD)为名老中医张云鹏治疗NAFLD的临床经验方,由丹参、泽泻、决明子、郁金、海藻和荷叶六味中药组成。该方化痰浊沉积,散瘀血积聚,从而消除肝内瘀积,使得血中痰浊得以清降,从而对NAFLD发挥较好的干预作用[2]。且有研究表明[3],JZLGD可减轻NAFLD大鼠肝脏中的病理损伤,改善肝功能,有效治疗NAFLD。但是,JZLGD治疗NAFLD的研究主要集中于临床和简单的药效实验,作用机制仍不明确。
本研究基于网络药理学探讨JZLGD治疗NAFLD的活性成分、核心靶点及潜在作用通路,并以棕榈酸(palmitic acid,PA)诱导的HepG2细胞为模型,探讨JZLGD调控NAFLD的药效及作用机制,以期为其临床应用及深入研发提供科学依据。
1 材料 1.1 实验药物泽泻、丹参、决明子、郁金、海藻、荷叶购于北京同仁堂药店。
1.2 动物及细胞系健康成年♂ SD大鼠体质量(190~230) g,购自于北京维通利华实验动物技术有限公司,饲养于山东中医药大学实验动物中心屏障设施,实验动物生产许可证编号:SCXK(京)2021-0006,动物实验设施许可证编号:SPF202311049。
1.3 主要实验试剂DMEM基础培养基(货号150410)、胎牛血清(货号164210)均购自武汉普诺赛公司;胰蛋白酶(货号25200056)购自美国Gibco公司;PA(货号P0500)购自默克公司;BCA蛋白浓度测定试剂盒(货号P0012)购自碧云天;TC试剂盒(货号F002-1-1)、TG试剂盒(货号A110-1-1)均购自南京建成生物工程研究所;β-actin(货号4967)、LC3(货号83506)、p62(货号5114)、AMPKα(货号2532)和phospho-AMPKα(货号2531)均购自CST公司;辣根酶标记山羊抗兔IgG(货号ZB-2301)、辣根酶标记山羊抗兔IgG(货号ZB-2305)均购自中杉金桥;AMPK抑制剂(货号171260-1MG)购自Millipore Sigma;氯喹(货号10 mmol·L-1)购自MCE公司。
1.4 主要实验仪器酶标仪(Bio-Tek,Epoch2)、微孔板恒温振荡器(杭州佑宁仪器有限公司,WZ80-2)、凝胶图像分析系统(上海天能科技有限公司,Tanon 4800Multi)。
2 方法 2.1 JZLGD活性成分筛选及靶点预测应用中药系统药理学数据库与分析平台(TCMSP,http://lsp.nwu.edu.cn/tcmsp.php)查找JZLGD中六味中药丹参、荷叶、海藻、泽泻、郁金、决明子所含成分,并综合口服生物利用度(oral bioavailability,OB)和类药性(drug likeness,DL)筛选活性成分。将OB≥30%和DL≥0.18设置为参数进行筛选,并结合2020版《中国药典》和相关文献进行成分补充。将活性成分化合物信息导入SwissTargetPrediction数据库(http://swisstargetprediction.ch/)获取化合物靶点,并通过TCMSP数据库和BATMAN数据库(http://bionet.ncpsb.org.cn/batman-tcm/)进行靶点补充。
2.2 获取NAFLD相关靶点及获取交集基因以“nonalcoholic fatty liver”为关键词在GeneCards数据库(https://www.genecards.org)与OMIM数据库(https://www.omim.org)筛选疾病靶点,通过Venny2.1.0将药物靶点与疾病靶点取交集。
2.3 PPI网络构建将交集基因导入STRING11.5数据库(https://string-db.org/)构建蛋白互作(protein-protein interaction,PPI)网络模型,将生物类别设置成“Homo sapiens”,最小互作阈值设置成“medium confidence”(>0.4),下载TSV文件并通过CytoScape3.9.1对JZLGD对治疗NAFLD的核心蛋白网络进行可视化处理,绘制PPI网络图,通过Network Analyzer分析PPI节点的拓扑参数,根据度值获取核心靶点。
2.4 药物-成分-靶点网络通过Cytoscape 3.9.1软件,对药物、活性成分、靶点之间的联系进行网络图谱,以系统分析JZLGD治疗NAFLD的潜在作用靶点并筛选主要有效成分。
2.5 GO分析和KEGG通路富集分析将JZLGD治疗NAFLD的交集基因输入Metascape数据库(https://metascape.org/),设置P < 0.01,分析其主要的生物学过程。
2.6 分子对接验证从RCSB PDB数据库(https://www.rcsb.org/)和AlphaFold数据库(https://alphafold.ebi.ac.uk/)检索下载核心靶点的3D结构PDB格式文件,小分子化合物3D结构从PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)获取SDF文件,利用OpenBabel-3.1.1软件将SDF文件转为mol2文件,使用Pymol 2.4.0对大分子蛋白靶点去水,去配体,使用AutodockTool 4.0软件将二者进行加氢、计算电荷、确定原子类型处理后保存为pdbqt格式文件备用。采用Autodock Vina对关键成分与核心靶点及自噬相关靶点进行分子对接验证。最后通过Discovery软件将对接结果可视化及相关信号通路,将分析结果导入微生信平台(www.bioinformatics.com.cn)进行可视化。
2.7 JZLGD的制备JZLGD方剂组成为泽泻10 g、决明子30 g、丹参10 g、郁金10 g、海藻30 g、荷叶10 g。根据课题组前期对JZLGD提取工艺的优化结果,提取工艺如下:将药材于11倍量水中,沸后煎煮90 min,提取3次,合并滤液减压浓缩后置于4 ℃冷藏储存。
2.8 含药血清制备健康成年♂ 16只SD大鼠随机分为2组,空白对照组8只、JZLGD给药组8只,采用2倍临床常用剂量给药(21 g·kg-1·d-1),每日2次,连续7 d。末次给药后1 h麻醉,腹主动脉取血,常温静置0.5 h,3 000 r·min-1离心10 min后取上清血清,0.22 μm微孔滤膜过滤,-80 ℃保存备用[4]。
2.9 细胞培养HepG2细胞在37 ℃,5% CO2培养箱中,用含10%胎牛血清、1%双抗的DMEM培养基培养,待细胞汇合度为90%左右时,取对数生长期的细胞用于实验。
2.10 MTT法检测含药血清对细胞活力的影响取对数生长期的HepG2细胞,接种于96孔板,每孔1×104个细胞,10%、15%及20%的空白血清及JZLGD含药血清给药24 h后,每孔加入20 μL MTT试剂培养4 h后,用150 μL的DMSO在室温下摇床上培养10 min,使结晶物充分融解,用酶标仪在490 nm波长下测量吸光度,确定对细胞活力没有影响的血清浓度。
2.11 NAFLD细胞模型的建立及分组给药HepG2细胞以3×108·L-1接种于6孔培养板中,细胞贴壁后,模型组加入终浓度为200 μmol·L-1 PA的培养基培养24 h[5],造模完成后,给予如下处理:对照组(培养基+20%空白血清)、模型组(培养基+20%空白血清)、JZLGD含药血清低剂量组(培养基+10% JZLGD含药血清+10%空白血清),JZLGD含药血清中剂量组(培养基+15% JZLGD含药血清+5%空白血清),JZLGD含药血清高剂量组(培养基+20% JZLGD含药血清),继续培养24 h,进行后续检测。
2.12 细胞给药及TG、TC含量的检测给药结束后,加入胰酶进行消化得到细胞悬液,将制备好的细胞悬液转移至EP管并加入细胞裂解液,裂解后用BCA蛋白定量试剂盒检测蛋白浓度,根据试剂盒说明书进行TC及TG检测[6]。
2.13 油红O染色检测JZLGD含药血清对HepG2细胞内的脂质的影响给药结束后,加PBS漂洗3次,再用PBS漂洗3次,加已配油红O工作液染色10 min,再用PBS漂洗3次,然后加60%异丙醇浸润10 s,最后用PBS洗3次,置于倒置显微镜下观察并拍照。
2.14 Western blot法检测自噬相关蛋白的表达将给药结束后,吸弃上清,PBS轻洗3次,每孔加入150 μL裂解液,置于冰上裂解30 min,4 ℃ 12 000 r·min-1离心15 min取上清,用BCA试剂盒检测蛋白浓度,调至统一浓度后,加入5×Loading Buffer混匀,96 ℃、10 min进行蛋白变性。配制10%和15%丙烯酰胺凝胶,每孔上样30 μg,按80 V 30 min,120 V 60 min进行电泳[7];260 mA转膜2 h,5%脱脂奶粉室温封闭3 h,按1 ∶ 1 000稀释β-actin、AMPKα、p-AMPKα、LC3和p62一抗,4 ℃摇床孵育过夜;次日,将膜用TBST洗5次,每次5 min,室温孵二抗2 h,TBST洗5次,每次5 min,配制显影液,用凝胶成像仪成像分析。
2.15 CC和CQ对JZLGD治疗NAFLD的干预作用取生长状态良好,汇合度为90%的HepG2细胞,接种于6孔板,每孔30×104个细胞,在37 ℃,5%CO2下培养24 h,加入含药培养基和PA 2 mL,同时设置正常对照组和模型对照组,H+CC和H+CQ组,加入CC(10 μmol·L-1)[8]和CQ(20 μmol·L-1)[9]JZLGD干预24 h。将制备好的细胞悬液转移至EP管,1 000 r·min-1离心10 min,弃上清液,留细胞沉淀。用PBS洗1~2次,1 000 r·min-1离心10 min,弃上清液,留细胞沉淀。加入0.1 mL PBS进行匀浆,冰水浴条件下加入TritonX-100,2%裂解液进行裂解,裂解好的液体用试剂盒检测各孔的TG、TC含量;用BCA蛋白定量试剂盒检测各孔蛋白浓度;计算各孔TG、TC含量与蛋白浓度的比值,即为各孔TG、TC的相对含量,实验重复3次。
2.16 统计学方法通过GraphPad Prism 8.0软件进行处理,数据以x±s表示,组间比较采用单因素方差分析,检验水准α=0.05。
3 结果 3.1 JZLGD有效成分的筛选与靶点预测从TCMSP数据库中以OB≥30%,DL≥0.18为条件,并通过文献检索对候选活性成分补充[10-14],共检索到JZLGD活性成分161个,其中丹参68个,海藻5个,荷叶25个,决明子24个,郁金21个,泽泻18个。通过Swiss Target Prediction数据库查询161个成分的相关靶点,筛选可能性值≥0.6的靶点为可能靶点,并通过TCMSP数据库、BATMAN数据库补充,剔除无靶点成分,最终得到靶点812个,清除重复项后得373个靶点,涉及有效成分64个(见中国知网本文增强出版附加材料1)。
3.2 交集基因根据GeneCards数据库与OMIM数据库所找疾病靶点,通过Venny2.1.0网站与药物靶点取得交集基因(Fig 1),共109个(见中国知网本文增强出版附加材料2)。
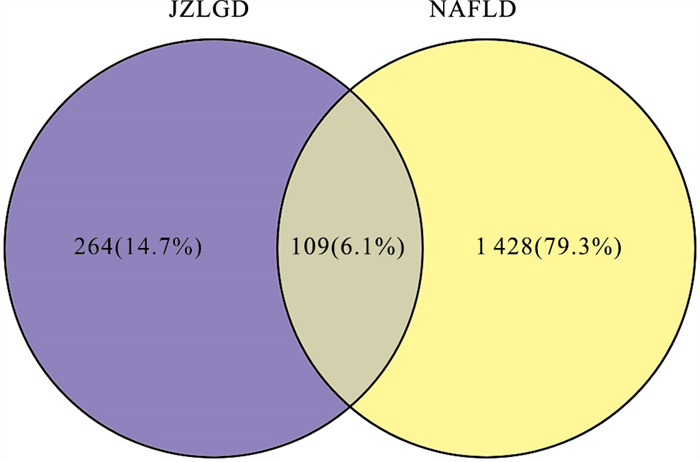
|
| Fig 1 Number of potential targets for treatment of NAFLD by JZLGD |
将JZLGD与NAFLD交集基因导入String网站,获得PPI图(Fig 2)。其中节点数108、边数1093、平均节点度20.2、平均局部聚类系数0.615;网络节点代表蛋白质,连线代表蛋白质之间的相互作用。邻接节点个数越多,成为关键基因的概率越大。将String网站输出结果导入在Cytoscape 3.9.1软件,采用CytoNCA计算网络节点的dgree值,根据dgree值大小排序,筛选出胰岛素(insulin,INS)、苏氨酸蛋白激酶(RAC-alpha serine/threonine-protein kinase,AKT1)、肿瘤坏死因子配体(tumor necrosis factor,TNF)、过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor gamma,PPARγ)等核心靶点(Tab 1)。
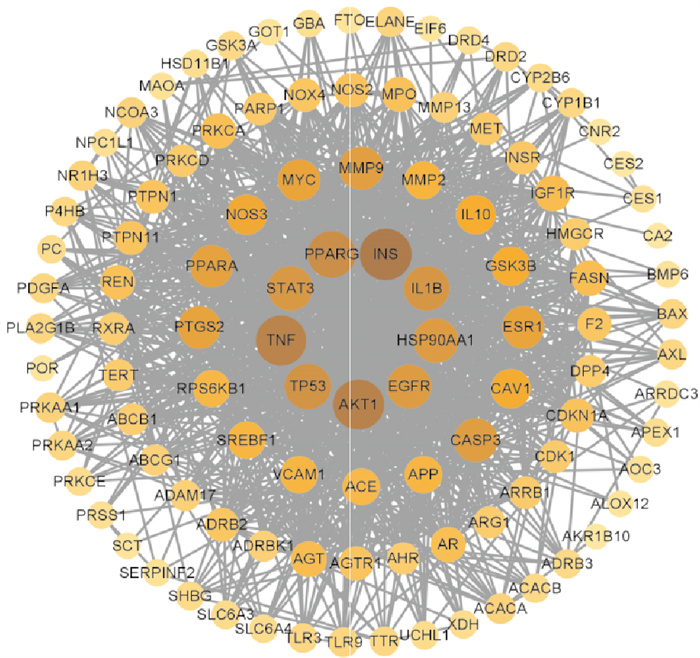
|
| Fig 2 JZLGD in NAFLD target protein PPI network diagram |
| Target | DC | EC | BC | CC |
| INS | 70 | 0.21385805 | 1304.6925 | 0.7394366 |
| AKT1 | 66 | 0.21338384 | 740.4505 | 0.7191781 |
| TNF | 65 | 0.21355136 | 628.978 | 0.7094595 |
| PPARG | 58 | 0.18538475 | 826.3457 | 0.6730769 |
| TP53 | 55 | 0.19419509 | 383.70145 | 0.6603774 |
| IL1B | 53 | 0.18883392 | 346.87756 | 0.65625 |
| STAT3 | 52 | 0.18850568 | 253.77391 | 0.6402439 |
| HSP90AA1 | 50 | 0.17262 | 465.64575 | 0.6402439 |
| EGFR | 50 | 0.17301042 | 370.74857 | 0.6441718 |
| CASP3 | 49 | 0.1843369 | 203.14464 | 0.6363636 |
根据PPI网络数据找出的关键靶点,将药物、关键靶点、关键靶点相关成分等信息导入Cytoscape 3.9.1软件,得到药物-成分-关键靶点网络(Fig 3),结合成分的水溶性及2020年版《中国药典》对各味中药指标性成分的规定,选取隐丹参酮、荷叶碱、儿茶素、丹参素、槲皮素、芦荟大黄素作为主要有效成分。
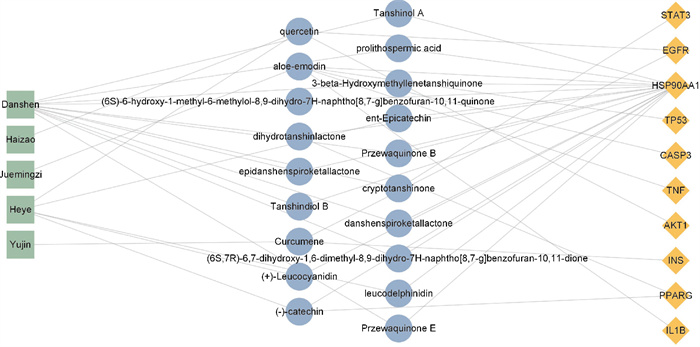
|
| Fig 3 Diagram of "drug-composition-key target" network of JZLGD for NAFLD |
通过metascape网站对相关靶点蛋白进行GO功能注释分析,包括细胞组分、分子功能和生物过程3部分。选取P值最小的前10个进行作图呈现(Fig 4)。结果发现,这些蛋白在生物过程方面主要涉及对激素的反应、对异生刺激的反应、磷酸化的正向调节、细胞对脂质的反应、小分子代谢过程的调控等过程;在细胞组分方面主要参与膜筏、裂解液泡、神经元细胞体等部分;在分子功能方面主要包括核受体活性、氧化还原酶活性、蛋白同源二聚化活性等过程。
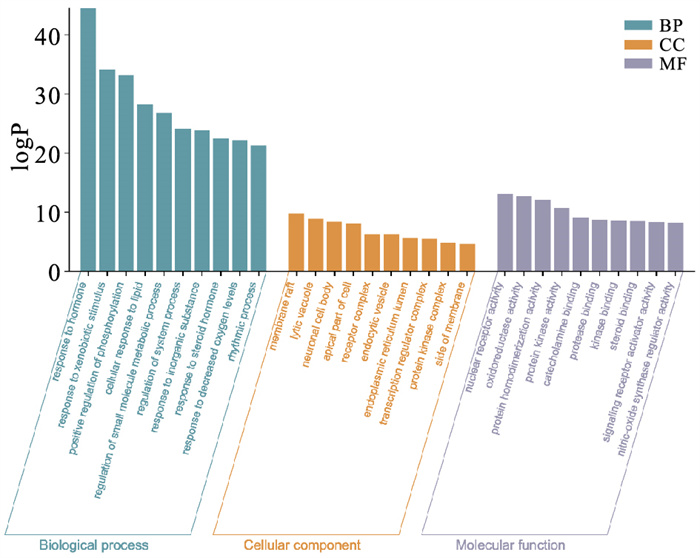
|
| Fig 4 GO functional enrichment analysis |
通过metascape网站进行KEGG通路富集分析,设置P < 0.01,选取排名前15的结果进行数据可视化。富集的KEGG通路主要包括胰岛素抵抗、NAFLD、AMPK信号通路、酒精性肝病、HIF-1信号通路、mTOR信号通路、自噬等(Fig 5)。值得注意的是,AMPK信号通路及mTOR信号通路都与自噬存在密切的联系,提示JZLGD干预NAFLD的作用机制与自噬紧密相关。
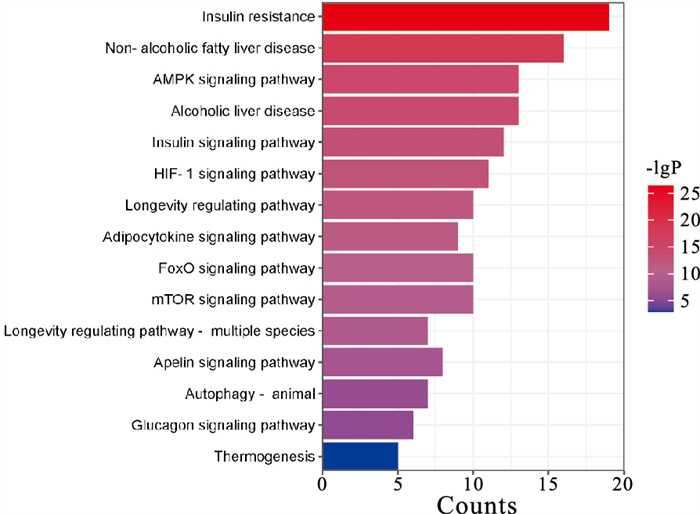
|
| Fig 5 KEGG path analysis |
采用Autodock Vina对选取的关键成分与排名前4的核心靶点及自噬相关靶点进行分子对接验证,对接结果见Tab 2。一般认为,结合能 < -20.9 kJ·mol-1,表明靶蛋白与活性成分结合性较好,且结合能越小表明两者对接越好。结果表明,关键成分与关键靶点及自噬相关靶点大部分可以较好结合,结合能TOP5分别为隐丹参酮-mTOR、荷叶碱-mTOR、槲皮素-PPARG、荷叶碱-AMPK、芦荟大黄素-mTOR(Fig 6)。
| Component name | INS | AKT1 | PPARG | TNF | AMPK | mTOR | LC3b | p62 |
| Source | PDB | PDB | PDB | PDB | PDB | PDB | AlphaFold | AlphaFold |
| ID | 7nhu | 7myx | 6t1s | 5uui | 4eai | 4dri | Q9GZQ8 | Q13501 |
| Cryptotanshinone | -7.4 | -7.6 | -8.3 | -7.7 | -8.7 | -10.7 | -8.1 | -7.1 |
| (-)-catechin | -5.6 | -6.3 | -8.7 | -6.6 | -8.4 | -8.6 | -7.3 | -6.8 |
| Aloe-emodin | -6.2 | -6.8 | -7.1 | -6.8 | -8.7 | -9.2 | -7.5 | -6.1 |
| Quercetin | -5.9 | -6.7 | -9.6 | -6.9 | -8.5 | -9.1 | -7.5 | -7.1 |
| Tanshinol A | -4.9 | -5.4 | -6.7 | -6.2 | -6.9 | -6.5 | -6.1 | -5.3 |
| Nuciferin | -6.3 | -6.3 | -7.4 | -6.5 | -9.4 | -9.6 | -7.3 | -6.2 |
| Atorvastatin calcium | -6.7 | -7.6 | -7.5 | -6 | -8.6 | -9.9 | -7.5 | -6.1 |
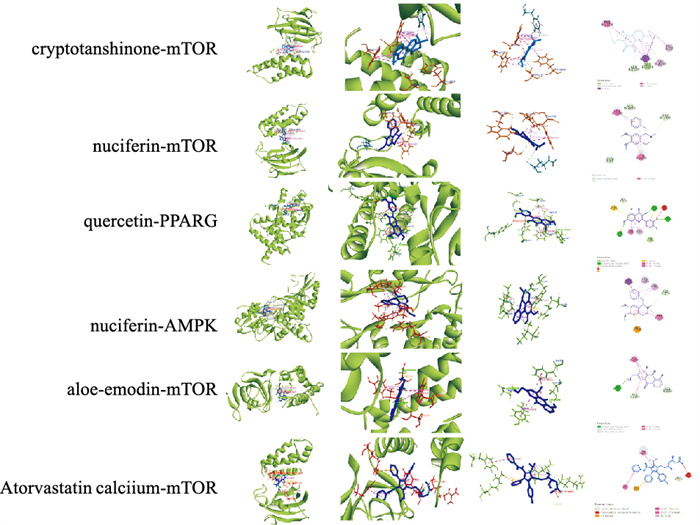
|
| Fig 6 Binding energy TOP5 docking results |
如Fig 7所示,与对照组比较,10%及15%的空白血清及含药血清会不同浓度地降低细胞活力,20%空白血清及含药血清对HepG2细胞均无影响,因此,后续实验选用20%浓度的血清。
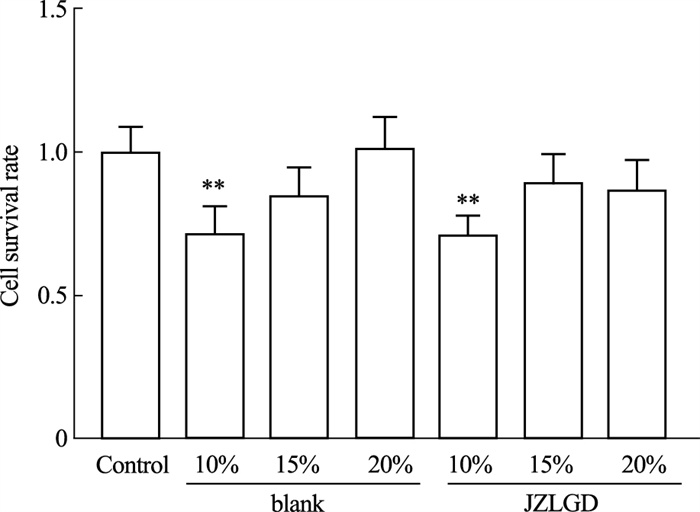
|
| Fig 7 Effect of JZLGD drug-containing serum on HepG2 cell viability (x±s, n=6) **P<0.01 vs Control group. |
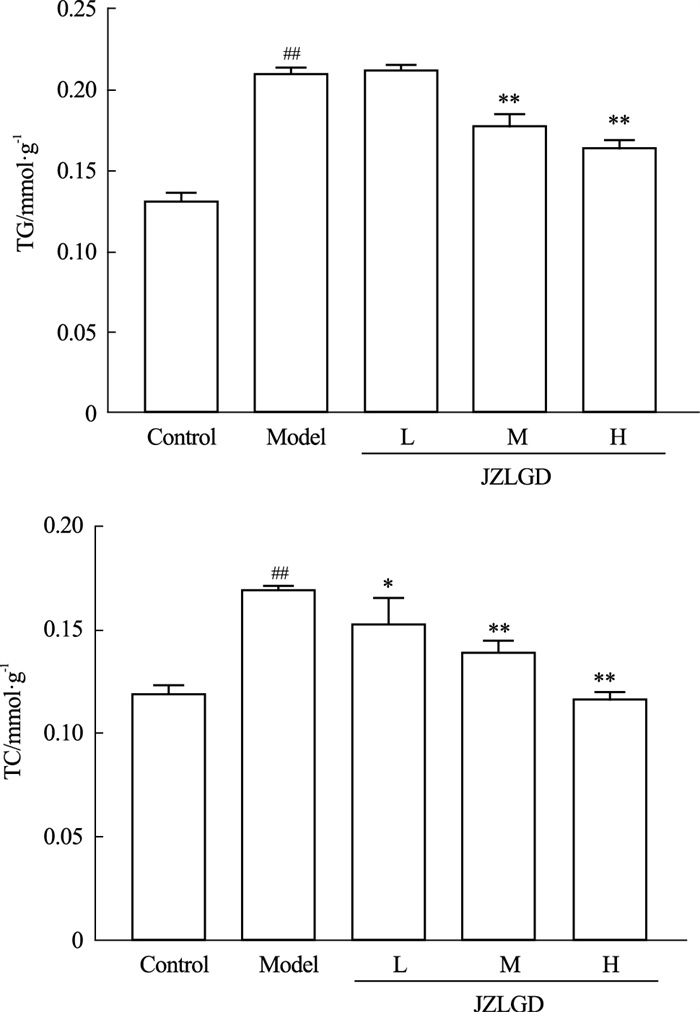
如Fig 8所示,PA诱导的HepG2细胞内TG和TC含量明显高于正常对照组,说明胞内脂质蓄积明显;JZLGD含药血清干预后,TG、TC的水平呈剂量依赖性下降,且高剂量组的效果尤为明显,说明JZLGD含药血清可以明显抑制肝脏脂质蓄积。
|
| Fig 8 Micrograph of effect of JZLGD drug-containing serum on lipid accumulation in HepG2 cells |
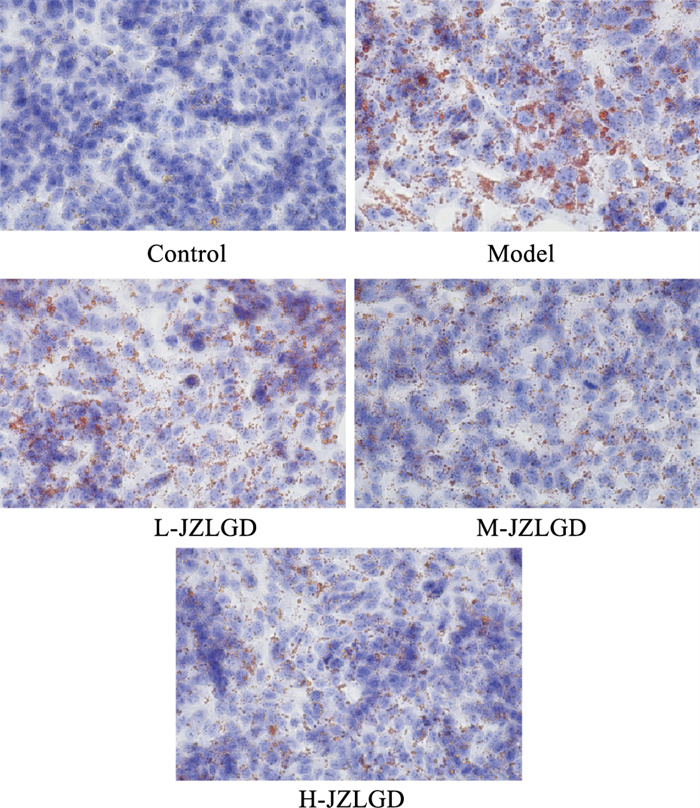
通过油红O染色观察细胞内脂质沉积的差异。如Fig 9所示,与对照组相比,PA诱导的HepG2细胞内出现大片橘色染色,脂滴大且多,表明细胞内脂质沉积明显增加,经JZLGD含药血清干预后,细胞内橘红色染色明显减少,脂质沉积随JZLGD含药血清给药剂量的增加而逐渐减少。
|
| Fig 9 Effect of JZLGD drug-containing serum on TG and TC contents in PA-induced HepG2 cells (x±s, n=3) ##P < 0.01 vs Control group; *P < 0.05, **P<0.01 vs Model control group. |
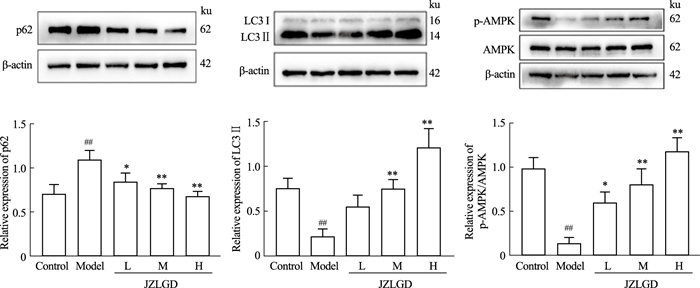
如Fig 10所示,与对照组相比,模型组LC3Ⅱ的表达水平明显降低,而p62表达量明显升高,说明自噬信号通路受到抑制;JZLGD含药血清处理后,与模型组相比,LC3Ⅱ的表达水平提升,同时下调p62水平,其中以高剂量组效果明显。通过检测AMPKα和p-AMPKα的蛋白表达水平,各组AMPKα的表达没有明显差异,模型组p-AMPKα/AMPKα比对照组明显降低,JZLGD含药血清干预后,AMPK磷酸化程度升高。提示JZLGD含药血清很有可能通过AMPK调节自噬。
|
| Fig 10 Expression of autophagy related proteins in HepG2 cells by JZLGD drug-containing serum (x±s, n=3) ##P < 0.01 vs Control group; *P < 0.05, **P < 0.01 vs Model group. |
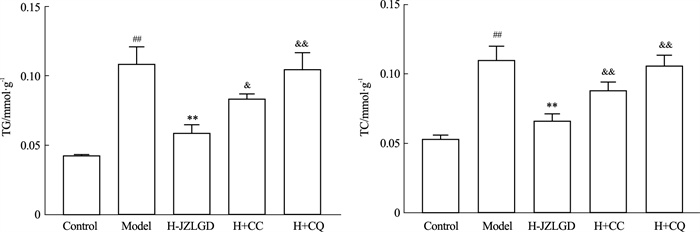
如Fig 11所示,与对照组相比,模型组TC、TG水平明显降低,H-JZLGD干预后,可以降低TG水平,H+CC和H+QC干预后,TG水平升高,说明JZLGD含药血清可能通过AMPK调控自噬改善NAFLD。
|
| Fig 11 Effects of CC and CQ on the intervention of TC and TG in NAFLD by JZLGD drug-containing serum (x±s, n=3) ##P < 0.01 vs Control group; *P < 0.05, **P < 0.01 vs Model group; & P < 0.05, &&P < 0.01 vs H-JZLGD group. |
中医认为,NAFLD属“肝癖”“肝积”“胁痛”等中医学范畴,“痰瘀阻络”为NAFLD发生发展的重要病机[15]。痰瘀互结,痰湿与瘀血易于胶结凝固,形成痰浊瘀血等浊毒并毒损肝络,导致肝失疏泄加重,周而复始,导致NAFLD的发生和发展[16-18],能够清除“痰浊瘀血”的化痰祛瘀类中药在NAFLD治疗中发挥重要作用[19]。
中医认为精微滞留蓄积而为浊,细胞中衰老的细胞器、错误合成的蛋白质,都是中医”痰瘀”在细胞微观层面上的体现,所以在NAFLD病变中所表现出的胆固醇、TG升高,也是其痰浊的物质基础和微观体现[20]。而自噬通过对自身胞质内物质和(或)细胞器进行包裹吞隆形成自噬体,进一步与溶酶体发生融合形成自噬溶酶体,最终将吞噬物降解,供给细胞重新利用或排出细胞外,进而稳定细胞形态和结构,对维持细胞正常功能具有重要意义[21]。自噬是肝细胞脂类代谢的关键环节,可以通过降解脂滴直接参与脂质代谢。自噬受到抑制时,可出现脂肪变性,导致明显的脂质沉积[22]。其发生与肝细胞脂类代谢平衡密切相关,在NAFLD发生发展中发挥关键作用。在NAFLD长期慢性脂质刺激下,自噬功能异常,引起肝脏脂肪蓄积,进而加剧肝脏代谢异常。因此,以自噬通路为靶点对祛瘀化痰类中药进行防治NAFLD的研究,为中医药治疗此病提供新的思路。
本研究网络药理学及分子对接方法结果表明,JZLGD可以通过胰岛素抵抗、AMPK、mTOR、自噬等信号通路干预NAFLD。AMPK作为细胞能量状态的主要传感器,参与脂质代谢、糖代谢等能量物质代谢过程,AMPK亦是调节细胞自噬的经典信号通路之一[23],因此,推测JZLGD可以通过AMPK调节自噬干预NAFLD。
NAFLD模型组细胞中p-AMPK、LC3Ⅱ表达水平明显降低,p62表达水平升高,说明AMPK-自噬通路确实受到抑制,JZLGD含药血清干预后,p-AMPK及LC3Ⅱ表达水平明显回升,p62表达水平下降,说明JZLGD可以激活AMPK诱导的自噬,及时清除TG、TC等痰浊瘀血,改善NAFLD。同时,加入CC和CQ干预后,抑制了JZLGD含药血清治疗NAFLD的作用,同样能够证明上述结果。
综上所述,JZLGD通过AMPK调控自噬通路从而改善肝脏脂肪变性,缓解脂质蓄积。
| [1] |
Souto K P, Meinhardt N G, Ramos M J, et al. Nonalcoholic fatty liver disease in patients with different baseline glucose status undergoing bariatric surgery: analysis of intraoperative liver biopsies and literature review[J]. Surg Obes Relat Dis, 2018, 14(1): 66-73. doi:10.1016/j.soard.2017.09.527 |
| [2] |
张雯, 李丹, 陈昶洲, 等. 张云鹏论治非酒精性脂肪性肝病经验[J]. 中医文献杂志, 2019, 37(4): 49-51. Zhang W, Li D, Chen C Z, et al. Zhang Yunpeng's experience in treating non-alcoholic fatty liver disease[J]. J Chin Med Literat, 2019, 37(4): 49-51. |
| [3] |
尹抗抗, 聂娟, 唐标. 降脂理肝汤抑制NLRP3炎症小体活化减轻高脂饮食诱导的大鼠非酒精性脂肪肝病[J]. 中国免疫学杂志, 2019, 36(22): 2716-20. Yin K K, Nie J, Tang B. Jiangzhiligan Decoction inhibits the activation of NLRP3 inflammatome and reduces non-alcoholic fatty liver disease induced by high fat diet in rats[J]. Chin J Immunol, 2019, 36(22): 2716-20. |
| [4] |
霍雨佳, 陈佳亮, 邹文玮, 等. 小柴胡汤含药血清体外抗流感病毒的实验研究[J]. 中成药, 2023, 45(9): 3077-80. Huo Y J, Chen J L, Zou W W, et al. Experimental study of Xiaochaihu Decoction containing serum against influenza virus in vitro[J]. Chin Patent Med, 2023, 45(9): 3077-80. |
| [5] |
Li X, Shi Z, Zhu Y, et al. Cyanidin-3-O-glucoside improves non-alcoholic fatty liver disease by promoting PINK1-mediated mitophagy in mice[J]. Br J Pharmacol, 2020, 177(15): 3591-607. doi:10.1111/bph.15083 |
| [6] |
章常华, 程子文, 薛亚楠, 等. 葛根芩连汤含药血清对游离脂肪酸诱导的HepG2细胞脂肪堆积模型FXR通路相关信号因子的影响[J]. 时珍国医国药, 2022, 33(9): 2077-80. Zhang C H, Cheng Z W, Xue Y N, et al. Effect of serum containing Gegen Qinlian Decoction on signaling factors related to FXR pathway in fat accumulation model of HepG2 cells induced by free fatty acids[J]. Shi Zhen Chin Med, 2022, 33(9): 2077-80. |
| [7] |
孙妍华, 季敬, 彭娇, 等. 基于PINK1-Parkin线粒体自噬通路探讨海昆肾喜含药血清对N2a/APP695细胞的神经保护作用[J]. 中国药理学通报, 2024, 40(3): 461-8. Sun Y H, Ji J, Peng J, et al. Study on the neuroprotective effect of Haikunhen-drug-containing serum on N2a/APP695 cells based on PINK1-Parkin mitochondrial autophagy pathway[J]. Chin J Pharmacol, 2024, 40(3): 461-8. doi:10.12360/CPB202309090 |
| [8] |
匡霞. 小檗碱对胰岛素抵抗HepG2细胞AMPK信号通路及其下游糖脂代谢相关蛋白表达的影响[D]. 武汉: 华中科技大学, 2012. Kuang X. Effects of Berberine on AMPK signaling pathway and its downstream glucolipid metabolism-related protein expression in insulin-resistant HepG2 cells [D]. Wuhan: Huazhong Univ Sci Technol, 2012. |
| [9] |
张涛, 殷雪翠, 任飞飞, 等. 生长分化因子11(GDF11)调节非酒精性脂肪性肝病的机制研究[J]. 临床肝胆病杂志, 2019, 39(9): 2103-9. Zhang T, Yin X C, Ren F F, et al. Study on the mechanism of growth differentiation factor 11(GDF11) regulating non-alcoholic fatty liver disease[J]. J Hepatobil Dis, 2019, 39(9): 2103-9. |
| [10] |
赵全如, 谢晓燕. 丹参的化学成分及药理作用研究进展[J]. 广东化工, 2021, 48(1): 57-9. Zhao Q R, Xie X Y. Research progress of chemical constituents and pharmacological effects of Salvia miltiorrhiza[J]. Guangdong Chem Indust, 2021, 48(1): 57-9. |
| [11] |
陈畅, 谢永艳, 黄丽萍. 荷叶碱药理作用的研究进展[J]. 南京中医药大学学报, 201, 37(4): 619-24. Chen C, Xie Y Y, Huang L Q. Research progress of pharmacological action of lotus leaf line[J]. J Nanjing Univ Chin Med, 201, 37(4): 619-24. |
| [12] |
刘梅, 郭小红, 孙全, 等. 温郁金的化学成分和药理作用研究进展[J]. 现代药物与临床, 2019, 36(1): 204-8. Liu M, Guo X H, Sun Q, et al. Research progress on chemical constituents and pharmacological effects of warm Yujin[J]. Mod Med Clin, 2019, 36(1): 204-8. |
| [13] |
张维君, 韩东卫, 李冀. 泽泻的化学成分及药理作用研究进展[J]. 中医药学报, 2019, 49(12): 98-102. Zhang W J, Han D W, Li J. Research progress on chemical constituents and pharmacological effects of Alisma sativa[J]. Chin J Tradit Chin Med, 2019, 49(12): 98-102. |
| [14] |
莫日根, 荷叶, 苏都那布其, 等. 中(蒙)药材决明子的研究概况[J]. 中国民族医药杂志, 2023, 29 (3): 62-8. Morigen, Heye, Sudunabuqi, Wang X L, et al. Research situation of Cassia seed in Chinese (Mongolian) [J]. Chin J Ethnic Med, 2023, 29 (3): 62-8. |
| [15] |
程玉佩, 张明香. 从痰瘀论治非酒精性脂肪肝研究进展[J]. 辽宁中医药大学学报, 2018, 20(11): 157-60. Cheng Y P, Zhang M X. Research progress of treating nonalcoholic fatty liver from phlegm stasis[J]. J Liaoning Univ Tradit Chin Med, 2018, 20(11): 157-60. |
| [16] |
张顺贞, 石安华, 姚政, 等. 非酒精性脂肪肝中医病因病机探讨[J]. 云南中医中药杂志, 2015, 36(1): 17-9. Zhang S Z, Shi A H, Yao Z, et al. Etiology and pathogenesis of nonalcoholic fatty liver[J]. Yunnan J Tradit Chin Med, 2015, 36(1): 17-9. |
| [17] |
蒋晓倩, 梁惠卿, 刘垚昱, 等. 吴耀南运用"浊毒"理论论治非酒精性脂肪性肝病验案举隅[J]. 医学信息, 2018, 33(4): 158-9. Jiang X Q, Liang H Q, Liu Y Y, et al. Wu Yaonan's application of "turbid poison" theory in the treatment of non-alcoholic fatty liver disease[J]. J Med Inf, 2018, 33(4): 158-9. |
| [18] |
王喜臣, 张珊珊, 李亚红, 等. 中医学关于非酒精性脂肪肝研究[J]. 吉林中医药, 2021, 41(1): 135-9. Wang X C, Zhang S S, Li Y H, et al. Study on nonalcoholic fatty liver in traditional Chinese medicine[J]. Jilin Chin Med, 2021, 41(1): 135-9. |
| [19] |
易鑫宇, 吕超, 周小博, 等. 中医药治疗非酒精性脂肪肝用药规律文献分析[J]. 湖南中医杂志, 2019, 35(11): 118-20. Yi X Y, Lyu C, Zhou X B, et al. Literature analysis of drug use in the treatment of nonalcoholic fatty liver with traditional Chinese medicine[J]. Hunan J Tradit Chin Med, 2019, 35(11): 118-20. |
| [20] |
杨艳, 宋一男, 赵微, 等. 真实世界NAFLD痰瘀相关证候分型客观化研究进展[J]. 亚太传统医药, 2019, 19(8): 198-201. Yang Y, Song Y N, Zhao W, et al. Research progress on objectification of phlegm-stasis related syndrome classification of NAFLD in real world[J]. Asia-pacif Tradit Med, 2019, 19(8): 198-201. |
| [21] |
王蓉芝, 王琳雳, 焦靖雯, 等. 自噬途径降解肝脏脂滴的研究进展[J]. 临床肝胆病杂志, 2024, 40(9): 1916-23. Wang R Z, Wang L L, Jiao J W, et al. Research progress of autophagy pathway degradation of liver lipid droplets[J]. J Clin Hepatobiliary Dis, 2024, 40(9): 1916-23. |
| [22] |
唐梦灵, 胡治强, 袁思琪, 等. 类鼻疽杆菌通过抑制自噬调控HepG2细胞胞内脂质代谢[J]. 第三军医大学学报, 2019, 41(18): 1722-9. Tang M L, Hu Z Q, Yuan S Q, et al. Malleoid bacillus regulates intracellular lipid metabolism in HepG2 cells by inhibiting autophagy[J]. J Third Mil Med Univ, 2019, 41(18): 1722-9. |
| [23] |
Tamargo-Gomez I, Marino G. AMPK: regulation of metabolic dynamics in the context of autophagy[J]. Int J Mol Sci, 2018, 19(12): 3812. |

