


2. 中国科学院合肥肿瘤医院药学中心,安徽 合肥 230000;
3. 合肥市第二人民医院药学部,安徽 合肥 230011;
4. 安徽医科大学第一附属医院药剂科,安徽 合肥 230022
 ,
TAN Ting-fei2,
ZHAO Ying-li3,
HAN Gong-wei1,
XIA Zi-tong1,
SHI Han-bing1,
LIU He-ying1,
WANG Jun-ping2,
XIA Quan1,4
,
TAN Ting-fei2,
ZHAO Ying-li3,
HAN Gong-wei1,
XIA Zi-tong1,
SHI Han-bing1,
LIU He-ying1,
WANG Jun-ping2,
XIA Quan1,4

2. Pharmacy Center, Hefei Cancer Hospital, Chinese Academy of Sciences, Hefei 230088, China;
3. the Second People's Hospital of Hefei, Hefei 230012, China;
4. the First Affiliated Hospital of Anhui Medical University, Hefei 230022, China
非霍奇金淋巴瘤(non-Hodgkin’s lymphoma,NHL)是一种异质性淋巴组织增生性恶性肿瘤[1]。据统计,2022年全球有55.3万NHL新发病例和25万死亡病例[2]。NHL分为T细胞和B细胞来源两大类,其中B细胞淋巴瘤(B-cell non-Hodgkin’s lymphoma,B-NHL)约占85%[3]。2020年,美国有7.7万B-NHL新发病例,占癌症诊断的4.3%[4]。随着对B-NHL发病机制研究的深入,已证实B细胞受体(B cell receptor,BCR)信号通路的异常激活,促进淋巴瘤细胞增殖和存活[5]。布鲁顿酪氨酸激酶(Bruton’s tyrosine kinase,BTK)作为BCR信号通路的关键部分,是治疗B-NHL的重要靶点[6-7]。2013年,伊布替尼作为首个非选择性的BTK抑制剂(BTK inhibitor,BTKi)被用于B-NHL的治疗。虽然伊布替尼的疗效较好,但在临床使用中仍出现了出血、心房颤动和感染等不良反应[8]。在1项共263例接受伊布替尼治疗的患者研究中,51%的患者出现了不同级别的出血事件,其中5%的患者发生血尿、颅内出血、术后出血等≥3级出血事件[9]。由于伊布替尼的出血机制可能与其脱靶作用相关,后续又相继研发和上市高选择性BTKi,如泽布替尼[10]。然而,在使用泽布替尼的患者中,仍有25例患者(36.8%)发生出血事件,但没有大出血的情况[11]。相较于伊布替尼,泽布替尼的大出血风险较低,提示BTKi的选择性可能与出血风险存在相关性。
已有报道,BTKi可以抑制血小板聚集,导致出血风险[12]。然而,伊布替尼和泽布替尼在调控BCR信号通路的同时,是否通过跨膜转运至血小板内部,对血小板BTK产生不同的靶向抑制或脱靶作用,导致两种药物出血风险的不同,目前尚不清楚。为了进一步阐明伊布替尼和泽布替尼对血小板BTK靶向结合能力的差异,本研究通过细胞热转移实验(cellular thermal shift assay,CETSA)和胞内药物摄取分析,用MEC-1细胞和人血小板两种模型,比较两种药物与靶蛋白BTK的结合以及胞内摄取情况,从而阐明两种选择性不同的BTK药物胞内作用的差异。
1 材料 1.1 细胞株与人血小板健康志愿者5名,年龄18~25岁,在2周内未服用阿司匹林、氯吡格雷等影响血小板功能的药物。人慢性B细胞白血病细胞(MEC-1细胞),购自武汉普诺赛生命科技有限公司。本研究经安徽医科大学第一附属医院伦理委员会批准(伦理号:2023660)。
1.2 试剂伊布替尼(货号:B23898,纯度≥98%,上海源叶生物科技有限公司);泽布替尼(批号:420076-202001,纯度99.5%,国家药品标准物质网);BTK重组兔单克隆抗体(货号:R23660,成都正能生物技术有限责任公司);GAPDH单克隆抗体(货号:60004-1-Ig,武汉三鹰生物技术有限公司);NP-40裂解液(货号:P0013F)、PMSF溶液(100 mmol·L-1),均购自碧云天生物技术有限公司;前列地尔注射液(批号:3B013T,北京泰德制药股份有限公司)。
1.3 仪器FA2004型电子天平(上海恒平科学仪器有限公司);KDC-1044低速离心机(安徽中科中佳科学仪器有限公司);高速冷冻离心机(德国Eppendorf公司);AB SCIEX Triple QuadTM 4500MD液相色谱串联质谱(美国AB SCIEX公司);IKA RV10数显旋转蒸发仪(广州仪科科技技术有限公司);AdvanceBio EC-C18反相液相色谱柱(安捷伦科技有限公司);UCD-1000B超声波细胞破碎仪(北京格莱普科技有限公司);Forma3111细胞培养箱(赛默飞世尔科技公司)。
2 方法 2.1 CETSA分析BTK靶向结合能力 2.1.1 血小板处理使用枸橼酸钠抗凝管采集健康志愿者全血,800 r·min-1离心10 min制备富含血小板血浆(platelet-rich plasma,PRP)。吸取PRP,按一定比例加入前列地尔注射液(PRP与前列地尔注射液的比例为1 mL ∶7 μL)和ACD溶液(柠檬酸0.84 g、柠檬酸三钠2.64 g、葡萄糖2.64 g、pH 5.0),3 000 r·min-1离心10 min;弃上清后,向沉淀部分加入洗涤溶液(氯化钠3.30 g、氯化钾0.14 g、磷酸氢二钠0.71 g、磷酸二氢钠1.87 g、EGTA 0.04 g、D-葡萄糖0.49 g,pH 6.0),3 000 r·min-1离心3 min;向沉淀部分加入Hepes台式液(Hepes 1.19 g、氯化钠4.03 g、氯化钾0.11 g、氯化钙0.05 g、碳酸氢钠0.50 g、磷酸二氢钠0.06 g、氯化镁0.18 g、D-葡萄糖0.50 g,pH 7.4),吹打均匀并调整血小板悬液密度为2.00×1011L-1。
2.1.2 熔解曲线将处理得到的洗涤血小板分为溶剂组、伊布替尼组(0.5 μmol·L-1)和泽布替尼组(0.5 μmol·L-1),37 ℃加药孵育15 min,孵育后放4 ℃冰箱冷却2~3 min。MEC-1细胞悬液调整密度为5×108L-1后,分为溶剂组、伊布替尼组(5 μmol·L-1)和泽布替尼组(5 μmol·L-1),细胞培养箱中加药孵育24 h,1 200 r·min-1离心5 min。各组在37~67 ℃之间按照5 ℃间隔设置温度梯度(共7个实验温度点),分别加热3 min后,迅速放4 ℃冰箱冷却,然后加NP40+PMSF裂解液,裂解1 h,12 000 r·min-1离心20 min后取上清,样品加入5×上样缓冲液,100 ℃水浴10 min,然后用Western blot法检测每组BTK蛋白表达情况。
2.1.3 等温曲线根据熔解曲线结果,筛选出合适的温度做等温曲线。将处理得到的洗涤血小板分为溶剂组、伊布替尼组(终浓度0.01、0.05、0.1、0.2、0.5、1、5、10 μmol·L-1)和泽布替尼组(终浓度0.01、0.05、0.1、0.3、0.5、1、5、10 μmol·L-1),37 ℃加药孵育15 min,孵育后放4 ℃冰箱冷却2~3 min。在65 ℃加热3 min后迅速放4 ℃冰箱冷却,加入NP40+PMSF裂解液,裂解1 h,12 000 r·min-1离心20 min,取上清,并加入5×上样缓冲液,100 ℃水浴10 min,用Western blot法检测每组BTK蛋白表达情况。MEC-1细胞分为溶剂组、伊布替尼组和泽布替尼组(终浓度均为1、2、5、10、15、20 μmol·L-1),加药后细胞培养箱中放置24 h,1 200 r·min-1离心5 min。在60 ℃加热3 min后迅速放4 ℃冰箱冷却,加入NP40+PMSF裂解液,裂解1 h,12 000 r·min-1离心20 min,取上清,并加入5×上样缓冲液,100 ℃水浴10 min,Western blot法检测每组BTK蛋白表达情况。
2.2 HPLC-MS/MS法检测胞内摄取 2.2.1 血小板和细胞样品前处理洗涤血小板,分为溶剂组、伊布替尼组(0.1、0.2、0.5 μmol·L-1)、泽布替尼组(0.1、0.3、0.5 μmol·L-1);MEC-1细胞分为溶剂组、伊布替尼组(1、5、10 μmol·L-1)和泽布替尼组(1、5、10 μmol·L-1)。PBS洗涤5次,去除培养环境的药物,重悬于PBS,取洗涤后的血小板或细胞各1 mL,随即采用细胞破碎仪破碎。所得裂解液用甲醇10 mL萃取,3 500 r·min-1离心15 min,收集上层有机相在旋转蒸发仪45 ℃旋干。残渣加入甲醇200 μL复溶,12 000 r·min-1离心10 min,过有机系0.22 μm微孔滤膜,取上清液备用。
2.2.2 标准品溶液的制备精密称取伊布替尼和泽布替尼,用甲醇分别配制质量浓度为1 g·L-1的伊布替尼和泽布替尼储备液,将储备液加入溶剂组处理后的样本中,按梯度稀释为0.5、1、10、50、100、200、500 μg·L-1的外标工作液。
2.2.3 检测条件以0.1%甲酸的5 mmol·L-1的乙酸铵(A)-0.1%甲酸的乙腈(B)为流动相,进样量5 μL,流速为0.35 mL·min-1,柱温35 ℃,正离子模式使用电喷雾离子源,多反应检测(MRM)模式。离子源温度为450 ℃,针电压+5.5 kV,碰撞气体为氮气。离子对:伊布替尼(m/z:440.5→138.1)、泽布替尼(m/z:472.1→455.1)。
2.3 统计学方法实验数据用GraphPad Prism8.0.2软件进行统计分析并绘图。结果以x±s表示,不同组间采用ANOVA单因素方差分析,两组间比较采用t检验。检验水准α=0.05。
3 结果 3.1 CETSA结果 3.1.1 MEC-1细胞的熔解曲线和等温曲线伊布替尼和泽布替尼是两种选择性不同的BTKi,本研究通过CETSA探究了MEC-1细胞在相同药物浓度和不同温度处理后BTK蛋白的表达情况。结果发现(Fig 1A),随着温度的升高,各组BTK蛋白的表达呈下降趋势,表明两种药物都具有和BTK结合的特点,MEC-1细胞熔解曲线见Fig 1B。在57~62 ℃之间溶剂组BTK蛋白的表达明显减少(Fig 1C-D),因此选择60 ℃作为等温曲线的实验温度。MEC-1在60℃条件下,BTK蛋白的表达随着药物浓度增加而明显升高(Fig 1E),MEC-1细胞等温曲线见Fig 1F。在MEC-1细胞模型中,相同温度和浓度条件下泽布替尼组BTK表达更明显(Fig 1C-D),说明泽布替尼与BTK靶向结合特异性比伊布替尼高。
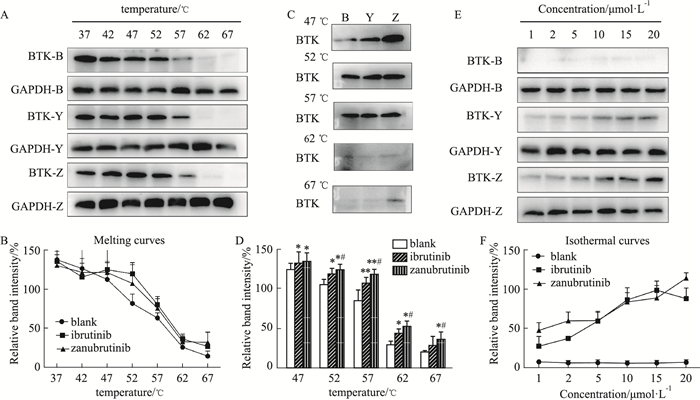
|
| Fig 1 Detection of BTK protein expression in MEC-1 cells by CETSA BTK-B: BTK-Blank; BTK-Y: BTK-Ibrutinib; BTK-Z: BTK-Zanubrutinib; GAPDH-B: GAPDH-Blank; GAPDH-Y: GAPDH-Ibrutinib; GAPDH-Z: GAPDH-Zanubrutinib. A: BTK and GAPDH expression at different temperature and at the same concentration; B: BTK and GAPDH were quantified to obtain relative intensities plotted as melting curves; C: Comparison of different groups at the same temperature. B: Blank; Y: Ibrutinib; Z: Zanubrutinib. D: BTK and GAPDH were quantified to compare different groups at the same temperature. *P < 0.05, **P < 0.01 vs Blank group; #P < 0.05 vs Ibrutinib group. E: BTK and GAPDH expression at different concentrations and at the same temperature; F: BTK and GAPDH were quantified to obtain relative intensities plotted as isothermal curves. |
为了探究两种BTK抑制剂是否能与血小板的BTK结合并存在差异,同样使用CETSA的方法检测处理后血小板中BTK蛋白的表达情况。与MEC-1细胞结果相似,相同浓度条件下,不同温度各组随着温度升高BTK蛋白降解明显(Fig 2A),得到熔解曲线(Fig 2B)。在62~67 ℃之间溶剂组BTK蛋白的表达明显减少,因此选择65 ℃作为等温曲线的实验温度(Fig 2C-D)。在65 ℃条件下,不同浓度各组随着浓度增加BTK表达更明显(Fig 2E),得到等温曲线(Fig 2F)。与MEC-1细胞结果相似,两种药物均能与血小板BTK结合,且泽布替尼对血小板BTK的结合特异性比伊布替尼更强(Fig 2C-D)。
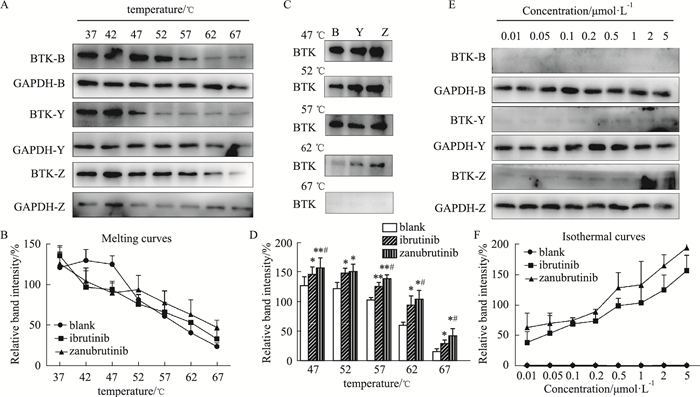
|
| Fig 2 Expression of BTK protein in human platelets detected by CETSA BTK-B: BTK-Blank; BTK-Y: BTK-Ibrutinib; BTK-Z: BTK-Zanubrutinib; GAPDH-B: GAPDH-Blank; GAPDH-Y: GAPDH-Ibrutinib; GAPDH-Z: GAPDH-Zanubrutinib. A: BTK and GAPDH expression at different temperature and at the same concentration; B: BTK and GAPDH were quantified to obtain relative intensities plotted as melting curves; C: Comparison of different groups at the same temperature. B: Blank; Y: Ibrutinib; Z: Zanubrutinib. D: BTK and GAPDH were quantified to compare different groups at the same temperature. *P < 0.05, **P < 0.01 vs Blank group; #P < 0.05 vs Ibrutinib group. E: BTK and GAPDH expression at different concentrations and at the same temperature; F: BTK and GAPDH were quantified to obtain relative intensities plotted as isothermal curves. |
以上的研究证实两种药物可以与MEC-1细胞和人血小板的BTK结合,推测是通过被胞内摄取的方式发挥作用。使用液相色谱串联质谱(LC-MS/MS)检测破碎后的MEC-1细胞,可以成功检测到MEC-1细胞内的药物浓度。如Fig 3A所示,伊布替尼组和泽布替尼组检测到的药物浓度均明显高于溶剂组,并且MEC-1细胞对两种药物的摄取呈浓度依赖。但在相同浓度下,MEC-1细胞摄取伊布替尼和泽布替尼的程度差异无显著性。

|
| Fig 3 Drug uptake of ibrutinib and zanubrutinib by MEC-1 cells (A) and human platelets (B) *P < 0.05, **P < 0.01 vs Blank group; #P < 0.05, ##P < 0.01 vs Ibrutinib group at the same concentration. |
为了探究伊布替尼和泽布替尼是否进入血小板内部与BTK结合,从而影响血小板活化导致出血风险的发生,对加药培养后的人血小板胞内摄取情况进行检测。如Fig 3B所示,与MEC-1细胞结果相似,血小板内检测到两种药物,伊布替尼各组和0.3、0.5 μmol·L-1泽布替尼检测到的浓度均高于溶剂组,结果有显著性差异(P < 0.05),并且血小板对两种药物的摄取呈浓度依赖。与MEC-1细胞不同的是,在相同浓度下(0.1、0.5 μmol·L-1)和临床药物平均血药浓度(0.2 μmol·L-1伊布替尼vs 0.3 μmol·L-1泽布替尼)条件下,血小板摄取伊布替尼的检测结果均明显高于泽布替尼。
4 讨论不同选择性的BTKi在临床使用中,出血风险不同。在一项针对泽布替尼与伊布替尼治疗华氏巨球蛋白血症的3期临床试验中,43%使用伊布替尼治疗的患者出现了1级和2级出血事件,如挫伤和鼻出血,9%的患者发生≥3级大出血事件;26%使用泽布替尼治疗的患者发生1~2级出血,6%患者出现大出血,与伊布替尼治疗相比,泽布替尼任何等级的出血率都明显降低[13]。有研究表明,这与泽布替尼对BTK与脱靶激酶的更高选择性一致[14]。
CETSA用于研究配体结合后蛋白质的热稳定性[15]。其原理是未结合的蛋白质在高温下变性并沉淀,而与配体结合的蛋白质仍保留在溶液中,检测可溶性蛋白质的表达并绘制熔解曲线。同时,CETSA方法还能反映在固定温度下,随着配体浓度增加靶标蛋白质的变化,从而得到等温曲线[16]。本研究的结果证明,相同浓度条件下,伊布替尼和泽布替尼与BTK结合随温度升高而降低;相同温度下,伊布替尼和泽布替尼与BTK结合随药物浓度升高而增加。MEC-1细胞和人血小板经过相同温度和相同浓度处理后,泽布替尼组BTK蛋白表达比伊布替尼组和溶剂组更明显,间接反映了伊布替尼与细胞内BTK的结合程度相对较低,导致靶蛋白在高温下降解幅度更大,而泽布替尼与BTK结合比伊布替尼稳定,因此降解程度更低。CETSA的分析结果证实,两种选择性不同的药物与BTK结合特点存在差异。
接受BTKi治疗的患者中出血事件较常见,但已证实非凝血系统受损引起[17]。BTK和相关激酶(如Tec)也在非白血病造血细胞中表达,BTK抑制剂在发挥治疗作用的同时,抑制血小板BTK及脱靶作用可抑制血小板对多种激动剂的反应,从而导致出血事件的发生[18]。在一项比较研究中,评估了伊布替尼和泽布替尼对血小板功能的影响,发现伊布替尼不仅参与抑制胶原反应和血小板活化,而且与泽布替尼相比,还参与降低GPIbα、GPIX和整合素αIIbβ3的表达[19]。然而,BTKi是直接作用于血小板表面受体,还是通过跨膜转运至血小板内影响血小板功能,目前还未有报道。本研究使用LC-MS/MS法检测药物孵育后MEC-1细胞及人血小板的药物浓度,证明伊布替尼和泽布替尼可被MEC-1细胞和血小板胞内摄取。在药物浓度选择方面,本研究根据文献报道的临床平均血药浓度,选择伊布替尼血小板孵育浓度为0.2 μmol·L-1[20],泽布替尼浓度为0.3 μmol·L-1[21]作为实验浓度。血小板的药物摄取实验分析结果显示,药物在临床平均血药浓度条件下可以被血小板摄取,并且相同浓度下摄取伊布替尼的程度高于泽布替尼,这可能也是导致伊布替尼出血风险高的原因之一。
本实验对于靶细胞(慢性B细胞白血病细胞MEC-1细胞)和副反应效应细胞(血小板)分别研究,发现(1)相较于伊布替尼,泽布替尼对靶蛋白BTK的选择性更高;(2)相同浓度和平均血药浓度条件下,血小板摄取伊布替尼高于泽布替尼。通过对血小板摄取两种BTKi的差异进行研究,可以了解BTK的选择性与临床常见的不良反应,如出血和房颤之间的关系。此结果对临床具有一定的参考价值,即在相同浓度和疗效下,伊布替尼比泽布替尼更容易出现房颤等心律失常;当临床对于BTKi相关房颤选择口服抗凝药治疗时,可能会加重出血风险。因此,在临床用药选择中,对于有出血风险或房颤的患者,选择泽布替尼比伊布替尼的风险更低。研究结果也为今后进一步阐明不同选择性的BTKi出血风险的差异及与血小板功能的相关性提供了实验依据。
| [1] |
Singh R, Shaik S, Negi B S, et al. Non-Hodgkin's lymphoma: a review[J]. J Family Med Prim Care, 2020, 9(4): 1834-40. doi:10.4103/jfmpc.jfmpc_1037_19 |
| [2] |
Bray F, Laversanne M, Sung H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2024, 74(3): 229-63. doi:10.3322/caac.21834 |
| [3] |
姜爽, 王晓波, 张治然, 等. 纳米雄黄抗B细胞非霍奇金淋巴瘤Raji细胞的体外作用研究[J]. 中国药理学通报, 2017, 33(12): 1721-9. Jiang S, Wang X B, Zhang Z R, et al. Effects of realgar nanoparticles on B cell non-Hodgkin's lymphoma Raji cells in vitro[J]. Chin Pharmacol Bull, 2017, 33(12): 1721-9. |
| [4] |
Milano A F. Non-Hodgkin lymphoma-nodal and extranodal: 20-year comparative mortality, survival & biologic behavior analysis by age, sex, race, stage, cell morphology/histology, cohort entry time-period and disease duration: a systematic review of 384, 651 total NHL cases including 261, 144 nodal and 123, 507 extranodal cases for diagnosis years 1975-2016: (SEER*Stat 8.3.6)[J]. J Insur Med, 2023, 50(1): 1-35. doi:10.17849/insm-50-1-1-35.1 |
| [5] |
Pal Singh S, Dammeijer F, Hendriks R W. Role of Bruton's tyrosine kinase in B cells and malignancies[J]. Mol Cancer, 2018, 17(1): 57. doi:10.1186/s12943-018-0779-z |
| [6] |
冯振, 赖冉. 泽布替尼治疗B细胞淋巴瘤的快速卫生技术评估[J]. 中国药房, 2024, 35(7): 848-52. Feng Z, Lai R. Rapid health technology assessment of zanubrutinib in the treatment of B cell lymphomas[J]. China Pharm, 2024, 35(7): 848-52. |
| [7] |
McDonald C, Xanthopoulos C, Kostareli E. The role of Bruton's tyrosine kinase in the immune system and disease[J]. Immunology, 2021, 164(4): 722-36. doi:10.1111/imm.13416 |
| [8] |
Paydas S. Management of adverse effects/toxicity of ibrutinib[J]. Crit Rev Oncol Hematol, 2019, 136: 56-63. doi:10.1016/j.critrevonc.2019.02.001 |
| [9] |
Seymour J F, Byrd J C, Ghia P, et al. Detailed safety profile of acalabrutinib vs ibrutinib in previously treated chronic lymphocytic leukemia in the ELEVATE-RR trial[J]. Blood, 2023, 142(8): 687-99. doi:10.1182/blood.2022018818 |
| [10] |
Song Y, Zhou K, Zou D, et al. Zanubrutinib in relapsed/refractory mantle cell lymphoma: long-term efficacy and safety results from a phase 2 study[J]. Blood, 2022, 139(21): 3148-58. doi:10.1182/blood.2021014162 |
| [11] |
Opat S, Tedeschi A, Linton K, et al. The MAGNOLIA trial: zanubrutinib, a next-generation Bruton tyrosine kinase inhibitor, demonstrates safety and efficacy in relapsed/refractory marginal zone lymphoma[J]. Clin Cancer Res, 2021, 27(23): 6323-32. doi:10.1158/1078-0432.CCR-21-1704 |
| [12] |
Lipsky A, Lamanna N. Managing toxicities of Bruton tyrosine kinase inhibitors[J]. Hematology Am Soc Hematol Educ Program, 2020, 2020(1): 336-45. doi:10.1182/hematology.2020000118 |
| [13] |
Tam CS, Opat S, D'Sa S, et al. A randomized phase 3 trial of zanubrutinib vs ibrutinib in symptomatic Waldenström macroglobulinemia: the ASPEN study[J]. Blood, 2020, 136(18): 2038-50. doi:10.1182/blood.2020006844 |
| [14] |
Guo Y, Liu Y, Hu N, et al. Discovery of zanubrutinib(BGB-3111), a novel, potent, and selective covalent inhibitor of Bruton's tyrosine kinase[J]. J Med Chem, 2019, 62(17): 7923-40. doi:10.1021/acs.jmedchem.9b00687 |
| [15] |
Jafari R, Almqvist H, Axelsson H, et al. The cellular thermal shift assay for evaluating drug target interactions in cells[J]. Nat Protoc, 2014, 9(9): 2100-22. doi:10.1038/nprot.2014.138 |
| [16] |
王莉, 刘景芳, 李维林, 等. 基于细胞热漂移测定(CETSA)技术鉴定活细胞内药物靶标的标准操作流程[J]. 微生物学报, 2023, 63(6): 2488-501. Wang L, Liu J F, Li W L, et al. Standard operating procedure for identification of drug targets in living cells based on cell thermal shift assay (CETSA)[J]. Acta Microbiol Sin, 2023, 63(6): 2488-501. |
| [17] |
von Hundelshausen P, Siess W. Bleeding by Bruton tyrosine kinase-inhibitors: dependency on drug type and disease[J]. Cancers (Basel), 2021, 13(5): 1103. doi:10.3390/cancers13051103 |
| [18] |
Zhang P, Solari F A, Heemskerk J W M, et al. Differential regulation of GPVI-induced Btk and Sykactivation by PKC, PKA and PP2A in human platelets[J]. Int J Mol Sci, 2023, 24(9): 7776. doi:10.3390/ijms24097776 |
| [19] |
Dobie G, Kuriri F A, Omar M M A, et al. Ibrutinib, but not zanubrutinib, induces platelet receptor shedding of GPIb-IX-V complex and integrin αⅡbβ3 in mice and humans[J]. Blood Adv, 2019, 3(24): 4298-311. doi:10.1182/bloodadvances.2019000640 |
| [20] |
Yasu T, Momo K, Yasui H, Kuroda S. Simple determination of plasma ibrutinib concentration using high-performance liquid chromatography[J]. Biomed Chromatogr, 2019, 33(3): e4435. doi:10.1002/bmc.4435 |
| [21] |
Zhang Y, Li Y, Zhuang Z, et al. Preliminary evaluation of zanubrutinib-containing regimens in DLBCL and the cerebrospinal fluid distribution of zanubrutinib: a 13-case series[J]. Front Oncol, 2021, 11: 760405. doi:10.3389/fonc.2021.760405 |