

陈彦(1968-),女,博士,研究员,博士生导师,研究方向:抗肿瘤中药新制剂研发,通信作者,E-mail:ychen202@hotmail.com
胞外核苷酸焦磷酸酶/磷酸二酯酶家族(ecto-nucleotide pyrophosphatases/phosphodiesterases,ENPPs)是一类具有相同保守结构的胞外蛋白,所有ENPPs成员共享1个同源催化核心,即磷酸二酯酶(phosphodiesterase,PDE)结构域。迄今为止,已有7个家族成员被鉴定(ENPP1-7)。在ENPP1-3中,PDE结构域两侧有2个N端生长素B样结构域和1个C端无活性核酸酶结构域,而ENPP4-7仅具有PDE结构域。底物结合位点的结构差异赋予了每种蛋白质相应的特性,因此,ENPP1、ENPP3、ENPP4和ENPP5水解核苷酸,而ENPP2、ENPP6和ENPP7通过催化结构域进化为磷酯酶[1]。
ENPP1作为ENPPs的初始成员,在50多年前被发现为血浆细胞分化抗原PC-1[2],是一种双硫键链同源二聚体,其单个分子量115 ku,多聚体分子量230~260 ku。ENPP1在许多组织中表达,对嘌呤能信号转导至关重要,因此,在心血管、神经、免疫、肌肉骨骼、激素和血液功能等调节中起重要作用。ENPP1最为认知的作用是通过生成焦磷酸盐,从而调节骨骼和软组织矿化。研究表明,ENPP1催化ATP或GTP水解为AMP或GMP,同时生成无机焦磷酸盐(inorganic pyrophosphate,PPi),PPi会影响骨骼和软骨矿化,使ENPP1成为哺乳动物骨骼和软骨发育的中心调节因子。然而,近年来的研究发现,ENPP1介导的腺苷代谢通路在肿瘤的发生发展中发挥至关重要的作用,并成为最有潜力的治疗靶标之一。本文将简要回顾ENPP1的结构和生理学功能,重点介绍其在肿瘤增殖、转移、免疫、复发中的作用,并总结现有的ENPP1抑制剂的主要研究进展。
1 ENPP1的结构和生理功能 1.1 ENPP1的结构ENPP1是1个多结构域蛋白质,由1个短的细胞内N端结构域、1个跨膜结构域、1个长的细胞外结构域组成。细胞外结构域由2个串联的N-末端体素结构域(SMB1-2)、1个催化结构域(PDE结构域)、1个“套索”环(LL)和1个C-末端核酸酶样结构域(NUC)组成[2]。其中,PDE结构域是ENPP家族的共同特征,承载着共同的焦磷酸酶/磷酸二酯酶活性[1]。据报道,直到2020年载脂蛋白形式的人源ENPP1(Fig 1)的X射线晶体结构才被发现,此前发现的结构类型均为鼠源ENPP1(Fig 2)。
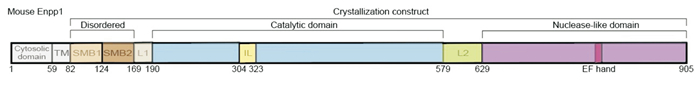
|
| Fig 1 Structure of murine ENPP1 |
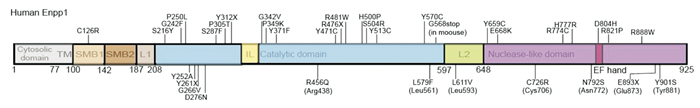
|
| Fig 2 Human ENPP1 structure |
ENPP1定位在细胞质膜,是具有单一跨膜结构的细胞外核苷酸酶。ENPP1的催化位点位于细胞外,可水解各种胞外化合物中的焦磷酸酶或磷酸二酯键,如核苷酸和溶血磷脂[3]。ENPP1通过不同的结构域参与不同的生物学过程,如催化核酸酶样结构域参与矿化,催化生长素样结构域参与胰岛素信号转导。因而,此前报道的关于ENPP1的文章,多数集中在对骨关节炎、糖尿病等的研究。ENPP1作为细胞外ATP和GTP水平的主要嘌呤能信号调节因子,参与腺苷代谢途径[4]。ATP和GTP被水解为AMP和GMP,同时释放PPi,产物AMP随后被CD73去磷酸化为无机磷酸盐(Pi)和腺苷。PPi是一种具有强抗钙活性的无机代谢物,与骨矿化密切相关。ENPP1在骨骼和软骨中高度表达[5],ENPP1缺乏常表现为多个组织的异位钙化、生长受限、过早死亡、骨骼畸形等。ENPP1还能通过与胰岛素受体的物理相互作用,诱导胰岛素抵抗,并增加葡萄糖不耐受和2型糖尿病的风险。因此,ENPP1作为胰岛素受体激活的负调节剂,被认为是胰岛素抵抗发展的关键角色[6]。
研究发现,ENPP1基因位于6q22-q23位点,该位点在许多肿瘤中均有扩增,ENPP1在卵巢癌、乳腺癌、胶质母细胞瘤、胆囊癌等实体肿瘤中也有高表达[4]。近年来,ENPP1被视为人类恶性肿瘤治疗的一个新的治疗靶点,其通过降解环鸟嘌呤腺嘌呤(cyclic GMP-AMP,cGAMP)发挥治疗恶性肿瘤的作用[7]。ENPP1出现在肿瘤-宿主免疫相互作用的间期,使平衡从促炎ATP向具有抗炎作用的Ado倾斜。作为cGAMP的水解酶,ENPP1负调控cGAMP-STING通路,进而抑制对肿瘤的先天免疫反应。研究表明,ENPP1水解cGAMP生成的腺苷促进了肿瘤免疫抑制与肿瘤转移。ENPP1作为免疫抑制和转移的控制开关:打开时,免疫反应被抑制,肿瘤细胞转移增加;关闭时,免疫反应正常,肿瘤细胞转移减少。多项研究表明,恶性肿瘤与代谢性疾病有着共同的生物学机制。除了痘病毒,ENPP1是唯一已知的cGAMP水解酶,它是由环磷酸鸟苷-腺苷合成酶(cyclic GAS,cGAS)生成的第二信使,参与胞质中双链DNA的先天免疫系统反应[8]。
近年来,关于ENPP1在肿瘤发展中的作用逐渐引发人们的关注。使用癌症基因组图谱计划(The Cancer Genome Atlas,TCGA)泛癌数据集分析ENPP1表达,发现ENPP1在乳腺癌中高表达[9],临床数据表明,原发性乳腺癌组织中ENPP1的表达与恶性肿瘤潜能和化疗反应有关[10]。ENPP1被认为是恶性肿瘤早期诊断的候选治疗靶点及生物标志物[11]。在管腔型或表达ABCG2的乳腺癌细胞中,ENPP1在肿瘤干细胞特性的获得中也起着重要作用[12]。另外,ENPP1在肿瘤进展中的作用超出了骨转移,因为其能够水解cGAMP,从而通过激活肿瘤微环境中的保护性STING信号,抑制宿主控制转移进展的能力[13]。
2 ENPP1在肿瘤中的作用 2.1 ENPP1在肿瘤增殖中的作用随着ENPP1表达的增加,肿瘤细胞分化更差,细胞增殖活性增强,恶性程度增高。Wang等[5]通过对Ⅱ型HGSOC卵巢上皮癌蛋白表达等系列研究,证明下调ENPP1的表达后,明显抑制卵巢癌细胞的增殖、迁移和侵袭,增殖相关基因PCNA和转移相关基因MMP-9的表达明显降低,卵巢癌细胞恶性行为受到抑制。同时,caspase-3的表达明显增加,表明其抑制细胞恶性行为的能力可能是通过下调ENPP1,启动细胞凋亡实现的。另外,ENPP1在肿瘤发展、伤口愈合和干细胞行为中起重要作用,并在肿瘤病理进展和耐药性中发挥重要作用。研究还发现,失调的ENPP1通过诱导肿瘤干细胞特性和上皮-间质转化(epithelial-mesenchymal transition,EMT),促进了恶性肿瘤的增殖。Min等[12]在肺癌研究中发现,当ENPP1基因在肺癌细胞系中被敲除时,包括ABCG2、SOX2、NANOG和CD44在内的大量干细胞标记物的表达减少,细胞增殖受到明显抑制。Takahashi等[10]通过对乳腺细胞的干细胞特性获得研究发现,ENPP1上调ABCG2转运蛋白,增加乳腺癌细胞的增殖能力,并对常规化疗产生耐药性。上述研究表明,ENPP1在肿瘤中的高表达与肿瘤增殖密切相关。
2.2 ENPP1在肿瘤转移、复发中的作用肿瘤的进一步转移扩散及复发,是最终导致绝大多数患者死亡的重要原因。研究发现,在从正常组织到原发肿瘤,再到转移的过程中,ENPP1的mRNA水平呈现逐步升高的趋势[14]。Min等[12]在肺癌研究中发现,ENPP1可能在增加肺癌的恶性和转移特征中发挥重要作用。此外,带有转移灶的原发乳腺癌肿瘤与非转移灶相比,ENPP1蛋白表达更高[14]。有研究发现,ENPP1能增加乳腺癌的骨转移,其作用机制可能与细胞外PPi的产生有关。在骨转移的情况下,由于高表达ENPP1的肿瘤细胞的存在,骨环境中的PPi水平有可能升高。这种不平衡的PPi可能导致矿化减少,从而创造出有利于骨吸收的环境,并诱导骨中释放生长因子,助长了肿瘤的生长,促进骨转移的发生发展[14]。众所周知,肿瘤转移与EMT密不可分[9]。EMT由肿瘤微环境中的肿瘤细胞分泌的多种细胞因子引发,其中最主要的是TGF-β[15]。多项报道均显示,TGF-β通过促进肿瘤增殖、EMT,诱导肿瘤转移[15-18]。而与EMT相关的分子途径主要包括TGF-β途径和Wnt/β-catenin途径,它们通过转录因子,如Snail/Slug、Twist、Six1和Cripto调节。Goswami等[9]通过对乳腺癌小鼠模型研究发现,ENPP1通过负调控2′3′-cGAMP-Wnt/β-catenin途径,调节EMT行为,使肿瘤细胞失去其上皮特征,并获得间质特征,进而导致肿瘤转移。此外,肿瘤细胞还可能通过增加ENPP1的表达来平衡STING途径的抗肿瘤影响,诱导转移。ENPP1的过表达部分通过产生细胞外腺苷,并使其他敏感肿瘤完全抵抗免疫治疗,从而促进了肿瘤迁移和转移[13]。
Ruiz-Fernández de Córdoba等[19]通过对乳腺癌患者手术后或放疗后局部区域衰竭与ENPP1间联系的研究表明,在ENPP1高表达的循环肿瘤细胞中,循环肿瘤细胞二次转移,招募多形核髓系衍生抑制细胞、ENPP1水解代谢产物促进中性粒细胞胞外陷阱的形成,两者共同导致了肿瘤复发。因而抑制ENPP1可以延长乳腺癌患者的无复发生存期,通过多次辐射照射消除ENPP1可以有效消除乳腺癌患者手术后或放疗后局部区域衰竭。另一研究同样表明,将乳腺癌细胞直接导入小鼠尾静脉或是原位移植后手术切除原发肿瘤,ENPP1的缺失均可明显延长总生存期,并明显减少局部肿瘤复发和转移。研究发现,ENPP1表达与免疫细胞浸润减少、转移增加和抗PD-1/PD-L1治疗的耐药性相关。在乳腺癌中,研究发现,他莫西芬耐药性是复发性乳腺癌患者死亡的1个主要原因。Umar等[20]对5 500个他莫昔芬疗法敏感和耐药的肿瘤细胞进行了比较蛋白质组分析,验证了47个不同丰度的差异蛋白质的存在,其中ENPP1与他莫西芬治疗复发疾病时的无进展生存期有明显关系。
综上,ENPP1在肿瘤转移和复发过程中扮演了重要角色。上述研究不仅支持了ENPP1在肿瘤转移、复发中的潜在作用,而且推测ENPP1可作为多种肿瘤的预后指标。
2.3 ENPP1在肿瘤免疫中的作用在肿瘤免疫治疗中,免疫检查点抑制剂疗法针对许多患者取得了显著的临床疗效。然而,还有很大一部分患者应用免疫检查点阻断治疗无效,这也是由于肿瘤T细胞浸润的缺乏。肿瘤免疫疗法的重点在于通过免疫激活机制,寻找使免疫冷肿瘤变热的方法。cGAS-STING途径在这方面的重要性已被充分证明[9]。然而,研究发现,ENPP1使STING激活的cGAMP-STING通路的相对平衡发生倾斜,从抗肿瘤向促肿瘤转移。Li等[13]总结大量研究表明,ENPP1通过水解细胞外cGAMP,抑制促炎肿瘤细胞的免疫浸润,实现免疫逃逸。因此,抑制ENPP1可以增强染色体不稳定的肿瘤细胞对免疫检查点抑制剂治疗的应答率。ENPP1通过水解细胞外2′3′-cGAMP,阻断cGAMP-STING通路,进而减少免疫细胞的浸润,从而增强肿瘤免疫。研究发现,ENPP1与CD39和CD73一起促进了腺苷在肿瘤微环境中的积累,并通过在宿主免疫细胞群中诱导表达腺苷受体A2AR来发出信号。肿瘤细胞高表达ENPP1可通过诱导多形核髓源性抑制细胞PMN-MDSC的趋化,增加中性粒细胞NET的浸润,减少树突状细胞DC的浸润,增加M2型巨噬细胞和CD4+调节性T细胞的浸润,以及导致自然杀伤细胞NK细胞和CD8+效应T细胞的细胞毒活性减弱,重塑免疫抑制的微环境,导致抗肿瘤免疫失效[4]。
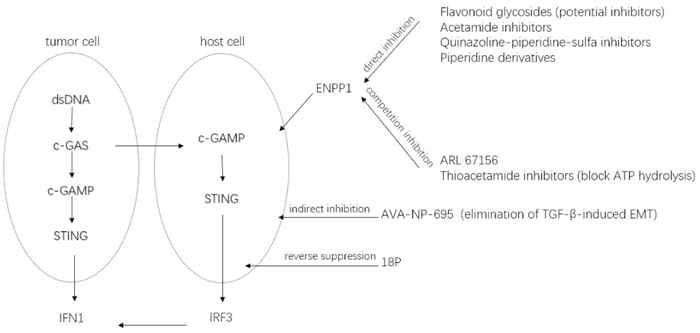
综上所述,ENPP1在多种实体瘤中呈现异常高表达,并与肿瘤增殖、转移、免疫抑制、耐药及复发息息相关(Fig 3)。抑制ENPP1可通过增加cGAMP水平促进STING激活,同时减少对腺苷通路的刺激。因此,研究者们已经开始进行ENPP1抑制剂的基础与临床前研究。
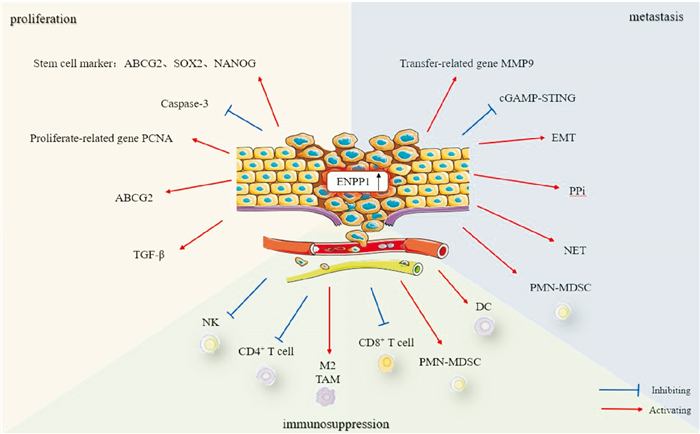
|
| Fig 3 Role of ENPP1 in tumors |
现有的ENPP1抑制剂主要包括天然小分子化合物、核苷酸类ENPP1抑制剂、非核苷酸类ENPP1抑制剂、新型小分子ENPP1抑制剂。其中,非核苷酸类ENPP1抑制剂主要包括乙酰胺类抑制剂、喹唑啉-哌啶-磺胺抑制剂、嘧啶类衍生物。
已经开发的核苷酸类ENPP1抑制剂大多数是腺嘌呤核苷酸衍生物,这些ENPP1的腺嘌呤核苷酸类似物抑制剂,如ARL 67156[22]、γ-S-α、β-metATP衍生物、α-borano-β、γ-metATP衍生物和硼磷酸二腺苷衍生物。这类抑制剂通常表现出竞争性抑制,因为它们的结构与天然ENPP1底物相似(Tab 1)。
| Inhibitors | Structure | Function | IC50 | Reference |
| Quinazoline-4-piperidine sulfamides (QPS1) | 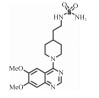 |
Preventing phosphate-induced apoptosis and mineralization of human VICs | (59.3±5.4)nmol·L-1 | 20 |
| Flavonoid glycosides (Cas: 1397173-50-0, 1169835-58-8) | 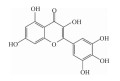 |
Inhibiting inflammatory cytokines and reducing platelet aggregation | 4.8 μmol·L-1 | 21 |
| ARL67156 | 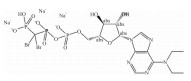 |
Blocking ATP, ADP hydrolysis, blocking ATP, ADP hydrolysis | (12±3)μmol·L-1 | 22 |
| Thioacetamide inhibitors |  |
Blocking ATP, ADP hydrolysis, blocking ATP, ADP hydrolysis | 20.0 nmol·L-1 | 23 |
| 3, 4-Dihydropyridine[4, 5-d]pyrimidin-2(1H)-1 derivative |  |
Inhibiting ENPP1 activity | 32.3 nmol·L-1 | 24 |
| 3, 4-Dihydropyridine[2, 3-d]pyrimidin-2(1H)-1 derivative | 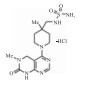 |
Inhibiting ENPP1 activity | 3.7 nmol·L-1 | 24 |
| STF-1084 | 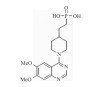 |
Inhibiting ENPP1 activity | 34 nmol·L-1 | 26 |
| 18p | 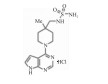 |
Inducing cytokines such as IFN- and IP-10 in a concentration-dependent manner | 25.0 nmol·L-1 | 25 |
| AVA-NP-695 | Unannounced | Eliminating TGF-β-induced EMT | (14±2) nmol·L-1 | 10 |
非核苷酸衍生的ENPP1抑制剂主要包括乙酰胺类抑制剂、喹唑啉-哌啶-磺胺抑制剂、嘧啶类衍生物。乙酰胺类抑制剂,如N-(3, 4-二甲氧基苯基)-2-(5-甲氧基-3h-咪唑[4, 5-b]吡啶-2-基硫)乙酰胺[23]。喹唑啉-哌啶-磺胺抑制剂,如喹唑啉-4-哌啶-4-甲基磺胺抑制剂QS1[21]。最近发现3, 4-二氢吡啶[4, 5-d]嘧啶-2(1H)-酮或3, 4-二氢吡啶[2, 3-d]嘧啶-2(1H)-酮可作为ENPP1抑制剂的高效核心支架,并合成两种ENPP1抑制剂[24]。
最近发现的具有吡咯嘧啶核的新型小分子ENPP1抑制剂18p,吡咯嘧啶18p对ENPP1具有较高的体外药效,通过刺激cGAMP介导的STING激活,激活干扰素敏感反应元件以及诱导细胞因子分泌,实现对ENPP1的抑制[25]。研究证实的一种口服可用的、选择性和高效的ENPP1抑制剂AVA-NP-695,能消除TGF-β诱导的EMT,同时负调节EMT来调节癌症转移[9]。另一种口服ENPP1抑制剂TXN10128在临床前结肠癌模型中显示出与抗PD-L1的协同生长抑制作用,能够促进肿瘤浸润淋巴细胞增加[26]。最近报道的一种ENPP1抑制剂ZX-8177在单独使用或与抗PD-L1联合使用时,显示出明显的肿瘤生长抑制作用,同样发现在结直肠癌小鼠模型中具有强烈的免疫重塑功能[27]。
已报道的ENPP1抑制剂有喹唑啉-哌啶-甲基磺胺抑制剂QPS2和Ex54(专利号:AU2018325445A1),QPS2和Ex54的稠合环占据与AMP的腺嘌呤相同的区域,但进一步延伸取代了与AMP的N6氢键的水。与AMP的磷酸盐不同,这些抑制剂的磺胺部分似乎在催化位点没有产生强烈的相互作用[28]。
最近有研究发现,天然产物黄酮类化合物中的杨梅素可以抑制ENPP1,进而可以治疗缺血性心脏损伤(Fig 4)。杨梅素耐药性较差,因此其进一步的开发相对有限,所以需要发现新的抑制ENPP1的杨梅素类似物作为替代品。研究进一步通过在自行研发的类黄酮天然产物数据库(Flavonoid Natural Products Database,FNPD)中进行虚拟筛选,筛选出2个类黄酮苷(Cas:1397173-50-0和1169835-58-8),作为潜在的ENPP1抑制剂,其主要作用机制是心脏损伤后有助于挽救非心肌细胞中的嘧啶生物合成,以及增强心脏修复和梗死后心脏功能,但不确定其是否可以用于癌症免疫并发挥ENPP1抑制作用[29]。
|
| Fig 4 Pathway of action of ENPP1 inhibitors in tumors |
目前,在各种各样的癌症免疫疗法中,STING激动剂已经成为一种特别有前途的方法,然而,STING激动剂的药代动力学和物理化学性质差的主要缺点,以及全身给药时细胞因子释放综合征的风险,在很大程度上限制了其在肿瘤内给药[28]。由于临床疗效有限,需要一种改进的方式来激活癌症治疗途径,触发cGAS-STING途径的一种方法是通过抑制下游酶ENPP1,一种直接水解2′3′-cGAMP的STING途径负调节因子,因而针对ENPP1抑制剂的研究受到大家的关注。
最具有发展为ENPP1抑制剂潜能的两种非核苷酸抑制剂——乙酰胺(乙酰胺类抑制剂)、QS1(喹唑啉-哌啶-磺胺抑制剂)均未达到临床试验标准。研究表明,乙酰胺不能特异性阻断cGAMP降解活性,缺乏对cGAMP或ENPP1的调控能力,不能用于进一步开发。实验表明,QS1非特异性阻断cGAMP,不适用于细胞外cGAMP降解的进一步研究[30]。已经获得专利的新型吡咯类小分子(专利号:WO2019023635A1)3H-咪唑-[4,5-c]吡啶和1H-吡咯-[2,5-c]吡啶及相关化合物可用作合成ENPP1抑制剂。2020年,Mavupharm公司开发的小分子MAVU-104(结构未知)被认为是第1个具有口服活性的ENPP1抑制剂,并随后启动临床试验,但尚没有临床试验信息[31]。
由此可见,尽管最近几年ENPP1在药物化学领域引起了广泛的关注,也有报道合成了小分子ENPP1抑制剂,但开发新型和有效的类药物ENPP1抑制剂仍具有挑战性。目前针对ENPP1抑制剂的研究,尚处于开发出有效的ENPP1抑制剂的化合物或先导化合物阶段。大部分ENPP1抑制剂处于临床前实验研究阶段,极少数ENPP1抑制剂达到临床试验标准,并处于临床试验阶段。
4 总结与展望ENPP1是一种定位在细胞质膜,具有单一跨膜结构的细胞外核苷酸酶。在过去的10年中,通过开发小分子激动剂如STING激动剂,激活肿瘤免疫微环境中的STING以实现肿瘤免疫作用[34]。几种ENPP1抑制剂已显示出免疫刺激作用,它们与其他治疗方式(如免疫检查点阻断、STING激活、DNA损伤反应抑制剂和放射治疗)相结合,代表了一种增强抗肿瘤免疫的有希望的途径。尽管ENPP1的抑制将实现类似的结果,但其可能表现出非常不同的动力学特征。STING激动剂主要通过肿瘤内给药,快速清除是阻碍其进一步发展的关键限制。此外,全身IFN激活的剂量依赖毒性可能会缩小治疗窗口。相反,ENPP1抑制作用在TME内的范围小得多,这可能会限制其全身毒性。因而针对ENPP1抑制剂的研究广受关注[32]。
与此同时,也存在一些问题:① ENPP1在肿瘤中的特异性高表达是否存在普适性,还需要进一步验证;② ENPP1调控腺苷通路是否与其他酶,如CD73等相互协作,而单一抑制ENPP1能否达到治疗目的?也需要更多的基础研究证明。③现有的ENPP1抑制剂主要包括天然小分子化合物、核苷酸类ENPP1抑制剂、非核苷酸类ENPP1抑制剂、新型小分子ENPP1抑制剂,其中非核苷酸类ENPP1抑制剂主要包括乙酰胺类抑制剂以及喹唑啉-哌啶-磺胺抑制剂。迄今为止,已开发的少量ENPP1抑制剂不太可能适用于体内实验。许多已报道的核苷酸类抑制剂在生理pH值下呈负电荷,口服生物利用度非常低,同时基于核苷酸的抑制剂的合成和纯化步骤也非常具有挑战性[33]。非核苷酸衍生抑制剂类化合物较核苷酸类抑制剂有更优的理化性质,但由于缺乏特异性、分子量高、效价低和不利的药代动力学特征等限制,缺乏作为药理学制剂的实用价值。因此,还需要进一步的研究来确定ENPP1抑制剂是否可以成为可行的候选药物。
| [1] |
Borza R, Salgado-Polo F, Moolenaar W H, et al. Structure and function of the ecto-nucleotide pyrophosphatase/phosphodiesterase (ENPP) family: tidying up diversity[J]. J Biol Chem, 2022, 298(2): 101526. |
| [2] |
Bollen M, Gijsbers R, Ceulemans H, et al. Nucleotide pyrophosphatases/phosphodiesterases on the move[J]. Crit Rev Biochem Mol Biol, 2000, 35(6): 393-432. doi:10.1080/10409230091169249 |
| [3] |
Kato K, Nishimasu H, Okudaira S, et al. Crystal structure of Enpp1, an extracellular glycoprotein involved in bone mineralization and insulin signaling[J]. Proc Natl Acad Sci USA, 2012, 109(42): 16876-81. |
| [4] |
Ruiz-Fernández de Córdoba B, Martínez-Monge R, Lecanda F. ENPP1 immunobiology as a therapeutic target[J]. Clin Cancer Res, 2023, 29(12): 2184-93. doi:10.1158/1078-0432.CCR-22-1681 |
| [5] |
Wang H, Ye F, Zhou C, et al. High expression of ENPP1 in high-grade serous ovarian carcinoma predicts poor prognosis and as a molecular therapy target[J]. PLoS One, 2021, 16(2): e0245733. doi:10.1371/journal.pone.0245733 |
| [6] |
Bacci Simonetta D C S, Prudente S, Trischitta V. ENPP1 gene, insulin resistance and related clinical outcomes[J]. Curr Opin Clin Nutr Metab Care, 2007, 10(4): 403-9. doi:10.1097/MCO.0b013e3281e386c9 |
| [7] |
Dennis M L, Newman J, Dolezal O, et al. Crystal structures of human ENPP1 in apo and bound forms[J]. Acta Crystallogr D Struct Biol, 2020, 76(Pt 9): 889-98. |
| [8] |
Li L, Yin Q, Kuss P, et al. Hydrolysis of 2'3'-cGAMP by ENPP1 and design of nonhydrolyzable analogs[J]. Nat Chem Biol, 2014, 10(12): 1043-8. doi:10.1038/nchembio.1661 |
| [9] |
Goswami A, Deb B, Goyal S, et al. AVA-NP-695 selectively inhibits ENPP1 to activate STING pathway and abrogate tumor metastasis in 4T1 breast cancer syngeneic mouse model[J]. Molecules, 2022, 27(19): 6721. doi:10.3390/molecules27196721 |
| [10] |
Takahashi R U, Miyazaki H, Takeshita F, et al. Loss of microRNA-27b contributes to breast cancer stem cell generation by activating ENPP1[J]. Nat Commun, 2015, 6: 7318. doi:10.1038/ncomms8318 |
| [11] |
Kawaguchi M, Han X, Hisada T, et al. Development of an ENPP1 fluorescence probe for inhibitor screening, cellular imaging, and prognostic assessment of malignant breast cancer[J]. J Med Chem, 2019, 62(20): 9254-69. |
| [12] |
Min H, Wenzheng G. Dysregulated ENPP1 increases the malignancy of human lung cancer by inducing epithelial-mesenchymal transition phenotypes and stem cell features[J]. Am J Cancer Res, 2019, 9(1): 134-44. |
| [13] |
Li J, Duran M, Dhanona N, et al. Metastasis and immune evasion from extracellular cGAMP hydrolysis[J]. Cancer Discov, 2021, 11(5): 1212-27. |
| [14] |
Lau W M, Doucet M, Stadel R, et al. Enpp1: a potential facilitator of breast cancer bone metastasis[J]. PLoS One, 2013, 8(7): e66752. |
| [15] |
Kim B N, Ahn D H, Kang N, et al. TGF-beta induced EMT and stemness characteristics are associated with epigenetic regulation in lung cancer[J]. Sci Rep, 2020, 10(1): 10597. |
| [16] |
O'Conner J W, Gomez E W. Cell adhesion and shape regulate TGF-beta1-induced epithelial-myofibroblast transition via MRTF-A signaling[J]. PLoS One, 2013, 8(12): e83188. |
| [17] |
Wang H, Guo S, Kim S J, et al. Cisplatin prevents breast cancer metastasis through blocking early EMT and retards cancer growth together with paclitaxel[J]. Theranostics, 2021, 11(5): 2442-59. |
| [18] |
Hao Y, Baker D, Ten Dijkep P. TGF-beta-mediated epithelial-mesenchymal transition and cancer metastasis[J]. Int J Mol Sci, 2019, 20(11): 2767. |
| [19] |
Córdoba B R F D. Tumor ENPP1 (CD203a)_haptoglobin axis exploits myeloid-derived suppressor cells to promote post-radiotherapy local recurrence in breast cancer[J]. Cancer Discov, 2022, 12(5): 1356-77. |
| [20] |
Umar A, Kang H, Timmermans A M, et al. Identification of a putative protein profile associated with tamoxifen therapy resistance in breast cancer[J]. Mol Cell Proteomics, 2009, 8(6): 1278-94. |
| [21] |
Patel S D, Habeski W M, Cheng A C, et al. Quinazolin-4-piperidin-4-methyl sulfamide PC-1 inhibitors: alleviating hERG interactions through structure based design[J]. Bioorg Med Chem Lett, 2009, 19(12): 3339-43. |
| [22] |
Levesqe S A, Lavole E G, Lecka J, et al. Specificity of the ecto-ATPase inhibitor ARL 67156 on human and mouse ectonucleotidases[J]. Br J Pharmacol, 2007, 152(1): 141-50. |
| [23] |
Chang L, Lee S Y, Leonczak P, et al. Imidazopyridine- and purine-thioacetamide derivatives: potent inhibitors of nucleotide pyrophosphatase/phosphodiesterase 1 (NPP1)[J]. J Med Chem, 2014, 57(23): 10080-100. |
| [24] |
Jung J E, Jang Y, Jeong H J, et al. Discovery of 3, 4-dihydropyrimido[4, 5-d]pyrimidin-2(1H)-one and 3, 4-dihydropyrido[2, 3-d]pyrimidin-2(1H)-one derivatives as novel ENPP1 inhibitors[J]. Bioorg Med Chem Lett, 2022, 75: 128947. |
| [25] |
Jeong H J, Lee H L, Kim S J, et al. Identification of novel pyrrolopyrimidine and pyrrolopyridine derivatives as potent ENPP1 inhibitors[J]. J Enzyme Inhib Med Chem, 2022, 37(1): 2434-51. |
| [26] |
Kim S A I, Yu A, Lee S, et al. Orally available ENPP1 inhibitor, TXN10128, restores STING activation in tumor microenvironment and confers anti-tumor responses in combination with immune checkpoint blockade[J]. Mol Cancer Ther, 2021, 20(12): LBA009. |
| [27] |
Iyyp Z, Sun S, Guo K, et al. ENPP1 inhibitor ZX8177 enhances anti-tumor activity of conventional therapies by modulating tumor microenvironment[J]. Cancer Res, 2022, 82(12): 5486. |
| [28] |
Onyedibe K I, Wang M, Sintim H O. ENPP1, an old enzyme with new functions, and small molecule inhibitors-a STING in the tale of ENPP1[J]. Molecules, 2019, 24(22): 4192. |
| [29] |
Song S, Shao Z. From myricetin to the discovery of novel natural human ENPP1 inhibitors: a virtual screening, molecular docking, molecular dynamics simulation, and MM/GBSA study[J]. Molecules, 2022, 27(19): 6175. |
| [30] |
Carozza J A, Brown J A, Bohnert V, et al. Structure-aided development of small-molecule inhibitors of ENPP1, the extracellular phosphodiesterase of the immunotransmitter cGAMP[J]. Cell Chem Biol, 2020, 27(11): 1347-58. |
| [31] |
Ding C, Song Z, Shen A, et al. Small molecules targeting the innate immune cGAS-STING-TBK1 signaling pathway[J]. Acta Pharm Sin B, 2020, 10(12): 2272-98. |
| [32] |
Cogan D, Bakhoum S F. Re-awakening innate immune signaling in cancer: the development of highly potent ENPP1 inhibitors[J]. Cell Chem Biol, 2020, 27(11): 1327-8. |
| [33] |
Hosoda N H S I, Kanda Y, Katada T. Inhibition of phosphodiesterase pyrophosphatase activity of PC-1 by its association with glycosaminoglycans[J]. Eur J Biochem, 1999, 265(2): 763-70. |
| [34] |
张菁菁, 冯博, 赵立波, 等. STING激动剂释药系统的研究进展[J]. 中国药理学通报, 2022, 38(10): 1446-52. Zhang Q Q, Feng B, Zhao L B, et al. Research progress on STING agonist drug release system[J]. Chin Pharmacol Bull, 2022, 38(10): 1446-52. |

