

2. 贵州中医药大学第一附属医院,贵州,贵阳 550025
杨莎莎(1985-),女,博士,副主任医师,硕士生导师,研究方向:中医药防治疾病的临床与基础研究,通信作者,E-mail:yangyuansha88@163.com
 ,
TIAN Wei-yi1,
CAI Kun1,
ZHOU Su-fang1,
LI Yao-feng1,
CHEN Xiang-yun1,
QIAN Hai-bing1
,
TIAN Wei-yi1,
CAI Kun1,
ZHOU Su-fang1,
LI Yao-feng1,
CHEN Xiang-yun1,
QIAN Hai-bing1
 ,
YANG Sha-sha2
,
YANG Sha-sha2

2. The First Affiliated Hospital of Guizhou University of Traditional Chinese Medicine, Guiyang 550002, China
中药在人类生存和繁衍中起到了重要作用,学者们一直致力于通过使用现代科学技术来鉴定中药的生物活性成份,从而揭示其治疗疾病的机制,如通过分离、提取技术发现中药新药标准模式等。尽管进行了很多深入研究,但中药治病疗效的内在科学机制目前仍不清楚。中药或中药复方中含有大量化学物质,但其绝大多数被证明没有生物活性。现在的研究成果仍不能很好的阐释中药治疗疾病的机制。2019年Nature杂志报道了近200种药物可以被肠道菌群进行代谢后产生治疗效果[1]。近年来,中药与肠道菌群的相互作用也被逐渐视为中药药效机理研究的新领域。随着对肠道菌群与中药化学成分之间相互作用的深入研究,发现中药被肠道菌群代谢后生成与原中药成分不同的新成分,而中药有效成分又可以通过维持肠道菌群的动态平衡抑制疾病的发生和发展。
1 人体健康和肠道菌群人体肠道内分布着大量微生物,约有100万亿个古生菌和细菌,种类超过1 000种,其中90%以上肠道细菌属于拟杆菌门、厚壁菌门、放线菌门。肠道菌群在维持人体健康中发挥着重要作用,如:(1)参与人体代谢:肠道菌群拥有比人类更加强大的代谢能力。许多膳食和宿主来源的底物,例如胆碱类、多糖类等被肠道菌群代谢后形成有益或有害物质[2],后者对全身和局部能够造成伤害。(2)塑造全身免疫力:肠道菌群可以调节适应性和固有免疫反应。有学者研究发现,在淋巴器官形成和细胞免疫过程中,肠道菌群的参与必不可少。例如,无菌小鼠定殖脆弱芽孢杆菌(Bacillus)后产生了一种被树突状细胞识别的细菌多糖,导致CD4+T细胞增殖并恢复脾白髓中的淋巴细胞发育[3]。(3)维持肠道免疫平衡:肠道粘膜免疫与肠道菌群关系密切。肠道菌群可以通过诱导免疫细胞释放相关干扰素,进而启动机体的免疫保护模式。此外,肠道微生物群通过促进血管生成、肠屏障功能稳态和粘膜糖基化,进而促进胃肠道结构成熟[4]。(4)影响宿主行为:肠道菌群在脑-肠互动中起着至关重要的作用,肠道菌群及其代谢产物(色氨酸代谢产物)通过免疫、神经(迷走神经)和内分泌等途径影响大脑功能,进而影响行为。有趣的是,通过恢复肠道菌群稳态可以减轻甚至逆转宿主行为异常[5],但其确切机制还有待深入研究。
2 肠道菌群和中药相互作用 2.1 中药代谢涉及肠道菌群 2.1.1 非碳水化合物小分子中药水煎剂中广泛存在极性萃取物,这些极性萃取物亲脂性能力较差,通常在宿主体内的利用率很低。但在肠道菌群的作用下,这些极性萃取物可以代谢为亲脂性较高的化学物质。中药中最常见的成分是糖苷类,例如三萜糖苷和类黄酮糖苷,因它们所具有的极性表面积以及氢键数量导致肠道吸收时能力有限[6]。在人类的肠道内,许多细菌(其中的拟杆菌和硬毛菌占主导)含有丰富的糖苷水解酶基因,肠道菌群利用其自身的糖苷水解酶基因,通过切断糖基或葡萄糖醛基对糖苷进行水解,该过程中能够产生次生糖苷和/或糖苷配基等物质,他们在肠道中更容易被吸收,从而具有更好的生物利用度[7]。
中药在肠道代谢过程中,肠道菌群能够依据中药化合物的结构和特性进行人体代谢反应。例如,中药中的糖苷通常是通过阶段性水解(degulicosical化和酯分解)来代谢的,然后通过骨骼修饰或骨骼分裂进一步形成水解产物(Paraglicosid和/或糖苷配体)。在肠道生物转化中,多种细菌可以共同协作代谢某个化合物,单类细菌也可以转化多种化合物。如柏皮素在进入肠道后,FutubacterK-60、Streptococcus S-3,Pediococcus Q-5、Bifidobacterium B-9和Bacteroides JY-6等5类细菌参与了其代谢[8]。丁酸梭菌通过多种反应机理,如去糖基化、缩合、脱水和脱氢、再分离出不同结构类型的几种化合物。研究表明,肠道菌群对每一种代谢物都具有高度的特异性。如,肠道菌群选择性裂解多种黄酮类化合物(异黄酮、黄酮醇等),分别代谢为乙基酚衍生物和C6-C2酚酸[9]。生物学转化的广泛性和特异性应分别归因于肠道菌群编码代谢酶的多样性和选择性。例如,两种具有相似物理特性的β-D-葡糖醛酸糖苷酶从真菌中分离出来,其中一种将甘草甜素特异性水解为甘草次酸,而另一种将甘草次酸单葡糖醛酸化物专门代谢为甘草次酸[10]。此外,肠道菌群内源性环境还促进中药成分的代谢过程,这在一定程度上被中药分子内代谢所证实。某些环烯醚萜苷和双酯二萜生物碱在NH3(或NH4+)和脂肪酸存在情况下,分子内分别发生了催化代谢反应。已发现某些肠道菌群衍生的代谢产物是中药前体的活性形式。例如,肠道菌群通过逐步脱糖基化作用将人参皂甙Rb1代谢为20(S)-原人参二醇和化合物K,且后面两种代谢物的生物利用度更高(Fig 1)。

|
| Fig 1 Crucial role of gut microbiota in intestinal biotransformation of ginsenoside Rb1 in mammalian host |
鞣花丹宁(Ellagitannins)是一组可水解的单宁,广泛存在于药用植物中,具有抗氧化、抗炎和预防癌症的特性。然而,药代动力学研究表明,其生物利用度极低。进一步研究证实,在鞣花丹宁酸转化为尿石素的过程中肠道菌群起到关键作用,尿石素在体内和体外均有良好的生物活性[11]。此外,肠道菌群对中药进行代谢后能够降低或增加其毒性。如乌头种类植物中存在一种二酯类二萜生物碱,被称为乌头碱,口服后导致宿主急性中毒,肠道菌群可以将乌头碱转化为脂古尼碱和苯甲酰可卡因从而降低毒性[12]。马兜铃酸(AA)及其衍生物具有肾毒性和致癌性,在这些成分中AAI的毒性最高,而AAI的肠道菌群代谢产物马兜铃内酰胺I在肾损伤中比AAI具有更高的细胞毒性。
2.1.2 碳水化合物多糖类和低聚糖类等碳水化合物是中药及其水萃取物中广泛存在的化学物质。在富含碳水化合物的中药中,如人参根茎、石斛茎等均具有抗炎、抗肿瘤、抗氧化作用。然而,口服中药后其碳水化合物不易被消化[13]。相反,宿主肠道菌群编码包含数千种碳水化合物活性酶(CAZymes),因此人类肠道菌群能够发酵多种中药聚糖。这些CAZyme可以通过不同的方法代谢中药中的碳水化合物。研究发现,拟杆菌使用类似SUs的系统加工淀粉,该系统由CAZymes组装了一系列具有遗传簇编码的蛋白质。而法氏杆菌可以在没有细胞外降解的条件下代谢单糖和低聚糖。因其转运蛋白有两种不同形式(磷酸转移酶系统、ATP结合盒),它们能够直接导入这些较小的糖类并进行细胞内加工[14]。此外,有学者发现在碳水化合物发酵时,肠道细菌同样发挥了协同作用。嗜热胞菌能够降低聚糖分解酶的表达,但令人感兴趣的是同时也提高了低聚糖的含量,这表明在肠道细菌共生情况下,嗜热芽孢杆菌进一步加工聚糖降解产物[15]。在连续降解之后,肠道菌群代谢中药碳水化合物为正丁酸酯、乙酸酯和丙酸酯等。短链脂肪酸(SCFAs)是将肠道微生物群的生理功能传递给宿主的最重要的信号分子之一。肠道菌群产生的SCFAs有两个去向,一是被肠上皮细胞利用,二是通过消化吸收进入循环系统,从而影响人体生理和病理状况。中药治疗疾病的机理可能是其碳水化合物成分的独特医学作用,但需要进一步研究验证。
2.2 中药治疗靶向肠道菌群已经证明中药在治疗疾病的过程中也可以改变肠道菌群的组成。中药可以改善涉及多种病理状况的肠道菌群失调,包括糖尿病、肠易激综合症等。我们前期研究证实,通过16SrRNA高通量测序,中药方剂大建中汤能够显著提高肠易激综合症模型大鼠肠道菌群的丰度、多样性;在门水平,大建中汤能够增加肠易激综合症模型大鼠体内的厚壁菌门、未分类的细菌、放线菌门丰度,降低拟杆菌门、变形菌门的丰度,进而对肠激综合征发挥治疗作用[16]。肠道菌群大量参与疾病的发生、发展,与口服中药后肠道菌群构成的可塑性有关,这是中药治疗疾病的新认识。使用无菌模型或粪便移植设计数个实验证实,中药治疗疾病的靶向目标为肠道菌群。例如,通过对十全大补汤的研究表明,在肠道菌群参与下改变了热休克蛋白的表达水平[17]。这些研究表明,肠道菌群在中药治疗疾病时具有重要作用,且中药对肠道菌群的调节是多方面的,其分子机制主要体现在抑制作用和促进作用两个方面。
2.2.1 抑制作用肠道致病性菌群可通过细胞外毒素或胞内侵入等方式,引起菌血症、腹泻等多种疾病。大肠杆菌大致分为腹泻性大肠杆菌和肠外致病性大肠杆菌(ExPEC)。肠微绒毛粘附于腹泻性大肠杆菌可造成微绒毛消失,进而造成了吸收表面的减少,这种损伤反过来通过干扰肠上皮水和离子的吸收通道而导致腹泻。尿路致病性大肠埃希菌(其为ExPEC的一种)能分泌多种毒素,例如细胞毒性坏死因子1与溶血素,其对宿主细胞的损害和信号传递的调控作用加强,从而影响宿主细胞的炎性症状及存活情况。很多抗菌素已逐渐成为该症状的常规治疗方式,可利用蛋白质合成、靶向细胞壁合成、DNA合成、RNA合成或者中间代谢,发挥病原菌抑制作用或者杀死病原菌。但是,由于新的细菌和多种耐药细菌的不断增加,研制新型抗生素是非常有必要的。体外实验证实,多种中药提取液均能有效地抑制细胞内侵袭和肠上皮细胞粘附,并能有效地抑制部分条件性致病菌的肠道定植。有关疾病模型显示,中药对身体中的机会性或潜在病原菌具有抑制效果[18](Fig 2)。

|
| Fig 2 Some potential mechanisms of gut microbiota-targeted therapy by traditional Chinese medicine |
革兰氏阴性细菌在肠道细菌中会分泌细胞壁的重要组成成分脂多糖(LPS)。稳态肠腔作为外源性LPS的储藏器,但在肠内菌群系统紊乱时会提高肠道的通透性,从而使LPS能够在肝脏和肠内循环。LPS在低水平时会激活CD14与TLR4信号,从而使促炎细胞因子(如IL-6及IL-1)和TNF-α激活,引起慢性炎症及代谢障碍。诸如2型糖尿病、肥胖症与非酒精性脂肪肝等代谢紊乱,往往表现出显著的炎症反应(IL-1、TNF-α及IL-6水平提高)、肠屏障完整性受损(ZO-1、Cb-1与occluding表达受到抑制)、脂多糖提高及肠道菌群群紊乱。中药能够通过重新平衡紊乱的肠道菌群,对肥胖症、2型糖尿病显示出良好的治疗效果。在多种疾病模型中,人们普遍认为拟杆菌门或厚壁菌门是肠道菌群的稳态标志。中药对变形菌门(诸如脱硫弧菌与大肠杆菌)产生的LPS具有抑制效果[19]。由于肠道菌群数量的改善,中药还能缓解代谢障碍及全身性炎症。除相关内毒素以外,一些被称作硫酸盐还原细菌的革兰阴性细菌,也可以生成硫化氢[20]。硫化氢能抑制平滑肌的收缩,诱导氯化物的分泌并调控伤害感受,这是一种重要的生理功能,其机制是激活ATP敏感的钾离子通道。但是,高浓度的硫化氢是一种有毒物质。有明确的临床证据表明过量硫化氢与IBD有关[21],但是有关的原因还不明确。硫酸盐还原菌是引起结肠内硫化氢浓度的主要外来病原体,能够促进结肠内硫化氢的水平提高,当其数量过多时会引起疾病[22]。从绞股兰中提取的三萜皂甙对小鼠有很好的抗肿瘤活性。有意思的是,这种皂甙明显消耗了硫酸盐还原菌和它的决定基因dsrA,而该基因与硫化氢的发病机制相关。
2.2.2 促进作用中药促进肠道细菌生长的主要方法是发挥益生元样作用,选择性地刺激共生有益细菌(益生菌)的生长,例如乳酸杆菌属、双歧杆菌属和拟杆菌属。哺乳动物肠道菌群具有很强的利用外源和内源碳水化合物作为营养物质的能力[14]。因此,人们普遍认为中药的益生元样作用来源于其碳水化合物和糖苷成分。几种植物性碳水化合物,如菊糖、低聚果糖和低聚半乳糖已被广泛用作益生元。此外,中药多糖的益生元样作用已被证实,由于中药碳水化合物的结构和肠道细菌发酵碳水化合物的过程都是特定的,因此,不同的中药具有产生不同的益生元样作用。人参多糖通过提高肠道狄氏副拟杆菌和普通拟杆菌的丰度,使戊酸增高、犬尿氨酸/色氨酸的比值降低,进而调节免疫增强对免疫治疗的应答[23]。口服小檗碱后,可以上调肠道肠球菌丰度,进而促进脑内多巴胺的产生。肠道菌群对碳水化合物的发酵产生大量的SCFAs,为宿主提供多种系统性和靶向性益处(Fig 2)。但是,中药刺激SCFAs的产生除了发酵中药化学物质外还应涉及其他机制。肠道菌群分析表明,小檗碱选择性地富集了两株SCFAs产生菌Blautia和Allobaculam。此外,在小鼠模型中还发现小檗碱显著增加了粪便中的SCFAs。考虑到小檗碱的强抗菌活性[24],我们认为小檗碱通过抑制肠道内某些竞争性细菌间接富集了SCFAs产生菌。然后,富集的SCFAs产生菌促进肠道菌群获取膳食和内源碳水化合物,从而促进SCFAs的产生。益生菌可以激活不同的信号通路,通过对肥胖模型进行益生元治疗,发现富集的双歧杆菌以GLP-2依赖的形式与改善的肠屏障功能、系统性及肝脏炎症相关,因为GLP-2抑制剂可抵消益生元作用且经GLP-2治疗可恢复。食用婴儿双歧杆菌对感染和LPS诱导的NF-κB活性有明显抑制作用,同时显著增加了喂养小鼠肠道黏膜和脾脏中CD4+CD25+Foxp3+T细胞的数量。同样,Treg细胞的诱导分化也介导了双歧杆菌(CD8+T细胞)肿瘤免疫的增强(增强的树突状细胞功能)以及阿克曼菌(Foxp3+T细胞)介导的2型糖尿病病理状态的改善(杯状细胞增多、葡萄糖耐量改善和脂肪组织炎症减轻)[25]。此外,生酸拟杆菌在无菌小鼠体内的定殖导致大肠内产生了丰富的IgA,通过诱导生发中心的形成和增加IgA+B细胞的数量进而维持粘膜免疫[26]。值得注意的是SCFA的“信使”身份可介导这些通路,具体来说,双歧杆菌、阿克曼氏菌和拟杆菌属中的某些细菌擅长产生SCFAs,从而能够刺激肠内分泌L细胞产生GLP-2、调节Treg细胞的稳态并促进肠IgA的产生。因此,SCFA作为上游信号分子是否和如何参与这些途径值得进一步研究(Fig 2)。另一个值得注意的问题就是所谓中药的有益和有害调节不是一定的,而是取决于宿主和肠道菌群的状态(基因型和表型)。例如硫化氢,肠道中等浓度硫化氢支持适当的生理功能,而高浓度硫化氢导致发病;另一个例子是B.fragilis通过产生免疫调节分子来预防IBD,但它特异性地需要两种IBD相关的人类基因Atg16l1和Nod2 [27]。随着肠道细菌及其相关物质(如SCFAs)的生理和病理作用的逐步揭示,基于肠道菌群的靶向治疗可以更加精确和个性化,使得中药的治疗在未来更加有效。
2.3 肠道菌群与中药多组分相互作用 2.3.1 协同作用中药和肠道菌群之间的复杂互连可能会导致肠细菌介导的中药成分之间发生串扰。中药多糖被认为是益生元,可选择性刺激益生菌集的生长,恢复肠道菌群的稳定状态。另外,天然糖苷还能够通过一些益生菌转换为更具有生物活性的物质,如糖苷配体等。这些事实证实,中药多糖虽然不能消化且在口服时不能直接用于宿主,但它们可能作为益生元起作用,从而通过促进益生菌的生长而导致肠道菌群发生有利的变化。肠道菌群改善后,可以显著提高中药的生物活性(Fig 3)。有研究发现,人参水提物人参多糖能够改善人参皂甙(人参皂甙Re和Rc)的肠道代谢,同时恢复肠道生态系统的平衡,尤其是加强乳酸杆菌和拟杆菌的生长,这两种益生菌是人参皂苷的主要代谢细菌[28]。人参多糖不仅产生能够类似于益生菌作用,还对介导中药疗效产生了新的间接作用。黄氨酸是大黄的主要成分,经过肠道细菌代谢后成为生物活性明显活跃的大黄酸花青素。这些研究表明,中药的各种成分可以协同而不是单独地起作用,这是“多种组分对多治疗靶点”的证实。中药复方是将数十种具有不同治疗作用的中药结合起来,在中国传统医学体系中是常见的做法,并且药物形式的相容性被认为可以增强疗效和降低毒性。然而,这种治疗方法尚未得到科学的理解,其作用机制也未明确。口服中药复方后经过肠道菌群介导,复方内药物之间和(或)单味药物的不同化学成分相互作用可能是一种潜在的机制,可以解释中药复方的功效以及组合不同中药的原理。例如,服用大建中汤能够改善肠道菌群稳态。总之,中药及中药复方调节肠道菌群组成,从而改变其有毒成分的肠道代谢是目前研究的一个重要方向。
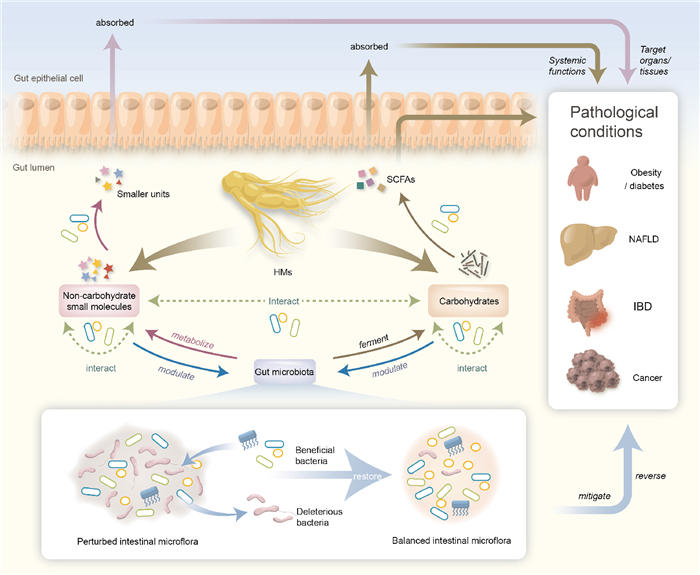
|
| Fig 3 Interactive network between traditional Chinese medicine and mammalian gut microbiota |
除了协同作用,中药组分之间经过肠道菌群介导的拮抗作用也出现在单个中药和中药配伍中,在桔梗或桔梗-甘草药对中,三萜糖苷(platycodin D)的肠道菌群代谢受到抑制。两个因素可以解释这类对抗,其一是中药化学成分的杀菌或抗菌活性引起肠道细菌的代谢能力下降,其二是代谢酶的多组分竞争。例如,当甘草与芍药1:1配伍应用时,甘草可以抑制芍药中单萜糖苷的肠道代谢。当甘草用量降低至1/5时,甘草中三萜糖苷的肠道代谢却异常减弱[29]。其原因是三萜苷与单萜苷可能有共享的代谢途径,竞争性代谢酶与肠道菌群在两药对中单萜糖苷和三萜糖苷的共代谢过程中产生拮抗作用。该研究同时也解释了为什么在临床处方中与芍药配对时甘草占主导地位。这种拮抗作用目前也成为了中药现代化的研究热点。
3 展望中医治疗相关疾病具有多途径、多层次与多靶点的特征。中药有效成分对多种病症起到明显改善效果,且毒副作用少,其优势与发展前景逐渐凸显。近年来,越来越多的学者开始关注中医药与肠道菌群的交互作用。随着科研的逐渐深入,中药治疗疾病的科学性得到进一步认识。中医药对病人肠道菌群的抑制与促进、肠道菌群对中药化学成分的生物转化,均已证实中药与肠道菌群相互作用在治疗病症中起到重要作用。中药经口给药过程中,必然会与肠道菌群发生直接接触,而肠道细菌介导的多组分协同效应,印证了中药“多组分对抗多靶点”理论。理解中药与肠道菌群间的相互作用,将为以中药为基础的新药研发带来革命性的变革。通常情况下,中药较好的吸收度或根据疾病的相关靶点(基因、蛋白质或者RNA)进行高通量体外筛选是中药药物研究的重要途径。但已有研究表明,在未被吸收的情况下,中药化学成分(如多糖)仍可与肠道菌群发生交互作用,对机体产生重要影响。所以,在新药研发中,除利用传统手段对中药与疾病有关的靶点进行筛选之外,还需要考虑中药与肠道菌群之间的相互作用。比如:对肠道菌群来说,中药多糖具有“益生元样”效应,应予以关注;中药混合提取物,特别是水提取物(同时含有多糖和小分子物质)也值得关注。另外,考虑到提取物多组分的协同作用可通过肠道菌群介导,特别是对含有多糖类和小分子物质的中药混合提取物需进行深入研究。
传统的中医理论认为,多种物质的协同作用是中药发挥效果的重要基础。目前,国内外学者研究主要集中在单一中药成分对肠道菌群的影响,以及单一中药成分被肠道菌群代谢过程。但是以“单一组分”为基础得出的结果可能不正确。在实际研究中,除代谢速率与水平不同外,还存在代谢途径的不同。比如,肠道菌群氧化效应是人参皂苷单体进行代谢的重要途径,但在整体试验中,却没有明确地揭示出这一现象。因此,要从整体上揭示中药与肠道菌群的相互作用机制,就必须从整个中药提取物上进行探讨。这就需要建立一套针对不同组分的高灵敏性、高特异性的全面化学分析方法,以深入理解中药对肠道菌群的调控作用。当前对中药研究尚无统一标准,建议采用化学标准化的提取物,以探讨中药与肠道菌群的相互作用。中药复方制剂标准化的核心是对制剂的质量控制,而制剂的定性与定量检测对用药后肠道菌群的影响起着决定性作用。比如,通过反相液相色谱发现金银花在发酵前后并无明显的化学组成变化[30],但发酵金银花对肥胖症与代谢性内毒素血症的抑制效果更为明显,本文将此现象归因于其所用的植物乳杆菌的益生菌效果。但是,对于高分子量物质中的很多极性成分,例如多糖类,常规的反相液相色谱方法并不能有效地检测出来,因而无法实现对高分子量物质的化学表征。对此,我们将进行更多的化学分析。同时,考虑到不同种类的中药化合物对肠道微生物的作用机理也不相同,所以建议将其分为多个组分,如小分子组分(按化学类型)、多糖组分(按分子分布),通过随机组合的形式对其进行生物学实验,观察哪个组分能够帮助中药发挥药效,并探讨其作用机制,以及多化学成分之间能否协同工作。
| [1] |
Zimmermann M, Zimmermann K M, Wegmann R, et al. Mapping human microbiome drug metabolism by gut bacteria and their genes[J]. Nature, 2019, 570(7762): 462-7. doi:10.1038/s41586-019-1291-3 |
| [2] |
Nicholson J K, Holmes E, Kinross J, et al. Hostgut microbiota metabolic interactions[J]. Science, 2012, 336(6086): 1262-7. doi:10.1126/science.1223813 |
| [3] |
Walter J, Armet A M, Finlay B B, et al. Establishing or exaggerating causality for the gut microbiome: lessons from human microbiota-associated rodents[J]. Cell, 2020, 180(2): 221-32. |
| [4] |
Stefan K L, Kim M V, Iwasaki A, et al. Commensal microbiota modulation of natural resistance to virus infection[J]. Cell, 2020, 183(5): 1312-24. doi:10.1016/j.cell.2020.10.047 |
| [5] |
Ara K, Fredrik B. From association to causality: the role of the gut microbiota and its functional products on host metabolism[J]. Mol Cell, 2020, 78(4): 584-96. doi:10.1016/j.molcel.2020.03.005 |
| [6] |
黄宇哲, 吴前震, 许腾龙, 等. 多糖对炎症性疾病及肠道菌群调控作用的研究进展[J]. 中国药理学通报, 2022, 38(11): 1601-6. Huang Y Z, Wu Q Z, Xu T L, et al. Advances in research of polysaccharides on inflammatory diseases and gut microbiota[J]. Chin pharmacol Bull, 2022, 38(11): 1601-6. |
| [7] |
Ara K, Fredrik B. From association to causality: the role of the gut microbiota and its functional products on host metabolism[J]. Molecular Cell, 2020, 78(4): 584-96. doi:10.1016/j.molcel.2020.03.005 |
| [8] |
舒心, 郭擎, 高彦祥. 槲皮素及其递送体系的研究进展[J]. 食品科学, 2022, 43(7): 202-12. Shu X, Guo Q, Gao Y X. Research progress on quercetin and its delivery system[J]. Food Sc, 2022, 43(7): 202-12. |
| [9] |
Gizem C, Koen V, Luigi L, et al. Interaction of dietary polyphenols and gut microbiota: microbial metabolism of polyphenols, influence on the gut microbiota, and implications on host health[J]. Food Frontiers, 2020, 1(2): 109-33. doi:10.1002/fft2.25 |
| [10] |
王梦丽. 杜仲水提物对高脂高糖饮食诱导的神经炎症的改善作用[D]. 陕西杨凌: 西北农林科技大学, 2020. Wang M L. The improvement effect of Eucommia ulmoides water extract on neuroinflammation induced by a high fat and high sugar diet[D]. Shanxi Yangling: Northwest A&F Univ, 2020. |
| [11] |
肖玉欣, 王楠, 王婧, 等. 鞣花酸和尿石素类代谢产物的生物活性及其对肠道健康的作用研究进展[J]. 食品科学, 2022, 43(9): 275-84. Xiao Y X, Wang N, Wang J, et al. A review of the bioactivity and gut Health benefits of ellagic acid and its metabolites, urolithins[J]. Food Sci, 2022, 43(9): 275-84. |
| [12] |
Marie S, Volker M, Arlt, et al. Schmeiser. DNA adducts formed by aristolochic acid are unique biomarkers of exposure and explain the initiation phase of upper urothelial cancer[J]. Int J Mol Sci, 2017, 18(10): 2144-52. |
| [13] |
Kmezik C, Mazurkewich S, Meents T, et al. A polysaccharide utilization locus from the gut bacterium Dysgonomonas mossii encodes functionally distinct carbohydrate esterases[J]. J Biol Chem, 2021, 296: 100500-11. doi:10.1016/j.jbc.2021.100500 |
| [14] |
Wardman J F, Bains R K, Rahfeld P, et al. Carbohydrate-active enzymes (CAZymes) in the gut microbiome[J]. Nat rev Microbiol, 2022, 20(9): 542-56. doi:10.1038/s41579-022-00712-1 |
| [15] |
Oliart R R, Badillo Z G, Quintana C R, et al. Production and characterization of cross-linked aggregates of geobacillus thermoleovorans ccr11 thermoalkaliphilic recombinant lipase[J]. Molecules, 2021, 26(24): 7569-78. doi:10.3390/molecules26247569 |
| [16] |
武静, 田维毅, 蔡坤, 等. 基于16SrRNA测序技术研究大建中汤调节肠易激综合征模型大鼠肠道菌群的作用机制[J]. 时珍国医国药, 2021, 32(8): 1814-8. Wu J, Tian W Y, Cai K, et al. Study on the mechanism of dajianzhong tang regulating the intestinal microflora in rats with irritable bowel syndrome model based on 16sRNA sequencing technology[J]. Lishizhen Med Mater Med Res, 2021, 32(8): 1814-8. |
| [17] |
Xu J, Chen, Hu B, Li S L. Understanding the molecular mechanisms of the interplay between herbal medicines and gut microbiota[J]. Mel Res Rev, 2018, 37(5): 1140-85. |
| [18] |
Lobel L, Cao Y G, Fenn K, et al. Diet posttranslationally modifies the mouse gut microbial proteome to modulate renal function[J]. Science, 2020, 369(6510): 1518-24. doi:10.1126/science.abb3763 |
| [19] |
Li X, Wu D, Niu J J, et al. Intestinal flora: a pivotal role in investigation of Traditional Chinese Medicine[J]. Am J Chinese Med, 2021, 49(2): 31-2. |
| [20] |
Myszkowska J, Derevenkov I, Makarov S V B, et al. Quantification and genetic diseases of the smallest signaling thiol metabolite: hydrogen sulfide[J]. Antioxidants, 2021, 10(7): 1065. doi:10.3390/antiox10071065 |
| [21] |
Bobbi B L, Anecita G L, Lynnette R F. A personalised dietary approach—a way forward to manage nutrient deficiency, effects of the western diet, and food intolerances in Inflammatory bowel disease[J]. Nutrients, 2019, 11(7): 1532-41. doi:10.3390/nu11071532 |
| [22] |
段晓梅, 闫爽, 倪连丽, 等. 复方蜚蠊提取物对大鼠溃疡性结肠炎肠道菌群的影响[J]. 中国药理学通报, 2019, 35(4): 591-2. Duan X M, Yan S, Yan L L, et al. Effects of medicine herbal compound Periplaneta americana extracts on intestinal microflora of rats with ulcerative colitis[J]. Chin Pharmacol Bull, 2019, 35(4): 591-2. |
| [23] |
Liu L, Jiang Z, Khan I, et al. Ginseng polysaccharides alter the gut microbiota and kynurenine/tryptophan ratio, potentiating the antitumour effect of antiprogrammed cell death 1/programmed cell death ligand 1 (anti-PD-1/PD-L1) immunotherapy[J]. Gut, 2022, 71(4): 734-45. doi:10.1136/gutjnl-2020-321031 |
| [24] |
Kazemipoor M, Fadaei T P, Zandi H, et al. Chemical composition and antibacterial activity of Berberis vulgaris (barberry) against bacteria associated with caries[J]. Clin Exp Dent Res, 2020, 7(4): 601-8. |
| [25] |
Allin K H, Jensen C B, acobsen R K, et al. Metformin use is not associated with reduced risk of older onset inflammatory bowel disease: a Danish nationwide population-based study[J]. J Gastroenterol, 2022, 57(10): 761-9. |
| [26] |
Marisa S, Alyssa S C, Silvia I, et al. Heterochronic faecal transplantation boosts gut germinal centres in aged mice[J]. Nat Commun, 2019, 10(1): 1-13. |
| [27] |
Chu H T, Khosravi A, Kusumawardhani I P, et al. Genemicrobiota interactions contribute to the pathogenesis of inflammatory bowel disease[J]. Science, 2016, 352(6289): 1116-20. |
| [28] |
Zhou S S, Zhou J, Xu J D, et al. Ginseng ameliorates exercise-induced fatigue potentially by regulating the gut microbiota[J]. Food Funct, 2021, 12(9): 3954-64. |
| [29] |
He R, Wang S H, Liu Q, et al. Liquiritin enhancing intestinal absorption of paeoniflorin in situ single-pass intestinal perfusion and in vitro Caco-2 cell monolayer absorption models[J]. Pharmacogn Mag, 2021, 17(75): 615-22. |
| [30] |
Xu, Chen H B, Li S L. Understanding the molecular mechanisms of the interplay between herbal medicines and gut microbiota[J]. Med Res Rev, 2017, 37(5): 1140-85. |