

帕金森病(Parkinson′s disease,PD)作为进行性的神经退行性疾病,发病率仅次于阿尔茨海默病,主要表现为中脑黑质区多巴胺能神经元死亡丢失和多巴胺能神经元内α-突触核蛋白(α-synuclein,α-syn)聚集,临床表现为进行性不对称性静息性震颤、肌强直、步态异常等。虽然基于多巴胺的疗法可有效对抗疾病早期的症状,但缺乏神经保护药物意味着疾病会继续发展, 除了传统上公认的多巴胺能神经元死亡和细胞内α-syn沉积的病理特征外[1]。线粒体功能障碍、氧化应激升高、脂质代谢紊乱、线粒体-ER互作等是PD病理生理学的进一步显著特征[2]。然而,将这些病理特征与神经变性联系起来的潜在机制仍不清楚。目前细胞器间产生的相互作用在细胞生物学领域受到诸多关注。内质网(endoplasmic reticulum,ER)和线粒体在细胞的生命活动中发挥着极其重要的功能,二者相互作用区域,称为线粒体相关膜,该区域参与脂质合成和运输、线粒体动力学、Ca2+转运等多种细胞过程的调节。在人类发生神经退行性疾病时,线粒体与ER之间的接触会出现明显的异常现象[3]。因此,靶向调控“ER-线粒体互作”可能为防治PD提供新策略。在这里,我们概述了ER-线粒体互作与线粒体相关膜(mitochondrial associated membranes,MAM)结构的生理意义和作用机制,以及ER-线粒体互作异常如何调控PD进程中相应的细胞过程。
1 ER-线粒体互作ER是最大的膜结合细胞器,作为细胞外空间内靶位点的第一个隔室执行包括膜蛋白的合成、运输、分泌等功能。ER不是一个独立的结构,而是与线粒体、高尔基体、溶酶体等多种细胞器形成接触的复合结构,其独特环境不仅非常适合蛋白质和脂质合成,而且还有助于其修饰。线粒体大量存在于骨骼肌和大脑等对能量需求高的组织中,给予体内真核细胞有氧呼吸提供场所,生命活动所需的能量由糖类、脂肪和氨基酸在此进行能量代谢[4]。线粒体是一种复杂的细胞器,通过裂变和融合经历连续的形态动态变化调节细胞代谢。随着研究的不断深入,真核细胞中的膜结合细胞器已被证明可以直接通过膜接触进行交流。ER和线粒体之间就存在这种现象。早在1959年,电子显微镜观察到ER和线粒体之间紧密膜接触的现象。1969年,通过电子显微镜首次在哺乳动物卵巢组织中观察到ER与线粒体之间存在物理相互作用[5]。Copeland和Dalton也提出ER和线粒体之间存在通信的概念[6]。ER和线粒体之间不同间距的触点子类型对应不同的功能,进而影响Ca2+信号传导、能量和脂质代谢、线粒体和ER动力学、ER应激反应、炎症、细胞凋亡和自噬等多种细胞进程[7],对于真核细胞维持体内平衡至关重要[8]。越来越多的证据表明[9],扰动的ER-线粒体信号传导会导致包括PD在内的许多神经退行性疾病。ER与线粒体互作调控机制见Fig 1。
|
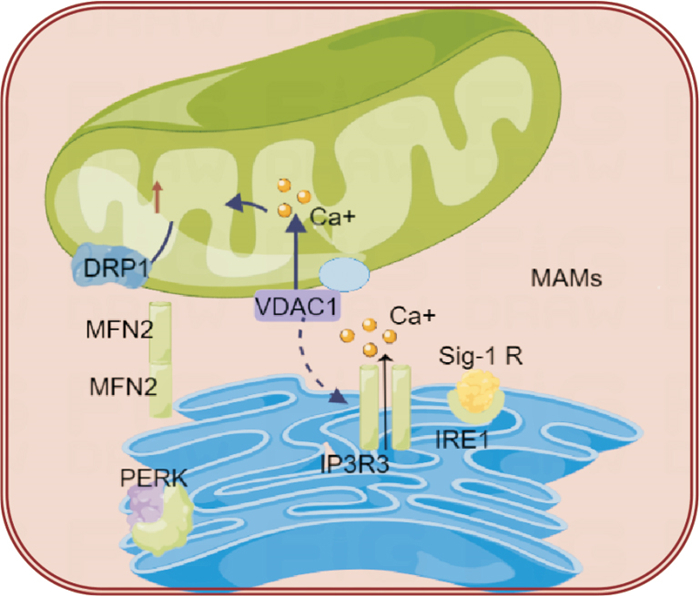
| Fig 1 Schematic representation of Ca2+ transport in course of Parkinson′s disease |
ER与线粒体通信的膜接触区域称为MAM, MAM是ER中与线粒体紧密相连的瞬态结构域,它在物理和生物学上将线粒体连接到ER线粒体表面的15%~20%通过MAM结构域在功能上与ER相连,这两种细胞器之间的特殊膜区域具有10~80 nm距离。MAM的多种接触位置具有调节多种细胞生物学特征的功能。大小在10到25 nm之间的触点主要用于Ca2+交换。在大约30nm的距离ER小管会包裹线粒体从而在线粒体分裂中发挥作用。而小于10 nm宽度的可使光滑的ER膜与线粒体形成紧密相关的接触,从而促进脂质交换的发生[10]。MAM的形成会改变ER膜的脂质环境,MAM驻留酶的构象以及它们与其他蛋白质的相互作用。它不仅在ER和线粒体之间提供栓系蛋白复合物,而且允许ER和线粒体之间代谢物和信号分子的功能转运,在本质上具有功能特性和酶活性,从而影响细胞功能。例如:MAM在运输线粒体和ER之间Ca2+、维持线粒体的正常形态、产生细胞生物能、脂质的代谢和运输、ER应激中具有重要的作用[11]。
3 MAM调控多种细胞生物学过程在PD中的研究进展ER-线粒体互作在胞质蛋白和膜蛋白合作下完成,ER和线粒体之间的固有稳态为协调俩个细胞器调控的多种细胞功能提供机会,MAM作为ER与线粒体之间的连接媒介,已在研究观察到其在PD中的结构或功能发生变化,由MAM调节的多种细胞功能的紊乱或缺陷,包括Ca2+运输、线粒体融合和分裂、磷脂合成在PD中被发现。鉴于MAM介导的机制在调节细胞命运和功能方面的重要性,在本节中,我们重点介绍在PD进程中,ER-线粒体互作异常后,MAM调控Ca2+运输、线粒体融合和分裂、磷脂合成的生物学机制。
3.1 MAM调控的Ca2+转运在PD中的研究进展Ca2+作为真核细胞的“第二信使”之一,在细胞内多种生物过程中发挥作用,正常情况下,当Ca2+通过肌醇1、4、5-三磷酸(inositol triphosphate,IP3)受体从ER中释放出来后,线粒体通过电压依赖性阴离子通道蛋白质和线粒体钙离子流入通道蛋白(mitochondrial calcium uniporter,MCU)与ER紧密接触,将钙从细胞溶质吸收到基质中,避免线粒体钙离子超载, 线粒体优先通过MAMs摄取Ca2+,它会改变对Ca2+亲和力低的线粒体摄取Ca2+的过程, 进而维持MAM区稳态,MAM稳态失衡会干扰Ca2+细胞器之间的转移,ER中由IP3R介导的Ca2+释放被抑制,进而导致ATP产生以及细胞活力的下降[12]。
细胞内的Ca2+主要储存在ER中,线粒体可以通过调节ER中Ca2+信号传导发生神经保护作用,当线粒体Ca2+超载,将引起线粒体通透性转换孔开放,进而促进细胞色素C、凋亡诱导因子等释放,激活半胱氨酸蛋白酶(caspases)3和9,最终导致细胞凋亡引发PD[13]。定位于MAM上PD相关蛋白DJ-1与MAM蛋白IP3R3-GRP75-VDAC复合物产生相互作用,DJ-1的丢失导致ER-线粒体相互作用减弱,促进ER-线粒体关联,调节Ca2+转移。有研究显示[14],在人神经干细胞(neural stem cells,NSCs)中,B细胞淋巴瘤/白血病-xL(Bcl-xL)可以直接结合和调节ER区的IP3受体,增强Ca2+释放,位于OMM上的线粒体Miro可以调节ER-线粒体接触位点(ERMCS)的完整性并与ERMCS Ca2+的转运蛋白相互作用,从而通过调节Ca2+从ER到线粒体运输实现线粒体内稳态。有学者表示[15],编码Aβ基因的APP生理功能障碍可能是PD早期核心病理。APP和α-syn位于MAM上并汇聚调节IP3R1-Grp75-VDAC2,它们重复促进线粒体钙流出。APP的缺失导致线粒体钙超负荷,从而增强有氧呼吸和ER应激,最终导致海马体过度凋亡和幼鼠空间记忆障碍。另有研究发现[16],PD引发的功能障碍降低了Mfn2的蛋白酶体依赖性周转,特别是在ER-线粒体界面,从而增加了ER-线粒体的接近度并减少了胞质钙瞬变。此外,在PD果蝇模型中的粉红色突变多巴胺能神经元中,ERMCS得到加强,Ca2+从ER到线粒体的转运会导致线粒体Ca2+升高以及神经功能受损和生存障碍[17]。这都表明ER-线粒体互作异常将极大影响PD线粒体内Ca2+内稳态进而损伤神经的保护作用,具体机制见Fig 1。
3.2 MAM调控的线粒体动力学在PD中的研究进展线粒体经历循环融合与分裂去改变线粒体形态、大小和位置的过程称为“线粒体动力学”,ER-线粒体互作密切调控着线粒体的裂变与融合。线粒体动力学(裂变、融合和迁移)对神经传递、突触维持和神经元存活很重要。线粒体融合和裂变之间的平衡调节会以各种方式促进神经分化和自我更新,融合与裂变失衡可损害线粒体的形态和功能,进而导致PD等多种疾病的发生[18]。
MAM是调控线粒体分裂的重要场所,线粒体分裂具体调控过程为由动力蛋白1(dynamin-related protein 1,Drp1)被线粒体分裂蛋白1(mitochondrial fission,Fis1)募集至OMM上,从而改变Rho GTP酶(mitochondrial Rho-GTPase,Miro)结构,形成的寡聚体结构会包裹住线粒体外膜,从而开始线粒体分裂过程;线粒体融合主要由受线粒体融合蛋白1(mitofusin 1,MFN1)、线粒体融合蛋白2(MFN2)和视神经萎缩蛋白(optic atrophy 1,OPA1)介导。位于MAM中的MFN2通过与线粒体外膜上的MFN1或MFN2的形成同源或者异源二聚体,参与ER与线粒体之间的连接,这对ER-线粒体互作至关重要,且融合缺陷可引起线粒体DNA丢失,而由DRP1和FIS1调节的裂变过程用于去除和降解具有受损DNA的线粒体[19]。有学者表示[20],PD缺陷星形胶质细胞无法去除受损的线粒体,很可能是由于它们缺乏MFN2泛素化或OMM蛋白的低效降解,PD相关基因E3泛素连接酶Parkin促进MFN2的泛素化,导致其通过蛋白酶体途径降解。PD可能使MAM的底物MFN2水平升高导致线粒体融合障碍[21],而OPA1的下调会导致线粒体产生碎片化,其呼吸复合物成分表达量减少和膜电位下降,树突生长受限以及大鼠皮质初级神经元中突触蛋白表达的下调。Drp1与PD发病相关基因富含亮氨酸的重复激酶2(LRRK2)突变体相互作用增加,从而过度磷酸化裂变蛋白,导致ROS产生和线粒体片段化增加。此外,PD中α-syn的相关突变可以抑制线粒体融合和裂变,并导致MAM功能下降、ER与线粒体的结合程度降低和线粒体碎裂增加[22]。另有研究显示,ER驻留的钙结合蛋白(RCN1)定位于MAM位点,PD可能会增强MAM位点的RCN1,然后通过有缺陷的线粒体产生裂变损害LC3非依赖性线粒体自噬,这都表明ER-线粒体互作异常会影响PD患者线粒体动力学的正常功能,具体机制见Fig 2。

|
| Fig 2 Mitochondrial fusion and fission in progression of Parkinson′s disease |
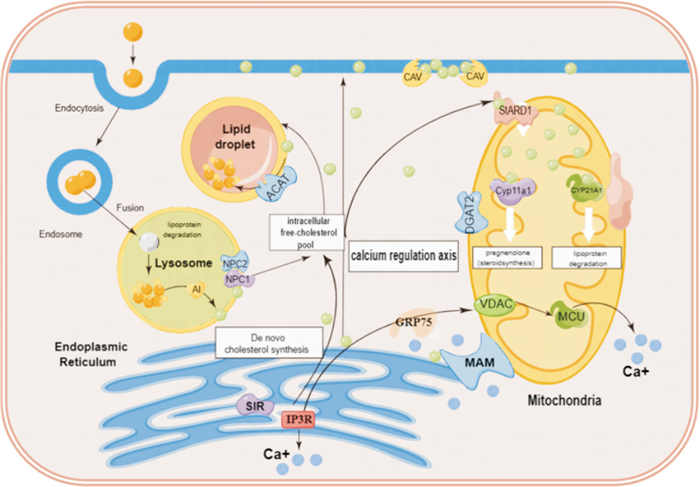
ER和线粒体互作可以调节磷脂和脂肪酸的代谢,磷脂合成的主要场所为ER,其可以与线粒体等其他细胞器进行接触维持细胞器间的磷脂交换,MAM含有的脂质代谢蛋白催化细胞中游离胆固醇转化为胆固醇酯,维持静止时结合胆固醇和游离胆固醇之间的动态[23],MAM中胆固醇水平的降低促进了ER和线粒体之间的相互作用并改变了磷脂酰丝氨酸(PS)和磷脂酰乙醇胺(PE)合成。合成甘油三酯(triglyceride,TG)的关键酶二酰基甘油酰基转移酶2(diacylglycerol acyltransferase 2,DGAT2)是由ER和线粒体共有的一些酶参与的,也存在MAM中[24]。除此之外,参与胆固醇生物合成的酶ACAT1也存在于MAM中。ACAT1在静止状态下催化游离胆固醇转化为胆固醇酯(dholesterylesters,CE),有助于维持膜结合和细胞质脂滴(LDs)储存的胆固醇之间的平衡。不仅如此,MAM还含有参与神经酰胺生物合成的酶,包括鞘磷脂磷酸二酯酶(SMASE)、神经酰胺合酶(CerS)和二氢神经酰胺去饱和酶(DES)[25]。胆固醇消耗和神经酰胺从头合成的抑制导致CHO细胞中MAMs蛋白(如Sigma1R和IP3R)向ER池迁移,这表明MAM中胆固醇和神经酰胺合成的改变会影响这些接触位点的结构。
脂质在神经元的正常生理功能和脑的结构发育中起着关键作用,在人体中枢神经系统(central nervous system,CNS)中发现了脂酰基、甘油糖脂、甘油磷脂、鞘脂、固醇脂、孕烯醇酮脂类、糖脂类和聚酮类等脂类成分,CNS的脂质含量位居第二位,仅低于脂肪组织,脑内的脂质成分是神经细胞发挥结构功能的主要成分,其胆固醇含量占人体总胆固醇含量20%[26]。脂质稳态失调是PD发作的基本特征之一,LDs相关的脂毒性也与PD病理有关[27]。研究证明[28],脂质代谢的改变会明显影响细胞功能和正常的神经活动,是导致CNS损伤的关键因素。另研究表明[29],PD患者的血浆中磷脂含量较对照组患者增加,同时发现,富含DHA/EPA的磷脂可明显改善脑功能;另有研究表明[30],在PD受试者的死后脑组织中,发现黑质中存在的星形胶质细胞中的中性脂质含量降低,而它们在神经元和小胶质细胞中的含量增加,这都证明ER-线粒体互作异常带来的脂质稳态紊乱可能是导致PD的发病机制之一,具体机制见Fig 3。
|
| Fig 3 Lipid metabolism in course of PD |
本文详细介绍了MAM这一结构的功能以及在PD中的重要作用,MAM通过调控Ca2+转运、线粒体动力学和脂质运输维持线粒体-ER互作的稳态,进而维持细胞稳态,发挥细胞保护作用;同时,MAM稳态失衡,进而引起线粒体过度分裂、融合以及Ca2+超载,对细胞产生病理性损伤。MAM结构稳态被破坏与ER-线粒体互作失衡的机制有可能导致包括PD在内的神经退行性疾病。ER-线粒体互作异常可使Ca2+转运失衡,线粒体Ca2+异常升高导致神经功能受损,线粒体裂变与融合发生失衡,会使线粒体发生碎片化以及功能受损进而影响疾病进程。
然而,还有很多问题值得更加深入研究,例如:在PD进程中,Ca2+转运、线粒体动力学和脂质运输之间是否有机制上的关联?课题组基于前期对PD的研究、文献分析以及生物信息学分析,发现在PD进程中,ER-线粒体互作异常常伴有脂质代谢紊乱,且MAM区域的脂质合成的酶DGAT2、ACAT1与Ca2+通道IP3R-GRP75-VDAC1-MCU蛋白具有一定的互作关系,但目前在PD的研究中,对于MAM区Ca2+通道蛋白调控脂质合成的机制并未涉及,因而,深入阐明MAM区Ca2+通道调控脂质合成的机制揭示PD发生发展机制是今后研究的重点,这将为PD的防治提供新的靶点和通路。
| [1] |
丁新玲, 孙会艳, 李强, 等. EGCG对帕金森病神经保护作用机制研究进展[J]. 中国药理学通报, 2023, 39(10): 1806-10. Ding X L, Sun H Y, Li Q, et al. Recent progress of epigallocatechin 3-gallate for treatment of Parkinson's diseas[J]. Chin Pharmacol Bull, 2023, 39(10): 1806-10. doi:10.12360/CPB202204135 |
| [2] |
Costa H N, Esteves A R, Empadinhas N, et al. Parkinson's disease: a multisystem disorder[J]. Neurosci Bull, 2023, 39(1): 113-24. doi:10.1007/s12264-022-00934-6 |
| [3] |
Yang P, Lin G, Wang M, et al. Long non-coding RNA ANRIL interacts with microRNA-34a and microRNA-125a, and they all correlate with disease risk and severity of Parkinson's disease[J]. J Clin Lab Anal, 2022, 36(1): 2-13. |
| [4] |
Sunanda T, Ray B, Mahalakshmi A M, et al. Mitochondria-endoplasmic reticulum crosstalk in parkinson's disease: the role of brain renin angiotensin system components[J]. Biomolecules, 2021, 11(11): 1-10. |
| [5] |
Ruby J R, Dyer R F, Skalko R G. Continuities between mitochondria and endoplasmic reticulum in the mammalian ovary[J]. Z Zellforsch Mikrosk Anat, 1969, 97(1): 30-7. doi:10.1007/BF00331868 |
| [6] |
Rizzuto R, Pinton P, Carrington W, et al. Close contacts with the endoplasmic reticulum as determinants of mitochondrial Ca2+ responses[J]. Science, 1998, 280(5370): 1763-6. doi:10.1126/science.280.5370.1763 |
| [7] |
Fernandes T, Domingues M R, Moreira P I, et al. A perspective on the link between mitochondria-associated membranes (MAMs) and lipid droplets metabolism in neurodegenerative diseases[J]. Biology (Basel), 2023, 12(3): 1-11. |
| [8] |
Zhao Y, Yang G. Potential of extracellular vesicles in the Parkinson's disease - pathological mediators and biomarkers[J]. Neurochem Int, 2021, 144: 1-10. |
| [9] |
Liu J, Yang J. Mitochondria-associated membranes: A hub for neurodegenerative diseases[J]. Biomed Pharmacother, 2022, 149: 1-10. |
| [10] |
Schiebout C, Frost H R. CAMML: Multi-label immune cell-typing and ste mness analysis for single-cell RNA-sequencing[J]. Pac Symp Biocomput, 2022, 27: 1 99-210. |
| [11] |
Fotopoulou C, Khan T, Bracinik J, et al. Outcomes of gynecologic cancer surgery during the COVID-19 pandemic: an international, multicenter, prospective covidsurg-gynecologic oncology cancer study[J]. Am J Obstet Gynecol, 2022, 227(5): 735. e1-25. doi:10.1016/j.ajog.2022.06.052 |
| [12] |
Perocchi F, Gohil V M, Girgis H S, et al. MICU1 encodes a mitochondrial EF hand protein required for Ca(2+) uptake[J]. Nature, 2010, 467(7313): 291-6. doi:10.1038/nature09358 |
| [13] |
Lee K S, Huh S, Lee S, et al. Altered ER-mitochondria contact impacts mitochondria calcium homeostasis and contributes to neurodegeneration in vivo in disease models[J]. Proc Natl Acad Sci USA, 2018, 115(38): E8844-53. |
| [14] |
Zhang S, Zhao J, Quan Z, et al. Mitochondria and other organelles in neural development and their potential as therapeutic targets in neurodegenerative diseases[J]. Front Neurosci, 2022, 16: 1-18. |
| [15] |
Wang Y, Miao Z, Xu C, et al. Pathological convergence of APP and SNCA deficiency in hippocampal degeneration of young rats[J]. Cell Death Dis, 2023, 14(5): 3-12. |
| [16] |
Rybarski M, Mrohs D, Osenberg K, et al. Loss of parkin causes endoplasmic reticulum calcium dyshomeostasis by upregulation of reticulocalbin 1[J]. Eur J Neurosci, 2023, 57(5): 739-61. doi:10.1111/ejn.15917 |
| [17] |
Pacitti D, Levene M, Garone C, et al. Mitochondrial neurogastrointestinal encephalomyopathy: into the fourth decade, what we have learned so far[J]. Front Genet, 2018, 9: 1-22. doi:10.3389/fgene.2018.00001 |
| [18] |
Faustini G, Marchesan E, Zonta L, et al. Alpha-synuclein preserves mitochondrial fusion and function in neuronal cells[J]. Oxid Med Cell Longev, 2019, 2019: 2-11. |
| [19] |
González-Jamett A M, Momboisse F, Haro-Acuña V, et al. Dynamin-2 function and dys-function along the secretory pathway[J]. Front Endocrinol (Lausanne), 2013, 4: 1-9. |
| [20] |
El-Hattab A W, Craigen W J, Scaglia F. Mitochondrial DNA maintenance defects[J]. Biochim Biophys Acta Mol Basis Dis, 2017, 1863(6): 1539-55. doi:10.1016/j.bbadis.2017.02.017 |
| [21] |
Sironi L, Restelli L M, Tolnay M, et al. Dysregulated interorganellar crosstalk of mitochondria in the pathogenesis of Parkinson's disease[J]. Cells, 2020, 9(1): 2-23. |
| [22] |
Johri A, Chandra A. Connection lost, MAM: errors in ER-mitochondria connections in neurodegenerative diseases[J]. Brain Sci, 2021, 11(11): 2-17. |
| [23] |
Gordaliza-Alaguero I, Cantó C, Zorzano A. Metabolic implications of organelle-mitochondria communication[J]. EMBO Rep, 2019, 20(9): 1-27. |
| [24] |
Bernard-Marissal N, Médard J J, Azzedine H, et al. Dysfunction in endoplasmic reticulum-mitochondria crosstalk underlies SIGMAR1 loss of function mediated motor neuron degeneration[J]. Brain, 2015, 138(Pt 4): 875-90. |
| [25] |
Hayashi T, Fujimoto M. Detergent-resistant microdomains determine the localization of sigma-1 receptors to the endoplasmic reticulum-mitochondria junction[J]. Mol Pharmacol, 2010, 77(4): 517-28. |
| [26] |
刘慧磷, 谭洁琼, 王芳. 脂质代谢紊乱与神经退行性疾病关系的研究进展[J]. 中南医学科学杂志, 2022, 50(1): 149-52. Liu H L, Tan J Q, Wang F. Progress in investigating the relationship between lipid metabolism disorders and neurodegenerative diseases[J]. Zhongnan J Med Sci, 2022, 50(1): 149-52. |
| [27] |
Fanning S, Haque A, Imberdis T, et al. Lipidomic analysis of α-synuclein neurotoxicity identifies stearoyl CoA desaturase as a target for parkinson treatment[J]. Mol Cell, 2019, 73(5): 1001-14. |
| [28] |
Farmer B C, Walsh A E, Kluemper J C, et al. Lipid droplets in neurodegenerative disorders[J]. Front Neurosci, 2020, 14: 1-9. |
| [29] |
Calzada E, Onguka O, Claypool S M. Phosphatidylethanolamine metabolism in health and disease[J]. Int Rev Cell Mol Biol, 2016, 321: 29-88. |
| [30] |
Han X, Zhao S, Song H, et al. Kaempferol alleviates LD-mitochondrial damage by promoting autophagy: implications in Parkinson's disease[J]. Redox Biol, 2021, 41: 1-16. |

