

2. 南京中医药大学医学代谢组学中心,江苏 南京 210023;
3. 南京中医药大学中西医结合学院,江苏 南京 210023
2. Medical Metabolomics Center, Nanjing University of Chinese Medicine, Nanjing 210023, China;
3. School of Integrated Chinese and Western Medicine, Nanjing University of Chinese Medicine, Nanjing 210023, China
肺纤维化(pulmonary fibrosis,PF)是多种弥漫性、间质性肺病的共同病理改变和最终结果。特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是临床最为常见的一种特发性间质性肺炎[1]。IPF具有较高的致死率,其机制为肺部损伤导致持续的细胞修复和促纤维化因子累积,并诱导成纤维细胞向肌成纤维细胞的转化,最终导致IPF。肺表面活性脂质对肺部功能的稳定起到重要作用,主要由磷脂(phospholipid,PL)和包括胆固醇在内的少量中性脂质组成。越来越多的研究表明,PF的发展过程与脂质代谢的改变密切相关[2],本文对近年来PF,尤其是最常见的IPF中脂质代谢研究进行了分析和总结。
1 IPF简介IPF是临床最为常见、较为严重的一种PF,其发病原因尚不明确。目前研究认为,IPF是一种上皮驱动疾病,其特征为肺部持续性损伤导致的弥漫性、进行性重塑,并伴有细胞外基质(extracellular matrix,ECM)沉积和瘢痕形成[3]。IPF发生机制为Ⅰ型、Ⅱ型肺泡上皮细胞(alveolar epithelial cell,AEC)因反复损伤而死亡,肺泡巨噬细胞以及淋巴细胞参与伤口愈合,并引起炎症反应,血管通透性增加并导致伤口临时基质形成;同时伴随表皮生长因子参与的AEC迁移和增殖,成纤维细胞向损伤部位迁移,并激活转化生长因子β(transforming growth factor β,TGF-β),促进成纤维细胞分化为肌成纤维细胞,进而导致ECM过度累积,最终发生纤维化,部分病理学变化见Fig 1。环境因素如吸烟、病毒感染,以及各类细胞异常等均可导致上皮损伤和细胞凋亡,在全球流行的新型冠状病毒COVID-19感染不仅导致细胞因子风暴、呼吸衰竭等,也可导致PF[4]。
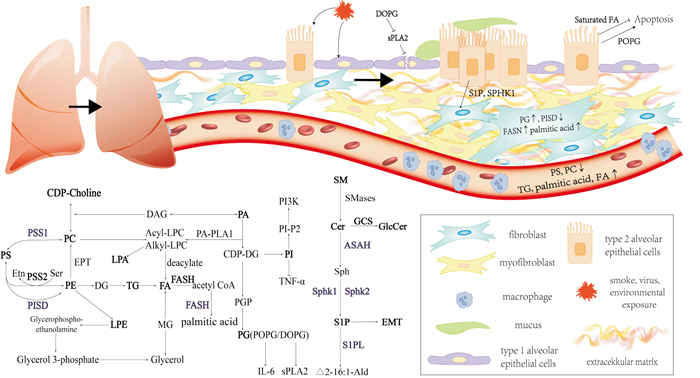
|
| Fig 1 Pathological changes and lipid metabolism of pulmonary fibrosis External factors cause type 1 and type 2 alveolar epithelial cell damage, type 2 epithelial cells show a fibroblast like phenotype through epithelial mesenchymal transition, and fibroblasts transform into myofibroblasts and secrete extracellular matrix, leading to the occurrence of PF. Each lipid and its metabolic enzymes play their respective roles in different cells to regulate the occurrence and development of PF. |
脂质可被大致分为脂肪酸类、甘油酯类、甘油磷脂类、鞘脂类、糖脂类、多聚酮类、甾醇脂类和异戊烯醇脂类8类,参与神经系统、代谢系统、呼吸系统等多系统疾病的发生发展,在能量转运、信号转导、细胞生长与凋亡、炎症反应等环节均发挥重要作用[5]。近年来兴起的脂质组学为研究脂质在组织或细胞等生物样品中的组成、结构及定量水平,寻找生物标志物,研究脂质分子在疾病发生发展中的作用提供了有力工具[6]。
Ⅱ型肺泡上皮细胞(type Ⅱ alveolar epithelial cells,AEC Ⅱ)是肺部脂质的主要来源,其分泌的表面活性脂质主要由磷脂构成,并参与稳定肺泡的功能。PF的发生发展涉及肺表面活性脂质的改变、脂质代谢失调及AEC Ⅱ损伤、肺泡巨噬细胞脂质代谢失调、鞘脂信号失调以及肺泡表面积减少等变化[7]。在IPF患者血清中,上调的脂质多为神经酰胺(ceramide,Cer)及甘油三酯(triglyceride,TG),下调的脂质主要是磷脂酰胆碱(phosphatidylcholine,PC)及溶血磷脂酰胆碱(lysophosphatidylcholine,LPC)[8]。博来霉素诱导的PF小鼠血清代谢组学研究表明,油酸、棕榈油酸及亚油酸可能是PF全过程的潜在标志物[9]。
3 PF中的脂质代谢及功能脂质成分在肺部功能的维持过程中起到至关重要的作用,脂质组学技术的发展促进了从脂质代谢的角度来理解PF。在IPF小鼠的血清中,脂质代谢水平明显降低,尤以甘油酯代谢及甘油磷脂代谢下调较为明显;在肺中,甘油酯、甘油磷脂、脂肪酰等大部分脂质在肺中的含量与正常组相比均出现下调趋势[10],如何解释这些脂质谱可能是目前面临的重要问题。肺部脂质组成的变化取决于脂质代谢的改变,部分脂质代谢过程见Fig 1,脂质代谢改变可能与纤维化发展密切相关。
3.1 脂肪酸类脂肪酸是合成磷脂的重要底物,研究表明,脂肪酸可促进IPF过程中的炎症反应。在IPF患者血浆的差异代谢物中,脂肪酸类成分棕榈油酸、油酸和亚油酸水平表现出明显升高。棕榈酸是AEC损伤的标志物,通过调节葡萄糖代谢、细胞增殖以及炎症反应,影响IPF进程[11]。当AEC Ⅱ中脂肪酸合成被抑制时,小鼠纤维化程度和上皮修复则被抑制。IPF疾病进展与脂肪酸代谢异常也密切相关,肌成纤维细胞中脂肪酸氧化程度下调,脂肪酸关键合成酶,如脂肪酸合酶(fatty acid synthase,FASN)及柠檬酸盐裂解酶等在肺表面活性脂质产生过程中表达增加。在博来霉素诱导的PF小鼠及TGF-β诱导的MRC5细胞中均表现出FASN的表达增加,抑制FASN可能有助于维持肺正常生理功能[12]。各脂肪酸类成分对PF的影响不同,脂肪酸链延长酶Elovl6功能的丧失,导致具有细胞毒性的棕榈酸水平上升,有保护作用的油酸、亚油酸和硬脂酸水平降低,而棕榈酸又可进一步通过内质网氧化应激导致细胞死亡及TGF-β的表达增加,促进PF进程[13-14]。有研究表明,补充特定的脂肪酸对改善纤维化有所帮助,但尚未有更多数据支撑其临床使用[15]。脂肪酸成分及其代谢在临床上的应用仍需深入研究。
3.2 甘油磷脂类甘油磷脂是肺表面活性脂质的重要组成成分,在PF中表现出代谢异常的成分有PC、磷脂酰乙醇胺(phosphatidyl ethnolamine,PE)、磷脂酰肌醇(phosphatidyl inositol,PI)、磷脂酰基甘油(phosphatidyl glycerol,PG)、磷脂酰丝氨酸(phosphatidylserine,PS)、LPC、溶血磷脂酸(lysophosphatidic acid,LPA)等。研究表明,博来霉素诱导的PF小鼠血清中,甘油磷脂随着疾病的发展出现了明显下降又回调的趋势[10]。
PC是肺表面活性物质的主要成分,其可通过磷脂酰丝氨酸脱羧途径的磷脂酰丝氨酸合成酶1(phosphatidylserine synthetase 1,PSS1)合成PS,再经PSS2合成PE。PC和LPC含量在PF中均明显降低,但研究表明,PF进程中PSS1、PSS2两种酶的水平并无显著差异[16],PC含量的降低可能是由于促进CDP-乙醇胺途径或其他代谢导致的。LPC的改变则可能是由于溶血磷脂酰胆碱酰基转移酶1改变了PC与LPC之间的代谢平衡,进而调节PF[17],PC或可成为PF的生物标志物。有研究表明,给予胆碱补充剂可改善囊性PF患者血浆中胆碱状态以及肺功能[18]。
PS是细胞膜内叶上的重要成分,在TGF-β诱导的人胚胎肺成纤维细胞中发现PS含量增加和磷脂酰丝氨酸脱羧酶(phosphatidylserine decarboxylase,PISD)减少[16],然而在IPF患者血浆中PS都成下降趋势[19]。PS在诱导细胞凋亡时被外化,进而导致细胞凋亡,PS在细胞膜上的暴露增多可能是IPF的发病机制之一[20],PS与IPF的关系仍有待研究。PE可由PS经过PISD分解代谢形成。研究表明,PE可诱导人肺成纤维细胞表现出抗纤维化表型,给予富含PE的早产儿呼吸窘迫综合征药剂可改善博来霉素诱导的PF,能通过阻断磷脂酶C(phospholipase C,PLC)减少胶原蛋白表达,表现出时间、剂量依赖性,并通过Ca2+信号导致肺成纤维细胞的凋亡[21]。
PG在IPF中认为是下降的[22]。PG亚组分棕榈酰油酰磷脂酰甘油(palmitoyl oleoyl phosphatidylglycerol,POPG)可减轻炎症性肺病的关键途径,抑制IL-6的产生,减少上皮细胞的凋亡[23];其另一亚组分18 ∶ 1/18 ∶ 1-二油酰基磷脂酰甘油(dioleoyl phosphatidylgyceroll,DOPG)可通过减少分泌性磷脂酶A2(secretory phospholipase A2,sPLA2)来预防肺泡上皮损伤,改善肺功能[24]。综上,PG在PF过程中的主要作用表现在对炎症和上皮细胞的调控方面。
PI是与PG一起构成肺表面活性物质的另一次要成分,关于PI与IPF的研究多集中于磷脂酰肌醇-3激酶(phosphatidylinositol 3 kinase,PI3K)信号通路。PF中,PI3K信号通路被激活,并激活下游自噬、氧化应激、内质网应激等反应。课题组前期研究发现,博来霉素诱导的PF小鼠中出现PI水平升高及脂质代谢紊乱的现象,与普遍的研究结果保持一致[25-26]。研究表明,PI可以抑制脂多糖引起的肿瘤坏死因子α(tumour necrosis factorα,TNF-α)的升高,减弱中性粒细胞浸润,抑制巨噬细胞引起的炎症反应[23]。
3.3 鞘脂类鞘脂是质膜的组成部分,参与调节重要的细胞功能,其中Cer参与细胞凋亡、衰老和生长抑制,而另一类成分鞘脂代谢的最终产物鞘氨醇-1-磷酸(sphingosine-1-phosphate,S1P)则参与调节细胞增殖以及炎症反应。S1P相关信号通路的异常激活会导致纤维化、癌症和血管功能障碍,抑制S1P的合成和鞘氨醇激酶(sphingosine kinase,SPHK)、S1P裂解酶的活性,可有效抑制体内纤维化进展[27]。SPHK1/S1P信号传导在TGF-β诱导的Hippo/YAP1途径激活和线粒体活性氧的生成中起重要作用,SPHK1的异常升高会促进AEC的上皮间充质转化过程,并直接导致成纤维细胞激活[28]。
Cer水平的升高会诱发细胞凋亡,并引起炎症反应。研究表明,与健康人群相比,囊性纤维化患者血浆中长链神经酰胺水平明显增高[29],在给予重组酸性神经酰胺酶后,小鼠Cer水平降低,炎症介质产生减少,并能减轻肺部炎症[30]。Cer经过葡萄糖基神经酰胺合成酶(glucosylceramide synthase,GCS)代谢成葡萄糖基神经酰胺(glucosylceramide,GlcCer),并能在体内与Cer、鞘氨醇协同抵御铜绿假单胞菌,虽没有直接杀菌作用,但可保护小鼠免受感染,减轻囊性PF引起的损伤[31]。
鞘脂的临床研究多集中于S1P通路调节剂的使用,FTY720是最常用的一种S1P调节剂,已用于治疗多发性硬化症。有研究表明,低剂量的FTY720可减轻PF,但缺乏特异性[26]。因此,未来肺部受体高特异性的S1P通路相关药物可能更有治疗潜力。
3.4 甘油酯类甘油酯类是血液循环中最丰富的脂质,包括TG和甘油二脂(diglyceride,DG)。TG在PF中表现的趋势不一致,在二氧化硅诱导的PF模型中出现TG的升高,这与早期研究的趋势相反[32-33]。目前研究普遍认为,PF患者TG水平升高,血浆中几种TG(碳原子数∶双键数为54 ∶ 5、54 ∶ 6、53 ∶ 7)水平有所上升。同时,脂质成分在疾病进展的不同时期存在差异。研究表明,PF稳定期和发展期患者血浆中TG和PC差异明显[34],对于这些差异脂质仍可进行更细致的探讨。近期研究发现,在博来霉素诱导的PF小鼠血清中,大部分甘油酯水平出现了明显的下调[10],甘油酯类成分在PF中的研究主要集中于其含量的改变,或可从中发现PF潜在生物标志物。甘油酯类对PF的作用尚未明确,有待进一步研究。
4 总结与展望综上,脂质代谢及其相关通路影响着PF的发生发展,目前研究较为详细的是PI3K和S1P信号通路,且二者都与TGF-β信号通路有共同的作用环节,多通路协同调控PF发展。除相关通路外,脂质还通过其代谢过程影响PF,PF中脂质代谢明显减少,同时线粒体功能也影响着脂质的组成和代谢,在PF患者中也表现出了线粒体功能的紊乱,这也是脂质代谢紊乱的原因之一。脂质代谢紊乱会促进成纤维细胞向肌成纤维细胞转化,加重PF,而破坏脂质代谢则可导致自发的PF[35]。脂质家族庞大且复杂,在PF疾病中仍需进行更系统的研究。TGF-β诱导的人胚肺成纤维细胞中发现PS水平增加[16],然而在IPF患者血浆中PS却成下降趋势[19],而在小鼠肺泡灌洗液中出现明显增多[23],TG在临床与动物研究中也表现出相反的变化趋势。这可能是由于种属差异导致的,脂质研究需对各类样本、动物与临床实验综合分析。脂质结构与药效关系可进一步研究,高饱和脂肪酸饮食可加剧IPF,而补充不饱和脂肪酸则可改善囊性PF[14-15],脂肪酸饱和度可能是影响其产生毒性或药效的关键因素。
目前,已有脂质靶向药物进行临床试验,PI3K通路抑制剂与S1P通路调节剂均表现出一定的治疗潜力,同时溶血磷脂酸受体拮抗剂及溶血磷脂酶D抑制剂也已进入临床试验[2, 25]。除现有研究外,靶向脂质代谢PF新药开发的潜在靶点还可能包括:脂肪酸代谢在PF疾病中改变明显,包括FASN和Elovl6等在内的酶类可能成为潜在治疗靶点,同时棕榈酸在PF疾病中表现出明显的脂毒性,抑制棕榈酸的合成或促进分解可能均有助于缓解PF;PF中鞘脂类相对于其他成分来说研究较为透彻,其高特异性的通路调节剂可能更具有研发优势;近年来研究较少的PS、PE、PG等成分均表现出一定的治疗作用,这些脂质仍有很大的研究空间。
尽管PF脂质代谢研究取得了一些进展,但仍面临着一系列问题。首先,脂质代谢失衡可诱发PF,而PF也可导致脂质代谢的紊乱,但二者之间关系仍有待进一步研究;其次,有关PF脂质的临床研究较少,已有的研究脂质在体内变化的趋势不一致,PC、LPC等一些脂质是否可以成为PF的生物标志物仍有待确证。功能脂质组学的发展有助于更深入挖掘脂质和PF之间的关系,阐明脂质在PF发生、发展中的重要作用,并有望发现PF新的治疗靶点及治疗药物。
| [1] |
Lederer D J, Martinez F J. Idiopathic pulmonary fibrosis[J]. N Engl J Med, 2018, 378(19): 1811-23. doi:10.1056/NEJMra1705751 |
| [2] |
Suryadevara V, Ramchandran R, Kamp D W, et al. Lipid mediators regulate pulmonary fibrosis: potential mechanisms and signaling pathways[J]. Int J Mol Sci, 2020, 21(12): 4257. doi:10.3390/ijms21124257 |
| [3] |
Moss B J, Ryter S W, Rosas I O. Pathogenic mechanisms underlying idiopathic pulmonary fibrosis[J]. Annu Rev Pathol, 2022, 17: 515-46. doi:10.1146/annurev-pathol-042320-030240 |
| [4] |
Spagnolo P, Kropski J A, Jones M G, et al. Idiopathic pulmonary fibrosis: disease mechanisms and drug development[J]. Pharmacol Ther, 2021, 222: 107798. doi:10.1016/j.pharmthera.2020.107798 |
| [5] |
吴丹, 孟永海, 杨炳友, 等. 脂质组学在中药研究中的应用[J]. 中草药, 2020, 51(21): 5405-13. Wu D, Meng Y H, Yang B Y, et al. Application of lipidomics on research of traditional Chinese medicine[J]. Chin Herb Med, 2020, 51(21): 5405-13. doi:10.7501/j.issn.0253-2670.2020.21.001 |
| [6] |
Masoodi M, Gastaldelli A, Hyötyläinen T, et al. Metabolomics and lipidomics in NAFLD: biomarkers and non-invasive diagnostic tests[J]. Nat Rev Gastroenterol Hepatol, 2021, 18(12): 835-56. doi:10.1038/s41575-021-00502-9 |
| [7] |
Agudelo C W, Samaha G, Garcia-Arcos I. Alveolar lipids in pulmonary disease[J]. Lipids Health Dis, 2020, 19(1): 122. doi:10.1186/s12944-020-01278-8 |
| [8] |
Seeliger B, Carleo A, Wendel-Garcia P D, et al. Changes in serum metabolomics in idiopathic pulmonary fibrosis and effect of approved antifibrotic medication[J]. Front Pharmacol, 2022, 13: 837680. doi:10.3389/fphar.2022.837680 |
| [9] |
陈叶青, 仇双逸, 范欣生, 等. 博来霉素诱导的肺纤维化形成不同时期模型大鼠血清代谢组学研究[J]. 中国药理学通报, 2022, 38(4): 512-8. Chen Y Q, Qiu S Y, Fan X S, et al. Metabolomic study on bleomycin-induced pulmonary fibrosis rat models at different stages[J]. Chin Pharmacol Bull, 2022, 38(4): 512-8. doi:10.12360/CPB202105006 |
| [10] |
Yang X H, Wang F F, Chi X S, et al. Disturbance of serum lipid metabolites and potential biomarkers in the bleomycin model of pulmonary fibrosis in young mice[J]. BMC Pulm Med, 2022, 22(1): 176. doi:10.1186/s12890-022-01972-6 |
| [11] |
Nambiar S, Tan D B A, Clynick B, et al. Untargeted metabolomics of human plasma reveal lipid markers unique to chronic obstructive pulmonary disease and idiopathic pulmonary fibrosis[J]. Proteomics Clin Appl, 2021, 15(2-3): e2000039. doi:10.1002/prca.202000039 |
| [12] |
Jung M Y, Kang J H, Hernandez D M, et al. Fatty acid synthase is required for profibrotic TGF-β signaling[J]. FASEB J, 2018, 32(7): 3803-15. doi:10.1096/fj.201701187R |
| [13] |
Sunaga H, Matsui H, Ueno M, et al. Deranged fatty acid composition causes pulmonary fibrosis in Elovl6-deficient mice[J]. Nat Commun, 2013, 4: 2563. doi:10.1038/ncomms3563 |
| [14] |
Chu S G, Villalba J A, Liang X, et al. Palmitic acid-rich high-fat diet exacerbates experimental pulmonary fibrosis by modulating endoplasmic reticulum stress[J]. Am J Respir Cell Mol Biol, 2019, 61(6): 737-46. doi:10.1165/rcmb.2018-0324OC |
| [15] |
Simon M I S D S, Dalle Molle R, Silva F M, et al. Antioxidant micronutrients and essential fatty acids supplementation on cystic fibrosis outcomes: a systematic review[J]. J Acad Nutr Diet, 2020, 120(6): 1016-33. doi:10.1016/j.jand.2020.01.007 |
| [16] |
Uchida N, Shimizu Y, Fujimaki M, et al. Metabolic changes induced by TGF-β1 via reduced expression of phosphatidylserine decarboxylase during myofibroblast transition[J]. J Clin Biochem Nutr, 2022, 70(2): 108-16. doi:10.3164/jcbn.21-121 |
| [17] |
Deng X, Hao C, Li Y, et al. Lysophosphatidylcholine acyltransferase 1 alleviates silica-induced pulmonary fibrosis by modulating lipid metabolism[J]. Biomed Pharmacother, 2022, 155: 113638. doi:10.1016/j.biopha.2022.113638 |
| [18] |
Schall J I, Mascarenhas M R, Maqbool A, et al. Choline supplementation with a structured lipid in children with cystic fibrosis: a randomized placebo-controlled trial[J]. J Pediatr Gastroenterol Nutr, 2016, 62(4): 618-26. doi:10.1097/MPG.0000000000001004 |
| [19] |
Yan F, Wen Z, Wang R, et al. Identification of the lipid biomarkers from plasma in idiopathic pulmonary fibrosis by Lipidomics[J]. BMC Pulm Med, 2017, 17(1): 174. doi:10.1186/s12890-017-0513-4 |
| [20] |
Guimarães-Pinto K, Maia E P, Ferreira J R M, et al. Efferocytosis in lung mucosae: implications for health and disease[J]. Immunol Lett, 2022, 248: 109-18. doi:10.1016/j.imlet.2022.07.005 |
| [21] |
Vazquez-de-Lara L G, Tlatelpa-Romero B, Romero Y, et al. Phosphatidylethanolamine induces an antifibrotic phenotype in normal human lung fibroblasts and ameliorates bleomycin-induced lung fibrosis in mice[J]. Int J Mol Sci, 2018, 19(9): 2758. doi:10.3390/ijms19092758 |
| [22] |
Hu C, Wang Y, Fan Y, et al. Lipidomics revealed idiopathic pulmonary fibrosis-induced hepatic lipid disorders corrected with treatment of baicalin in a murine model[J]. AAPS J, 2015, 17(3): 711-22. doi:10.1208/s12248-014-9714-4 |
| [23] |
Spengler D, Winoto-Morbach S, Kupsch S, et al. Novel therapeutic roles for surfactant-inositols and phosphatidylglycerols in a neonatal piglet ARDS model: a translational study[J]. Am J Physiol Lung Cell Mol Physiol, 2018, 314(1): 32-53. doi:10.1152/ajplung.00128.2017 |
| [24] |
Preuβ S, Scheiermann J, Stadelmann S, et al. 18:1/18:1-Dioleoyl-phosphatidylglycerol prevents alveolar epithelial apoptosis and profibrotic stimulus in a neonatal piglet model of acute respiratory distress syndrome[J]. Pulm Pharmacol Ther, 2014, 28(1): 25-34. doi:10.1016/j.pupt.2013.10.002 |
| [25] |
Xu Y, Wang X, Han D, et al. Revealing the mechanism of Jiegeng decoction attenuates bleomycin-induced pulmonary fibrosis via PI3K/Akt signaling pathway based on lipidomics and transcriptomics[J]. Phytomedicine, 2022, 102: 154207. doi:10.1016/j.phymed.2022.154207 |
| [26] |
Weckerle J, Picart-Armada S, Klee S, et al. Mapping the metabolomic and lipidomic changes in the bleomycin model of pulmonary fibrosis in young and aged mice[J]. Dis Model Mech, 2022, 15(1): dmm049105. doi:10.1242/dmm.049105 |
| [27] |
Wang E, He X, Zeng M. The role of S1P and the related signaling pathway in the development of tissue fibrosis[J]. Front Pharmacol, 2019, 9: 1504. doi:10.3389/fphar.2018.01504 |
| [28] |
Huang L S, Sudhadevi T, Fu P, et al. Sphingosine kinase 1/S1P signaling contributes to pulmonary fibrosis by activating Hippo/YAP pathway and mitochondrial reactive oxygen species in lung fibroblasts[J]. Int J Mol Sci, 2020, 21(6): 2064. doi:10.3390/ijms21062064 |
| [29] |
Westhölter D, Schumacher F, Wülfinghoff N, et al. CFTR modulator therapy alters plasma sphingolipid profiles in people with cystic fibrosis[J]. J Cyst Fibros, 2022, 21(4): 713-20. doi:10.1016/j.jcf.2022.02.005 |
| [30] |
Gardner A I, Haq I J, Simpson A J, et al. Recombinant acid ceramidase reduces inflammation and infection in cystic fibrosis[J]. Am J Respir Crit Care Med, 2020, 202(8): 1133-45. doi:10.1164/rccm.202001-0180OC |
| [31] |
Kovacic B, Sehl C, Wilker B, et al. Glucosylceramide critically contributes to the host defense of cystic fibrosis lungs[J]. Cell Physiol Biochem, 2017, 41(3): 1208-18. doi:10.1159/000464382 |
| [32] |
常美玉. α-硫辛酸调节线粒体能量代谢干预SiO2诱导的小鼠肺纤维化作用研究[D]. 河南新乡: 新乡医学院, 2021. Chang M Y. Effects of α-lipoic acid on SiO2-induced pulmonary fibrosis in mice through regulating mitochondrial energy metabolism[D]. Henan Xinxiang: Xinxiang Med Univ, 2021. |
| [33] |
Iannello S, Cavaleri A, Milazzo P, et al. Low fasting serum triglyceride level as a precocious marker of autoimmune disorders[J]. MedGenMed, 2003, 5(3): 20. |
| [34] |
Nambiar S, Clynick B, How B S, et al. There is detectable variation in the lipidomic profile between stable and progressive patients with idiopathic pulmonary fibrosis (IPF)[J]. Respir Res, 2021, 22(1): 105. doi:10.1186/s12931-021-01682-3 |
| [35] |
Tian Y, Duan C, Feng J, et al. Roles of lipid metabolism and its regulatory mechanism in idiopathic pulmonary fibrosis: a review[J]. Int J Biochem Cell Biol, 2023, 155: 106361. doi:10.1016/j.biocel.2022.106361 |

