


2. 浙江中医药大学药学院,浙江 杭州 310053;
3. 浙江大学医学院,浙江 杭州 310058
2. School of Pharmacy, Zhejiang Chinese Medical University, Hangzhou 310053, China;
3. School of Medicine, Zhejiang University, Hangzhou 310058, China
急性肺损伤(acute lung injury,ALI)是由各种直接或间接致病因素(例如肺炎、吸入性肺损伤、重度烧伤、创伤以及非心源性休克等)导致的肺组织结构发生特征性病变而出现的一种呼吸道疾病[1]。ALI作为临床常见的危重病,其起病迅速且极易恶化发展成为以进行性急性呼吸窘迫和难治性低氧血症为临床特征的急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)并导致呼吸衰竭,死亡率高达30%~50%,不仅严重危害到人类生命与健康,还加剧了全球公共卫生系统的负担[2]。ALI/ARDS的发病机制十分复杂,主要涉及炎症反应失调、肺泡-毛细血管屏障功能障碍,肺泡液体清除受损和氧化应激等诸多方面[3]。目前,ALI的治疗手段有限,抗炎药物如皮质类固醇、抗氧化药物如N-乙酰半胱氨酸(N-acetylcysteine,NAC)主要用于治疗ALI,但这类药物副作用大,临床应用仍存在较大争议[4],临床上主要通过机械通气和体外膜肺氧合(extracorporeal membrane oxygenation ECMO)来缓解症状,提高患者的生存率。因此,积极寻找新的有效治疗ALI的药物尤为重要。
2019年12月,新型冠状病毒肺炎(coronavirus disease 2019,COVID-19),即严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV2)引起的一种高传染性、高死亡率呼吸道疾病,被公认为全球严重的健康威胁[5]。但值得注意的是,中医药在COVID-19的预防、治疗和康复中发挥了重要作用[6],许多研究借助网络药理学和分子对接技术,对一线防治COVID-19的经典中医药方剂、中成药及其组方中草药的作用机制进行了分析:藏药麻花秦艽可以降低炎症因子IL-1β、IL-6和TNF-α水平,减轻肺部炎症反应,其防治细胞因子的活性成分主要为木犀草素、熊果酸等[7];麻杏石甘汤中的木犀草素、槲皮素、山柰酚等成分可能通过IL-17、TNF、C型凝集素受体等信号通路发挥抗炎、抗病毒和免疫调节等作用[8]。其中木犀草素(luteolin)是最常见的天然黄酮类化合物之一,主要存在于金银花、菊花、白毛夏枯草等植物中,具有很强的抗炎、抗菌、抗氧化和抗肿瘤等作用,并且大多数关于木犀草素的研究都集中在其抗炎作用上[9]。有研究表明,木犀草素能够通过抑制ICAM-1、NF-κB、氧化应激和部分iNOS通路,对脓毒症诱导的小鼠急性肺损伤产生抑制作用[10];在探讨木犀草素在LPS诱导的ALI中的作用及其相关机制研究中发现,木犀草素能通过cGMP/PI3K途径激活肺泡上皮钠通道,减轻ALI的相关炎症[11]。由此说明木犀草素在治疗ALI等相关疾病方面具有巨大潜力,但相关机制研究较少,分子机制尚未完全明确。
网络药理学是从系统生物学和生物网络平衡的角度揭示药物的整体调节作用机理机制,从而指导临床治疗的一门新兴学科,其核心理论“网络靶标”突破“单基因、单靶标”研究模式的局限,通过系统性构建“药物-基因-靶点-疾病”多层次网络关系解析药物与疾病之间的关联规律,这与中医药学整体观、辨证论治的原则相契合[12]。分子对接是一种预测分子(如蛋白质受体与配体)之间非共价键结合的计算机模拟技术,通过计算预测小分子与受体结合时的亲和力及构象,用于评估结合情况[13]。基于此,本研究采用网络药理学、分子对接技术及动物实验验证,从药物靶点、疾病靶点、信号通路等方面,分析木犀草素抗急性肺损伤可能存在的分子机制,为后续进一步探索木犀草素治疗急性肺损伤相关作用机制提供更多参考与借鉴。
1 材料与方法 1.1 材料 1.1.1 实验动物SPF级C57BL/6雄性小鼠15只,7周龄,20~25 g,购自上海斯莱克有限公司,生产许可证号SCXK(沪)2022-0004。实验动物饲养于浙江大学实验动物中心SPF级别的屏障环境内,在标准昼夜条件(12 h)饲养,保持环境温度23 ℃~25 ℃和相对湿度45%~55%。所有动物实验均获得浙江大学动物保护与伦理委员会的批准,伦理号ZJU20240408。
1.1.2 药物与试剂木犀草素(美国MedChemExpress公司,货号HY-N0162);脂多糖(LPS),大肠杆菌055:B5(美国Sigma-Aldrich公司,货号L2880);Quick StartTM Bradford 1x Dye Reagent(美国Bio-Rad公司,货号5000205);RIPA裂解液(碧云天生物技术公司,货号P0013B);蛋白酶抑制剂Cocktail、磷酸酶抑制剂Cocktail(美国Selleckchem公司,货号B14001、B15001);Western一抗稀释液、Western二抗稀释液、Western一抗二抗去除液(碧云天生物技术公司,货号P0023A、P0023D、P0025);兔单抗p-Akt (Ser473)(美国Cell Sighnaling Technology公司,货号#4060S);兔单抗AKT(pan)(美国Cell Sighnaling Technology公司,货号#4691S);兔单抗GAPDH(杭州戴格生物科技有限公司,货号db14510);RDye® 800CW山羊抗兔IgG二抗(美国LI-COR公司,货号926-32211);苏木精伊红(HE)染液(南京建成生物工程研究所,货号D006)。
1.1.3 仪器Multiskan SkyHigh全波长酶标仪(美国赛默飞公司);Odyssey CLx红外激光双色图像分析系统(美国LI-COR公司);Olympus数字切片扫描仪VS200(日本奥林巴斯公司)。
1.2 方法 1.2.1 网络药理学分析 1.2.1.1 木犀草素作用靶点获取以“Luteolin”或木犀草素CAS登记号“491-70-3”为检索词在PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)中获取到木犀草素的SMILES号,并导入Swiss Target Prediction数据库中得到木犀草素的作用靶点。
1.2.1.2 疾病相关靶点的收集使用GeneCards数据库(https://www.genecards.org/)以“Acute Lung Injury”为关键词进行检索,得到急性肺损伤的作用靶点。
1.2.1.3 疾病-药物共同靶点的筛选将“1.1”中药物作用的靶点与“1.2”中疾病相关靶点一同导入Venny2.1在线平台(https://bioinfogp.cnb.csic.es/tools/venny/),取交集得出两者的共同靶点,并绘制韦恩图,最终获得木犀草素作用于急性肺损伤的潜在靶点。
1.2.1.4 PPI网络构建及核心靶点的筛选利用String在线分析平台(https://string-db.org/),选择“Multiple proteins”选项,上传木犀草素与急性肺损伤的共同靶点,将物种设定为“Homo sapiens”,各靶点最低互作阈值选择为0.4,并隐藏网络中未连接的节点,最终获得蛋白互作网络图(PPI),并导出PNG格式图以及TSV格式文件。为使蛋白互作网络图更加清晰直观,将TSV格式文件导入Cytoscape3.8.2软件进行整理优化。此外,通过Cytoscape3.8.2的内置插件cytoHubba以靶点的degree值为筛选要求选取出前10位为核心靶点。
1.2.1.5 GO和KEGG通路富集分析将木犀草素与急性肺损伤的共同靶点上传至David数据库(https://david.ncifcrf.gov/),物种选择“Homo sapiens”并进行分析。GO功能富集分析选择生物过程(bologica process,BP)、细胞组成(cellular component,CC)、分子功能(molecular function,MF)进行下载,KEGG通路富集分析选择“Pathways”来获取相关通路。最后,将两者数据分别按照微生信平台(https://www.bioinformatics.com.cn/)的绘图要求进行Excel数据的整理、上传,绘制出相应的气泡图与条形图。
1.2.1.6 分子对接验证使用Auto Dock软件将木犀草素与PPT网络中Degree值排名前10的核心靶点进行分子对接验证。从PubChem数据库中获取木犀草素化合物3D结构的SDF格式,利用Open Babel软件对下载的SDF文件进行转换,获得化合物的PDB文件。在PDB(https://www.rcsb.org/)和NCBI(https://www.ncbi.nlm.nih.gov/)数据库中搜索靶点蛋白名称,在“Structure”中获取最佳的PDB结构。运用Auto Dock Tools1.5.7软件对化合物进行加全氢、设置为配体、检测扭转键等操作,并保存PDBQT格式文件;对蛋白质结构进行去水、加全氢,保存PDBQT格式文件为受体。然后运行Auto Dock进行分子对接,得到结合能。最后通过Pymol软件对对接结果进行可视化分析。
1.2.2 动物实验 1.2.2.1 动物分组及模型建立15只C57BL/6雄性小鼠适应性喂养7 d后,随机分为正常组(CON)、模型组(LPS)和木犀草素组(L+Lu15)3组。LPS造模前30 min,木犀草素组小鼠灌胃给药(15 mg·kg-1,1×PBS),灌胃体积为10 mL·kg-1,正常组和模型组小鼠灌胃等体积生理盐水[14]。采用有创气管滴注LPS的方法建立小鼠急性肺损伤模型。将LPS粉末充分溶解于1×PBS,配置成10 g·L-1的原液。灌胃30 min后,模型组和木犀草素组小鼠麻醉并固定于手术台,沿颈部正中暴露气管。微量进样针抽取10 μL空气柱,再抽取适量LPS(4 mg·kg-1),用生理盐水补足至总体积30 μL,向气管内缓慢注射。注射结束后,缝合小鼠颈部皮肤,翻滚小鼠使LPS在肺内均匀分布。
1.2.2.2 样本收集与处理LPS造模24 h后,使用三溴乙醇麻醉并处死小鼠。打开小鼠胸腔,取小鼠右肺第三叶置于4%多聚甲醛,用于组织病理学研究,其余肺组织(右肺两叶和左肺两叶)分别保存于-80 ℃冰箱用于蛋白免疫印迹实验。
1.2.2.3 苏木精-伊红(HE)染色检测组织病理学小鼠肺组织在4%多聚甲醛固定3 d,依次经过脱水、透明、浸蜡、包埋和切片。将小鼠肺组织白片脱蜡和水化后进行苏木精核染5.5 min,自来水洗涤,伊红浆染10~20 s,自来水洗涤,风干后用中性树胶封片。VS200数字切片扫描仪扫描染色后的组织样本,并观察组织病理学变化。
1.2.2.4 蛋白免疫印迹法(Western blot)检测肺组织中相关蛋白取一小块肺组织,根据组织大小加入适量含有磷酸酶抑制剂和蛋白酶抑制剂的RIPA裂解液,于冰上将组织剪碎后,用匀浆机充分研磨,4 ℃,13 000×g离心15 min,收集上清。采用考马斯亮蓝法测定蛋白浓度,加入5×蛋白上样缓冲液,100 ℃变性5 min。使用10 %分离胶进行SDS-PAGE电泳,每孔上样50 μg总蛋白,体积15 μL。先恒压70 V将样本压成线,再调整为恒压130 V。电泳结束后,在冰浴条件下,恒流300 mA转膜90 min,将蛋白转移至NC膜。使用1×TBS配置5% BSA,室温下摇床封闭1 h。加一抗p-AKT(1 ∶ 500)、AKT(1 ∶ 500)和GAPDH(1 ∶ 1 000),4 ℃孵育过夜。1×TBST洗涤4次,每次5 min。荧光二抗(1 ∶ 5 000)室温孵育1.5 h。1×TBST洗涤4次,每次5 min。Odyssey CLx红外激光双色图像分析系统扫膜。采用ImageStudio进行蛋白条带的灰度值的分析。
1.2.3 统计学分析采用GraphPad Prism 9.0软件进行数据分析,多组样本间采用单因素方差分析进行比较,所有数据以x±s表示。
2 结果 2.1 网络药理学研究结果 2.1.1 木犀草素与急性肺损伤共同靶点在Swiss TargetPrediction数据库检索木犀草素的SMILES号,得到木犀草素作用的靶点100个,在GeneCards数据库搜索“Acute Lung Injury”获取到急性肺损伤的相关靶点9 512个,通过Venny2.1获取木犀草素与急性肺损伤的共同靶点为85个,包括NOX4、AKR1B1、XDH、MAOA、FLT3、CA2等。
2.1.2 PPI网络构建及核心靶点的筛选将85个共同靶点导入String在线平台,构建蛋白质互作网络图(PPI),网络图包括85个节点,495条边,平均节点度为11.6,平均局部聚类系数0.58。通过Cytoscape3.8.2软件的优化,进而绘制出更为直观的蛋白互作网络图,其中圆形节点代表靶点,节点大小与颜色深浅代表靶点degree值大小,再利用cytoHubba内置插件,以degree值筛选出前10位为核心靶点,分别为:AKT1、EGFR、SRC、MMP9、ESR1、PTGS2、MMP2、GSK3B、KDR、PARP1。
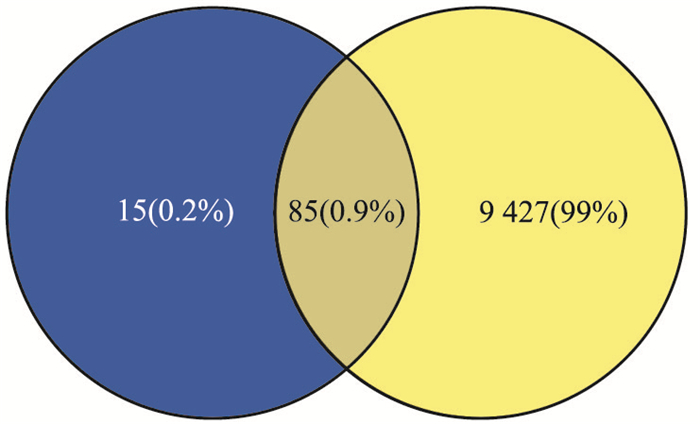
|
| Fig 1 The common targets of luteolin and acute lung injury |
应用David数据库对共同靶点进行富集分析,包括GO中的生物过程(BP)、细胞组成(CC)、分子功能(MF)以及KEGG通路富集分析。GO富集分析结果共获得BP条目265个、CC条目48个以及MF条目107个,按照P Value排序,分别选取BP、CC和MF前10的条目进行绘制气泡图。其中,BP条目主要涉及信号转导(signal transduction)、蛋白磷酸化(protein phosphorylation)、凋亡过程的负调控(negative regulation of apoptotic process)等过程;CC条目主要包括质膜(plasma membrane)、细胞溶质(cytosol)、细胞质(cytoplasm)等;MF条目主要涉及ATP结合、蛋白丝氨酸/苏氨酸/酪氨酸激酶活性(protein serine/threonine/tyrosine kinase activity)、蛋白激酶活性(protein kinase activity)等。
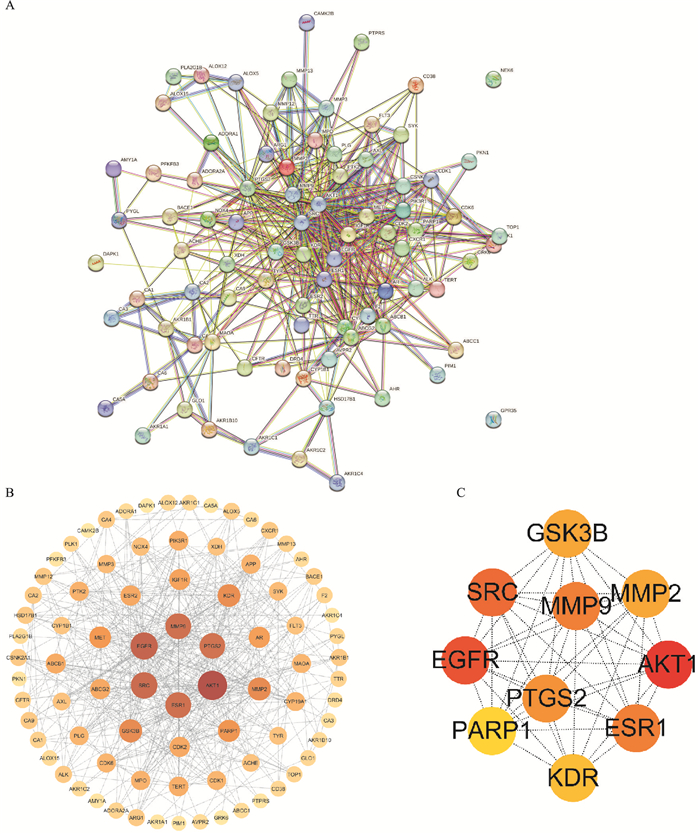
|
| Fig 2 PPI network map and core targets A: PPI network map of common targets protein of luteolin and acute lung injury; B: The PPI network map optimized by cytoscape; C: The top 10 core targets of PPI network map. |
KEGG通路富集分析共获得92条信号通路,并选取PValue值前20条通路进行结果可视化。结果显示木犀草素可能通过PI3K-AKT信号通路(PI3K-AKT signaling pathway)、ErbB信号通路(ErbB signaling pathway)、VEGF信号通路(VEGF signaling pathway)等发挥抗急性肺损伤的作用。
2.1.4 分子对接结果通过Auto Dock软件分别将木犀草素与PPI网络中Degree值排名前10的核心靶点AKT1、EGFR、SRC、MMP9、ESR1、PTGS2、MMP2、GSK3B、KDR、PARP1进行分子对接,结果见Tab 1,对接结合能分别为-4.07、-4.97、-3.89、-4.72、-5.73、-4.7、-5.06、-5.68、-3.82、-4.88 kal·mol-1。化合物与核心靶点的结合能越低,表明化合物与靶蛋白结合越稳定。由分子对接结果可知,木犀草素与这些关键靶点之间具有良好的结合活性,其中ERS1、GSK3B、MMP2结合能低于-5.0 kal·mol-1,与木犀草素之间的亲和力更强,表明木犀草素可能通过作用于以上关键靶点来发挥抗ALI的作用。最后用PyMOL软件对对接结果进行可视化。
| Target | PDB ID | Binding energy(kal·mol-1) |
| ESR1 | 1L2I | -5.73 |
| GSK3B | 7S6V | -5.68 |
| MMP2 | 1GXD | -5.06 |
| EGFR | 1IVO | -4.97 |
| PARP1 | 1UK1 | -4.88 |
| MMP9 | 4H82 | -4.72 |
| PTGS2 | 5F19 | -4.7 |
| AKT1 | 3O96 | -4.07 |
| SRC | 2BDJ | -3.89 |
| KDR | 3WZE | -3.82 |
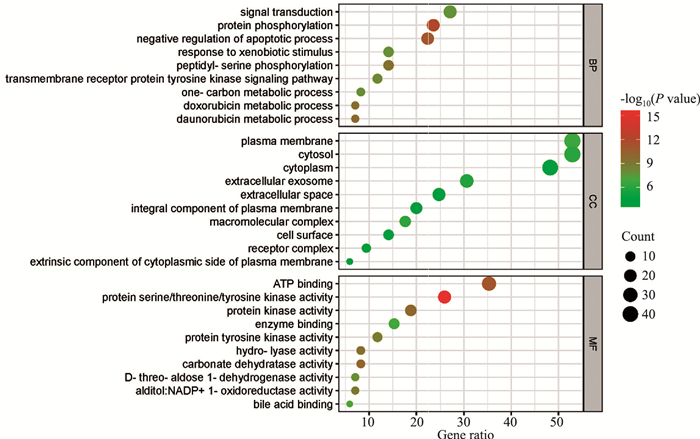
|
| Fig 3 GO function analysis |
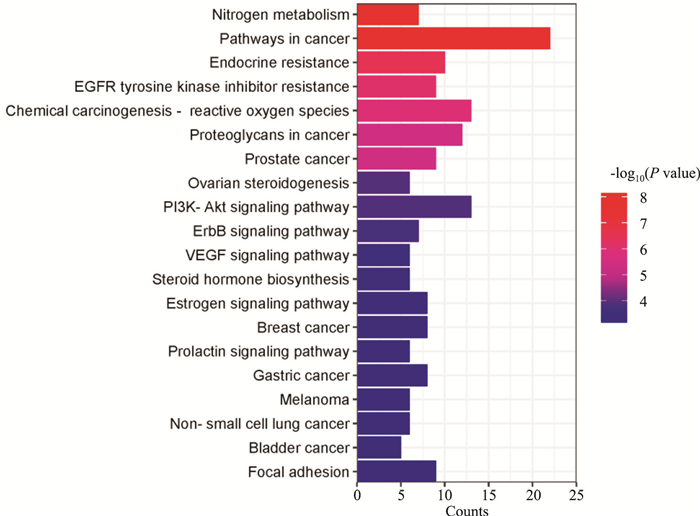
|
| Fig 4 KEGG pathway enrichment analysis |
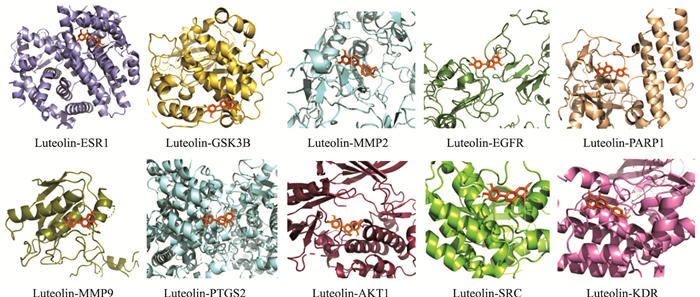
|
| Fig 5 Molecular docking of luteolin with disease-related core targets |
与正常组相比,LPS诱导的急性肺损伤小鼠模型中,肺泡出现大量炎性细胞的浸润,中性粒细胞数量增加,肺泡壁增厚,发生了明显的病理变化。木犀草素治疗后,小鼠肺组织的中性粒细胞数量明显下降,肺泡壁未显著增厚,肺组织结构有所改善,提示木犀草素在LPS诱导的小鼠急性肺损伤模型中,能够抑制炎症浸润,有较强的抗炎作用。
2.2.2 木犀草素对ALI小鼠肺组织p-AKT/AKT表达的影响利用Western blot检测各组小鼠肺组织中p-AKT和AKT的蛋白水平,结果显示与LPS组相比,L+Lu15组p-AKT/AKT的比值明显降低,提示木犀草素在LPS诱导的小鼠急性肺损伤模型中,可能通过抑制AKT的磷酸化缓解炎症反应。
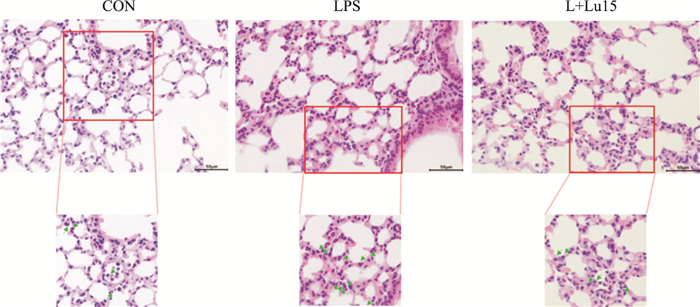
|
| Fig 6 HE staining of lung tissue sections of ALI mice (scale=50 μm) The green arrows are neutrophils. CON: Normal group; LPS: Model group (4 mg·kg-1); L+Lu15:Luteolin group (15 mg·kg-1) |
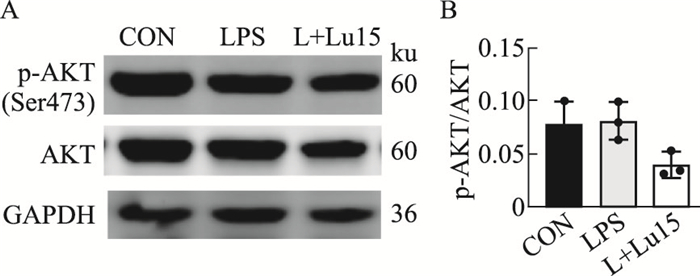
|
| Fig 7 The inhibitory effect of luteolin on p-AKT/AKT signaling in lung tissue of ALI mice (x±s, n=3) A: Western blot was used to detect the expression of p-AKT and AKT in lung tissue of mice; B: The gray values of p-AKT and AKT were quantified by software, and the ratio of the two was calculated and counted. CON: Normal group; LPS: Model group (4 mg·kg-1); L+Lu15:Luteolin group (15 mg·kg-1). |
木犀草素是一种天然黄酮类化合物,具有抗炎、抗氧化、抗凋亡、抗肿瘤等作用,提示木犀草素可能具有抗ALI的研究价值和开发潜力。对此,本研究通过网络药理及分子对接技术探究木犀草素抗急性肺损伤的分子机制,以期为临床治疗急性肺损伤以及相关药物的研发提供更多的理论依据。
该研究根据网络药理学方法,筛选出木犀草素作用靶点100个,ALI相关靶点9 512个,两者取交集预测木犀草素作用于ALI的靶点共85个,再通过分析这85个靶点的PPI蛋白互作网络,其中Degree值排前10的有AKT1、EGFR、SRC、MMP9、ESR1、PTGS2、MMP2、GSK3B、KDR、PARP1,这些蛋白被认为是Hub靶点,可能在木犀草素抗ALI的过程中起着重要作用。
为了预测木犀草素抗ALI的潜在分子机制,同时对靶蛋白进行了GO和KEGG通路富集分析。GO分析的结果显示,这些靶点主要涉及信号转导、蛋白磷酸化、凋亡过程的负调控、质膜、细胞溶质、ATP结合、蛋白丝氨酸/苏氨酸/酪氨酸激酶活性、蛋白激酶活性等生物功能。KEGG通路分析结果显示木犀草素化合物的许多靶点富集在信号通路中,如PI3K-AKT信号通路(PI3K-AKT signaling pathway)、ErbB信号通路(ErbB signaling pathway)、VEGF信号通路(VEGF signaling pathway)等。其中PI3K-AKT信号通路是与炎症密切相关的信号通路,参与调节多种生物学过程,包括细胞增殖、分化、凋亡、代谢和迁移等多个环节,并在ALI的炎症反应、上皮/内皮屏障的完整性、肺泡液清除率、肺水肿,以及后期的组织修复、气道重塑等过程中发挥重要作用。近年来,大量体内外研究表明,PI3K-AKT信号通路在LPS诱导的急性炎症反应中发挥着重要的调节作用。有研究报道[15],通过由ROS介导的PI3K/AKT/NF-κB途径能够抑制促炎性细胞因子的释放,对LPS诱导的ALI具有保护作用。Zhou等[16]研究发现,抑制PI3K/AKT/NF-κB信号通路的激活,能够防御LPS诱导的ALI。Qu等[17]研究发现,调节PI3K/AKT/mTOR途径相关的自噬,可以抑制LPS诱导的ALI中炎症因子的产生,从而改善ALI。
因此,我们就木犀草素是否影响PI3K-AKT信号通路进行了验证性工作,采用了木犀草素的有效剂量对LPS诱导的急性肺损伤小鼠进行了预防处理,结果验证了木犀草素对LPS诱导的急性肺损伤的有效性,同时我们检测了PI3K-AKT通路,发现其对AKT的磷酸化有一定抑制作用,但LPS诱导的AKT磷酸化本身并不显著。此结果侧面说明分子对接和预测的结果有一定准确性,但与实际情况不一定完全相符,仍需要体内体外实验进行验证。
综上所述,本文基于网络药理学和分子对接的研究方法,通过筛选木犀草素与ALI的共同靶点,预测木犀草素作用于ALI的核心靶点,结合GO和KEGG通路富集以及分子对接等一系列分析,从系统层面揭示了木犀草素抗急性肺损伤多靶点、多途径的分子机制。同时在LPS诱导的小鼠急性肺损伤模型中,验证了木犀草素较强的抗炎作用,且抑制AKT磷酸化活化,表明木犀草素可能通过抑制AKT的磷酸化缓解炎症反应。
| [1] |
Zhang J, Guo Y, Mak M, et al. Translational medicine for acute lung injury[J]. J Transl Med, 2024, 22(1): 25. doi:10.1186/s12967-023-04828-7 |
| [2] |
Hough C L, Herridge M S. Long-term outcome after acute lung injury[J]. Curr Opin Crit Care, 2012, 18(1): 8-15. doi:10.1097/MCC.0b013e32834f186d |
| [3] |
Huang Q, Le Y, Li S, et al. Signaling pathways and potential therapeutic targets in acute respiratory distress syndrome (ARDS)[J]. Respir Res, 2024, 25(1): 30. doi:10.1186/s12931-024-02678-5 |
| [4] |
Zhuang C, Kang M, Lee M. Delivery systems of therapeutic nucleic acids for the treatment of acute lung injury/acute respiratory distress syndrome[J]. J Control Release, 2023, 360: 1-14. doi:10.1016/j.jconrel.2023.06.018 |
| [5] |
Zheng Y, Jin D, Lin J, et al. Understanding COVID-19 in Wuhan from the perspective of cold-dampness: clinical evidences and mechanisms[J]. Front Med, 2021, 8: 617659. doi:10.3389/fmed.2021.617659 |
| [6] |
齐卓操, 刘树森, 吴苏婉, 等. 基于网络药理学和分子对接探究大黄-瓜蒌药对防治新型冠状病毒肺炎合并急性肺损伤的有效成分和分子靶点[J]. 中国药理学通报, 2023, 39(11): 2156-61. Qi Z C, Liu S S, Wu S W, et al. The effective components and molecular targets of Dahuang-Gualou medicine pair in prevention and treatment of corona virus disease 2019 complicated with acute lung injury based on network pharmacology and molecular docking[J]. Chin Pharmacol Bull, 2023, 39(11): 2156-61. |
| [7] |
高小敏, 徐雅, 刘杜霞, 等. 藏药麻花秦艽防治细胞因子风暴活性成分与作用机制的网络药理学研究[J]. 中草药, 2021, 52(1): 186-95. Gao X M, Xu Y, Liu D X, et al. Active components and mechanism of Tibetan medicine Gentiana straminea against cytokine storm[J]. Chin Herb Med, 2021, 52(1): 186-95. |
| [8] |
王哲义, 孙怿泽, 曲稔栋, 等. 基于网络药理学的麻杏石甘汤治疗新型冠状病毒肺炎(COVID-19)作用机制探讨[J]. 中草药, 2020, 51(8): 1996-2003. Wang Z Y, Sun Y Z, Qu R D, et al. Network pharmacological study on mechanism of Maxing Shigan Decoction in treatment of coronavirus disease 2019 (COVID-19)[J]. Chin Herb Med, 2020, 51(8): 1996-2003. |
| [9] |
Huang L, Kim M Y, Cho J Y. Immunopharmacological activities of luteolin in chronic diseases[J]. Int J Mol Sci, 2023, 24(3): 2136. doi:10.3390/ijms24032136 |
| [10] |
Rungsung S, Singh T U, Rabha D J, et al. Luteolin attenuates acute lung injury in experimental mouse model of sepsis[J]. Cytokine, 2018, 110: 333-43. doi:10.1016/j.cyto.2018.03.042 |
| [11] |
Hou Y, Li J, Ding Y, et al. Luteolin attenuates lipopolysaccharide-induced acute lung injury/acute respiratory distress syndrome by activating alveolar epithelial sodium channels via cGMP/PI3K pathway[J]. J Ethnopharmacol, 2022, 282: 114654. doi:10.1016/j.jep.2021.114654 |
| [12] |
李梢, 张鹏, 王鑫, 等. 网络靶标理论、关键技术与中医药应用[J]. 世界科学技术-中医药现代化, 2022, 24(9): 3261-9. Li S, Zhang P, Wang X, et al. Network target theory, modernization of traditional chinese medicine and materia medica-world science and technology[J]. World Sci Technol Mod Tradit Chin Med, 2022, 24(9): 3261-9. |
| [13] |
Mc Nutt A T, Francoeur P, Aggarwal R, et al. GNINA 1.0:molecular docking with deep learning[J]. J Cheminform, 2021, 13(1): 43. doi:10.1186/s13321-021-00522-2 |
| [14] |
Lee J P, Li Y C, Chen H Y, et al. Protective effects of luteolin against lipopolysaccharide-induced acute lung injury involves inhibition of MEK/ERK and PI3K/Akt pathways in neutrophils[J]. Acta Pharmacol Sin, 2010, 31(7): 831-8. doi:10.1038/aps.2010.62 |
| [15] |
Jiang K, Guo S, Yang C, et al. Barbaloin protects against lipopolysaccharide (LPS)-induced acute lung injury by inhibiting the ROS-mediated PI3K/AKT/NF-κB pathway[J]. Int Immunopharmacol, 2018, 64: 140-50. |
| [16] |
Zhou B, Weng G, Huang Z, et al. Arctiin prevents LPS-induced acute lung injury via inhibition of PI3K/AKT signaling pathway in mice[J]. Inflammation, 2018, 41(6): 2129-35. |
| [17] |
Qu L, Chen C, He W, et al. Glycyrrhizic acid ameliorates LPS-induced acute lung injury by regulating autophagy through the PI3K/AKT/mTOR pathway[J]. Am J Transl Res, 2019, 11(4): 2042-55. |

