

2. 临沂市人民医院肿瘤科,山东 临沂 276000
肖斌(1988-),女,博士,讲师,硕士生导师,研究方向:神经药理学,通信作者,E-mail:xiaobin@ybu.edu.cn
2. Dept of Oncology, People′s Hospital of Linyi, Linyi, Shandong 276000, China
学习和记忆是一切认知活动的基础,而海马是学习和记忆的关键结构,也是探讨大脑学习记忆机制的主要研究对象。结构上海马分为海马回(cornu ammonis,CA)1、CA3及齿状回(dentate gyrus,DG),其中DG是外部感觉信息进入海马的门户,在空间学习记忆的编码和存储中发挥关键作用[1]。海马学习记忆的细胞学基础是突触可塑性,分为短时程和长时程改变,后者又包括长时程增强(long-term potentiation,LTP)和长时程抑制,其中LTP被广泛用于海马学习记忆细胞学机制的研究。DG的LTP产生和维持依赖N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDAR)。NMDAR是异四聚体结构,其中NR2是其调节亚单位,包括NR2A~D四个类型,而NR2A在海马DG广泛分布,参与海马学习记忆功能及神经可塑性[2]。DG缺失NR2A明显抑制小鼠突触的长时程可塑性,损害其在空间模式分离任务的表现[3],但海马NR2A的分布在学习记忆相关活动中呈现动态变化,如抑制LTP可代偿性引起NR2A在树突棘等突触部位分布增多,但不同脑区、不同行为学范式下,NR2A表现出不同的可塑性改变[2, 4]。因此,NR2A在某一特定行为过程的分布改变及其作用,仍需大量工作加以补充。
NVP-AAM077是现阶段研究较为广泛的一种NR2A的拮抗剂[5],较好改善了工具药对NR2亚基,尤其NR2A和NR2B特异性不高的缺点,对NR2A的特异性是NR2B的100倍[6],被用于调节NR2A依赖的海马学习记忆及其相关LTP[7-8]。研究发现[9-11],NVP-AAM077能够影响DG的NR2A依赖的行为学及神经元的电生理特性,具有潜在的改善海马认知功能的作用。因此,本研究以海马DG为研究对象,依赖经典的水迷宫行为学范式,通过脑部微量注射技术联合分子生物学实验,探讨DG微量注射NVP-AAM077对海马空间记忆功能的作用及可能机制,为NVP-AAM077及其他NR2A的靶点药物研究提供神经药理学基础。
1 材料与方法 1.1 试剂NVP-AAM077、通过促进蛋白质合成改善老龄小鼠学习记忆功能的综合应激反应抑制剂(integrated stress response inhibitor,ISRIB),均购自Med Chem Express公司;一抗脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、NR2A、β-actin、激活转录因子4(activating transcription factor 4,ATF4)、磷酸化真核翻译起始因子2α(eukaryotic initiation factor 2α,eIF2α),均购自Abcam公司;抗兔IgG-HRP,购自Cell Signaling Technology公司;ECL显影剂,购自Millipore公司。
1.2 实验动物及分组SD大鼠,♂,3月龄,购自辽宁长生实验动物股份有限公司,生产许可证号:SCXK(辽)J2020-0001。所有实验大鼠于自然光照、(23±2) ℃条件下分笼饲养,食水自由饮用。第一批实验:实验动物随机分为训练组(Training)和非训练组(Non-training),两大组再随机分为DG微量注射NVP-AAM07(NVP,n=6)和注射溶媒组(CON,n=6),利用Morris水迷宫(Morris water maze,MWM)对实验动物进行空间学习记忆训练,利用Western blot检测NR2A、BDNF、p-eIF2α和ATF4表达变化。第二批实验:随机将实验动物分为DG微量注射NVP-AAM07联合注射ISRIB组(NVP+ISRIB,n=6)、单独注射NVP-AAM07(NVP+NS,n=6)和注射溶媒组(Veh,n=6),利用MWM检测实验动物空间记忆能力,利用Western blot检测DG区ATF4表达变化。动物实验方案经延边大学动物伦理委员会批准(伦理号:YD20230620002)。
1.3 头部手术及给药利用10%乌拉坦腹腔注射进行麻醉(5 mL·kg-1)。大鼠于脑立体定位仪上固定,进行头部脱毛,暴露手术部位。以前囟为参考点确定目标区域(定位坐标:AP 3.4 mm;L/R 1.6 mm;H 3 mm),用电钻钻孔插入外套管,并与3枚螺丝一起固定在颅骨表面。套管外用注射器后端截取的圆柱形套管(高1 cm)灌注牙托粉和牙托水固定。术后大鼠休息48 h后,由外套管插入微量给药针,连接微量给药泵,行为学训练前30 min以0.5 μL·min-1的速度向海马DG区注射1 μL的NVP-AAM07(152 μg·L-1)或生理盐水,注射结束后停留3 min,持续给药共6 d。ISRIB(2.3 μg·L-1)给药方法与前两种相同,但从行为学训练开始前3 d直到行为学训练结束持续给药,共9 d。
1.4 Morris水迷宫检测大鼠海马的空间记忆能力MWM由圆形水池、圆形站台和视频记录系统组成。实验水温(22±2) ℃,第三象限(目标象限)水面1 cm下固定圆形站台。正式实验前进行2 min的适应性训练。正式实验分为定位航行实验和空间探索实验,其中定位航行实验4 d,建立大鼠空间学习能力,具体为大鼠分别从4个象限的入水点下水,训练其找到水下隐藏站台并爬上站台。d 5进行空间探索实验,记录大鼠在120 s内穿越原站台区的次数,以此来衡量大鼠的空间记忆能力。
1.5 Western blot检测DG区蛋白的表达麻醉下断头处死大鼠,冰上分离海马DG组织于离心管内(管内存有预冷裂解液),匀浆后用低温离心机离心,取上清液;BSA法测定蛋白浓度;恒压下进行电泳和转膜(90 V);封闭液内室温封闭2 h,PBST润洗30 min后,加入一抗4 ℃孵育过夜;PBST洗涤30 min,二抗室温下孵育2 h;ECL显色,曝光。
1.6 统计学分析利用Prism7.0软件对数据进行统计分析,计量资料以 x±s表示。两两比较采用独立样本t检验;多组样本均数比较采用单因素或双因素方差分析,两两比较采用Bonferroni-t检验,P < 0.05具有统计学意义。
2 结果 2.1 NVP-AAM07抑制行为学训练引发的DG区NR2A表达增多如Fig 1所示,与非训练组相比,训练组CON大鼠海马DG的NR2A表达明显增多(P < 0.01)。与训练组的CON相比,微量注射NVP明显抑制训练组大鼠海马DG的NR2A表达(P < 0.05)。
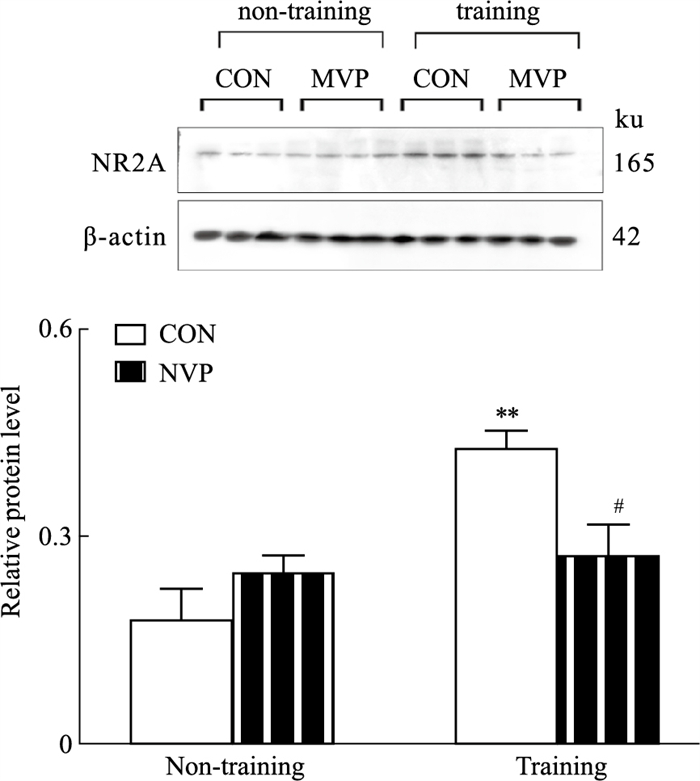
|
| Fig 1 Effects of microinjection of NVP on expression of NR2A in hippocampal DG (x±s, n=3) **P < 0.01 vs Non-training CON group; #P < 0.05 vs Training CON group. |
非训练CON大鼠和NVP大鼠DG的p-eIF-2α表达无明显改变(Fig 2A);与训练组的CON大鼠相比,训练组NVP大鼠的p-eIF-2α表达明显增多(P < 0.01)。非训练CON大鼠和NVP大鼠DG的ATF4表达无明显改变(Fig 2B);与训练组的CON大鼠相比,训练组NVP大鼠的ATF4表达明显增多(P < 0.01)。
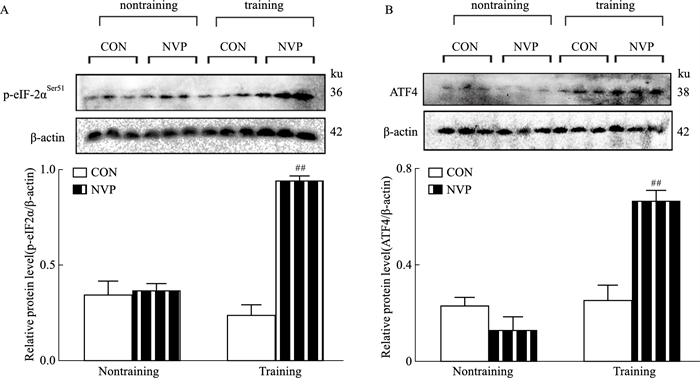
|
| Fig 2 Effects of microinjection of NVP on expression of p-eIF-2α (A) and ATF4 (B) in hippocampal DG (x±s, n=3) ##P < 0.01 vs Training CON group. |
如Fig 3所示,与非训练组相比,训练组的CON大鼠DG的BDNF表达明显增多(P < 0.05)。与训练组的CON相比,微量注射NVP明显抑制训练组大鼠BDNF的表达(P < 0.01)。
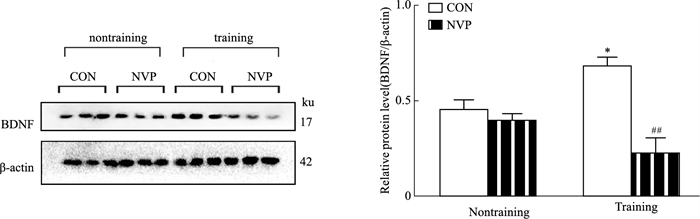
|
| Fig 3 Effects of microinjection of NVP on expression of BDNF in hippocampal DG (x±s, n=3) *P < 0.05 vs Non-training CON group; ##P < 0.01 vs Training CON group. |
与Vehicle(NVP+NS)相比,注射ISRIB(NVP+ISRIB)海马DG的p-eIF-2α表达无明显改变(Fig 4A),但下游的ATF4表达明显降低(P < 0.01,Fig 4B)。
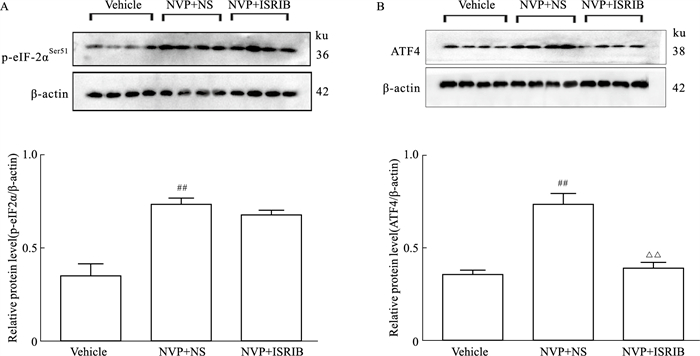
|
| Fig 4 Effects of microinjection of ISRIB on expression of p-eIF-2α (A) and ATF4 (B) in hippocampal DG (x±s, n=4) ##P < 0.01 vs Vehicle group; △△P < 0.01 vs NVP+NS group. |
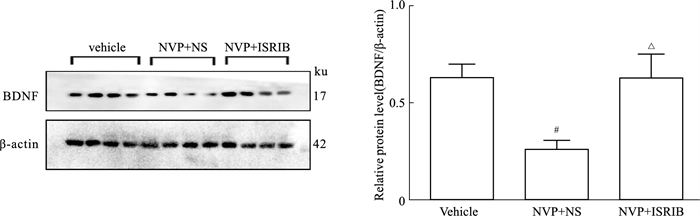
如Fig 5所示,与Vehicle(NVP+NS)相比,注射ISRIB(NVP+ISRIB)海马DG的BDNF表达明显增加(P < 0.05)。
|
| Fig 5 Effects of microinjection of ISRIB on expression of BDNF in hippocampal DG (x±s, n=4) #P < 0.05 vs Vehicle group; △P < 0.05 vs NVP+NS group. |
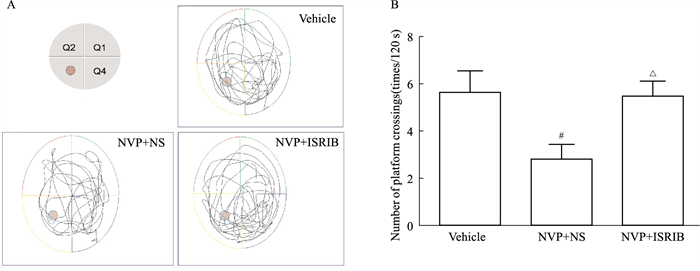
MWM实验典型的轨迹图可以看出(Fig 6A),Vehicle大鼠运动轨迹有目的性,表现为多次穿越原站台区位置;NVP+NS大鼠穿越原站台区次数较少,轨迹主要集中在没有目标站台的第4象限,而NVP+ISRIB组大鼠在目标象限(原站台所在第3象限)的游泳轨迹较密集,穿越原平台区域次数明显增多(P < 0.05,Fig 6B)。
|
| Fig 6 Effects of microinjection of ISRIB on spatial memory impairment induced by NVP (x±s, n=6) A: The typical swimming trace; B: The number of platform crossings of the MWM test. #P < 0.05 vs Vehicle group; △P < 0.05 vs NVP+NS group. |
海马学习和记忆功能依赖神经递质谷氨酸(glutamate,Glu)及其受体介导的兴奋性信号的传导。Glu受体包括离子型受体和代谢型受体两大类,前者与Glu结合后发挥门控特性,引起细胞膜离子电导的改变,后者则是通过G蛋白偶联的细胞内信号转导引发细胞的生物学效应。上述多种Glu受体中,离子型NMDAR被认为是DG学习记忆及突触LTP形成和保持的关键分子。NMDAR的拮抗剂,如美金刚等,已被广泛用于缓解Glu能信号功能亢进引发的兴奋性毒性作用。不仅如此,Glu-NMDAR与癌症发生、发展及不良预后有关,应用NMDAR拮抗剂能够抑制外周肿瘤增殖和侵袭,其主要通过作用于下游的MEK-MAPK和CaMK发挥作用[12]。上述研究提示了NMDAR为多种功效药物开发的重要靶点。随着对NMDAR结构的不断研究发现,NR2是NMDAR的关键调节亚单位,成年海马主要分布NR2B和NR2A,而在神经元成熟、行为学训练、突触可塑性改变的过程中,均伴随着NR2B和NR2A分布和NMDAR组成的动态重塑[2, 13],但这个改变(甚至不变,如敲除NR2A不影响小鼠的空间参考记忆[14])与受试者本身,如动物种类、年龄以及行为学范式等受试条件有关。本研究基于水迷宫行为学训练范式,探讨了海马NR2A在空间学习记忆前后的改变,发现5 d的空间学习记忆促进大鼠海马NR2A的表达,提示NR2A在调节海马学习记忆中的潜在价值。
本研究小组前期研究表明,DG的Glu-NMDAR系统在大鼠海马学习记忆及认知障碍中发挥关键作用:正常大鼠DG区Glu通过激活NMDAR参与调节主动回避反应及习得性LTP;在病理情况下,如阿尔茨海默病模型大鼠,DG的Glu-NMDAR信号在大鼠行为学训练过程中表现为过度应答[15],而该信号在肥胖相关的海马学习记忆能力下降中表现为DG的Glu过度应答,但出现NR2A的受体下调和下游CaMKII/BDNF通路抑制反应[16]。既往的研究提示,DG的Glu-NMDAR信号精准应答是海马记忆形成的重要分子基础。结合本实验研究结果可推测:DG的NR2A参与大鼠空间学习记忆活动,表现为NR2A表达的增多,而NR2A在内的几乎全部学习记忆相关蛋白质的合成均依赖细胞核内调控分子的转录及翻译过程,因此,本研究从蛋白质合成的角度探究海马DG区微量注射NVP的药理学作用机制。本研究发现海马内微量注射NVP可阻断学习记忆诱发的海马NR2A以及促进记忆形成的蛋白BDNF的表达,推测NVP可能是通过阻断NR2A合成相关的转录翻译过程实现的。
eIF2α在蛋白质的翻译中发挥关键作用。真核细胞eIF2为三聚体复合物,包括α、β和γ亚基,能够与甲硫酰基启动因子tRNA和GTP形成三元复合物,后者参与形成43S起始前复合体,并扫描识别起始密码子AUG,促进蛋白质翻译进入延伸阶段。但在某些异常状态下,eIF2αSer51位点磷酸化并负性调节翻译的起始,引起学习记忆相关蛋白,如BDNF翻译停滞,并优先激活某些特殊结构的序列,如ATF4的转录以适应细胞内的变化,这个过程即为蛋白质稳态失衡诱发的整合应激反应(integrated stress response ISR)[17],而eIF2α/ATF4通路也被认为是参与细胞增殖和死亡调控的关键因子[18]。本研究检测发现,行为学训练并不引起磷酸化eIF2αSer51和ATF4的表达改变,提示ISR可能并不参与正常生理状态的细胞反应,但注射NVP明显增加了两者的表达,提示ISR可能参与NVP引起的海马空间记忆损伤。如前所述,ISR会引起学习记忆相关蛋白合成阻滞,因此,本研究检测了海马BDNF的表达变化,发现行为学训练促进海马BDNF表达,提示海马BDNF参与大鼠空间学习记忆过程中,这与其他学者的大部分研究结果相符,但上述变化被NVP明显抑制。综合上述结果可知,NR2A/BDNF途径参与海马空间学习记忆过程,利用NVP抑制NR2A会引起海马空间记忆损伤,这与ISR引起的学习记忆相关蛋白质翻译障碍有关。为验证上述猜测,本研究海马内微量注射ISRIB,发现ISRIB可以明显缓解NVP引起的空间学习记忆损伤,抑制ATF4表达,并缓解BDNF合成障碍。
综上所述,NR2A是NMDAR参与海马DG学习记忆的关键亚基,NVP通过抑制DG的NR2A损伤海马空间记忆,其作用机制主要与ISR有关。
| [1] |
Borzello M, Ramirez S, Treves A, et al. Assessments of dentate gyrus function: discoveries and debates[J]. Nat Rev Neurosci, 2023, 24(8): 502-17. doi:10.1038/s41583-023-00710-z |
| [2] |
Furuie H, Yamada M. Neonatal blockade of NR2A-containing but not NR2B-containing NMDA receptor induces spatial working memory deficits in adult rats[J]. Neurosci Res, 2022, 176: 57-65. doi:10.1016/j.neures.2021.10.005 |
| [3] |
Kannangara T S, Eadie B D, Bostrom C A, et al. GluN2A-/- mice lack bidirectional synaptic plasticity in the dentate gyrus and perform poorly on spatial pattern separation tasks[J]. Cereb Cortex, 2015, 25(8): 2102-13. doi:10.1093/cercor/bhu017 |
| [4] |
Baez M V, Cercato M C, Jerusalinsky D A. NMDA receptor subunits change after synaptic plasticity induction and learning and memory acquisition[J]. Neural Plast, 2018, 2018: 5093048. |
| [5] |
Seifried L, Soleimanpour E, Dieterich D C, Fendt M. Cognitive flexibility in mice: effects of puberty and role of NMDA receptor subunits[J]. Cells, 2023, 12(9): 1212. doi:10.3390/cells12091212 |
| [6] |
Auberson Y P, Allgeier H, Bischoff S, et al. 5-Phosphonomethylquinoxalinediones as competitive NMDA receptor antagonists with a preference for the human 1A/2A, rather than 1A/2B receptor composition[J]. Bioorg Med Chem Lett, 2002, 12(7): 1099-102. doi:10.1016/S0960-894X(02)00074-4 |
| [7] |
Ge Y, Dong Z, Bagot R C, et al. Hippocampal long-term depression is required for the consolidation of spatial memory[J]. Proc Natl Acad Sci USA, 2010, 107(38): 16697-702. doi:10.1073/pnas.1008200107 |
| [8] |
Zhang X H, Liu S S, Yi F, et al. Delay-dependent impairment of spatial working memory with inhibition of NR2B-containing NMDA receptors in hippocampal CA1 region of rats[J]. Mol Brain, 2013, 6: 13. doi:10.1186/1756-6606-6-13 |
| [9] |
He S, Shao L R, Wang Y, Bausch S B. Synaptic and extrasynaptic plasticity in glutamatergic circuits involving dentate granule cells following chronic N-methyl-D-aspartate receptor inhibition[J]. J Neurophysiol, 2013, 109(6): 1535-47. doi:10.1152/jn.00667.2012 |
| [10] |
He S, Shao L R, Rittase W B, Bausch S B. Increased Kv1 channel expression may contribute to decreased sIPSC frequency following chronic inhibition of NR2B-containing NMDAR[J]. Neuropsychopharmacology, 2012, 37(6): 1338-56. doi:10.1038/npp.2011.320 |
| [11] |
Vasuta C, Caunt C, James R, et al. Effects of exercise on NMDA receptor subunit contributions to bidirectional synaptic plasticity in the mouse dentate gyrus[J]. Hippocampus, 2007, 17(12): 1201-8. doi:10.1002/hipo.20349 |
| [12] |
Li L, Hanahan D. Hijacking the neuronal NMDAR signaling circuit to promote tumor growth and invasion[J]. Cell, 2013, 153(1): 86-100. doi:10.1016/j.cell.2013.02.051 |
| [13] |
Dupuis J P, Nicole O, Groc L. NMDA receptor functions in health and disease: old actor, new dimensions[J]. Neuron, 2023, 111: 2312-28. doi:10.1016/j.neuron.2023.05.002 |
| [14] |
Bannerman D M, Niewoehner B, Lyon L, et al. NMDA receptor subunit NR2A is required for rapidly acquired spatial working memory but not incremental spatial reference memory[J]. J Neurosci, 2008, 28(14): 3623-30. doi:10.1523/JNEUROSCI.3639-07.2008 |
| [15] |
Ren P, Xiao B, Wang L P, et al. Nitric oxide impairs spatial learning and memory in a rat model of Alzheimer's disease via disturbance of glutamate response in the hippocampal dentate gyrus during spatial learning[J]. Behav Brain Res, 2022, 422: 113750. doi:10.1016/j.bbr.2022.113750 |
| [16] |
唐若祺. 食源性肥胖对空间学习过程中的大鼠海马齿状回区谷氨酸水平的影响[D]. 延吉: 延边大学, 2020. Tang R Q. Effect of diet-induced obesity on glutamate levels inthehippocampal dentate gyrus during spatial learning in rats[D]. YanJi: Yanbian Univ, 2020. |
| [17] |
Krzyzosiak A, Pitera A P, Bertolotti A. An overview of methods for detecting eIF2α phosphorylation and the integrated stress response[J]. Methods Mol Biol, 2022, 2428: 3-18. |
| [18] |
李端, 王永辉, 周静, 等. 雷公藤红素通过调控ATF4/caspase-3/GSDME信号通路促进肝癌细胞焦亡[J]. 中国药理学通报, 2024, 40(2): 299-307. Li D, Wang Y H, Zhou J, et al. Tripterine promotes pyroptosis of liver cancer cells by regulating ATF4/caspase-3/GSDME signaling pathway[J]. Chin Pharmacol Bull, 2024, 40(2): 299-307. |

