

2. 安徽医科大学药学院, 安徽 合肥 230032
2. School of Pharmacy, Anhui Medical University, Hefei 230032, China
在充足的氧气环境中,心脏所产生的超过95%的ATP源自于线粒体的氧化磷酸化过程[1]。剩余的5%主要来自于糖酵解,还有一小部分来自于柠檬酸循环。而人类胎儿心脏在缺氧和低脂肪酸的环境中,则主要依赖于葡萄糖和乳酸的代谢。随着心肌细胞的成熟,从糖酵解代谢向线粒体氧化磷酸化转变,最终,成人心肌约95%的能量来源于氧化磷酸化过程。在成年人的心脏中,大约70%至90%的心脏ATP是由脂肪酸氧化产生的,剩下的10%至30%来自于葡萄糖和乳酸的氧化,以及一小部分的酮体和某些氨基酸。健康心脏在代谢方面具有灵活性,可以随时在不同能量底物之间转换,以维持ATP生成。
1.1 心肌脂肪酸代谢脂肪酸是成年人心脏的主要能量来源,并为线粒体的氧化磷酸化过程提供必要的辅酶因子(在有氧条件下,脂肪酸通过β-氧化代谢进入线粒体,并在其中被逐步氧化释放能量。这个过程产生了辅酶因子辅酶A和辅酶Q。)。脂肪酸通过脂肪酸转运蛋白(如组织特异性脂肪酸转运蛋白CD36/FAT和脂肪酸结合蛋白FABP)在细胞膜上进行转运,以进入心肌细胞。在摄取脂肪酸后,心肌细胞通过脂肪酸共轭反应将脂肪酸转化为脂肪酸酰基辅酶a。短链脂肪酸可以直接进入线粒体,而长链脂肪酸则需要通过肉碱转运系统进入。长链脂肪酸在线粒体外膜上与肉碱棕榈酰转移酶1(carnitine palmitoyltransferase 1,CPT-1)结合,形成长链酰基肉碱,然后通过肉碱-乙酰肉碱转位酶转运至线粒体。在线粒体内,脂肪酸酰基辅酶a再次通过肉碱棕榈酰转移酶2(carnitine palmitoyltransferase 2,CPT-2)还原为长链脂肪酰基辅酶a。在这个过程中,CPT-1是限速酶,其催化反应是决定脂肪酸氧化速率的关键调控节点。随后,脂肪酰基辅酶a进入β-氧化过程,生成乙酰辅酶a、还原型烟酰胺腺嘌呤(nicotinamide adenine dinucleotide,NADH)和还原型黄素二核苷酸(flavine adenine dinucleotide, reduced,FADH2)等产物。同样,乙酰辅酶a进入三羧酸(tricarboxylic acid,tCA)循环后也会产生NADH和FADH2。电子传递链利用NADH和FADH2所提供的能量,创造了线粒体质子梯度。F1F0型腺苷三磷酸酶则利用线粒体膜上的巨大电化学质子梯度,将二磷酸腺苷(adenosine diphosphate,ADP)磷酸化为ATP,为心脏提供能量(Fig 1)。
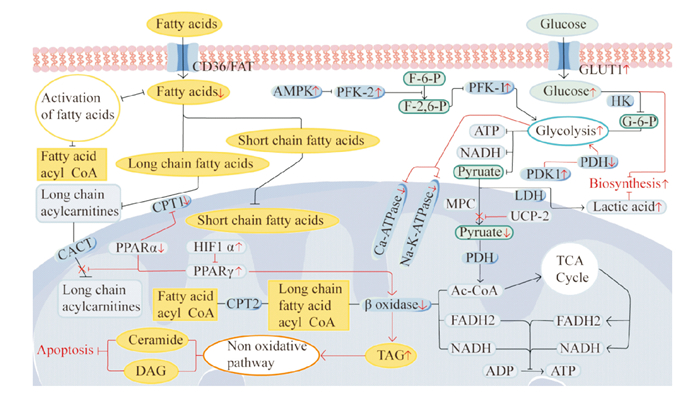
|
| Fig 1 Schematic representation of major metabolic pathways in normal and failing hearts Red arrows indicate changes in heart failure; up indicates up-regulation or promotion, down indicates down-regulation or inhibition. CD36/FAT is tissue-specific fatty acid transporter protein; CPT-1 is carnitine palmitoyltransferase 1; CPT-2 is carnitine palmitoyltransferase 2; CACT is carnitine-acyl-carnitine deficiency; PPARs is peroxisome proliferator-activated receptor; HIF1α is hypoxia-inducible factor 1α; TAG is triglyceride; DAG is diacyl glycerol; GLUT1 is glucose transport protein 1; AMPK is AMP-dependent protein kinase; PFK-1 is 6-phosphofructokinase 1; PFK-2 is 6-phosphofructokinase 2; HK is hexokinase; G-6-P is glucose-6-phosphate; F-6-P is fructose-6-phosphate; ADP is adenosine diphosphate; ATP is adenosine triphosphate; PDK1 is pyruvate dehydrogenase kinase-1; PDH is pyruvate dehydrogenase; LDH is lactate dehydrogenase; UCP-2 is mitochondrial uncoupling protein-2; MPC is mitochondrial pyruvate carrier; NADH is nicotinamide adenine dinucleotide; FADH2 is flavine adenine dinucleotide, reduced. |
在健康情况下,心脏主要依赖脂肪酸来产生能量,但在心力衰竭时,它会转向使用葡萄糖作为主要的能量来源。葡萄糖的代谢始于葡萄糖的摄取。在心脏中,葡萄糖通过多种细胞表达的葡萄糖转运蛋白(glucose transporters,GLUTs)进入心肌细胞,其中包括胰岛素敏感的GLUT4和胰岛素非依赖的GLUT1。一旦葡萄糖进入心肌细胞,它会经由己糖激酶的磷酸化生成葡萄糖-6-磷酸,然后通过糖酵解途径转化为丙酮酸盐。糖酵解是葡萄糖利用的主要途径,也是葡萄糖氧化的第一步。糖酵解过程会产生丙酮酸、NADH和少量的ATP。这些由糖酵解产生的ATP可用于维持心脏的舒缩功能,即在心脏的舒张期将所需的钙离子摄取到肌浆网中。在糖酵解过程中,一个葡萄糖生成两个丙酮酸分子[2]。在细胞质中,丙酮酸可以通过线粒体丙酮酸载体(mitochondrial pyruvate carrier,MPC)进入线粒体,未进入线粒体的丙酮酸可以在乳酸脱氢酶的作用下转化为乳酸。在线粒体中,丙酮酸通过丙酮酸脱氢酶(pyruvate dehydrogenase,PDH)生成乙酰辅酶A,PDH作为丙酮酸代谢的关键调节因子和限速酶,在此过程中发挥重要作用。乙酰辅酶A可以进入三羧酸循环,然后完成有氧氧化过程[3],产生ATP来提供能量(与心肌脂肪酸代谢类似)(Fig 1)。
1.3 心肌酮体代谢在正常情况下(非禁食期间),酮体通常以较低的浓度存在,心肌会最小程度地摄取酮体[4]。然而,在禁食或应激期间,酮体是维持代谢稳态的重要组成部分。当血浆葡萄糖水平降低、或者在长时间禁食或饥饿期间,酮体主要在肝脏中由乙酰辅酶A生成,这个过程被称为生酮。游离脂肪酸从脂肪组织中通过脂肪分解释放出来,进入肝细胞并在线粒体基质中进行β-氧化来产生乙酰辅酶A,然后通过3-羟基-3-甲基戊二酰辅酶A生酮途径生成酮体。在这个过程中,会产生3种酮体:乙酰乙酸(acetoacetate,AcAc)、β-羟基丁酸(β-hydroxybutyrate,β-OHB)和丙酮。两个乙酰辅酶A经过硫解酶反应生成乙酰-乙酰辅酶A(acetoacetyl CoA,AcAc-CoA),然后第三个乙酰辅酶A与3-甲基戊二酰辅酶A合成酶2缩合生成3-羟基-3-甲基戊二酰辅酶A (3-hydroxy-3-methylglutaryl CoA lyase,HMGC)。随后,通过HMGC裂解酶将HMGC转化为AcAc。AcAc会被线粒体中的磷脂酰胆碱依赖性β-OHB脱氢酶-1 (beta-hydroxybutyrate dehydrogenase 1,BDH1)还原为β-OHB。β-OHB可能通过单羧酸转运体1(monocarboxylate transporter 1,MCT1)被心肌细胞摄取用作能量来源。由于血液中的循环酮体浓度高于肝外组织,酮体会通过MCT1沿浓度梯度转运到肌细胞中,然后进入线粒体被氧化利用。在线粒体内,β-OHB被BDH1氧化为AcAc;AcAc再通过3-酮酰基辅酶A转移酶1与琥珀酰辅酶A进行CoA交换,产生AcAc-CoA和琥珀酸。这一步是酮体利用的限速阶段。随后,AcAc-CoA在硫解酶的作用下可逆地转化为乙酰辅酶a,进入TCA循环,产生ATP(Fig 2)。
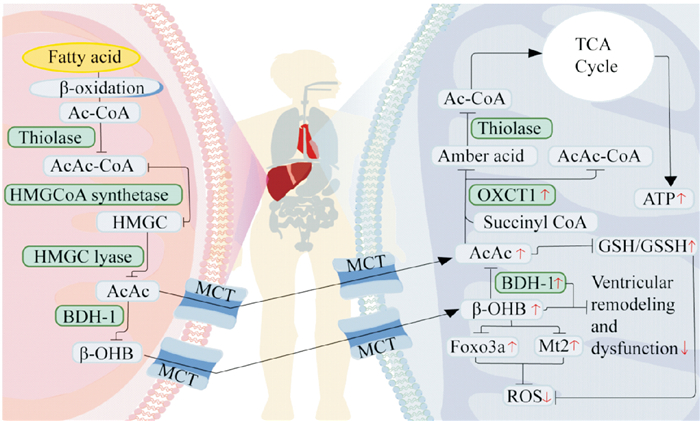
|
| Fig 2 Energy metabolism of ketone bodies in normal and failing hearts Red arrows indicate changes in heart failure; up indicates upregulation or promotion, down indicates downregulation or inhibition. Ac-CoA is acetyl-coA; AcAc-CoA is acetyl-acetyl-coenzyme A; HMGC is 3-hydroxy-3-methylglutaryl-coenzyme A; AcAc is acetoacetate; β-OHB is β-hydroxybutyrate; MCT is monocarboxylate transporter; TCA cycle is tricarboxylic acid cycle; OXCT1 is succinyl coenzyme A transferase; ATP is adenosine triphosphate phosphate; GSH is glutathione; GSSH is oxidized glutathione; BDH1 is phosphatidylcholine-dependent; β-OHB dehydrogenase-1; Mt2 is metallothionein 2; ROS is reactive oxygen species. |
当发生心力衰竭时,以下3种能量代谢方式会发生紊乱:底物吸收和利用、氧化磷酸化、磷酸转移。此时,心脏失去了代谢灵活性,产生ATP的能力下降,出现能量缺乏[5]。心力衰竭的特征是心肌氧化还原调节的变化,其中主要特征是氧化应激的增加[6]。氧化应激引起的活性氧物质(reactive oxygen species,ROS)的增加可引发脂质过氧化,损害线粒体DNA(mitochondrial DNA,mtDNA),消耗抗氧化剂,同时减少线粒体ATP的产生。我们的研究表明,中药心肌尔康可以对小鼠心肌梗死诱导的心力衰竭发挥抗氧化作用,降低体内的氧化应激水平[7]。在心力衰竭时,心肌细胞对脂肪酸的利用能力下降,对葡萄糖的利用能力增加,线粒体功能损害,从而导致心肌能量代谢的改变。
2.1 脂肪酸代谢紊乱有研究表明,完全氧化1 mol 20碳脂肪酸(约134 mol)所产生的ATP量远远大于1 mol葡萄糖(约30 mol)[8]。然而当产生相同数量的ATP时,脂肪酸氧化所需的氧气量比葡萄糖氧化更多,在缺氧条件下,脂肪酸氧化的生产效率明显低于葡萄糖氧化[5]。当心脏收缩功能障碍发生时,心脏对脂肪酸的摄取会减少,β-氧化酶的表达下调,脂肪酸氧化率降低。另外,研究表明,在心力衰竭的代偿性肥厚期(收缩功能正常)中,脂肪酸摄取或氧化的差异并不明显,然而,当心力衰竭发展到一定严重程度时(EF < 50%),特发性扩张型心肌病患者(收缩功能障碍)的脂肪酸氧化会降低。在心力衰竭的不同阶段,脂肪酸摄取和氧化的降低程度不同,这可能导致细胞内脂质的积累,其中一部分以甘油三酯(triacylglycerol,TAG)的形式储存。TAG可以通过非氧化途径进行代谢,生成有毒的脂质物质,如神经酰胺和二酰甘油。这种脂质毒性会导致线粒体功能障碍和细胞凋亡,并可能加剧高血脂的恶化(Fig 1)。
在那些报告脂肪酸氧化减少的研究中,发现参与脂肪酸氧化转录调控的基因和酶的表达和活性也同时下降。这些基因和酶包括过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptors, PPARs)、视黄醇X受体α(PPARα和过氧化物酶体增殖物激活受体γ共激活剂1-alpha的辅助因子)、雌激素相关受体,以及一些参与脂肪酸氧化的酶,如CPT-1、中链酰基辅酶A脱氢酶、分化簇36(cluster of Differentiation 36,CD36)和脂肪酸转运蛋白-1。脂肪酸氧化的减少可能归因于PPARα信号的抑制, 以及缺氧诱导因子1α(hypoxia-inducible factor 1-alpha,HIF1α)-PPARγ信号轴的激活。这个信号轴的激活会影响脂肪酸向线粒体的转运,并降低脂肪酸氧化酶的活性。PPARs可以调节CPT1的水平,在老龄小鼠的心脏中,PPARα显著降低。有研究表明,在成年小鼠的心脏中,主动脉缩窄(transverse aortic constriction,TAC)损伤和I/R损伤后,PPARα和CPT1的表达显著降低。而使用PPARα激动剂可以增加CPT1的表达,从而增加小鼠心肌细胞脂肪酸氧化[9](Fig 1)。
脂质代谢紊乱可能在心肌缺血再灌注(myocardial ischemia-reperfusion,MIR)损伤引起的心力衰竭中起关键作用,我们的研究结果表明,中药心肌尔康可通过抑制MIR诱导的炎症和血脂代谢紊乱来发挥心肌保护作用,通过恢复失调的脂质组学来保护心脏免受MIR损伤[10]。
2.2 糖代谢的变化大多数研究显示,在病理性肥大和心力衰竭中,心肌对葡萄糖的摄取增加,这可能与GLUT1的表达增加相关。心力衰竭发生时,心肌脂质分解代谢减少,线粒体氧化代谢和ATP生成降低,无氧糖酵解(非葡萄糖氧化)逐渐成为衰竭心肌的主要能量来源[11]。在心力衰竭小鼠模型中,葡萄糖衍生的丙酮酸盐氧化(即葡萄糖氧化)减少;心力衰竭患者的心肌活检中,MCT1、PDH、MPCs和丙酮酸/丙氨酸氨基转移酶的表达降低,表明丙酮酸转运和代谢减少,这支持了葡萄糖氧化的减少[12](Fig 1)。
糖酵解的增加可能是由于ATP依赖性的6-磷酸果糖激酶1(phosphofructokinase-1,PFK-1)的活性增加,该酶是糖酵解的限速酶。6-磷酸果糖激酶2(phosphofructokinase-2,PFK-2)通过磷酸化果糖-6-磷酸在糖酵解过程中调节果糖-2, 6-二磷酸水平,而果糖-2, 6-二磷酸是PFK-1的强力刺激剂。心脏特异性激酶缺陷的PFK-2突变小鼠心脏的糖酵解和胰岛素敏感性降低。因此,与野生型小鼠相比,TAC术后心脏特异性激酶缺陷PFK-2小鼠的糖酵解并未增加。然而,过表达激酶活性的PFK-2可增强缺氧小鼠心肌细胞的收缩性。在心力衰竭发生时,腺苷酸激活蛋白激酶激活促进PFK-2磷酸化,上调糖酵解,抑制糖原合成,减少能量消耗,在心肌损伤后可能发挥保护作用(Fig 1)。
线粒体解偶联蛋白-2(mitochondrial uncoupling protein-2,UCP-2)位于线粒体内膜。Kutsche等[13]的研究证实UCP-2可以阻止丙酮酸盐进入线粒体进行氧化,从而导致葡萄糖代谢通量转向糖酵解和谷氨酰胺分解,以产生ATP来弥补线粒体氧化不足的现象,进而导致乳酸水平升高。另一项研究表明,丙酮酸脱氢酶激酶-1(pyruvate dehydrogenase kinase,PDK1)表达增强和PDH表达减弱时,会推动高强度的细胞糖酵解[14]。PDH是葡萄糖氧化限速酶,可被PDK1磷酸化和失活,PDK1通过抑制PDH在糖酵解中发挥作用[15](Fig 1)。
Umbarawan等[16]认为葡萄糖摄取和糖酵解的增加被用于生物合成而不是ATP的产生。这可能是糖酵解的增加不足以完全代偿心力衰竭时的能量不足或恢复心脏功能的原因之一。心脏内磷酸戊糖途径的激活[16]表明在肥大性生长期间产生更多核糖-5-磷酸和还原型辅酶Ⅱ,分别用于核苷酸和膜脂的合成。己糖胺生物合成途径形成尿苷二磷酸-N-乙酰葡萄糖,这种物质被用于各种蛋白质的糖基化修饰,可能促进心室肥大。
糖酵解还会削弱Na+/K+ ATP酶和Ca2+ ATP酶的Na+、Ca2+外排能力,破坏离子稳态,并进一步损害收缩功能。在心力衰竭晚期,由于心肌胰岛素敏感性降低,心脏葡萄糖摄取受损,进一步减少了葡萄糖用于ATP生产的可用性(Fig 1)。
2.3 酮体代谢改变心力衰竭进展过程中常见线粒体功能障碍,但与脂肪酸不同,酮体利用路径更为高效。衰竭心脏中酮体代谢途径上调,有助于其完全氧化。
越来越多的证据表明,在心力衰竭时,循环中的酮体浓度和心肌酮氧化水平增加。通过核磁共振氢谱,Du等人发现衰竭心脏中循环酮体水平的增加与心肌能量消耗呈正相关。在扩张型心肌病患者和心力衰竭小鼠模型中,线粒体酮体氧化的关键酶如BDH1和琥珀酰辅酶A转移酶的表达也上调[4](Fig 2)。
酮体通过促进提高还原型谷胱甘肽和氧化型谷胱甘肽的比例发挥抗氧化作用,从而直接对抗氧化应激,清除氧自由基。β-OHB可以通过激活Foxo3a和金属硫蛋白2(metallothionein 2,Mt2)启动子基因,显著抑制线粒体氧化应激。β-OHB还具有诱导细胞增殖和抑制炎症的作用。在心力衰竭小鼠和犬中,增加β-OHB的输送可以减轻心室重塑和功能障碍[17]。在小鼠实验模型中,心脏特异性缺失BDH1加重了心力衰竭模型中的心脏功能障碍和重构[17],而心脏特异性过表达BDH1可以减轻心脏纤维化和收缩功能障碍,这表明增加酮体氧化对于压力超负荷心脏具有保护作用(Fig 2)。
一项研究表明,在小鼠衰竭心脏中,通过增加酮体向心脏的输送,增强心肌细胞中酮体的氧化可提高ATP的生成速率,而对葡萄糖或脂肪酸的氧化速率没有显著影响。对人体的研究也表明,输入β-OHB不会降低心脏脂肪酸氧化率。促进衰竭心脏中的酮体氧化可以改善ATP生成,但不能改善心脏效率(Fig 2)。
综上所述,增强酮氧化为衰竭的心脏提供了额外的燃料来源,并且没有影响心脏对脂肪酸和葡萄糖的利用,但没有提高心脏效率。酮体对抗了线粒体氧化应激作用,有利于恢复心脏功能。
3 心力衰竭时线粒体功能障碍衰竭心脏的线粒体功能受损可能由多种原因引起,包括:(1) 线粒体Ca2+稳态的ROS产生和失调;(2) 线粒体动力学的紊乱,持续的线粒体吞噬和心肌细胞自噬细胞死增加;(3) 线粒体蛋白转录调节的改变和翻译后蛋白修饰的增加[18-21]。
线粒体Ca2+是导致心力衰竭线粒体功能障碍的重要因素[22]。Ca2+不足会降低线粒体中代谢酶的活性,而线粒体Ca2+超载则会激活细胞死亡途径[23]。此外,心力衰竭中出现的Ca2+平衡失调可能会导致线粒体成为Ca2+的吸收池[24]。我们的研究表明,中药心肌尔康可抑制血管紧张素Ⅱ诱导的AC16细胞中calpain1的过度活性,改善钙泵功能,对AC16细胞具有保护作用,同时在心力衰竭小鼠模型中发挥心血管和肾脏保护作用[25]。
线粒体动力学是指线粒体在裂变和融合循环中的变化过程。线粒体融合对于维持正常线粒体和心脏功能至关重要,而裂变则有助于通过线粒体吞噬去除功能失调和去极化的线粒体。线粒体融合可以形成长而相互连接的线粒体网络,而线粒体裂变可能导致线粒体碎裂和心肌线粒体网络的破坏。衰竭心脏中,调节线粒体动力学的蛋白表达发生变化,同时线粒体裂变形态也发生改变[26]。过度或无节制的裂变可能导致线粒体碎裂,从而引发线粒体吞噬、抗氧化能力下降、ROS生成增加和细胞死亡。
线粒体吞噬是指选择性清除线粒体的过程。与线粒体生物发生和动力学一样,线粒体吞噬是高度调节的,并且通常与线粒体生物发生耦合,发生在线粒体裂变之后。线粒体自噬需要完整的宏观自噬/溶酶体功能,但在某些情况下也可能独立于自噬发生。目前已经描述了四个主要的线粒体吞噬受体:SQSTM1(也称为p62)、optineurin(OPTN)、BNIP3和FUNDC1,它们都包含LC3识别结构域,并允许线粒体连接到自噬体。线粒体吞噬对于维持线粒体质量控制至关重要,通过去除受损的线粒体来实现。心力衰竭中,线粒体吞噬的增加可能是一种适应性反应,以限制线粒体损伤并保持ATP产生。然而,在心力衰竭中持续的线粒体吞噬可能导致过度清除线粒体,从而减少心脏中线粒体的数量。此外,在受损的线粒体吞噬状态下,功能失调的线粒体无法完全降解。这些受损的线粒体可能破坏线粒体网络中的能量平衡,或者通过激活细胞死亡途径(如自噬)诱导进一步的损伤。线粒体动力学的改变可能是导致心力衰竭中总体线粒体氧化能力降低的重要因素,因此也直接影响ATP的产生[27]。
心力衰竭中的线粒体ROS:在心力衰竭患者和动物模型中,过量的线粒体ROS的产生会对心脏造成明显的损害。已经证明,针对线粒体ROS的靶向清除对心力衰竭动物模型具有益处。线粒体ROS的产生依赖于线粒体膜电位。ROS与浓度升高的钙离子结合导致线粒体膜通透性转换孔开放,进而降低线粒体膜电位,减少线粒体外膜磷酸化电位,对细胞功能产生不利影响。ROS的激增导致细胞色素c的释放,并通过细胞凋亡途径启动细胞死亡。过量的ROS产生对心肌细胞的线粒体造成不可逆的损伤,限制了ATP的产生,从而在高氧化能量需求时不足以支持质子泵的功能。
线粒体生物发生:mtDNA的突变导致导致多种疾病,其特征是一些高能组织(如心肌)中的能量稳态的改变(ATP合成减少)。不同病因的心衰患者也显示mtDNA含量减少和mtDNA编码的蛋白质减少。已报道心力衰竭心脏中线粒体生物发生受损,可能是由于mtDNA复制缺陷的结果。
4 纠正能量代谢在心力衰竭治疗中的价值心力衰竭是一种能量供给不足的疾病,主要原因包括心脏线粒体氧化能力下降、糖酵解增加导致葡萄糖氧化的解耦合,以及脂肪酸氧化减少或保持不变。这些代谢变化导致心脏效率下降。心力衰竭中心脏线粒体氧化代谢的变化是由于关键酶的转录调节改变,以及氧化还原状态和代谢物信号的改变所致。这些变化进而引发翻译后的表观遗传调节,从而影响能量代谢酶基因的表达。值得注意的是,针对线粒体氧化代谢的药理靶向已经成为一种新的治疗方法,可以提高心力衰竭患者的心脏效率,减少能量不足,并改善心功能。线粒体功能被认为是多种疾病的治疗靶点,其中包括心力衰竭。
通过调节能量代谢来降低心力衰竭的潜在治疗策略:(1) 线粒体靶向抗氧化剂(mitoquinone,MitoQ):MitoQ已被证明可以预防棕榈酸刺激的心肌干细胞中的氧化应激和线粒体蛋白改变[28]。在动物实验中,MitoQ降低了心脏氧化应激,防止了肥胖大鼠心脏纤维化和肥大的发展[28]。此外,MitoQ还显著改善了上行主动脉收缩小鼠的左心室功能障碍和代谢相关基因表达的增加[29]。MitoQ是一种含有带正电荷的亲脂性阳离子的分子,可以在带负电荷的线粒体内广泛积累。其活性抗氧化成分是泛醌,与辅酶Q10中的活性抗氧化剂相同。亲脂性阳离子使MitoQ能够在细胞内选择性和广泛地积累,而其他抗氧化剂则均匀地分布在整个细胞中,例如辅酶Q10。(2) Elamipretide:Elamipretide是一种小型线粒体靶向四肽,也是一种心磷脂过氧化物酶抑制剂,可以减少有毒活性氧(ROS)的产生并稳定心磷脂。(3) CGP-37157:CGP-37157是一种Na+/Ca2+抑制剂,可以抑制豚鼠心脏线粒体中由Na+诱导的Ca2+释放,从而减少Ca2+堆积刺激ROS的产生。(4) SGLT-2抑制剂:SGLT-2抑制剂是钠-葡萄糖协同转运蛋白2的抑制剂,可以调节葡萄糖代谢紊乱。有研究观察到,在糖尿病患者中使用SGLT-2抑制剂对心血管具有意想不到的益处,这提示了调节心脏中葡萄糖和酮体代谢的机会。(5) 调节脂肪酸代谢紊乱:Etomoxir是一种线粒体CPT1抑制剂,而CPT1是脂肪酸β-氧化的限速酶。曲美他嗪通过竞争性抑制长链3-酮酰基辅酶A硫醇酶来抑制游离长链,从而促进葡萄糖用于ATP生产。中药心肌尔康可通过平衡脂质代谢、抑制炎症和氧化应激等多种途径来发挥心肌保护作用,保护心脏免受心肌梗死和MIR损伤引起的心力衰竭[7, 10]。
这些方法的应用可以调节心力衰竭患者的能量代谢,从而改善心脏功能。然而,仍然需要进一步的研究来验证这些治疗策略的安全性和有效性。
| [1] |
赵鑫龙, 杨杰孚. 心肌能量代谢与心力衰竭的研究进展[J]. 中华心血管病杂志, 2022, 50(4): 404-9. Zhao X L, Yang J F. Research progress on the relationship between myocardial energetic metabolism and heart failure[J]. Chin J Cardiol, 2022, 50(4): 404-9. |
| [2] |
Tran D H, Wang Z V. Glucose metabolism in cardiac hypertrophy and heart failure[J]. J Am Heart Assoc, 2019, 8(12): e012673. doi:10.1161/JAHA.119.012673 |
| [3] |
Nakano H, Fajardo V M, Nakano A. The role of glucose in physiological and pathological heart formation[J]. Dev Biol, 2021, 475: 222-33. doi:10.1016/j.ydbio.2021.01.020 |
| [4] |
Ho K L, Zhang L, Wagg C, et al. Increased ketone body oxidation provides additional energy for the failing heart without improving cardiac efficiency[J]. Cardiovasc Res, 2019, 115(11): 1606-16. doi:10.1093/cvr/cvz045 |
| [5] |
Karwi Q G, Uddin G. M, Ho K. L, et al. Loss of metabolic flexibility in the failing heart[J]. Front Cardiovasc Med, 2018, 5: 68. doi:10.3389/fcvm.2018.00068 |
| [6] |
Shanmugam G, Wang D, Gounder S S, et al. Reductive stress causes pathological cardiac remodeling and diastolic dysfunction[J]. Antioxid Redox Signal, 2020, 32(18): 1293-312. doi:10.1089/ars.2019.7808 |
| [7] |
Wang X Y, Huang G Y, Lian F Z, et al. Protective effect of Xin-Ji-Er-Kang on cardiovascular remodeling in high-salt induced hypertensive mice: role ofoxidative stress and endothelial dysfunction[J]. Biomed Pharmacother, 2019, 115: 108937. doi:10.1016/j.biopha.2019.108937 |
| [8] |
He Y, Huang W, Zhang C, et al. Energy metabolism disorders and potential therapeutic drugs in heart failure[J]. Acta Pharm Sin B, 2021, 11(5): 1098-116. doi:10.1016/j.apsb.2020.10.007 |
| [9] |
Cao T, Liccardo D, LaCanna R, et al. Fatty acid oxidation promotes cardiomyocyte proliferation rate but does not change cardiomyocyte number in infant mice[J]. Front Cell Dev Biol, 2019, 7: 42. doi:10.3389/fcell.2019.00042 |
| [10] |
Sun L J, Wang X Y, Xia J, et al. Xin-Ji-Er-Kang protects heart from ischemia-reperfusion injury by rebalancing lipid metabolism[J]. Front Pharmacol, 2022, 13: 981766. doi:10.3389/fphar.2022.981766 |
| [11] |
Nyberg M, Jones A. M. Matching of O(2) utilization and O(2) delivery in contracting skeletal muscle in health, aging, and heart failure[J]. Front Physiol, 2022, 13: 898395. doi:10.3389/fphys.2022.898395 |
| [12] |
Fernandez-Caggiano M, Kamynina A, Francois A. A, et al. Mitochondrial pyruvate carrier abundance mediates pathological cardiac hypertrophy[J]. Nat Metab, 2020, 2(11): 1223-31. doi:10.1038/s42255-020-00276-5 |
| [13] |
Kutsche H S, Schreckenberg R, Weber M, et al. Alterations in glucose metabolism during the transition to heart failure: the contribution of Ucp-2[J]. Cells, 2020, 9(3). |
| [14] |
Kurian J, Yuko A. E, Kasatkin N, et al. Uncoupling protein 2-mediated metabolic adaptations define cardiac cell function in the heart during transition from Young to Old Age[J]. Stem Cells Transl Med, 2021, 10(1): 144-56. doi:10.1002/sctm.20-0123 |
| [15] |
Noordali H, Loudon B L, Frenneaux M P, et al. Cardiac metabolism - a promising therapeutic target for heart failure[J]. Pharmacol Ther, 2018, 182: 95-114. doi:10.1016/j.pharmthera.2017.08.001 |
| [16] |
Umbarawan Y, Syamsunarno M, Koitabashi N, et al. Glucose is preferentially utilized for biomass synthesis in pressure-overloaded hearts: evidence from fatty acid-binding protein-4 and -5 knockout mice[J]. Cardiovasc Res, 2018, 114(8): 1132-44. doi:10.1093/cvr/cvy063 |
| [17] |
Horton J L, Davidson M T, Kurishima C, et al. The failing heart utilizes 3-hydroxybutyrate as a metabolic stress defense[J]. JCI Insight, 2019, 4(4). |
| [18] |
Kumar A A, Kelly D P, Chirinos J. A. Mitochondrial dysfunction in heart failure with preserved ejection fraction[J]. Circulation, 2019, 139(11): 1435-50. doi:10.1161/CIRCULATIONAHA.118.036259 |
| [19] |
Karwi Q G, Zhang L, Altamimi T R, et al. Weight loss enhances cardiac energy metabolism and function in heart failure associated with obesity[J]. Diabetes Obes Metab, 2019, 21(8): 1944-55. doi:10.1111/dom.13762 |
| [20] |
Tong M, Zablocki D, Sadoshima J. The role of Drp1 in mitophagy and cell death in the heart[J]. J Mol Cell Cardiol, 2020, 142: 138-45. doi:10.1016/j.yjmcc.2020.04.015 |
| [21] |
Kenny H C, Abel E D. Heart failure in type 2 diabetes mellitus[J]. Circ Res, 2019, 124(1): 121-41. doi:10.1161/CIRCRESAHA.118.311371 |
| [22] |
刘涛, 李晶, 鲍翠玉. 线粒体损伤与糖尿病心肌病发病关系的研究进展[J]. 中国药理学通报, 2018, 34(4): 456-8. Liu T, Li J, Bao C Y. Research progress of mitochondria in diabetic cardiomyopathy[J]. Chin Pharmacol Bull, 2018, 34(4): 456-8. |
| [23] |
O'Rourke B, Ashok D, Liu T. Mitochondrial Ca(2+) in heart failure: not enough or too much?[J]. J Mol Cell Cardiol, 2021, 151: 126-34. doi:10.1016/j.yjmcc.2020.11.014 |
| [24] |
Bauer T M, Murphy E. Role of mitochondrial calcium and the permeability transition pore in regulating cell death[J]. Circ Res, 2020, 126(2): 280-93. doi:10.1161/CIRCRESAHA.119.316306 |
| [25] |
Ling X X, Chen H, Fu B B, et al. Xin-Ji-Er-Kang protects myocardial and renal injury in hypertensive heart failure in Mice[J]. Phytomedicine, 2021, 91: 153675. doi:10.1016/j.phymed.2021.153675 |
| [26] |
Chaanine A H, Joyce L D, Stulak J M, et al. Mitochondrial morphology, dynamics, and function in human pressure overload or ischemic heart disease with preserved or reduced ejection fraction[J]. Circ Heart Fail, 2019, 12(2): e005131. doi:10.1161/CIRCHEARTFAILURE.118.005131 |
| [27] |
李珂娟, 陈建淑, 李勇男, 等. Parkin泛素化调节线粒体稳态在心血管疾病中的研究进展[J]. 中国药理学通报, 2024, 40(2): 224-8. Li K J, Chen J S, Li Y N, et al. Research progress of Parkin protein regulating mitochondrial homeostasis through ubiquitination in cardiovascular diseases[J]. Chin Pharmacol Bull, 2024, 40(2): 224-8. |
| [28] |
Jimenez-Gonzalez S, Marin-Royo G, Jurado-Lopez R, et al. The crosstalk between cardiac lipotoxicity and mitochondrial oxidative stress in the cardiac alterations in diet-induced obesity in rats[J]. Cells, 2020, 9(2). |
| [29] |
Kim S, Song J, Ernst P, et al. Mitoq regulates redox-related noncoding rnas to preserve mitochondrial network integrity in pressure-overload heart failure[J]. Am J Physiol Heart Circ Physiol, 2020, 318(3): H682-95. doi:10.1152/ajpheart.00617.2019 |

