

2. 赣南医科大学药学院,江西 赣州 341000;
3. 中国医学科学院药物研究所 神经科学中心,天然药物活性物质与功能国家重点实验室,北京 100050
陈乃宏(1961-),男,研究员,博士生导师,研究方向:神经药理学,通信作者,E-mail: chennh@imm.ac.cn
2. School of Pharmacy, Ganzhou Medical University, Ganzhou, Jiangxi 341000, China;
3. State Key Laboratory of Bioactive Substances and Functions of Natural Medicines, Institute of Materia Medica & Neuroscience Center, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
缺血性脑卒中(ischemic stroke,IS)是导致我国人民死亡和残疾的主要疾病之一,病理表现为局部区域脑血流被突然剥夺后脑组织的破坏。临床上治疗IS关键致力于尽早实现血管再通[静脉注射组织型纤溶酶原激活剂(tissue-type plasminogenactivator,t-PA)溶栓和/或机械取栓],以挽救缺血区的神经元。受血管再通治疗时间窗口窄的限制,患者从中获益极其有限[1]。因此,国内外学者长期致力于阐明IS复杂的病理机制,探寻减轻缺血后神经功能损伤的潜在治疗靶点和有效且受限少的诊疗措施。
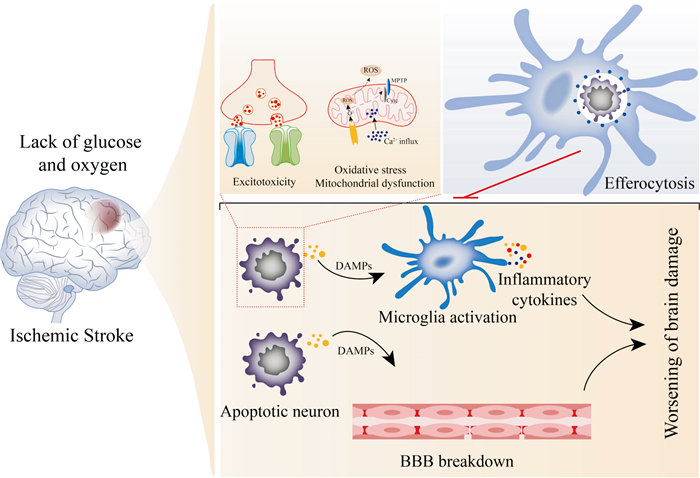
IS发生后,缺血缺氧引起的兴奋性毒性,氧化应激和线粒体功能障碍导致大量神经元凋亡[2]。垂死或凋亡的神经元会继发性坏死,不受控制地释放细胞内分子,这些关键的细胞内分子称为损伤相关分子模式(damage-associated molecular patterns,DAMPs)。DAMPs参与诱导神经炎症,促进血脑屏障破坏,募集外周炎性细胞,进而加重脑损伤。及时清除垂死或凋亡的神经元,防止其进一步继发性坏死,有助于减少脑内微环境中DAMPs和细胞碎片的聚集,缓解神经炎症[3]。小胶质细胞作为卒中后第一反应者,会被迅速激活并迁移至缺血区域,发挥胞葬作用。胞葬作用是特指吞噬细胞在凋亡细胞(apoptotic cells,ACs)发生坏死和释放DAMPs之前将其吞噬清除的过程,由de Cathelinea等[4]于2003年首次提出,用于区别传统的吞噬作用。近年来,许多研究表明小胶质细胞胞葬作用在IS后脑损伤的发生、发展和结局中起着至关重要的作用,适当的胞葬作用能够及时有效地清除ACs,减轻神经炎症反应,改善卒中预后(Fig 1)。如果能够从小胶质细胞胞葬作用调控机制着手,找到关键的治疗靶标,对后续的药物研发具有重要参考价值。本文首先总结了小胶质细胞胞葬作用的相关通路和调节机制,其次概述了小胶质细胞胞葬作用与IS二者之间的关系,最后综述了针对脑缺血后小胶质细胞胞葬作用的潜在治疗方法的研究进展。
|
| Fig 1 Clearance of apoptotic neurons by microglial efferocytosis attenuates acute neuroinflammation and diminishes brain injury |
正常生理状态下,机体清除ACs的效率和能力非常高,以维持内稳态[5]。在解决病理的过程中,大量细胞经历死亡。一方面,广泛的损伤,例如烫伤、机械性损伤或化学性损伤,致使细胞经历坏死,细胞内物质释放到组织微环境中,激活炎症免疫途径,最终导致周围的健康细胞受损和组织破坏。另一方面,炎症微环境下吞噬细胞的吞噬功能障碍,导致死亡细胞无法被及时清除,大量死细胞堆积,DAMPs的释放和细胞碎片持续刺激固有免疫系统,诱导大量炎性介质产生,进一步危害细胞,加重组织损伤[6]。
胞葬作用,即ACs的清除,是正常生理条件下机体维持组织内稳态和疾病后恢复内稳态的重要过程[7]。胞葬作用主要由专业吞噬细胞(如巨噬细胞、树突状细胞和小胶质细胞)完成,也可以少部分由非专业吞噬细胞(如肠上皮细胞、内皮细胞和星形胶质细胞)完成。胞葬作用的破坏会导致不同器官的众多疾病的恶化[6]。小胶质细胞作为中枢神经系统驻留的唯一专业吞噬细胞,在维持脑内稳态中发挥着关键作用,其胞葬作用失常严重影响着阿尔茨海默症、帕金森病、脑卒中等神经退行性疾病的发展和结局。神经元相较于胶质细胞和脑内其它细胞更为脆弱,在急性缺血损伤后较早出现功能障碍以及更快走向死亡[8]。因此,本文关注小胶质细胞对凋亡神经元的胞葬作用。小胶质细胞胞葬作用过程可分为发现AC、结合AC、内化和降解AC 3个阶段。
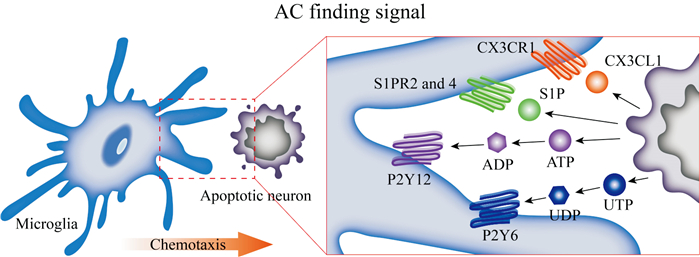
1.1 AC发现信号小胶质细胞实施胞葬作用的第一步是定位和找到吞噬目标,这个过程依赖于AC发现信号。细胞凋亡由细胞内应激的线粒体途径(内源性凋亡)或细胞外刺激激活细胞膜表面上的死亡受体(外源性凋亡)触发。内源性凋亡主要受抗凋亡和促凋亡的B细胞淋巴瘤因子2(B cell lymphoma 2,BCL-2)家族蛋白动态调控[9],包括BCL-2、BCL-xL、BCL-2相关X蛋白、BCL-2拮抗剂/杀手等。目前已知的介导外源性凋亡的死亡受体包括肿瘤坏死家族成员,例如肿瘤坏死因子-ɑ受体1(tumor necrosis factor-alpha receptor 1),CD95(也称为Fas受体)和肿瘤坏死因子相关的凋亡诱导配体(TNF-related apoptosis-inducing ligand)受体,它们被激活后募集接头蛋白,随后与caspase 8结合并激活caspase 3和caspase 7,允许凋亡[10]。凋亡过程中,细胞通过释放细胞膜脂代谢产物,例如1-磷酸鞘氨醇(sphingosine1-phosphate,S1P)、核苷酸(腺苷三磷酸(adenosine triphosphate,ATP)和尿苷三磷酸(uridine triphosphate,UTP)以及趋化因子(如C-X3-C-基元配体1(chemokine C-X3-C-motif ligand 1,CX3CL1)等AC发现信号至细胞外环境中,招募吞噬细胞并刺激其胞葬潜能(Fig 2)。
|
| Fig 2 AC finding signals involved in microglial efferocytosis |
S1P是一种具有多种生物活性的溶血磷脂,能够与5种不同的G蛋白偶联受体(S1PR1-5)结合,广泛参与淋巴细胞运输、小胶质细胞活化、神经元凋亡和内皮屏障功能调节等生物过程。鞘氨醇激酶1(sphingosine kinase 1,SPHK1)和SPHK2在神经元凋亡后表达上调,使鞘磷脂磷酸化产生S1P[11]。ACs释放S1P至周围环境,通过与表达于小胶质细胞上的S1PR2和S1PR4受体结合,帮助小胶质细胞找到吞噬对象,介导AC发现信号。值得注意的是,S1P参与调控小胶质细胞胞葬作用,除了介导AC发现信号外,还作为小胶质细胞表面的髓系细胞触发受体2(triggering receptor expressed on myeloid cells-2,Trem2)的内源性配体,介导AC结合信号,促进小胶质细胞吞噬凋亡神经元[12]。
细胞外的ATP和UTP来源途径主要有两种:(1)作为神经递质由活跃的神经元突触释放;(2)凋亡或应激细胞通过泛连接蛋白-1(Pannexin-1)通道释放。ATP被凋亡神经元释放到细胞外并迅速转化为腺苷二磷酸(adenosine diphosphate,ADP),通过激活小胶质细胞上的嘌呤P2Y12(P2Y purinoceptor 12)受体,趋化小胶质细胞向凋亡神经元迁移。P2Y12受体似乎也介导了小胶质细胞向突触的募集,敲除P2Y12受体延迟了依赖于小胶质细胞的突触修剪[13]。近期研究发现,正常生理状态下小胶质细胞对神经元的监视和保护作用与神经元突触持续释放的ATP和小胶质细胞上P2Y12受体建立的神经元-小胶质细胞连接密切相关[14]。同样地,细胞外UTP也会迅速转化为尿苷二磷酸(uridine diphosphate,UDP),激活对应的嘌呤P2Y6受体,帮助小胶质细胞找到吞噬目标。
CX3CL1及其受体是一组趋化小胶质细胞向凋亡神经元迁移的经典AC发现信号。小胶质细胞利用趋化因子C-X3-C-基元受体1(chemokine CX3C motif receptor 1,CX3CR1)与细胞外环境中的凋亡神经元来源的CX3CL1结合找到吞噬目标。趋化因子的趋化功能与AC发现信号介导的趋化作用高度一致,越来越多的研究表明,除了趋化因子CX3CL1以外,还有许多潜在的趋化因子参与介导AC发现信号,例如C-C基元配体12(chemokine C-C-motif ligand 12,CCL12)、CCL21和趋化因子C-X-C-基元配体10(chemokine C-X-C-motif ligand 10)能够与ACs及凋亡泡表面外翻的磷脂酰丝氨酸(phosphatidylserine,PS)结合,然后通过吞噬细胞上相应的受体发挥趋化作用[15]。
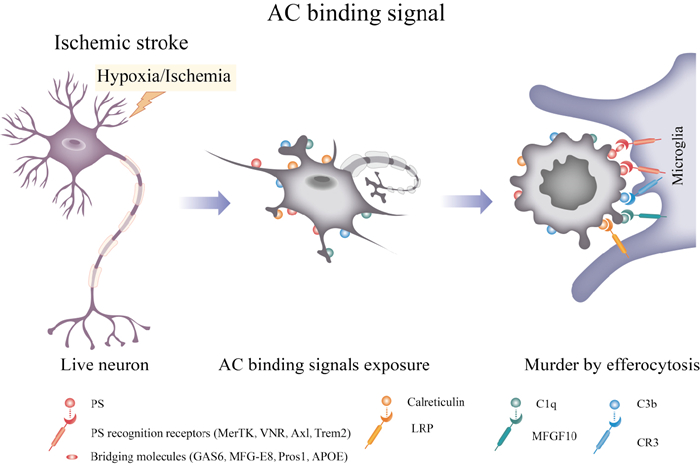
1.2 AC结合信号小胶质细胞通过AC发现信号趋化靠近凋亡神经元后,需要进一步精确地识别吞噬对象,这依赖于ACs表面显示的AC结合信号(Fig 3)。PS是研究最为广泛和被认为最具潜力的AC结合信号。在健康活细胞中,磷脂酰丝氨酸被翻转酶(p4型ATP酶)以ATP依赖的方式限制于质膜的内小叶[16],ATP8A1和ATP8A2是目前发现表达在脑内的两种P4型ATP酶。细胞经历凋亡时,活化的Caspase 3使p4型ATP酶裂解失活,同时Caspase 3还会激活磷脂混杂酶XK相关蛋白8(XK-related protein 8),最终导致细胞膜磷脂不对称性丧失,将PS暴露于细胞表面,发出凋亡信号。吞噬细胞表面上的PS识别受体通过或不通过桥接分子与PS结合,吞噬ACs。有趣地是,健康细胞中的PS在钙离子激活的磷脂混杂酶跨膜蛋白16F(transmembrane protein 16F,TMEM16F)的作用下也会出现短暂暴露于细胞外叶。短暂暴露PS的健康细胞不会被吞噬,而缺乏功能性p4型ATP酶的健康细胞经历PS暴露事件则会被迅速吞噬,这表明P4型ATP酶能够积极阻止吞噬[17]。小胶质细胞利用暴露的PS识别和结合凋亡神经元的分子机制已被广泛综述[18],可总结简述为以下两种方式:(1)由小胶质细胞表面的Trem2或G蛋白偶联受体56(G-protein coupled receptor 56,GPR56)直接与PS结合;(2)小胶质细胞表面受体Mer酪氨酸蛋白激酶(Mer tyrosine-protein kinase,MerTK),玻璃连接蛋白受体(vitronectin receptor,VNR),酪氨酸激酶Axl和Trem2分别在桥接分子生长抑制特异性蛋白6(growth arrest-specific gene 6,GAS6),乳脂球表皮生长因子-8(milk fat-globule epidermal growth factor 8,MFG-E8),蛋白S(protein S,Pros1)和载脂蛋白E(apolipoprotein E,APOE)的帮助下间接与PS结合。
|
| Fig 3 AC binding signals involved in microglial efferocytosis |
除了PS介导AC结合信号外,钙网蛋白和补体1q(complement 1q,C1q)、补体3b(complement 1q,C3b)也参与小胶质细胞识别凋亡神经元的过程[19]。当神经元受到缺血应激并发生凋亡时,钙网蛋白会从内质网易位到细胞表面,结合小胶质细胞上的低密度脂蛋白受体相关蛋白(low-density lipoprotein receptor-related protein,LRP),随后被胞葬作用清除。补体成分C3在转化酶的作用下能够生成C3a和C3b,C3b及其受体CR3介导ACs的清除。C1q能够与ACs表面去唾液酸糖蛋白结合,经小胶质细胞的表皮生长因子样蛋白10(multiple epidermal growth factor like domains 10,MEGF-10)受体形成AC结合信号,促进胞葬作用。此外,C1q还能作为ACs膜调理素,细胞膜经C1q调理后,钙网蛋白更易结合于ACs表面,促进钙网蛋白-LRP依赖的胞葬作用。
1.3 AC的内化和降解小胶质细胞在AC结合信号的介导下识别凋亡神经元后,依靠快速的质膜重组和合成完成进一步内化。肌动蛋白聚合允许质膜的内陷和局部扩张,是吞噬体的形成和有效捕获凋亡神经元的关键。调控该过程的机制集中于一个关键因子——属于Rho家族小GTP酶的Ras相关C3肉毒毒素底物1(Ras-related C3 botulinum toxin substrate 1,Rac1)[6]。Rac1具有两种不同的核苷酸结合形式以对应不同的两种状态:Rac1-GTP(活化态)和Rac1-GDP(非活化态)。Rac1-GDP在鸟苷酸交换因子的催化作用下,完成GDP-GTP交换而被激活。胞质分裂作用因子8(dedicator of cytokinesis 8,DOCK8),DOCK10,VAV1等鸟苷酸交换因子参与小胶质细胞Rac1-GTP调控的神经炎症和细胞迁移等过程[20-21]。
吞噬体形成的下一阶段是吞噬体的成熟,并最终在吞噬体和溶酶体的融合后完成降解。早期吞噬体的成熟需要RAB GTP酶家族成员RAB5的参与。RAB5如果功能丧失,将导致吞噬体成熟受阻。RAB5阳性的早期吞噬体能够招募III型磷脂酰肌醇激酶(phosphoinositide-3-kinase class 3,PIK3C3),它催化磷脂酰肌醇形成信号磷脂酰肌醇3磷酸(phosphatidylinositol 3 phosphate,PI3P)。在RAB5、PIK3C3、PI3P的共同作用下,早期吞噬体逐步成熟为晚期吞噬体,其生物标志物也随着RAB7的获得和RAB5的丢失发生改变。RAB7及其两个效应蛋白Rab相互作用蛋白(Rab-interacting lysosomal protein)和氧化固醇结合蛋白相关蛋白1(oxysterol-binding protein-related protein)与溶酶体相关膜蛋白1(lysosomal associated membrane protein 1,LAMP1)和LAMP2相互作用,促进吞噬体和溶酶体的融合[6]。二者融合后,新形成的吞噬溶酶体依赖于其高酸性(pH 4.5-5.0)和高活性的组织蛋白酶降解ACs。高酸环境本身有助于细胞尸体的降解,同时也是溶酶体酸水解酶发挥水解作用的重要条件。最终,吞噬溶酶体在高酸性和氧化剂、水解酶、脂肪酶等活性物质的帮助下,降解被内吞的ACs。
2 小胶质细胞胞葬作用与IS脑缺血后急性期,缺血缺氧导致小胶质细胞胞葬作用障碍,凋亡神经元不能被及时有效清除而继发性坏死,释放DAMPs和产生大量细胞碎片,持续刺激产生神经炎症。值得注意的是,卒中后小胶质细胞胞葬功能障碍并不仅仅发生于缺血损伤区,位于病变核心远端区域的海马齿状回,因小胶质细胞对ACs清除能力受损,致使该区域炎症反应较高,神经发生减少[22]。有研究报道,小鼠实施短暂性大脑中动脉阻断术(transient middle cerebral occlusion,tMCAO)手术后3 d内,连续使用P2Y6受体抑制剂MRS2578进行干预,降低小胶质细胞吞噬作用,会导致脑损伤加剧,神经功能缺陷恶化[23]。因此,在卒中后急性期,增强小胶质细胞胞葬作用可能是治疗IS的有效途径。
然而,缺血缺氧应激的尚可存活的神经元也会发出AC发现和AC结合信号,例如释放CX3CL1和短暂暴露PS等,被小胶质细胞吞噬清除,导致不必要的神经元丢失[24]。多数研究表明,小胶质细胞吞噬应激神经元导致神经元丢失主要发生在缺血半暗区,抑制该过程有助于卒中预后。在内皮素1诱导的局灶性脑缺血模型中,敲除PS识别信号MFG-E8或MerTK有助于改善长期运动功能障碍和减少脑萎缩,这可能与降低梗死周围区活神经元被吞噬有关[25]。敲低介导缺血后神经元PS短暂暴露的TMEM16F,可减少半暗带应激神经元的小胶质细胞吞噬,从而降低梗死面积促进功能恢复[26]。补体成分C3激活抑制剂B4Crry有效减少缺血性半暗带中应激但可挽救的神经元和突触的吞噬,限制出血转化,协同提高t-PA的安全性、有效性,并可改善卒中后认知功能[27]。上述研究表明,抑制小胶质细胞吞噬可挽救神经元,减少神经元丢失,有助于改善缺血性卒中病理状况。
3 靶向IS后小胶质细胞胞葬作用的治疗策略小胶质细胞在整个IS病程中扮演重要角色,胞葬作用作为其关键免疫调节功能,靶向调节小胶质细胞胞葬作用的药物研发越来越受到研究者的青睐。以下内容综述了近年来针对调节缺血后小胶质细胞胞葬作用的药物研究进展,希望能够为IS的药物研发提供一定的参考。
米诺环素是第二代四环素类抗生素,具有广谱抗菌作用。然而,近些年来研究者一直将关注点聚集于它的非抗生素特性上。米诺环素分子量(495 ku)小,高溶解性,以及能够有效透过血脑屏障,作用于中枢神经系统。最近发现米诺环素能够调节小胶质细胞功能,且已被证实可以减少局灶性脑缺血后梗死面积。卒中后早期使用米诺环素进行干预,显著减少CD68+小胶质细胞数量,而CD68作为小胶质细胞溶酶体标志物,能够反映小胶质细胞的胞葬能力,这表示米诺环素的抗缺血损伤能力可能是通过调节小胶质细胞胞葬作用达到的[28]。
他汀类药物是临床上最常用于降低患者血液总胆固醇的药物之一,这可能介导了它们降低脑卒中风险的作用。除降低胆固醇外,他汀类药物还被报道具有抗氧化、抗炎和免疫调节作用,以及一种与胆固醇无关的方式抑制小胶质细胞吞噬作用。他汀类药物在临床上和实验研究中表现出的IS后神经保护作用与其多效调节性密切相关。
FTY-720,一种S1P类似物。在大鼠tMCAO后两天内给予FTY-720治疗,能够显著增强小胶质细胞对缺血损伤后神经元的清除,减少脑梗死体积,改善神经功能[12]。FTY-720促IS后急性期小胶质细胞胞葬作用与其能够作为Trem2受体的配体,增强AC结合信号有关。FTY-720及其修饰物用于肌萎缩侧索硬化和多发性硬化等神经退行性疾病已进入临床前研究阶段,扩大其适应症应用于IS早期,改善卒中预后具有较大潜力。
中药成分是现代药物开发的巨大宝库,从中药天然产物中挖掘抗IS的药物极具潜力,例如从水芹籽分离的丁苯酞是我国脑血管病治疗领域第一个拥有自主知识产权的国家一类新药,可阻断IS所致脑损伤的多个病理环节,多靶点、多途径改善脑缺血临床症状。
红景天苷(salidroside,SAL)是活血化瘀药红景天(来源于景天科植物大花红景天Rhodiola crenulata [(Hook. f. et Thoms.) H. Ohba的干燥根和根茎]的主要有效成分,也是药典规定的红景天的中药质量生物标志物。SAL已被证实能够缓解多种疾病的炎症反应。有研究报道,SAL能够通过调节小胶质细胞极化和促进小胶质细胞胞葬作用,降低tMCAO小鼠脑梗死率并改善神经功能[29]。
拟人参皂苷F11(pseudoginsenoside F11,PF11)是西洋参特有的一种奥克梯隆型人参皂苷,具有心血管系统和神经系统保护作用。在永久性缺血卒中中,PF11主要通过调控介导AC结合信号的CR3,促进小胶质细胞的吞噬清除作用[30]。
4 结语小胶质细胞的胞葬作用在缺血性卒中中扮演双重作用的角色。一方面机体通过该作用清除凋亡神经元,防止继发性坏死,减少炎症;另一方面,小胶质细胞错误识别应激神经元为吞噬对象,导致缺血半暗区神经元不必要丢失。此外,小胶质细胞对脑缺血的反应根据病程进展分为急性期、亚急性期和慢性期,又可根据位置分为梗死核心区,梗死周围区和梗死远端区,不同时间不同区域小胶质细胞功能有着较大差别。因此,简单阻断或促进小胶质细胞胞葬作用不可取,重要的是提高小胶质细胞胞葬作用的同时,降低其吞噬活神经元的副作用。近年来,研究者们越来越关注小胶质细胞的胞葬作用在神经退行性疾病病理机制中发挥的重要功能。然而,基于现阶段小胶质细胞的胞葬作用在缺血卒中后病理进程中的具体机制仍未清晰,迫切需要阐明小胶质细胞胞葬作用在不同缺血卒中模型,发病后不同阶段、不同脑区的分子机制和信号通路。需要特别注意的是,无论是缺血后小胶质细胞的胞葬作用机制研究还是靶向小胶质细胞胞葬作用的药物研发,区分小胶质细胞的清除对象是死亡神经元还是应激可存活神经元十分重要。随着IS病理机制逐渐明晰,靶向小胶质细胞胞葬作用的药物进一步挖掘,相信在不久的未来将改变临床上针对IS的治疗策略匮乏的局面。
| [1] |
Mendelson S J, Prabhakaran S. Diagnosis and management of transient ischemic attack and acute ischemic stroke: a review[J]. JAMA, 2021, 325(11): 1088-98. doi:10.1001/jama.2020.26867 |
| [2] |
王漫漫, 张勇, 付雪琴, 等. 缺血性脑卒中神经元死亡机制[J]. 中国药理学通报, 2023, 39(9): 1627-32. Wang M M, Zhang Y, Fu X Q, et al. Mechanism of neuronal death in ischemic stroke[J]. Chin Pharmacol Bull, 2023, 39(9): 1627-32. doi:10.12360/CPB202204057 |
| [3] |
Fan P L, Wang S S, Chu S F, Chen N H. Time-dependent dual effect of microglia in ischemic stroke[J]. Neurochem Int, 2023, 169: 105584. doi:10.1016/j.neuint.2023.105584 |
| [4] |
de Cathelineau A M, Henson P M. The final step in programmed cell death: phagocytes carry apoptotic cells to the grave[J]. Essays Biochem, 2003, 39: 105-17. doi:10.1042/bse0390105 |
| [5] |
Doran A C, Yurdagul A J R, Tabas I. Efferocytosis in health and disease[J]. Nat Rev Immunol, 2020, 20(4): 254-67. doi:10.1038/s41577-019-0240-6 |
| [6] |
Boada-Romero E, Martinez J, Heckmann B L, Green D R. The clearance of dead cells by efferocytosis[J]. Nat Rev Mol Cell Biol, 2020, 21(7): 398-414. doi:10.1038/s41580-020-0232-1 |
| [7] |
Arandjelovic S, Ravichandran K S. Phagocytosis of apoptotic cells in homeostasis[J]. Nat Immunol, 2015, 16(9): 907-17. doi:10.1038/ni.3253 |
| [8] |
Lipton P. Ischemic cell death in brain neurons[J]. Physiol Rev, 1999, 79(4): 1431-568. doi:10.1152/physrev.1999.79.4.1431 |
| [9] |
Segawa K, Kurata S, Yanagihashi Y, et al. Caspase-mediated cleavage of phospholipid flippase for apoptotic phosphatidylserine exposure[J]. Science, 2014, 344(6188): 1164-8. doi:10.1126/science.1252809 |
| [10] |
Li H, Zhu H, Xu C J, Yuan J. Cleavage of BID by caspase 8 mediates the mitochondrial damage in the Fas pathway of apoptosis[J]. Cell, 1998, 94(4): 491-501. doi:10.1016/S0092-8674(00)81590-1 |
| [11] |
Zhang L, Dong Y, Wang Y, et al. Sphingosine-1-phosphate (S1P) receptors: promising drug targets for treating bone-related diseases[J]. J Cell Mol Med, 2020, 24(8): 4389-401. doi:10.1111/jcmm.15155 |
| [12] |
Xue T, Ji J, Sun Y, et al. Sphingosine-1-phosphate, a novel TREM2 ligand, promotes microglial phagocytosis to protect against ischemic brain injury[J]. Acta Pharm Sin B, 2022, 12(4): 1885-98. doi:10.1016/j.apsb.2021.10.012 |
| [13] |
Sipe G O, Lowery R L, Tremblay M è, et al. Microglial P2Y12 is necessary for synaptic plasticity in mouse visual cortex[J]. Nat Commun, 2016, 7: 10905. doi:10.1038/ncomms10905 |
| [14] |
Cserép C, Pósfai B, Lénárt N, et al. Microglia monitor and protect neuronal function through specialized somatic purinergic junctions[J]. Science, 2020, 367(6477): 528-37. doi:10.1126/science.aax6752 |
| [15] |
Pontejo S M, Murphy P M. Chemokines act as phosphatidylserine-bound "find-me" signals in apoptotic cell clearance[J]. PLoS Biol, 2021, 19(5): e3001259. doi:10.1371/journal.pbio.3001259 |
| [16] |
Nagata S, Sakuragi T, Segawa K. Flippase and scramblase for phosphatidylserine exposure[J]. Curr Opin Immunol, 2020, 62: 31-8. doi:10.1016/j.coi.2019.11.009 |
| [17] |
Segawa K, Yanagihashi Y, Yamada K, et al. Phospholipid flippases enable precursor B cells to flee engulfment by macrophages[J]. Proc Natl Acad Sci U S A, 2018, 115(48): 12212-7. doi:10.1073/pnas.1814323115 |
| [18] |
Butler C A, Popescu A S, Kitchener E J A, et al. Microglial phagocytosis of neurons in neurodegeneration, and its regulation[J]. J Neurochem, 2021, 158(3): 621-39. doi:10.1111/jnc.15327 |
| [19] |
Chen W, Zhang Y, Zhai X, et al. Microglial phagocytosis and regulatory mechanisms after stroke[J]. J Cereb Blood Flow Metab, 2022, 42(9): 1579-96. doi:10.1177/0271678X221098841 |
| [20] |
Wu L, Xue R, Chen J, Xu J. Dock8 deficiency attenuates microglia colonization in early zebrafish larvae[J]. Cell Death Discov, 2022, 8(1): 366. doi:10.1038/s41420-022-01155-6 |
| [21] |
Shah V B, Ozment-Skelton T R, Williams D L, Keshvara L. Vav1 and PI3K are required for phagocytosis of beta-glucan and subsequent superoxide generation by microglia[J]. Mol Immunol, 2009, 46(8-9): 1845-53. doi:10.1016/j.molimm.2009.01.014 |
| [22] |
Rudolph M, Schmeer C W, Günther M, et al. Microglia-mediated phagocytosis of apoptotic nuclei is impaired in the adult murine hippocampus after stroke[J]. Glia, 2021, 69(8): 2006-22. doi:10.1002/glia.24009 |
| [23] |
Wen R X, Shen H, Huang S X, et al. P2Y6 receptor inhibition aggravates ischemic brain injury by reducing microglial phagocytosis[J]. CNS Neurosci Ther, 2020, 26(4): 416-29. doi:10.1111/cns.13296 |
| [24] |
Brown G C, Neher J J. Microglial phagocytosis of live neurons[J]. Nat Rev Neurosci, 2014, 15(4): 209-16. doi:10.1038/nrn3710 |
| [25] |
Neher J J, Emmrich J V, Fricker M, et al. Phagocytosis executes delayed neuronal death after focal brain ischemia[J]. Proc Natl Acad Sci USA, 2013, 110(43): E4098-107. |
| [26] |
Zhang Y, Li H, Li X, et al. TMEM16F aggravates neuronal loss by mediating microglial phagocytosis of neurons in a rat experimental cerebral ischemia and reperfusion model[J]. Front Immunol, 2020, 11: 1144. doi:10.3389/fimmu.2020.01144 |
| [27] |
Alawieh A M, Langley E F, Feng W, et al. Complement-dependent synaptic uptake and cognitive decline after stroke and reperfusion therapy[J]. J Neurosci, 2020, 40(20): 4042-58. doi:10.1523/JNEUROSCI.2462-19.2020 |
| [28] |
Yew W P, Djukic N D, Jayaseelan J S P, et al. Early treatment with minocycline following stroke in rats improves functional recovery and differentially modifies responses of peri-infarct microglia and astrocytes[J]. J Neuroinflammation, 2019, 16(1): 6. doi:10.1186/s12974-018-1379-y |
| [29] |
Liu X, Wen S, Yan F, et al. Salidroside provides neuroprotection by modulating microglial polarization after cerebral ischemia[J]. J Neuroinflammation, 2018, 15(1): 39. doi:10.1186/s12974-018-1081-0 |
| [30] |
Liu Y, Wu C, Hou Z, et al. Pseudoginsenoside-F11 accelerates microglial phagocytosis of myelin debris and attenuates cerebral ischemic injury through complement receptor 3[J]. Neuroscience, 2020, 426: 33-49. doi:10.1016/j.neuroscience.2019.11.010 |

