

2. 硒资源研究与生物应用湖北省重点实验室,湖北 恩施 445000;
3. 中国中医科学院广安门医院,北京 100053
黄胜(1987-),男,博士,讲师,硕士生导师,研究方向:中医药防治肝病,通信作者,E-mail: hs19870604@163.com
2. Selenium Resocerces Research and Bioapplication Hubei Key Laboratory, Enshi Hubei 445000, China;
3. Guang'anmen Hospital, China Academy of Traditional Chinese Medicine, Beijing 100053, China
在全球范围内,原发性肝癌(primary liver cancer,PLC)是最常见的致命恶性肿瘤之一,是世界上第六大最常发生的癌症,也是癌症死亡的第三大常见原因[1]。世界卫生组织国际癌症研究机构于2020年发布的全球癌症数据报告中指出[2],2020年全球的癌症新发病例数约为1 930万,死亡病例数近1 000万,其中PLC发病例数约为91万,占比4.70%,死亡病例数约83万,占比8.30%。
目前,对PLC的有效治疗手段主要包括部分肝切除、肝脏移植和局部消融手术、放化疗、基因生物治疗为主,但是易产生多种副反应,部分患者身体难以耐受,加之手术治疗价格昂贵,患者经济负担较大,故其并非首选。如果仅采取支持对症治疗,患者的自然生存时间很短,严重地威胁患者的生命安全和生活质量。中医药具有中药多成分、多靶点的协同效应的特点。近些年,在中药中筛选疗效佳、副作用小且能显著治疗肝癌的药物已成为中医药研究的热点。因此,治疗肝癌具有明显疗效的正肝方的作用机制的阐明对推进该类疾病治疗及药物开发具有重要意义。
网络药理学(network pharmacology)是一门基于系统生物学、基因组学、蛋白组学等的学科理论,通过计算机大数据、人工智能等现代方法,构建疾病-表型-基因-药物多层网络的新兴学科。网络药理学的概念是2007年由Andrew L Hopkins教授首次提出,2011年由国人继续研发并提出基于“网络靶点”的模式,建立NIMS(Network target-based Identification of Multicomponent Synergy)的算法,Tao等[3]通过连接药物化合物、药理学、系统生物学以及基因组学进行网络重构,构建了“成分-靶点-疾病”网并进行了运用,初步预测出药物作用机制,基于网络药理学初步推测正肝方治疗肝癌的主要活性成分、核心蛋白靶点以及相关信号通路,为研究提供充足理论依据和技术支持。目前,关于正肝方治疗PLC的相关的分子机制研究较少,本研究旨在通过利用网络药理学的方法来预测正肝方治疗PLC的分子机制并通过动物实验来验证正肝方治疗PLC的有效性,从而探正肝方治疗PLC的可能的分子机制及提供些许循证依据。
1 材料与方法 1.1 实验材料HERB(http://herb.ac.cn/)、TCMSP(http://tcmspw.com/tcmsp.php/)、PubChem(http://pubchem.ncbi.nlm.nih.gov/)、Swiss ADME/Target Prediction(http://www.swisstargetprediction.ch/)、Uniport(https://www.uniprot.org/)、http://bidd.nusedu.sg/gooup/ttd/ttd.asp)、OMIM(http://www.omim.org/)、String(https://string-db.org/)、Gene Cards(https://www.genecards.org/)、Venny 2.1(https://bioinfogp.cnb.csic.es/tools/venny/)网站以及Cytoscape 3.8.2和R 4.1.3软件。
1.2 方法 1.2.1 正肝方药物成分检索与活性成分筛选基于TCMSP和HERB数据库收集正肝方(黄芪、丹参、白花蛇舌草、枸杞子、醋鳖甲、酒女贞子、醋三棱、醋莪术、重楼和川芎)十味中药所含有的化合物成分。限定参数口服生物利用度(oral bioavailability,OB)≥30%、类药性(drug-like property, DL)≥0.18进行筛选;通过Pubchem数据库查找药物的活性成分及其对应的SMILES号,并将SMILES号输入Swiss ADME数据库对有效活性成分进行初步筛选,利用Swiss Target Prediction数据库初步筛选后的活性成分进行靶点预测。
1.2.2 正肝方药物成分对应靶标数据库构建通过Uniprot蛋白数据库对筛选的靶点进行信息标准化的校对及删除重复值后即得到正肝方所有有效活性成分对应的靶点,将所选基因导入Cytoscape 3.8.2软件,绘制化合物成分与对应靶标网络图。
1.2.3 肝癌对应靶标网络构建以OMIM、TTD和Gene Cards数据库检索疾病“Liver Cancer”的靶点基因,其中Gene Cards数据库得到的“疾病Gene”信息以相关性分值(relevance score)连续取中位数至Relevance score≥10进行筛选相关的疾病靶点,合并4个数据库的靶点结果,删除重复值。
1.2.4 正肝方药物以及肝癌的Venn图的构建通过在通过韦恩图在线工具Venny 2.1进行取交集得到共同的靶点,即正肝方治疗肝癌的可能靶点,将药物活性成分靶点与疾病靶点取交集,得到药物与疾病的共有靶点。
1.2.5 正肝方药物-成分-靶点网络图的构建将交集靶点导入STRING网站,物种一栏选择为人类(Homo sapiens),勾选最高的可信度(highist confidence)≥0.9,隐藏空白靶点,其余参数设置为默认,得到PPI网络图,并将TSV文件导入Cytoscape V3.8.2软件统计蛋白质PPI数,计算Degree值,以平均Degree值的两倍进行筛选,得到核心靶点。
1.2.6 功能通路分析运用R 4.1.3软件及其相关的“org.Hs.eg.db” “enrichplot” “ggplot2”等安装包以及Metascape数据库对核心交集靶点进行GO功能与KEGG富集通路分析,筛选排名靠前的基因功能及通路,并对其进行可视化处理。
1.3 动物实验验证 1.3.1 实验动物与药物SD大鼠,雄性,SPF级,5周龄,体质量(200±20) g,共80只,购于辽宁长生生物技术股份有限公司,实验动物许可证号:SCXK(辽)2023-0001。动物实验方案经湖北民族大学伦理委员会批准,伦理审批号:2023-20号,所有实验程序均按照中国国家卫生研究院的实验动物护理和使用指南进行。
正肝方颗粒由黄芪50 g、丹参30 g、白花蛇舌草30 g、枸杞子30 g、醋鳖甲30 g、酒女贞子30 g、醋三棱10 g、醋莪术10 g、重楼10 g、川芎10 g十味中药组成,购自广东一方制药有限公司。
1.3.2 主要试剂和仪器DEN肝癌诱导剂,分子式(C2H5)2NNO,950 g·L-1,纯度>99%(批号:N0756),购自Sigma公司;0.9%NaCl购自Sigma公司;Western封闭液(批号:P0023B)、一抗稀释液(批号:AZ050)、二抗稀释液(批号:P0023D)、磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase, GAPDH)抗体(批号:AF1186)、辣根过氧化物酶标记的羊抗兔(批号:A0208)购自上海碧云天生物技术有限公司;半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3, Caspase-3)抗体(批号:19677-1-AP)购自武汉三鹰生物技术有限公司;B淋巴细胞瘤-2基因(B-cell lymphoma-2, Bcl-2)抗体(批号:26593-1-AP)、Bcl-2相关X蛋白(Bcl-2 associated X protein, Bax)抗体(批号:50599-2-Ig)购自美国Proteintech;ELC发光液,武汉科瑞有限公司;BCA蛋白浓度测定试剂盒(批号:E1WP201)购自南京恩晶生物科技有限公司。
全波长酶标仪(型号:1510-01611C)、凝胶成像系统FluorChemE凝胶成像系统(型号:A44116)购自美国ThermoFisherScientific公司;电泳及转膜系统(型号:B212AT04E)购自美国Bio-Rad公司; 高精度电子天平(型号:FA2004)购自北京赛多利斯科学仪器有限公司;高速冷冻离心机(型号:5811)购自德国Eppendorf公司;全自动组织匀浆仪(型号:MagNA Lyser)购自瑞士罗氏Roche公司。
1.3.3 药物配置饮片-冲剂剂量换算后,一副正肝方饮片冲剂质量为90.82 g,药物剂量按照成人与大鼠体表面积进行换算,90.82÷70×6.3≈8 g·kg-1,设高量组为成人剂量(8 g·kg-1),中、低剂量组分别为成人量的1/2倍(4.0 g·kg-1)和1/4倍(2.0 g·kg-1),分别用纯水溶解配成800 g·L-1、400 g·L-1、200 g·L-1中药冲剂。槐耳颗粒人的每日用量为60 g·d-1,换算大鼠人的等效剂量为60/70×6.3≈5.4 g·kg-1g,加入纯水配制成540 g·L-1混悬液。
1.3.4 建模及分组将60只SD雄性大鼠适应性喂养1周后进行实验分组,随机分为6组,分别为正常组、DEN组、阳性对照组(槐耳颗粒组)、正肝方低、中、高剂量组,每组10只。造模方式:采取DEN诱导法建立肝癌大鼠模型,除正常组大鼠按50 mL·kg-1剂量腹腔注射生理盐水外,其余各组大鼠第2~4周,每周2次腹腔注射12%的DEN,第5~12周,每周1次腹腔注射12%的DEN,注射体积均为50 mL·kg-1。第13~16周除正常组、DEN组大鼠按照按10 mL·kg-1灌胃纯水外,其余各组大鼠给予相应的药物剂量灌胃,正肝方低、中、高剂量组分别按照200 g·L-1、400 g·L-1、800 g·L-1浓度中药水剂,槐耳颗粒按照10 mL·kg-1大鼠体质量灌胃给药,1次/d。
1.3.5 相关蛋白表达检测将肝脏组织提取总蛋白后BCA试剂盒定量蛋白浓度,将提取好后的样本蛋白进行SDS-PAGE电泳;转膜,封闭;加入相应的一抗,一抗包括GAPDH(体积比1∶2 000,下同)为稀释比例(即蛋白抗体与抗体稀释液的比例,如1 μL抗体加入1 mL稀释液)。Bax(1∶2 000)、Bcl-2(1∶2 000)、Caspase-3(1∶1 000)于4 ℃冰箱孵育过夜;洗膜后加入二抗,室温孵化2 h,洗膜后加入ECL化学发光试剂,显影并用显色仪拍照;最后用ImageJ软件对相应蛋白条带进行灰度分析。
1.4 统计学处理数据分析采用SPSS统计软件(版本22.0),结果以x±s形式呈现。组间差异的比较通过单因素方差分析(One-way ANOVA)进行。多组间的比较同样采用单因素方差分析(One-way ANOVA),图形制作使用GraphPad Prism(版本9.0)。
2 结果 2.1 正肝方药物成分预测经过TCMSP和HERB数据库查询且Swiss ADME和Swiss Target Prediction平台筛选后,最终得到147个主要活性成分,获得正肝方药物253个靶点,按照重要程度,将前十的化学成分列举如下(Tab 1)。统计正肝方药物活性成分的出现频次,发现木犀草素(luteolin)、槲皮素(quercetin)、常春藤皂苷元(Hederagenin)、β-谷固醇(beta-sitosterol)这4种成分在正肝方中出现的次数最多。
| Drug | MOL ID | MOL Name |
| MOL001659 | Poriferasterol | |
| Baihuasheshecao | MOL001670 | 2-methoxy-3-methyl-9, 10-anthraquinone |
| MOL000098 | Quercetin | |
| MOL001494 | Mandenol | |
| Chuanxiong | MOL002135 | Myricanone |
| MOL002140 | Perlolyrine | |
| MOL001601 | 1, 2, 5, 6-tetrahydrotanshinone | |
| Danshen | MOL000006 | Luteolin |
| MOL007036 | 5, 6-dihydroxy-7-isopropyl-1, 1-dimethyl-2, 3-dihydrophenanthren-4-one | |
| Ezhu | MOL000296 | Hederagenin |
| MOL001323 | Sitosterol alpha1 | |
| Gouqizi | MOL003578 | Cycloartenol |
| MOL000098 | Quercetin | |
| MOL000211 | Mairin | |
| Huangqi | MOL000239 | Jaranol |
| MOL000098 | Quercetin | |
| MOL000358 | beta-sitosterol | |
| Nvzhenzi | MOL000006 | Luteolin |
| MOL000098 | Quercetin | |
| MOL001297 | trans-gondoic acid | |
| Sanleng | MOL000296 | Hederagenin |
| MOL000358 | beta-sitosterol | |
| CHEMBL205 | Carbonic anhydrase Ⅱ | |
| Chonglou | CHEMBL3594 | Carbonic anhydrase Ⅸ |
| CHEMBL3592 | Squalene monooxygenase | |
| CHEMBL3596077 | Alpha-(1, 3)-fucosyltransferase 7 |
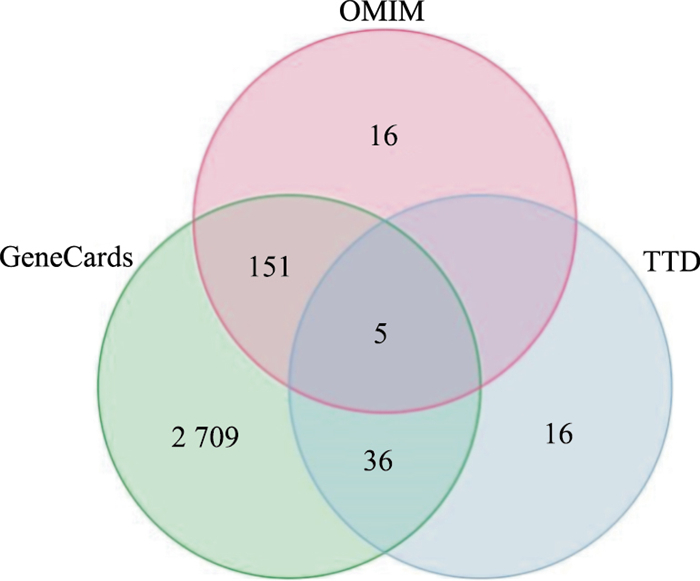
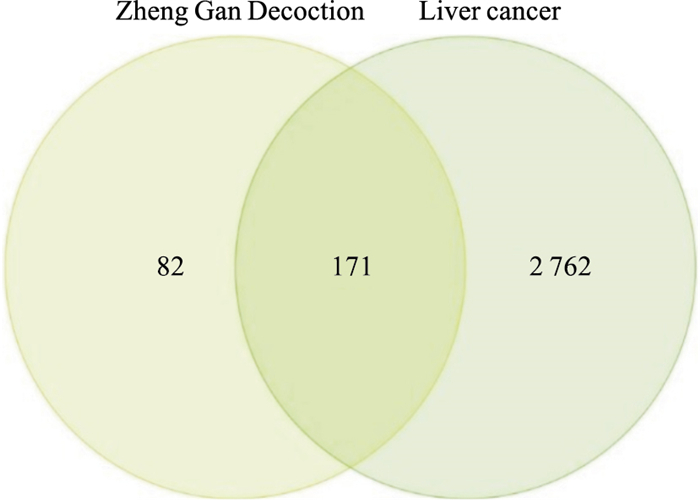
GeneCards数据库有2 901个靶点、OMIM数据库有172个靶点、TTP数据库有57个靶点,合并删除重复值后得到2 933个肝癌疾病靶点(Fig 1)。将肝癌靶基因与正肝方药物靶点取交集后,获正肝方药物活性成分靶点与疾病靶点的共同靶点共有171个,共有靶点可能是发挥抗肝癌的作用靶点(Fig 2)
|
| Fig 1 Weien diagram of liver cancer targets |
|
| Fig 2 Weien diagram of the differential targets of Zheng Gan Decoction and hepatocellular carcinoma |
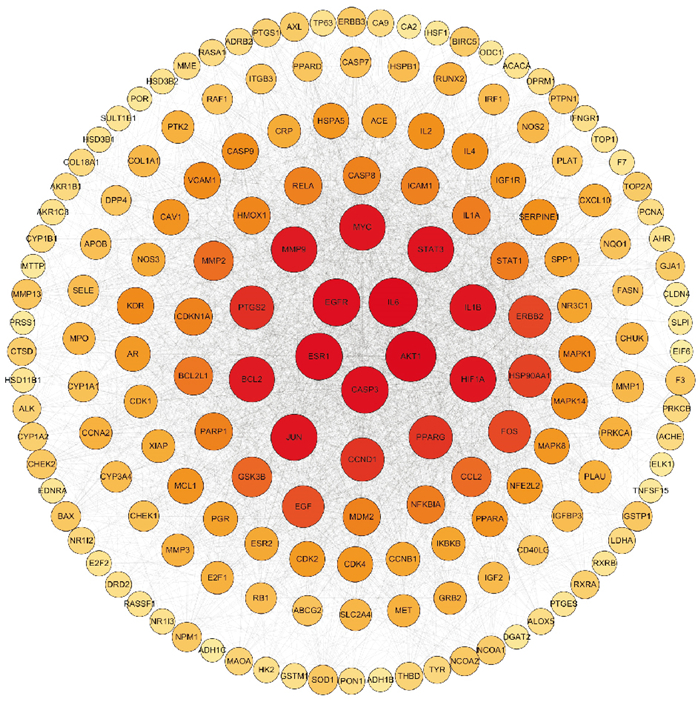
通过STRING数据库,对正肝方抗HCC的靶点进行蛋白互作分析,构建PPI网络,并筛选出重要靶点利用Cytoscape进行构建网络。如Fig 3所示,共有171个节点,3 882条边。通过网络拓扑分析筛选正肝方抗HCC的主要靶点,按照Degree值将靶点排序,数值越大,圆圈越大,颜色越深,处在内圈,由图可知CASP3、ESR1、EGFR、AKT1、IL6、BCL2、MYC、STAT3、PTGS2、JUN为位居前十的基因,可能成为正肝方抗肝癌的重要靶点(Fig 4)。

|
| Fig 3 PPI network diagram Degree value will target point sorting, the larger the value, the larger the circle, the darker the color, at the inner circle. |
|
| Fig 4 Core target network diagram |
将正肝方所有有效成分和该成分所对应的肝癌靶点导入Cytoscape软件,即可得出正肝方治疗肝癌的药物调控网的可视化图片(Fig 5)。

|
| Fig 5 Diagram of regulatory network of Zheng Gan Decoction-hepatocellular carcinoma system |
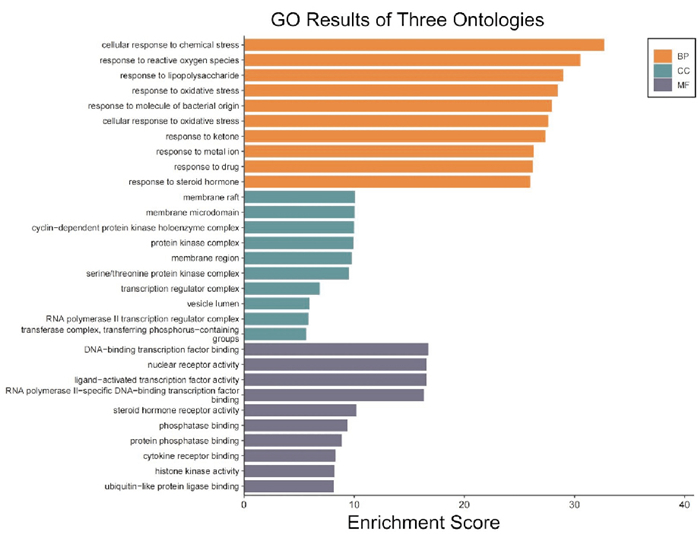
GO分析又分为生物过程(biological processes, BP)、细胞组分(cellular component, CC)与分子功能(molecular function, MF)。以P≤0.01为筛选条件,在GO生物功能注释分析结果中,筛选出BP富集条目4 232条,主要参与细胞凋亡信号通路的调节、小分子代谢过程的调控、氧化应激的反应、化学应激的反应以及药物的反应等;CC富集条目313条,主要涉及膜筏、膜区、转录调节复合物、蛋白激酶复合物、转移酶复合体以及含磷基团转移酶活性等;MF富集条目513条,主要集中在DNA结合转录因子、核受体活性、磷酸酶结合、泛素样蛋白连接酶结合以及蛋白质丝氨酸/苏氨酸激酶活性等。根据Log10(P)值进行排序,GO分析结果使用条形图展示(Fig 6)。
|
| Fig 6 GO enrichment analysis of intersecting targets of Zheng Gan Decoction and hepatocellular carcinoma |
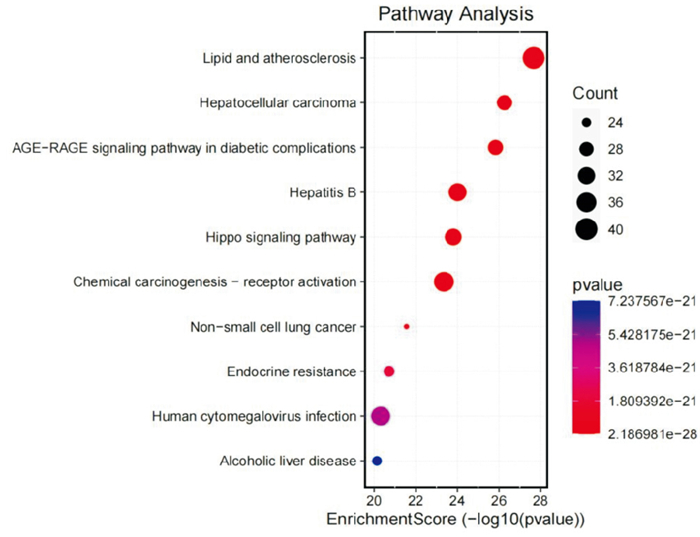
在KEGG通路富集分析结果中,共筛选出265条通路,包括肝细胞癌信号通路、非小细胞肺癌信号通路、酒精性肝病、乙型肝炎信号通路、化学致癌-受体激活、Hippo信号通路等,并通过气泡图进行展示见Fig 7。气泡颜色越深且面积越大,说明该通路越重要,由Fig 7可知,正肝方作用机制的相关靶点富集通路中癌症通路和肝病通路较为多见,预测正肝方具有显著的抗肝癌活性。正肝方活性成分抗肿瘤靶点信号通路为凋亡通路,核心蛋白为Bcl-2、Bax、caspase-3。下面将进行动物实验验证正肝方对相关核心凋亡蛋白的影响。
|
| Fig 7 KEGG enrichment of anti-tumor targets of active ingredients of Zheng Gan Decoction |
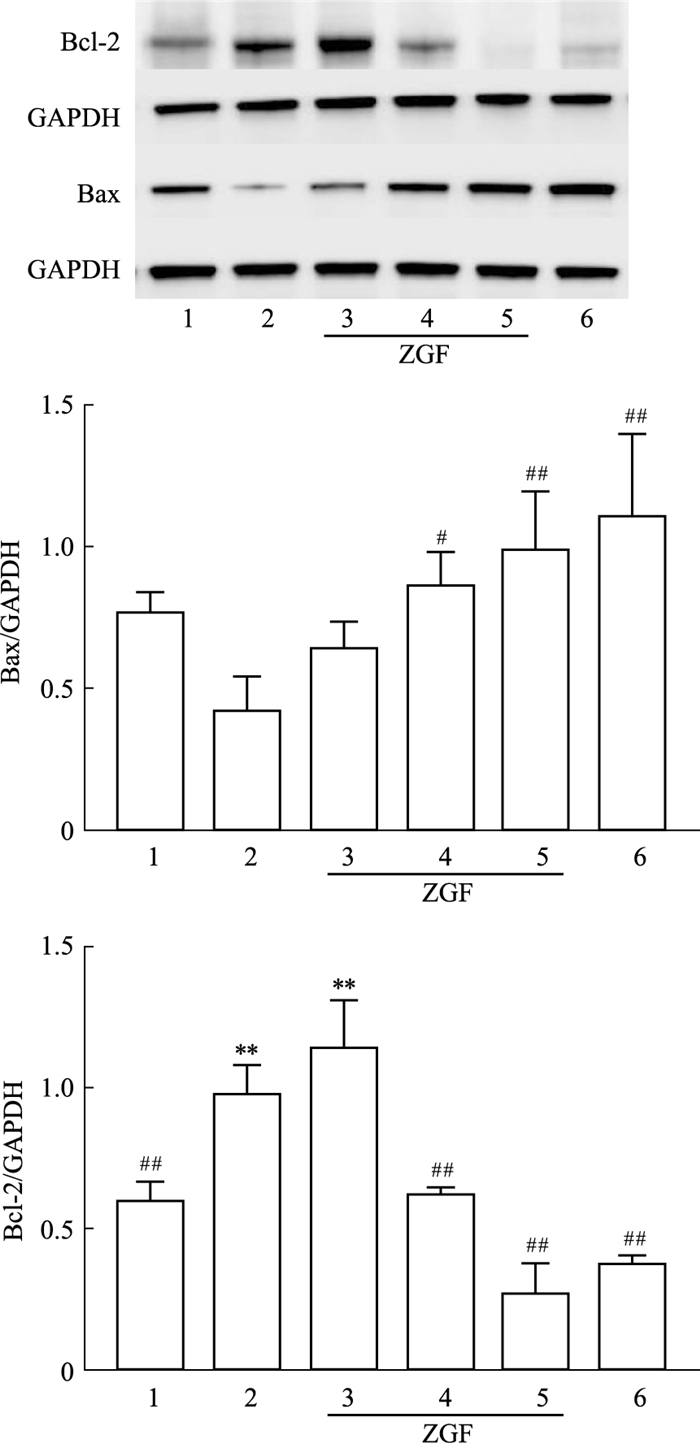
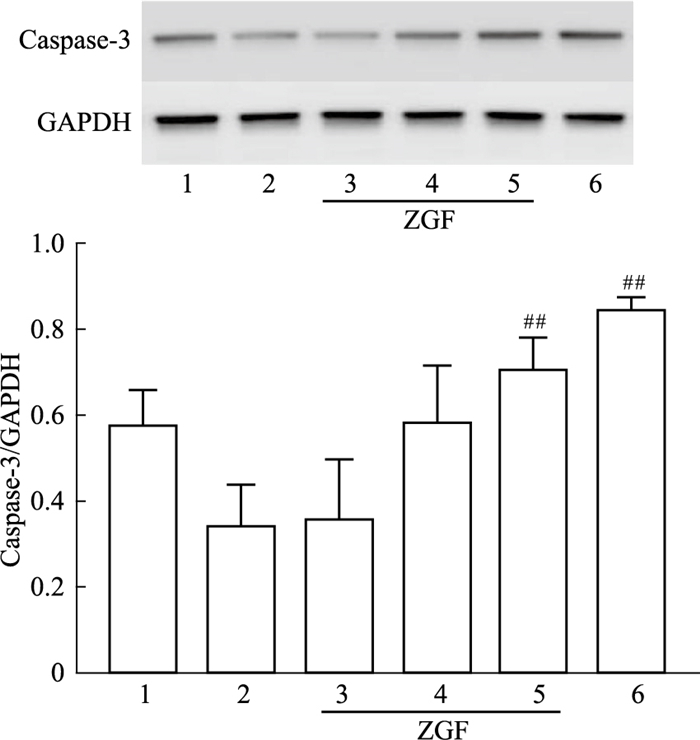
Bcl-2、Bax、Caspase-3蛋白在细胞凋亡的过程中发挥着重要作用。为了深入研究正肝方对肝癌的作用,我们进一步对凋亡关键蛋白进行了验证,采用Western blot检测凋亡蛋白Bcl-2、Bax、Caspase-3表达量的变化,如Fig 8, 9所示,结果表明,与模型对照组比较,正肝方各剂量组及槐耳阳性对照组肝癌组织中Bax和Caspase-3蛋白表达水平均明显升高(P<0.01),且随着正肝方剂量的增加而增加,具有剂量相关性;Bcl-2蛋白表达水平均明显降低(P<0.01),其中在正肝方高剂量组和阳性对照组中表现极为显著(P<0.01)。
|
| Fig 8 Effect of Zheng Gan Decoction on levels of apoptotic protein Bcl-2 and Bax protein in liver tissue of DEN-induced hepatocellular carcinoma rats 1:Normal control; 2:Model; 3:Low dose; 4:Middle dose; 5:High dose; 6:Active control. **P<0.01 vs the Normal control group; #P<0.05, ##P<0.01 vs the Model group |
|
| Fig 9 Effect of Zheng Gan Decoction on protein level of apoptotic protein caspase-3 in liver tissue of rats with DEN-induced hepatocellular carcinoma 1:Normal control; 2:Model; 3:Low dose; 4:Middle dose; 5:High dose; 6:Active control. **P<0.01 vs the Normal control group; #P<0.05, ##P<0.01 vs the Model group. ##P<0.01 vs the Model group |
正肝方是杨大国教授经过50余年的临床验证,针对肝癌多由“机体正气不足,气滞、血瘀、痰浊、热毒互结而成”的中医病因病机创建的经验方。杨教授多以此方为基础方,结合患者个体病证来加减化裁辨证论治,临床上多用于慢性肝炎、肝纤维化、肝硬化、肝癌前病变等疾病,效若桴鼓。课题组前期研究正肝方对DEN诱导的肝癌前病变大鼠的影响,研究表明正肝方一定程度上可以改善肝功能指标,缓解肝癌前病变状况[4]。
通过网络药理学方法,我们得出正肝方有147个主要活性成分,253个重要靶点基因,肝癌疾病有2 933个靶点,取交集药物与疾病的共同靶点有171个。正肝方治疗肝癌可能是通过木犀草素、槲皮素、β-谷固醇、常春藤皂苷元等主要活性成分。通过PPI蛋白相互作用网络,我们发现CASP3、Bcl-2、AKT1、IL6等为正肝方抗肝癌的核心蛋白靶点。GO分析主要参与细胞凋亡信号通路的调节、化学应激的反应、转录调节复合物、蛋白激酶复合物以及泛素样蛋白连接酶结合等。通过KEGG通路富集,共筛选出265条通路,分为参与各种癌症相关的信号通路以及参与各种肝病相关的信号通路,其中Hippo信号通路将是本课题的研究重点。
综合以上结果以及查阅相关文献,本课题组认为正肝方治疗肝癌的主要活性成分可能是木犀草素、槲皮素、常春藤皂苷元、β-谷固醇。木犀草素,化学名为3′,4′,5,7-四羟基黄酮,具有抗肿瘤、抗炎杀菌、抗氧化等多种药理作用。研究表明,木犀草素可以通过调控肿瘤细胞活性氧水平[5],抑制肿瘤细胞增殖,阻滞肿瘤细胞生长周期,上调Bax蛋白表达水平,降低Bcl-2蛋白表达水平,激活Caspase途径以及等其他多种机制从而诱导肝癌细胞凋亡,发挥抗肿瘤作用[6]。槲皮素,化学名为3,3′,4′,5,7-五羟基黄酮,具有抗氧化、抗病毒、抗肿瘤等作用,目前在肝癌、肺癌、乳腺癌、膀胱癌以及胃癌等多种肿瘤的发展中均有显著的抑制作用,并且临床上与多种化疗药物联用表现出良好的协同作用,具有多药耐药性[7]。通过用不同浓度的槲皮素(0~100 μmol·L-1)或槲皮素和5-FU联合处理,结果表明槲皮素通过诱导肝癌细胞凋亡和细胞周期阻滞来抑制肝癌细胞的增殖[8]。常春藤皂苷元,化学名为3β,4α-3,23-二羟基齐墩果-12-烯-28-酸。通过生信分析和动物实验,发现其可以通过抑制IL6蛋白的表达,激活PD-1/PD-L1和MAPK信号通路活性,调节B细胞受体、T细胞受体信号通路,抑制肝癌肿瘤免疫微环境的形成,从而达到抑制肝癌细胞增殖的作用[9]。
倪晓晨等[10]研究发现,α-常春藤皂苷元具有显著的抗肿瘤活性,可以通过激活Hippo通路,降低YAP的表达水平,抑制肝癌细胞SMMC-7721和HepG2增殖,促进肝癌细胞的凋亡。β-谷甾醇,化学名为(3β)-豆甾-5-烯-3-醇,在抗肿瘤方面有较好的作用,被广泛运用于癌症的预防和治疗方面。王凯等[11]探讨β-谷甾醇对肝癌细胞增殖的影响,发现其可能通过抑制CDC25B蛋白的表达来促进肝癌细胞的凋亡。
孙玉侠等[12]探讨消癌解毒方对肝癌小鼠肿瘤的影响,结果表明可以通过影响Bcl-2、Bax、Cleaved-caspase-3蛋白含量,促进肝癌细胞凋亡。刘燕等[13]通过探讨扁蒴藤素对DEN诱导大鼠肝细胞癌的作用机制,发现用药组通过调节Bax、cleaved-caspase-3、Bcl-2凋亡相关蛋白水平达到抗肿瘤的作用。说明这些凋亡相关研究肝癌的发生发展密切相关。
目前在国际上根据细胞宏观形态学变化将细胞死亡分为细胞坏死、细胞凋亡以及细胞程序性死亡三种方式。细胞凋亡是由于生长因子紊乱、内质网应激及DNA损伤等多种微环境的变化导致的一种主动死亡方式。细胞凋亡中,Bcl-2蛋白家族起关键作用,是研究最早也是最经典的调控细胞凋亡的家族,由于具有Bcl-2同源结构域(Bcl-2 homology domain,BH),共分为3个亚家族,包括BH1、BH2、BH3和BH4,其中BH1-4结构域由Bc1-2、Bcl-xl、Mc1-1等抗凋亡蛋白组成;BH1-3结构域由Bax、Bad、Bcl-xs等促凋亡蛋白组成。Bcl-2和Bax作为凋亡家族中最重要的调控蛋白,可以通过形成同源或异源二聚体来调节细胞凋亡。当Bax形成同源二聚体时诱导细胞凋亡,Bax与Bcl-2形成异源二聚体时则实现了Bcl-2抑制细胞凋亡的功能[14]。研究表明,Bcl-2蛋白家族可以通过调节线粒体的功能控制凋亡因子的释放[15]。
caspases是一个半胱氨酸依赖蛋白内切酶家族,具有进化保守性,在细胞凋亡调节中扮演着关键的角色。根据其结构一般分为3种类型,包括诱导凋亡启动子亚类、效应子亚类以及与炎症细胞因子相关亚类,其中Caspase-8、9、10位于的诱导凋亡的起始阶段;Caspase-3、6、7位于下游,可以直接诱发细胞凋亡[16]。而Caspase-3是Caspase级联反应下游最重要的凋亡蛋白,其激活在很大程度上依赖于细胞色素(cytochrome C,Cyt-c)的释放,Cyt-c是线粒体电子电子传递链上的一个主要组成部分,其从线粒体释放是凋亡启动的关键步骤。在正常生理条件下,Bax在OMM和胞质溶胶之间表现出静止的二聚体构象,线粒体代谢为平衡的状态,当促凋亡Bax蛋白在转录或翻译后被激活后,其发生二聚体寡聚化,从而改变线粒体通透性,促进Cyt-C释放到细胞质中,激活下游caspase级联反应,活化caspase-3,最终诱导细胞凋亡[17]。梁金凤等[18]研究钌多吡啶配合物的抗肝癌机制,发现钌配合物可以上调caspase-3活性表达,诱导Hep3B人肝癌细胞凋亡。
本研究通过借助中药复方网络药理学的研究,我们初步推测正肝方治疗肝癌可能是通过木犀草素、槲皮素、β-谷固醇、常春藤皂苷元等主要活性成分,通过caspase-3、Bcl-2、AKT1、IL6等核心蛋白靶点发挥抗肝癌的作用,并通过Western blot进行实验证实。
| [1] |
Li X, Ramadori P, Pfister D, et al. The immunological and metabolic landscape in primary and metastatic liver cancer[J]. Nat Rev Cancer, 2021, 21(9): 541-57. doi:10.1038/s41568-021-00383-9 |
| [2] |
Sung H, Ferlay J, Siegel R L, et al. Global Cancer Statistics 2020: Globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-49. doi:10.3322/caac.21660 |
| [3] |
Tao W, Xue X, Xia W, et al. Network pharmacology-based prediction of the active ingredients and potential targets of Chinese herbal Radix Curcumae formula for application to cardiovascular disease[J]. J Ethnopharmacol, 2013, 145(1): 1-10. doi:10.1016/j.jep.2012.09.051 |
| [4] |
孙童, 胡世平, 杨大国, 等. 正肝方对二乙基亚硝胺诱导的肝癌前病变模型大鼠肝组织PTEN/PI3K/AKT信号通路的影响[J]. 世界中西医结合杂志, 2023, 18(7): 1278-84, 1314. Sun T, Hu S P, Yang D G, et al. Effects of Zheng Liver Formula on PTEN/PI3K/AKT signalling pathway in rat liver tissue of diethylnitrosamine-induced hepatocellular carcinoma model[J]. World J Integ Tradit West Med, 2023, 18(7): 1278-84, 1314. |
| [5] |
Cho H J, Choi J Y, Kim W J, et al. Luteolin acts as a radiosensitizer in nonsmall cell lung cancer cells by enhancing apoptotic cell death through activation of a p38/ROS/caspase cascade[J]. Int J Oncol, 2015, 46(3): 1149-58. doi:10.3892/ijo.2015.2831 |
| [6] |
解举民, 段卓, 刘欣. 木犀草素抗肿瘤作用的研究进展[J/OL]. 肿瘤药学, (2023-08-02)[2024-01-31]. https://kns.cnki.net/kcms2/detail/43.1507.R.20230801.1713.010.html. Xie J M, Duan Z, Liu X. Progress in the study of antitumor effects of lignans[J/OL]. Anti-tumor Pharm, (2023-08-02)[2024-01-31]. https://kns.cnki.net/kcms2/detail/43.1507.R.20230801.1713.010.html. |
| [7] |
徐瑞雪, 王宇. 槲皮素抗肿瘤作用研究进展[J/OL]. 中成药, (2023-05-31)[2024-01-31]. https://kns.cnki.net/kcms2/detail/31.1368.R.20230530.1600.002.html. Xu R X, Wang Y. Progress of anti-tumor effects of quercetin[J/OL]. Chin Tradit Pat Med, (2023-05-31)[2024-01-31]https://kns.cnki.net/kcms2/detail/31.1368.R.20230530.1600.002.html. |
| [8] |
Hisaka T, Sakai H, Sato T, et al. Quercetin suppresses proliferation of liver cancer cell lines in vitro[J]. Anticancer Res, 2020, 40(8): 4695-700. doi:10.21873/anticanres.14469 |
| [9] |
崔文超, 刘明远, 关宝生, 等. 常春藤皂苷元调控IL-6抑制肝癌细胞增殖的免疫机制[J]. 中国免疫学杂志, 2023, 39(9): 1864-71. Cui W C, Liu M Y, Guan Y S, et al. Immune mechanism of ivy saponin element regulating IL-6 to inhibit hepatocellular carcinoma cell proliferation[J]. Chin J lmmunol, 2023, 39(9): 1864-71. doi:10.3969/j.issn.1000-484X.2023.09.013 |
| [10] |
倪晓晨, 姜晓敏, 于世龙, 等. α-常春藤皂苷抗肿瘤活性研究进展[J/OL]. 中华中医药学刊, 42, 2(2024): 60-3. Ni X C, Jiang X M, Yu S L, et al. Progress of anti-tumor activity of α-evergreen saponin[J/OL]. Chin J T C M, 42, 2(2024): 60-3. |
| [11] |
王凯, 李卫, 李志芳, 等. β-谷甾醇靶向CDC25B抑制肝癌细胞增殖[J]. 中山大学学报(医学科学版), 2022, 43(4): 675-84. Wang K, Li W, Li Z F, et al. β-Sitosterol targeting CDC25B inhibits hepatocellular carcinoma cell proliferation[J]. J Sun Yat-sen Univ(Med Sci), 2022, 43(4): 675-84. |
| [12] |
孙玉侠, 吴勉华, 孙莎莎, 等. 基于蛋白组学探讨消癌解毒方通过IL-6/TNF-α/STAT3通路抑制肝癌小鼠肿瘤生长的作用机制[J]. 中药新药与临床药理, 2023, 34(11): 1505-13. Sun Y M, Wu M Q, Sun S S, et al. Proteomics-based investigation on the mechanism of tumor growth inhibition in hepatocellular carcinoma mice via IL-6/TNF-alpha/STAT3 pathway by the anti-cancer detoxification formula[J]. Tradit Chin Drug Res Clin Pharmacol, 2023, 34(11): 1505-13. |
| [13] |
刘燕, 张冬华, 黄渝茜, 等. 扁蒴藤素调节ROS/ASK1/JNK信号通路对二乙基亚硝胺诱导大鼠肝癌的抑制作用[J]. 实用医学杂志, 2023, 39(20): 2597-602. Liu Y, Zhang D H, Huang Y Q, et al. Inhibition of diethylnitrosamine-induced hepatocellular carcinoma in rats by regulation of ROS/ASK1/JNK signaling pathway by lentinan[J]. J Pract Med, 2023, 39(20): 2597-602. doi:10.3969/j.issn.1006-5725.2023.20.007 |
| [14] |
胡善明, 王亚楠, 许正茂, 等. Bcl-2家族分子在细胞凋亡中的作用研究进展[J]. 动物医学进展, 2021, 42(10): 85-9. Hu S M, Wang Y N, Xu Z M, et al. Progress in the study of the role of Bcl-2 family molecules in apoptosis[J]. Prog Vet Med, 2021, 42(10): 85-9. |
| [15] |
Kaloni D, Sarah T Dn, Andreas S, et al. BCL-2 protein family: attractive targets for cancer therapy[J]. Apoptosis, 2023, 28(1-2): 20-38. doi:10.1007/s10495-022-01780-7 |
| [16] |
杨致昊, 刘畅, 窦露, 等. Caspases的研究进展及其与肉嫩度的关联机制[J]. 食品与发酵工业, 2021, 47(17): 277-82. Yang Z H, Liu C, Dou L, et al. Progress in the study of caspases and its association mechanism with meat tenderness[J]. Food Ferm Ind, 2021, 47(17): 277-82. |
| [17] |
陈文鹏, 卢健棋, 庞延, 等. 强心汤对OMA1封闭心力衰竭大鼠心肌组织Caspase-3、Bax、Bcl-2表达的影响[J]. 中西医结合心脑血管病杂志, 2023, 21(22): 4101-6. Chen W P, Lu J Q, Pang Y, et al. Effects of cardiotonic soup on the expression of Caspase-3, Bax, and Bcl-2 in myocardial tissues of rats with OMA1-closed heart failure[J]. Chin J Integrat Med Cardio-Cerebrovasc Dis, 2023, 21(22): 4101-6. doi:10.12102/j.issn.1672-1349.2023.22.007 |
| [18] |
梁金凤, 李伟镇, 李晓玲, 等. 新型钌多吡啶配合物诱导肝癌细胞凋亡的机制研究[J]. 中国药理学通报, 2015, 31(11): 1592-7. Liang J F, Li W Z, Li X L, et al. Apoptosis in hepatocellular carcinoma induced by novel ruthenium polypyridyl complexes[J]. Chin Pharmacol Bull, 2015, 31(11): 1592-7. doi:10.3969/j.issn.1001-1978.2015.11.022 |

