

RNA甲基化修饰是近年来表观遗传领域的前沿和热点,包括m6A、m1A、m5C、m7G甲基化修饰等。其中m6A甲基化修饰是最丰富的一种修饰,广泛存在于mRNA、tRNA、miRNA、LncRNA等各种RNA中,它通过影响RNA代谢过程(RNA剪切、出核、稳定性、翻译等)可在转录后水平上调控基因表达,继而影响细胞的增殖、分化、代谢等生理功能[1]。药物代谢酶和药物转运体在外源性药物的吸收、分布、消除和排泄过程中具有重要作用,两者表达水平的改变可能影响药物的治疗效果。最近的研究表明,m6A修饰通过调控药物代谢酶和药物转运体表达可影响药物代谢过程,进而导致药物药效不足或发生不良反应。本文从m6A修饰的角度出发,将m6A修饰对药物代谢酶和药物转运体表达调控机制的研究进展进行综述。
1 m6A甲基化修饰m6A甲基化修饰是指RNA分子上腺苷酸的第6位氮原子发生甲基化,其主要发生在DRACH序列中(D:腺嘌呤、鸟嘌呤或尿嘧啶;R:腺嘌呤或鸟嘌呤;H:腺嘌呤、胞嘧啶或尿嘧啶),该序列常常出现在mRNA的终止密码子附近、3′-非翻译区(3′-UTR)以及长外显子区域[2]。
m6A修饰是一个动态调控的过程(Fig 1),其主要涉及3种蛋白:甲基转移酶(“writer”)、去甲基化酶(“eraser”)、m6A识别蛋白(“reader”)。甲基转移酶是由多个蛋白组成的复合物,包括甲基转移酶样蛋白3(methyltransferase-like 3,METTL3)、甲基转移酶样蛋白14(methyltransferase-like 14,METTL14)、Wilms肿瘤相关蛋白(Wilms′ tumour 1-associating protein,WTAP)、RNA结合基序蛋白15(RNA-binding motif protein 15,RBM15)、含锌指CCCH型13(zinc finger CCCH domain-containing protein 13,ZC3H13)等,其中METTL3是甲基转移酶的核心结构,催化腺苷酸甲基化,而METTL14通过与METTL3形成异二聚体来稳定METTL3结构域,甲基转移酶的主要作用是将S-腺苷甲硫氨酸(S-adenosyl methionine,SAM)上的活性甲基转移至RNA上从而形成m6A修饰[3]。去甲基化酶主要有脂肪肥胖相关蛋白(fat mass and obesity-associated protein,FTO)和ALKB同源蛋白5(AlkB homology 5,ALKBH5),它们负责将RNA上的m6A修饰去除[4]。m6A识别蛋白包括YT521-B同源域(YT521-B homology domain,YTH)蛋白家族、核不均一核糖蛋白(heterogeneous nuclear ribonucleoproteins,HNRNPs)、胰岛素样生长因子2 mRNA结合蛋白(insulin-like growth factor 2 mRNA-binding proteins,IGF2BPs)等,这些特异性的m6A识别蛋白通过识别mRNA上的m6A修饰并与之结合,进而参与调控mRNA的剪切加工、出核过程、mRNA稳定性以及翻译效率等,从而使m6A修饰在细胞的各种生理过程中发挥作用[2]。
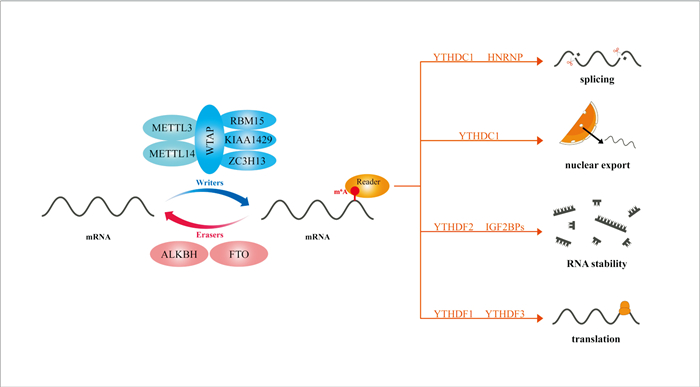
|
| Fig 1 Main molecular mechanism of m6A regulating gene expression |
m6A修饰可调控药物代谢酶表达(Fig 2),药物代谢酶分为Ⅰ相代谢酶和Ⅱ相代谢酶。Ⅰ相代谢酶主要是细胞色素P450(cytochrome P450,CYP);Ⅱ相代谢酶包括尿苷二磷酸葡萄糖醛酸转移酶(UDP- glucuronosyltransferases,UGTs)、谷胱甘肽-S-转移酶(glutathione S-transferases,GSTs)等,它们通过催化药物代谢来降低药物的药理活性并使其水溶性增强以利于从体内排出[5]。
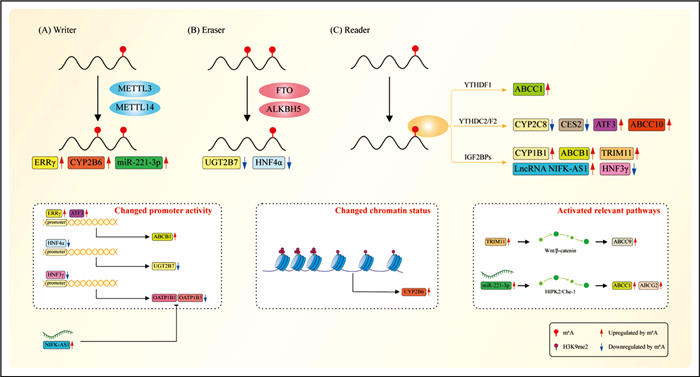
|
| Fig 2 Mechanism of m6A regulating drug-metabolizing enzymes and drug transporters |
CYP1B1参与了多环芳烃等多种致癌物的激活,它产生的致癌代谢物可引起DNA损伤和活性氧生成,并导致恶性肿瘤发展[6]。Sun等[7]最近发现,乳腺癌细胞和组织中高表达的METTL14可上调CYP1B1 mRNA中的m6A修饰水平,使其mRNA稳定性升高从而促进CYP1B1蛋白表达,导致乳腺癌恶性进展。此外,在急性髓系白血病细胞系和宫颈癌细胞系中,METTL14同样以m6A依赖的方式稳定CYP1B1 mRNA来促进CYP1B1表达,进而增强肿瘤细胞的增殖和迁移能力,促进肿瘤发展[8-9]。ALKBH5也参与调控CYP1B1表达,Ye等[10]研究发现,间充质干细胞中的ALKBH5表达水平降低会增强IGF2BP1对CYP1B1 mRNA的稳定作用,使CYP1B1蛋白表达增多,进而导致线粒体功能发生障碍,最终促进间充质干细胞衰老。
2.1.2 CYP2C8CYP2亚家族是CYPs中最大的一个分支,参与临床上绝大部分的药物代谢。最近,Nakano等[11]用甲基化泛抑制剂3-脱氮腺苷处理HepaRG细胞后,发现CYP1A2、CYP2B6、CYP2C8的表达水平分别升高1.6倍、2.2倍、2.7倍,该团队进一步探究了CYP2C8表达上调的机制,发现CYP2C8 mRNA 3′-UTR区域存在m6A修饰,YTHDC2识别并结合该处m6A修饰引发CYP2C8 mRNA降解,导致CYP2C8蛋白表达水平下降,使HepaRG细胞代谢阿莫地喹的能力下降。
2.1.3 CYP2B6除了直接调控外,m6A修饰还可通过影响组蛋白修饰状态间接调控CYPs表达。Isono等[12]在HepaRG细胞中敲减METTL3和METTL14后发现,CYP2B6基因启动子上游区域的组蛋白H3K9二甲基化水平升高,致使该范围的染色质结构变得紧实从而抑制CYP2B6基因的转录活性,导致HepaRG细胞对安非他酮的代谢能力下降。Li等[13]在游离脂肪酸诱导HepG2细胞构建的脂肪肝细胞模型中同样也发现,METTL3可促进CYP2B6的表达并进一步导致HepG2细胞产生胰岛素抗性;而加入METTL3抑制剂STM2457后,CYP2B6的表达明显被抑制,HepG2细胞也恢复了对胰岛素的敏感性。
2.1.4 CES2羧酸酯酶2(carboxylesterases,CES2)是一种丝氨酸酯酶,参与代谢脂类、酰胺类等外源性药物和甘油三酯、二酰甘油等内源性物质[14]。Takemoto等[15]证实CES2受m6A修饰调控,YTHDC2通过识别CES2 mRNA 3′-UTR区域的m6A修饰来参与CES2 mRNA的降解,使得CES2蛋白表达下调;当在细胞中敲减FTO或ALKBH5会减弱对伊立替康和脂质的代谢,而敲减METTL3或METTL14则会加强代谢两者的能力。
2.2 m6A修饰调控Ⅱ相代谢酶UGTs是最重要的Ⅱ相药物代谢酶之一,参与了35%的Ⅱ相代谢,通过催化葡萄糖醛酸与内源性物质(如胆汁酸、激素) 或外源性物质(如药物)的极性基团结合以促进代谢物质的清除[16]。UGTs的转录活性受肝细胞核因子4α(hepatocyte nuclear factor 4α,HNF4α)的调控[17]。Ondo等[18]在Huh-7细胞中研究发现,敲减ALKBH5会降低UGT2B7 mRNA稳定性从而直接下调UGT2B7表达,而敲减FTO会降低HNF4α表达水平,HNF4α作为转录因子又可进一步导致UGT2B7表达下调。
3 m6A修饰对药物转运体的调控m6A修饰也可调控药物转运体表达(Fig 2),药物转运体主要分为两个亚家族:一类是ATP-结合盒(ATP-binding cassette, ABC)转运体,主要负责将药物从细胞内转运至细胞外;另一类是溶质载体(solute carrier, SLC)转运体,主要负责将药物从细胞外转运至细胞内[19]。
3.1 m6A修饰调控ABC转运体 3.1.1 ABCB1ABCB1又称多药耐药蛋白(multidrug resistance,MDR1)或P-糖蛋白(P-glycoprotein,P-gp),它是最早被发现的ABC转运体,也是目前研究最多的ABC转运体,广泛存在于肝脏、肠道、肾脏、大脑等全身各组织和器官中。ABCB1的底物十分广泛,临床使用的药物约40% 都经ABCB1转运[20]。Yang等[21]在对紫杉醇耐药的结直肠癌(colorectal cancer,CRC)细胞中研究发现,IGF2BP3通过以m6A依赖的方式提高ABCB1 mRNA的稳定性,进而上调ABCB1蛋白水平,使CRC细胞对紫杉醇的外排能力增强,最终导致CRC细胞对紫杉醇耐药。Liu等[22]研究发现,YTHDF2以m6A依赖的方式负调控转录因子ATF3使其表达上调,而ATF3又可进一步结合到ABCB1启动子区域促进后者转录,使ABCB1的表达增加,从而降低细胞内他莫昔芬的浓度,导致MCF-7细胞对他莫昔芬耐药。同样的,m6A修饰也能够促进雌激素相关受体(estrogen related receptors,ERRs)前体mRNA的剪接来上调ERRγ的表达,表达水平上升的ERRγ通过促进ABCB1转录使ABCB1表达水平上调,导致肝癌细胞HepG2和乳腺癌细胞MCF-7对阿霉素耐药[23]。
3.1.2 ABCCABCC又称多药耐药相关蛋白(multidrug resistance-associated proteins,MRPs),是ABC转运体中亚型最多的一类转运体,其在肺癌、乳腺癌、神经母细胞瘤等多种癌症中表达水平升高并导致肿瘤细胞对化疗药物耐药。Xu等[24]研究发现,在对伊马替尼耐药的胃肠道间质瘤(gastrointestinal stromal tumor,GIST)细胞和组织中,表达上调的METTL3可提高YTHDF1和eEF-1促进ABCC1 mRNA翻译的作用,从而使ABCC1的蛋白表达量明显增多,进而导致细胞内伊马替尼浓度降低并造成GIST细胞对伊马替尼耐药;而在细胞或小鼠模型中给予ABCC1抑制剂后,可逆转因METTL3表达上调所引起GIST细胞对伊马替尼耐药。Zhang等[25]在耐药的鼻咽癌细胞中研究发现,IGF2BP2以m6A依赖的方式提高TRIM11 mRNA的稳定性从而促进TRIM11表达,而TRIM11又可通过激活下游Wnt/β-catenin信号通路来提高ABCC9启动子活性,使ABCC9表达增多,导致鼻咽癌细胞对顺铂耐药。m6A修饰还可经外泌体途经对其他细胞产生影响,Xiao等[26]发现,对吉非替尼耐药(gefitinib-resistant,GR)的肺癌细胞H1975/GR会分泌富含FTO的外泌体,当该外泌体被对吉非替尼敏感的PC9细胞吸收后,外泌体中丰富的FTO会降低PC9细胞中ABCC10 mRNA上的m6A修饰水平,从而减弱YTHDF2对ABCC10 mRNA的降解作用,使PC9细胞中ABCC10蛋白表达水平增加,导致PC9细胞对吉非替尼产生了获得性耐药。
3.1.3 ABCG2ABCG2又称乳腺癌耐药蛋白(breast cancer resistance protein,BCRP),在乳腺癌的耐药过程中发挥着重要作用。Pan等[27]研究发现,乳腺癌MCF细胞中的METTL3可通过促进miR-221-3p成熟来上调其表达,而miR-221-3p的上调则会抑制HIPK2/Che-1通路,使ABCG2和ABCC1蛋白表达增多,进而促进阿霉素的外排,造成MCF细胞对阿霉素耐药;体内实验也证明,给予乳腺癌耐药小鼠miR-221-3p抑制剂后,可逆转因METTL3过表达引起的对阿霉素耐药现象。
3.2 m6A修饰调控SLC转运体除了ABC转运体外,一些SLC转运体的表达也受到m6A修饰的影响。有机阴离子转运多肽(organic anion-transporting polypeptides,OATPs)OATP1B1(又名:SLCO1B1)和OATP1B3(又名:SLCO1B3)在肝细胞基底膜上特异性表达,主要介导内源性物质(如胆汁酸、前列腺素、类固醇等)和外源性药物(如索拉菲尼、甲氨蝶呤、强心苷等)从血液中转入细胞[28]。最近,Zhou等[29]在肝细胞癌(hepatocellular carcinoma,HCC)患者中研究发现,METTL14的下调会减弱IGF2BPs对HNF3γ mRNA的稳定作用并使HNF3γ表达下降,而HNF3γ的下调又会进一步降低OATP1B1和OATP1B3基因的转录活性,使OATP1B1和OATP1B3蛋白表达下降,从而导致肝癌患者对索拉菲尼耐药。此外,Chen等[30]发现m6A修饰调控OATP1B1和OATP1B3的另一机制,在HCC患者中IGF2BP1会以m6A依赖的方式提高LncRNA NIFK-AS1的稳定性使其表达水平上调,而NIFK-AS1又进一步负调控OATP1B1和OATP1B3,最终使OATP1B1和OATP1B3表达下调,导致HCC患者对索拉菲尼敏感度下降。
4 结语与展望表观遗传修饰是引起药物代谢个体差异的重要原因之一,既往的研究主要集中于DNA甲基化、组蛋白修饰和非编码RNA对药物代谢酶和转运体的影响。近年来的研究表明,m6A修饰既可直接调控药物代谢酶或转运体表达,又可通过影响转录因子或相关通路激活水平来间接调控药物代谢酶或转运体表达;而且,m6A修饰还能影响表观遗传的其他修饰如非编码RNA和组蛋白修饰进而调控药物代谢酶或转运体表达。目前,有关m6A修饰调控药物代谢酶和转运体表达的文献仍较少,RNA甲基化的其他修饰类型如m1A、m5C、m7G修饰是否影响药物代谢过程也尚未见报道,RNA甲基化修饰对药物代谢酶和转运体的调控机制仍需进一步研究。此外,深入研究m6A修饰对药物代谢酶和转运体的调控作用也将有助于人们理解个体对药物反应的表型差异,为临床用药的安全性和合理性提供依据。
| [1] |
徐英杰, 文雪倩, 冯璐瑶, 等. RNA m5C甲基化在肿瘤发生发展中的调控作用[J]. 中国药理学通报, 2021, 37(10): 1352-5. Xu Y J, Wen X Q, Feng L Y, et al. Role of m5C RNA methylation in cancer[J]. Chin Pharm Bull, 2021, 37(10): 1352-5. doi:10.3969/j.issn.1001-1978.2021.10.005 |
| [2] |
Zaccara S, Ries R J, Jaffrey S R. Reading, writing and erasing mRNA methylation[J]. Nat Rev Mol Cell Biol, 2019, 20(10): 608-24. doi:10.1038/s41580-019-0168-5 |
| [3] |
Huang H, Weng H, Chen J. m(6)A modification in coding and non-coding RNAs: Roles and therapeutic implications in cancer[J]. Cancer Cell, 2020, 37(3): 270-88. doi:10.1016/j.ccell.2020.02.004 |
| [4] |
Chen M, Wong C M. The emerging roles of N6-methyladenosine (m6A) deregulation in liver carcinogenesis[J]. Mol Cancer, 2020, 19(1): 44. doi:10.1186/s12943-020-01172-y |
| [5] |
周锦屏, 张蕊, 师少军, 等. 雷公藤对药物代谢酶和转运体的调控作用研究进展[J]. 中国医院药学杂志, 2020, 40(14): 1595-9. Zhou J P, Zhang R, Shi S J, et al. Advances in the modulation of Tripterygium on drug metabolizing enzyme and transporter[J]. Chin J Hosp Pharm, 2020, 40(14): 1595-9. |
| [6] |
Kwon Y J, Shin S, Chun Y J. Biological roles of cytochrome P450 1A1, 1A2, and 1B1 enzymes[J]. Arch Pharm Res, 2021, 44(1): 63-83. doi:10.1007/s12272-021-01306-w |
| [7] |
Sun T, Wu Z, Wang X, et al. LNC942 promoting METTL14-mediated m(6)A methylation in breast cancer cell proliferation and progression[J]. Oncogene, 2020, 39(31): 5358-72. doi:10.1038/s41388-020-1338-9 |
| [8] |
Li J, Li Z, Bai X, et al. LncRNA UCA1 promotes the progression of AML by upregulating the expression of CXCR4 and CYP1B1 by affecting the stability of METTL14[J]. J Oncol, 2022, 2022: 2756986. |
| [9] |
Xie Q, Li Z, Luo X, et al. piRNA-14633 promotes cervical cancer cell malignancy in a METTL14-dependent m6A RNA methylation manner[J]. J Transl Med, 2022, 20(1): 51. doi:10.1186/s12967-022-03257-2 |
| [10] |
Ye G, Li J, Yu W, et al. ALKBH5 facilitates CYP1B1 mRNA degradation via m6A demethylation to alleviate MSC senescence and osteoarthritis progression[J]. Exp Mol Med, 2023, 55(8): 1743-56. doi:10.1038/s12276-023-01059-0 |
| [11] |
Nakano M, Ondo K, Takemoto S, et al. Methylation of adenosine at the N6 position post-transcriptionally regulates hepatic P450s expression[J]. Biochem Pharmacol, 2020, 171: 113697. doi:10.1016/j.bcp.2019.113697 |
| [12] |
Isono M, Nakano M, Fukami T, et al. Adenosine N6-methylation upregulates the expression of human CYP2B6 by altering the chromatin status[J]. Bioche Pharmacol, 2022, 205: 115247. doi:10.1016/j.bcp.2022.115247 |
| [13] |
Li Y, Zhang D, Gao Y, et al. METTL3 exacerbates insulin resistance in hepatocytes by regulating m(6)A modification of cytochrome P450 2B6[J]. Nutr Metab (Lond), 2023, 20(1): 40. doi:10.1186/s12986-023-00762-z |
| [14] |
Wang D, Zou L, Jin Q, et al. Human carboxylesterases: A comprehensive review[J]. Acta Pharm Sin B, 2018, 8(5): 699-712. doi:10.1016/j.apsb.2018.05.005 |
| [15] |
Takemoto S, Nakano M, Fukami T, et al. m6A modification impacts hepatic drug and lipid metabolism properties by regulating carboxylesterase 2[J]. Biochem Pharm, 2021, 193: 114766. doi:10.1016/j.bcp.2021.114766 |
| [16] |
Yang N, Sun R, Liao X, et al. UDP-glucuronosyltransferases (UGTs) and their related metabolic cross-talk with internal homeostasis: A systematic review of UGT isoforms for precision medicine[J]. Pharmacol Res, 2017, 121: 169-83. doi:10.1016/j.phrs.2017.05.001 |
| [17] |
Bock K W. Functions and transcriptional regulation of adult human hepatic UDP-glucuronosyl-transferases (UGTs): Mechanisms responsible for interindividual variation of UGT levels[J]. Biochem Pharmacol, 2010, 80(6): 771-7. doi:10.1016/j.bcp.2010.04.034 |
| [18] |
Ondo K, Isono M, Nakano M, et al. The N6-methyladenosine modification posttranscriptionally regulates hepatic UGT2B7 expression[J]. Biochem Pharmacol, 2021, 189: 114402. doi:10.1016/j.bcp.2020.114402 |
| [19] |
杨世磊, 刘克辛. 药物转运体表观遗传调控机制的研究进展[J]. 药物评价研究, 2017, 40(9): 1229-34. Yang S L, Liu K X. Research progress on regulation mechanism of epigenetic modifications for drug transporters[J]. Drug Evaluation Res, 2017, 40(9): 1229-34. |
| [20] |
Liu X. ABC family transporters[J]. Adv Exp Med Biol, 2019, 1141: 13-100. |
| [21] |
Yang Z, Zhao F, Gu X, et al. Binding of RNA m6A by IGF2BP3 triggers chemoresistance of HCT8 cells via upregulation of ABCB1[J]. Am J Cancer Res, 2021, 11(4): 1428-45. |
| [22] |
Liu X, Yuan J, Zhang X, et al. ATF3 modulates the resistance of breast cancer cells to tamoxifen through an N6-methyladenosine-based epitranscriptomic mechanism[J]. Chem Res in Toxicol, 2021, 34(7): 1814-21. doi:10.1021/acs.chemrestox.1c00206 |
| [23] |
Chen Z, Wu L, Zhou J, et al. N6-methyladenosine-induced ERRγ triggers chemoresistance of cancer cells through upregulation of ABCB1 and metabolic reprogramming[J]. Theranostics, 2020, 10(8): 3382-96. doi:10.7150/thno.40144 |
| [24] |
Xu K, Zhang Q, Chen M, et al. N6-methyladenosine modification regulates imatinib resistance of gastrointestinal stromal tumor by enhancing the expression of multidrug transporter MRP1[J]. Cancer Lett, 2022, 530: 85-99. doi:10.1016/j.canlet.2022.01.008 |
| [25] |
Zhang R, Li S W, Liu L, et al. TRIM11 facilitates chemoresistance in nasopharyngeal carcinoma by activating the β-catenin/ABCC9 axis via p62-selective autophagic degradation of Daple[J]. Oncogenesis, 2020, 9(5): 45. doi:10.1038/s41389-020-0229-9 |
| [26] |
Xiao P, Liu Y K, Han W, et al. Exosomal delivery of FTO confers gefitinib resistance to recipient cells through ABCC10 regulation in an m6A-dependent manner[J]. Mol Cancer Res, 2021, 19(4): 726-38. doi:10.1158/1541-7786.MCR-20-0541 |
| [27] |
Pan X, Hong X, Li S, et al. METTL3 promotes adriamycin resistance in MCF-7 breast cancer cells by accelerating pri-microRNA-221-3p maturation in a m6A-dependent manner[J]. Exp Mol Med, 2021, 53(1): 91-102. doi:10.1038/s12276-020-00510-w |
| [28] |
Anabtawi N, Drabison T, Hu S, et al. The role of OATP1B1 and OATP1B3 transporter polymorphisms in drug disposition and response to anticancer drugs: a review of the recent literature[J]. Expert Opin Drug Metab Toxicol, 2022, 18(7-8): 459-68. doi:10.1080/17425255.2022.2113380 |
| [29] |
Zhou T, Li S, Xiang D, et al. m6A RNA methylation-mediated HNF3γ reduction renders hepatocellular carcinoma dedifferentiation and sorafenib resistance[J]. Signal Transduct Target Ther, 2020, 5(1): 296. doi:10.1038/s41392-020-00299-0 |
| [30] |
Chen Y T, Xiang D, Zhao X Y, et al. Upregulation of lncRNA NIFK-AS1 in hepatocellular carcinoma by m6A methylation promotes disease progression and sorafenib resistance[J]. Human Cell, 2021, 34(6): 1800-11. doi:10.1007/s13577-021-00587-z |

