

2. 山东中医药大学药学院,山东 济南 250000;
3. 济宁医学院附属医院心内科,济宁市心血管疾病诊疗重点实验室,山东 济宁 272029
2. Dept of Pharmacy, Shandong University of Traditional Chinese Medicine, Jinan 250000, China;
3. Dept of Cardiology, Affiliated Hospital of Jining Medical University, Jining Key Laboratory for Diagnosis and Treatment of Cardiovascular Diseases, Jining Shandong 272029, China
内皮细胞(endothelial cell,EC)是构成人体血管和淋巴管内膜的关键细胞,在向组织输送氧气、输送营养物质、清除代谢废物以及调节组织微环境方面发挥关键作用。EC由于位于血液和组织的交界,因此也是血液中多种损伤因素的直接靶点,受损的EC会在凝血调控、血管紧张度的调节、血管通透性调节、白细胞黏附调节等方面发生功能障碍。内皮间质转化(endothelial to mesenchymal transition,EndMT)是近年来发现的一种新的内皮细胞损伤形式,在特定的刺激因素下,内皮细胞会失去内皮细胞表型和功能转而获得间充质细胞表型和功能。在胚胎时期,EndMT是心脏瓣膜、肺动脉和主动脉形成的关键过程,而近年来研究发现,EndMT还广泛参与多种疾病的发生发展。非编码RNAs(non-coding RNAs,ncRNAs)是指不编码蛋白质的RNA,以前被认为是没有功能的转录副产物,近年来研究发现,ncRNAs可以与蛋白质、DNA和RNA相互作用,参与基因的激活和沉默,RNA的剪切、修饰和编辑,蛋白质的翻译等多种细胞活动。研究显示,ncRNAs可通过调控EndMT参与多种疾病的发生发展。本篇综述旨在总结ncRNAs调控EndMT在多种疾病中发挥的作用及相关作用靶点,为临床治疗EndMT相关疾病提供新靶点和新思路。
1 EndMTEndMT即在特定的刺激因素下,内皮细胞失去内皮细胞标志物如分化簇31(cluster of differentiation 31,CD31)和血管内皮钙粘蛋白(vascular endothelial cadherin,VE-cadherin),而获得间充质细胞标志物如神经钙粘蛋白(neural-cadherin,N-cadherin)和波形蛋白Vimentin,细胞形态由内皮细胞卵圆形变成间充质细胞纺锤形的过程。EndMT导致内皮细胞失去其原有功能,例如血管形成能力、抑制凝血酶形成能力、凝集素结合能力和摄取低密度脂蛋白胆固醇能力,转而获得间充质细胞的部分功能,例如收缩性、侵袭性、迁移性和胶原分泌特性。EndMT的发生受多种因素的影响,目前研究最多的是转化生长因子β(transforming growth factor-β,TGF-β)家族对EndMT的诱导作用。在TGF-β的亚型(TGF-β1、TGF-β2和TGF-β3)中,目前在与EndMT关系中研究较多的是TGF-β2,其与EndMT的发生最为密切。TGF-β信号通过Ⅱ型TGF-β受体(type Ⅱ TGF-β receptor,TGFBR2),以及Ⅰ型TGF-β受体的激活来诱导EndMT。此外,EndMT还与KLF等信号通路的激活有关[1]。
最近研究表明,EndMT不仅参与胚胎心脏和血管发育,而且还与动脉粥样硬化、纤维化疾病、肺动脉高压、癌症、血管生成和脑血管畸形等众多病理生理过程有关。动脉粥样硬化是一种在动脉内形成粥样硬化斑块的慢性动脉壁疾病。在动脉粥样硬化的过程中,EC发生EndMT,导致EC损伤、脂蛋白沉积、炎症等和纤维帽形成,最终导致动脉粥样硬化的发生;此外,EndMT还会导致EC形态发生改变,细胞间黏附性降低,从而增加动脉粥样斑块的不稳定性。器官纤维化是各种刺激引起的慢性炎症的最终病理结果,不仅降低了相关器官的功能,还增加了相关疾病的死亡率。慢性炎症可导致EC获得间充质表型,诱发EndMT,EC分泌胶原纤维并沉积在细胞外基质中,最终导致器官纤维化的发生。肺动脉高压病理特征是毛细血管前肺动脉重塑,在各种刺激因素作用下,EC发生EndMT,导致EC和平滑肌细胞增殖、分泌胶原,动脉内膜增厚和闭塞,从而导致肺血管阻力和肺动脉压升高。EndMT还参与血管生成,例如,哺乳动物的心脏受到急性损伤时,EC在损伤区域聚集并发生EndMT,一方面获得更强的迁移能力促进血管修复;一方面生成成纤维细胞表达促血管生成分子,进而促进血管生成。脑动静脉畸形是发生在全脑的血管病变,其特点是毛细血管数量减少,血管微环境发生改变,导致动静脉的直接接触,血管大小和血流速度发生改变,从而导致血流中断、缺氧和炎症的发生,最终造成内皮细胞损伤并诱发EndMT,而EndMT的发生会进一步导致脑血管的不规则扩张,使血管壁内应力发生改变,进一步加重脑血管畸形。肿瘤微环境由肿瘤细胞、肿瘤血管、成纤维细胞、炎症细胞和细胞外基质组成,肿瘤微环境中的成分与恶性肿瘤细胞相互作用,通过直接的细胞接触或分泌各种细胞因子,调节肿瘤组织的特征,并影响肿瘤的时空进展和转移。TGF-β主要由肿瘤微环境中的肿瘤细胞和浸润性炎症细胞分泌,其诱导肿瘤内皮细胞发生EndMT,使肿瘤血管系统内皮屏障丧失,促进肿瘤细胞的转移和扩散。综上所述,EndMT是多种疾病的发病基础,在多种疾病中发挥重要的调控作用。
2 ncRNAs目前研究较多的参与疾病调控的ncRNAs主要包括微小RNA(microRNA,miRNA)、长链非编码RNA(long non-coding RNA,lncRNA)和环状RNA(circular RNA,circRNA)。miRNA是一类长度在18-25个核苷酸的ncRNA,其通过与靶信使RNA(messenger RNA,mRNA)的3′-非翻译区(3′- untranslated region,3′-UTR)中的互补序列相互作用,诱导mRNA的降解或翻译抑制,在转录后水平调节基因表达。竞争性内源RNA(competing endogenous RNA,ceRNA)可以通过与靶基因竞争性结合miRNA间接调节靶基因的表达,这种miRNA的竞争性结合被称为miRNA“海绵机制”。miRNA还可以被包装成囊泡状外泌体结构在全身循环,介导不同组织和细胞之间的信息交流。lncRNA是一类超过200个核苷酸的ncRNAs。lncRNA根据其基因组位置可分为4种,包括由两个蛋白质编码基因之间DNA序列转录而来的基因间lncRNA;由蛋白质编码基因的内含子产生的内含子lncRNA;与已知蛋白质编码基因重叠的重叠lncRNA;转录方向与蛋白质编码基因相反的反义lncRNA。lncRNA作用机制较为复杂,其可通过“海绵机制”吸附miRNA促进靶mRNA的表达,从而参与调节细胞的活性和功能;lncRNA还可与染色质结合,从而改变局部染色质结构或向特定位点募集具有调节功能的分子来调控基因表达;此外,lncRNA可以与多种蛋白质相互作用促进蛋白质复合物的组装或削弱蛋白质之间的作用。circRNA是ncRNAs的另一个亚类,它们的环状结构通常由反分裂引起,具有高度稳定性,可抵抗RNA外切酶的消化作用。circRNA以前被认为是错误剪接形成的,没有任何功能。然而,越来越多的研究表明,circRNA可以作为基因调节器,在编码蛋白质过程中发挥作用。circRNA与lncRNA类似,可作为miRNA海绵或RNA结合蛋白隔离因子,通过控制mRNA水平来调节基因表达。此外,circRNA还可以通过与RNA结合蛋白相互作用调控RNA选择性剪接来控制基因转录。近年来研究发现,ncRNAs可以通过调控EndMT广泛参与疾病的发生发展,且其作为生物标志物和治疗靶点已经展现出良好的临床前景。
3 miRNA调控EndMT参与疾病发生发展 3.1 miRNA调控EndMT参与动脉粥样硬化研究发现,miR-374b和miR-449a的异常表达可以通过诱导EndMT参与动脉粥样硬化的发生发展[2-3]。内皮丝裂原激活酶7(mitogen-activated kinase 7,MAPK7)信号是抑制EndMT的关键因子,可以减缓动脉粥样硬化的病程进展,Vanchin等[2]研究发现在小鼠主动脉和猪腹三叉血管内膜重塑部位血管内皮细胞MAPK7表达下降;体外实验进一步发现,TGF-β诱导人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)中miRNA-374b表达增加,miRNA-374b靶向抑制MAPK7导致其表达下降,诱发EndMT,而恢复HUVECs中MAPK7信号的表达能有效缓解EndMT;在人冠状动脉狭窄样本中发现疾病的严重程度与MAPK7表达水平降低和miR-374b表达水平升高有关。Jiang等[3]通过检测人动脉粥样硬化斑块中miR-449a的表达发现,相比于正常动脉,miR-449a在动脉粥样硬化斑块中表达明显升高;在HUVECs中,miR-449a通过抑制脂联素受体(adiponectin receptor,AdipoR2),增强间充质细胞标志物表达,促进细胞增殖和迁移,诱导EndMT的发生;向ApoE-/-小鼠尾静脉注射miR-449a拮抗剂可以降低小鼠胸主动脉和主动脉弓部动脉粥样硬化斑块面积,减缓ApoE-/-小鼠动脉粥样硬化的发展进程。
3.2 miRNA调控EndMT参与纤维化疾病研究表明miR-21和miR-29的异常表达可以通过调控EndMT参与纤维化疾病的发生发展[4-5]。Li等[4]发现,在糖尿病小鼠心脏中miR-21的表达水平明显升高,小鼠心脏胶原沉积明显增加,进一步研究发现,miR-21直接抑制SMAD家族成员7(SMAD family member 7,Smad7),从而激活SMAD家族成员2/3(SMAD family member 2/3,Smad2/3)信号通路介导高糖诱导的EndMT,最终导致心肌纤维化的发生;在小鼠体内注射miR-21抑制剂后可有效改善小鼠心脏功能并减少心脏血管周围纤维化。肾纤维化是进行性慢性肾脏疾病发展到末期的共同结果,肽基肽酶-4(dipeptidyl peptidase-4,DPP-4)抑制剂利格列汀是一种用于治疗糖尿病的药物,可以有效的改善糖尿病小鼠的肾纤维化。在链脲佐菌素诱导小鼠糖尿病肾纤维化模型中发现miR-29表达水平明显降低,使用利格列汀后恢复了miR-29水平并抑制了DPP-4的表达,从而缓解了EndMT和肾纤维化[5]。
3.3 miRNA调控EndMT参与淋巴管和血管生成血管生成受血管内皮生长因子(vascular endothelial growth factor,VEGF)、Notch、TGF-β等信号的调节,研究表明miRNA可以通过调控EndMT参与血管生成。miR-9在肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)刺激的大鼠淋巴管内皮细胞(lymphatic endothelial cell,LEC)中表达升高,过表达miR-9可通过抑制核因子κB(nuclear factor-κB,NF-κB)诱导EndMT、增强LEC迁移能力并促进LEC成管[6]。有意思的是,有研究发现发生EndMT的内皮细胞也可能阻碍血管生成,在HUVECs中miR-342-5p过表达促进了EndMT,而体内过表达miR-342-5p可抑制小鼠新生血管生成,进一步研究发现,这一抑制作用可能与miR-342-5p通过下调内皮糖蛋白endoglin抑制VEGF和TGF-β信号通路有关[7]。
3.4 miRNA调控EndMT参与糖尿病miR-497和miR-200b可通过调控EndMT参与糖尿病[8-9]。研究发现褪黑素通过上调miR-497表达,抑制Rho相关卷曲蛋白激酶1(rho-associated coiled-coil containing kinases 1,ROCK1)ROCK1和ROCK2的表达,从而抑制糖尿病大鼠肾脏内皮细胞EndMT,缓解糖尿病肾病进程[8]。EC是糖尿病视网膜组织损伤的主要靶细胞,而EC的EndMT是糖尿病视网膜病变的关键机制[10]。Cao等[9]研究发现,高糖环境通过抑制miR-200b的表达,诱导人视网膜微血管内皮细胞(human retinal microvascular endothelial cells,HRMECs)发生EndMT,而miR-200b转基因小鼠经过高糖诱导则不易发生EndMT,进一步研究发现,miR-200b通过靶向作用Smad2、Snail家族转录抑制因子1(snail family transcriptional repressor 1,Snai1)和组蛋白乙酰转移酶p300,从而抑制EndMT缓解糖尿病诱发的视网膜病变。
3.5 miRNA调控EndMT参与肺动脉高压肺动脉高压是一种进行性肺血管疾病,与肺动脉内皮细胞功能障碍和肺动脉平滑肌细胞增殖有关[11]。在肺动脉高压发生时,miR-130a在肺微血管内皮细胞(microvascular endothelial cells,MVECs)中表达升高,miR-130a受NF-κB的调控并靶向作用于骨形态发生蛋白受体2(bone morphogenetic protein receptor 2,BMPR2),进而促进α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)的激活,诱导MVECs发生EndMT[12]。研究发现,miR-204的异常表达与肺动脉高压有关,miR-204在缺氧诱导的大鼠肺动脉内膜和人肺动脉内皮细胞(human pulmonary arterial endothelial cells,HPAECs)中表达下降,而使用miR-204抑制剂后将进一步促进缺氧诱导EndMT的发生,加速肺动脉高压的发展进程[13]。在诱导肺动脉高压的大鼠及发生EndMT的原代大鼠肺动脉内皮细胞中,miR-181b-5p表达下降,而其过表达则有效缓解了肺动脉高压大鼠的血流紊乱、肺血管肥大、右心室重塑和EndMT过程,进一步研究发现miR-181b-5p通过靶向抑制内皮细胞特异性分子1 endocan和TGF-β受体1(transforming growth factor beta receptor 1,TGFBR1)的水平抑制EndMT的发生[14]。
3.6 miRNA调控EndMT参与肿瘤EC、平滑肌细胞和周皮细胞构成肿瘤血管系统,最近的研究表明,EC通过EndMT在肿瘤的转移和进展中起着调控作用。Zhang等[15]研究发现,miR-494在人肝癌组织中表达高于癌旁组织,而去乙酰化酶SIRT3在人肝癌组织中表达低于癌旁组织,miR-494靶向作用于SIRT3,通过调节SIRT3/TGF-β/Smad信号通路,成为促进EndMT和肝癌发展的关键介质;裸鼠体内实验表明,miR-494抑制剂能有效抑制裸鼠肝肿瘤的生长和增殖。miR-302c是另一种与肝癌相关的miRNA,研究发现,其在与肝癌细胞共培养的HUVECs中表达降低,在HUVECs中过表达miR-302c可通过靶向抑制异黏蛋白(metadherin,MTDH)基因的表达抑制EndMT进程,并抑制共培养的肝癌细胞生长;在裸鼠的体内注射与miR-302c过表达HUVECs共培养的肝癌细胞的裸鼠肿瘤明显小于注射与正常HUVECs共培养的肝癌细胞的裸鼠肿瘤[16]。
4 lncRNA调控EndMT参与疾病发生发展 4.1 lncRNA调控EndMT参与动脉粥样硬化染色体基因异常与EndMT和动脉粥样硬化的发生密切相关,最新的研究发现,染色体9p21(chromosome 9p21,Chr9p21)位点是目前已知的与动脉粥样硬化有关的最强遗传风险因素,lncRNA ANRIL就在其编码区域内[17]。多梳抑制复合物(polycomb repressive complex,PRC)是细胞中主要的基因抑制复合物之一,负责启动和维持表观遗传染色质修饰,从而控制基因表达[18]。Holdt等[17]对人外周血单核细胞的研究发现,动脉粥样硬化患者中ANRIL的表达升高,在过表达ANRIL的血管内皮细胞中发现,ANRIL通过与PRC结合,促进细胞的增殖、迁移、抑制细胞凋亡,诱发血管内皮细胞发生EndMT,从而导致动脉粥样硬化的发生,而敲低ANRIL表达,则逆转了上述过程。lncRNA MALAT1在进化上高度保守,在动脉粥样硬化斑块中表达水平普遍降低,研究表明,ApoE-/-MALAT1-/-小鼠更易发生动脉粥样硬化[19]。另有研究表明,MALAT1的高表达诱发了EndMT的发生[20-21],但关于MALAT1在动脉粥样硬化中对EndMT的调控作用还未见报道,有待进一步研究。
4.2 lncRNA调控EndMT参与糖尿病在糖尿病患者中,高糖环境可引发视网膜微血管内皮细胞受损,使内皮细胞发生EndMT。Thomas等[22]发现,lncRNA H19在葡萄糖诱导的HRMECs中表达下降,而过表达H19则显著逆转EndMT;在H19敲除糖尿病小鼠模型中抑制TGF-β1表达可缓解EndMT的进程,表明H19通过TGF-β1调节EndMT,最终参与糖尿病视网膜病变的发生。DNA甲基转移酶1(DNA methyltransferase 1,DNMT1)是DNMT家族的一员,其异常表达可影响DNA甲基化。在糖尿病大鼠视网膜组织中基因甲基化程度明显加深,DNMT1可通过甲基化lncRNA MEG3启动子区域抑制MEG3的表达,从而激活PI3K/Akt/mTOR信号通路促进大鼠视网膜微血管内皮细胞的EndMT,加重糖尿病引发的视网膜损伤[23]。Tan等[24]研究发现,MALAT1在高糖诱导的HRMECs中表达升高,MALAT1靶向抑制miR-205-5p从而解除miR-205-5p对VEGF的抑制作用,诱发EndMT并促进糖尿病视网膜病变。
4.3 lncRNA调控EndMT参与血管生成lncRNA在功能上除了调控自身的转录位点(顺式调节)外,还可以调节远处染色体位点的基因表达(反式调节)。Neumann等[25]发现,缺氧诱导的HUVECs中lncRNA GATA6-AS表达明显升高,而沉默GATA6-AS可促进赖氨酸氧化酶2(lysyl oxidase like 2,ROCK1)表达,从而阻断TGF-β2诱导的EndMT,抑制内皮细胞迁移,促进血管形成;在免疫缺陷小鼠体内注射沉默GATA6-AS的HUVECs后,小鼠血管生成能力明显增强。
4.4 lncRNA调控EndMT参与肿瘤研究发现,相比于正常人,肺癌患者的循环内皮祖细胞发生了EndMT,且MALAT1表达升高,MALAT1作为一种miRNA海绵与miR-145竞争性结合,靶向作用于TGFBR2和Smad3,从而促进EndMT的发生[21]。血管生成拟态(vasculogenic mimicry,VM)是指侵袭性肿瘤细胞模仿胚胎血管生成网络模式的独特能力,目前的研究表明,lncRNA n339260在人类肝癌细胞VM过程中上调VE-cadherin的表达[26],而VE-cadherin作为内皮细胞的标志物与EndMT的发生密切相关,因此,lncRNA n339260可能调控EndMT的发生,但是其调控机制及作用靶标目前尚不清楚,未来还需要进一步的研究。
5 circRNA调控EndMT参与疾病发生发展 5.1 circRNA调控EndMT参与脑血管疾病EndMT与血脑屏障完整性受损有关,circRNA在大脑中高度表达,并参与阿尔茨海默病、帕金森病等多种脑疾病的病理过程。Yang等[27]研究表明,抑制circHECW2表达可减轻脂多糖(lipopolysaccharide,LPS)导致的小鼠脑血管损伤和内皮细胞EndMT,circHECW2可通过与miR-30d结合,调控自噬蛋白5(autophagy related 5,ATG5)的表达,从而调节脑血管中EndMT的过程。因此,特异性阻断circHECW2是治疗血脑屏障损伤的潜在方法。Bai等[28]的实验发现,miR-143在急性缺血性中风患者和小鼠中风模型的血浆中表达升高,而circDLGAP4表达水平则显著降低,进一步实验证明,circDLGAP4通过与miR-143结合发挥作用,在短暂性大脑中动脉闭塞模型中,circDLGAP4过表达组小鼠脑微血管内皮细胞发生EndMT的程度得到明显改善,即上调circDLGAP4表达可通过抑制EndMT减轻血脑屏障损伤、神经功能缺损和梗死面积。
5.2 circRNA调控EndMT参与纤维化疾病矽肺是一种肺部疾病,其特征是长期吸入含有游离硅尘的空气导致成纤维细胞的过度增殖和迁移,从而使矽肺患者发生进行性肺纤维化,多项研究表明,内皮细胞可通过EndMT参与矽肺的发生[29]。Fang等[30]发现,SiO2可诱导小鼠肺部血管发生EndMT,SiO2可上调circHECTD1的表达,通过抑制其宿主基因HECTD1的表达诱导EndMT,特异性敲除circHECTD1则逆转了SiO2诱导的EndMT,最终抑制肺纤维化的进程。
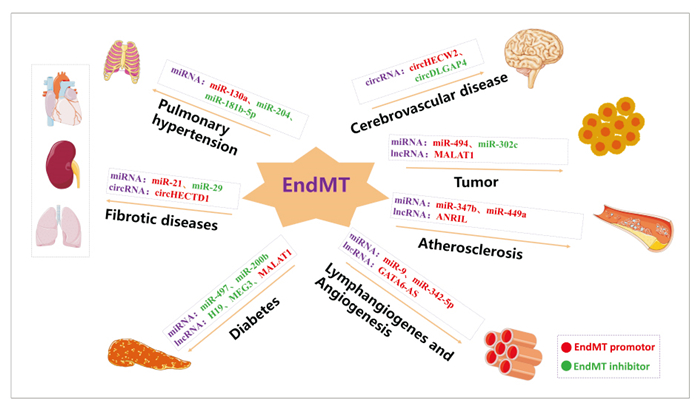
6 总结与展望在本篇综述中,我们总结了ncRNAs在与EndMT有关的众多疾病中发挥的作用(Fig 1),并总结了在研究过程中所涉及到的ncRNAs和实验模型(Tab 1)。通过总结我们发现,EndMT是动脉粥样硬化、器官纤维化、糖尿病、肺动脉高压、血管生成、脑血管畸形以及肿瘤等众多疾病的发病基础,而ncRNAs在调节EndMT这一过程中发挥的关键作用可能与调控EndMT相关转录因子、内皮、间充质细胞标志物以及EndMT相关信号通路有关。我们发现,近几年以来人们在miRNA领域的研究相对丰富,所涉及的疾病比较广泛,然而,对于circRNA的研究却相对较少,circRNA在体内具有更加稳定的结构,可以耐受RNA酶的降解,其在众多疾病中的调控作用具有较大的研究前景和应用价值。值得注意的是,部分ncRNAs通过调控EndMT在血管生成、动脉粥样硬化、肿瘤等疾病方向的作用机制及其作用靶点目前尚不清楚,未来还需要继续深入的研究。此外,EndMT与血管生成的关系具有两面性和复杂性,一方面EC发生EndMT后内皮功能减退,成管能力减弱;一方面其获得了更强的迁移能力,更易迁移至缺血区域形成血管,因此,未来还需进一步明确微环境对EndMT与血管生成关系的影响。总的来说,ncRNAs调控EndMT是一个具有挑战性且极具光明前途的领域,ncRNAs是EndMT相关疾病未来临床治疗的潜在靶点。
|
| Fig 1 ncRNAs participate in occurrence and development of diseases by regulating EndMT circRNA: circular RNA; EndMT: endothelial to mesenchymal transition; lncRNA: long non-coding RNA; miRNA: microRNA; ncRNAs: non-coding RNAs. |
| Disease | ncRNAs | Target | Experimental model | Reference |
| Atherosclerosis | miR-374b | MAPK7 | ex vivo: porcine abdominal trifurcations, aorta of mice, human coronary arteries | |
| in vitro: HUVECs | [2] | |||
| miR-449a | AdipoR2 | in vivo: ApoE-/-mice | ||
| ex vivo: human carotid atherosclerotic plaque | ||||
| in vitro: HUVECs | [3] | |||
| ANRIL | PRC | ex vitro: human peripheral blood mononuclear cells | [17, 18] | |
| Fibrotic diseases | miR-21 | Smad7 | in vivo: diabetes mellitus mouse model | |
| in vitro: HUVECs | [4] | |||
| miR-29 | DPP-4 | in vivo: diabetes mellitus mouse model | ||
| in vitro: HUVECs | [5] | |||
| circHECTD1 | HECTD1 | in vivo: mice exposed to SiO2 | ||
| ex vivo: lung tissue from silicosis patients | ||||
| in vitro: HUVECs | [30] | |||
| Lymphangiogenes | miR-9 | NF-κB | in vitro: human and rat lymphatic endothelial cells | [6] |
| Angiogenesis | miR-342-5p | endoglin | in vivo: miR-342-5p overexpressing mouse model | |
| in vitro: HUVECs | [7] | |||
| GATA6-AS | LOXL2 | in vivo: hind limb ischemia mouse model | ||
| in vitro:HUVECs | [25] | |||
| Diabetes | miR-497 | ROCK1 | ||
| ROCK2 | in vivo: diabetes mellitus rat model | |||
| in vitro: human glomerular endothelial cells | [8] | |||
| miR-200b | Smad2 | |||
| Snai1 | in vivo: diabetes mellitus mouse model | |||
| p300in vitro: HRMECs | [9] | |||
| H19 | TGF-β1 | in vivo: diabetes mellitus mouse model | ||
| in vitro: HRMECs | [22] | |||
| MEG3 | PI3K/Akt/mTOR | in vivo: diabetes mellitus rat model | ||
| in vitro: rat retinal microvascular endothelial cells | [23] | |||
| MALAT1 | miR-205-5p | in vivo: diabetes mellitus mouse model | ||
| in vitro: HRMECs | [24] | |||
| Pulmonary hypertension | miR-130a | BMPR2 | in vivo: pulmonary arterial hypertension mouse model | |
| in vitro: MVECs | [12] | |||
| miR-204 | ATG7 | in vivo: hypoxia rat model | ||
| ex vitro: rat pulmonary artery | ||||
| in vitro: HPAECs | [13] | |||
| miR-181b-5p | Endocan | in vivo: pulmonary arterial hypertension rat model | ||
| TGFBR1 | in vitro: rat pulmonary artery endothelial cells | [14] | ||
| Cerebrovascular diseases | circHECW2 | miR-30d | in vivo: LPS-induced mouse model | |
| in vitro: HBMECs | [27] | |||
| circDLGAP4 | miR-143 | in vivo: transient middle cerebral artery occlusion mouse model | ||
| ex vivo: plasma of acute ischemic stroke patients | ||||
| in vitro: mouse brain endothelial cells | [28] | |||
| Tumor | miR-494 | SIRT3 | in vivo: hepatocellular carcinoma xenografts in nude mouse | [15] |
| miR-302c | MTDH | in vivo: hepatocellular carcinoma xenografts in nude mouse | ||
| in vitro: HUVECs | [16] | |||
| MALAT1 | miR-145 | ex vivo: circulating endothelial progenitor cells of lung cancer patients | [21] | |
| ATG7: autophagy related 7; BMPR2: bone morphogenetic protein receptor 2; DPP-4: dipeptidyl peptidase-4; EndMT: endothelial to mesenchymal transition; HUVECs: human umbilical vein endothelial cells; HRMECs: human retinal microvascular endothelial cells; HPAECs: human pulmonary artery endothelial cells; HBMECs: human brain microvascular endothelial cells, LOXL2: lysyl oxidase like 2; MTDH: metadherin; MVECs: pulmonary microvascular endothelial cells; MAPK7: mitogen-activated kinase 7; ncRNAs: non-coding RNAs; NF-κB: nuclear factor-κB; PRC: polycomb repressive complex; ROCK1: rho-associated coiled-coil containing kinases 1; ROCK2: rho-associated coiled-coil containing kinases 2; Snai1: snail family transcriptional repressor 1; Smad2: SMAD family member 2; Smad7: SMAD family member 7; TGF-β1: transforming growth factor-β1; TGFBR1: transforming growth factor beta receptor 1. | ||||
| [1] |
何丽, 涂梦欣, 黄梅, 等. 红景天苷调控KLF4/eNOS信号抑制Hcy诱导内皮-间质转分化的作用[J]. 中国药理学通报, 2021, 37(5): 681-6. He L, Tu M X, Huang M, et al. Salidroside inhibits endothelial-mesenchymal transition by regulating KLF4 /eNOS signaling pathway[J]. Chin Pharmacol Bull, 2021, 37(5): 681-6. doi:10.3969/j.issn.1001-1978.2021.05.016 |
| [2] |
Vanchin B, Offringa E, Friedrich J, et al. MicroRNA-374b induces endothelial-to-mesenchymal transition and early lesion formation through the inhibition of MAPK7 signaling[J]. J Pathol, 2019, 247(4): 456-70. doi:10.1002/path.5204 |
| [3] |
Jiang L, Hao C, Li Z, et al. miR-449a induces EndMT, promotes the development of atherosclerosis by targeting the interaction between AdipoR2 and E-cadherin in Lipid Rafts[J]. Biomed Pharmacother, 2019, 109: 2293-304. doi:10.1016/j.biopha.2018.11.114 |
| [4] |
Li Q, Yao Y, Shi S, et al. Inhibition of miR-21 alleviated cardiac perivascular fibrosis via repressing EndMT in T1DM[J]. J Cell Mol Med, 2020, 24(1): 910-20. doi:10.1111/jcmm.14800 |
| [5] |
Kanasaki K, Shi S, Kanasaki M, et al. Linagliptin-mediated DPP-4 inhibition ameliorates kidney fibrosis in streptozotocin-induced diabetic mice by inhibiting endothelial-to-mesenchymal transition in a therapeutic regimen[J]. Diabetes, 2014, 63(6): 2120-31. doi:10.2337/db13-1029 |
| [6] |
Chakraborty S, Zawieja D C, Davis M J, Muthuchamy M. MicroRNA signature of inflamed lymphatic endothelium and role of miR-9 in lymphangiogenesis and inflammation[J]. Am J Physiol Cell Physiol, 2015, 309(10): C680-92. doi:10.1152/ajpcell.00122.2015 |
| [7] |
Yan XC, Cao J, Liang L, et al. miR-342-5p is a Notch downstream molecule and regulates multiple angiogenic pathways including Notch, vascular endothelial growth factor and transforming growth factor beta signaling[J]. J Am Heart Assoc, 2016, 5(2): e003042. doi:10.1161/JAHA.115.003042 |
| [8] |
Liu F, Zhang S, Xu R, et al. Melatonin attenuates endothelial-to-mesenchymal transition of glomerular endothelial cells via regulating miR-497/ROCK in diabetic nephropathy[J]. Kidney Blood Press Res, 2018, 43(5): 1425-36. doi:10.1159/000493380 |
| [9] |
Cao Y, Feng B, Chen S, et al. Mechanisms of endothelial to mesenchymal transition in the retina in diabetes[J]. Invest Ophthalmol Vis Sci, 2014, 55(11): 7321-31. doi:10.1167/iovs.14-15167 |
| [10] |
Giordo R, Nasrallah G K, Posadino A M, et al. Resveratrol-elicited PKC inhibition counteracts NOX-mediated endothelial to mesenchymal transition in human retinal endothelial cells exposed to high glucose[J]. Antioxidants (Basel), 2021, 10(2): 224. doi:10.3390/antiox10020224 |
| [11] |
Evans C E, Cober N D, Dai Z, et al. Endothelial cells in the pathogenesis of pulmonary arterial hypertension[J]. Eur Respir J, 2021, 58(3): 2003957. doi:10.1183/13993003.03957-2020 |
| [12] |
Li L, Kim I K, Chiasson V, et al. NF-kappaB mediated miR-130a modulation in lung microvascular cell remodeling: Implication in pulmonary hypertension[J]. Exp Cell Res, 2017, 359(1): 235-42. doi:10.1016/j.yexcr.2017.07.024 |
| [13] |
Liu T, Zou X Z, Huang N, et al. Down-regulation of miR-204 attenuates endothelial-mesenchymal transition by enhancing autophagy in hypoxia-induced pulmonary hypertension[J]. Eur J Pharmacol, 2019, 863: 172673. doi:10.1016/j.ejphar.2019.172673 |
| [14] |
Zhao H, Wang Y, Zhang X, et al. miR-181b-5p inhibits endothelial-mesenchymal transition in monocrotaline-induced pulmonary arterial hypertension by targeting endocan and TGFBR1[J]. Toxicol Appl Pharmacol, 2020, 386: 114827. doi:10.1016/j.taap.2019.114827 |
| [15] |
Zhang J, Zhu Y, Hu L, et al. miR-494 induces EndMT and promotes the development of HCC (Hepatocellular Carcinoma) by targeting SIRT3/TGF-beta/SMAD signaling pathway[J]. Sci Rep, 2019, 9(1): 7213. doi:10.1038/s41598-019-43731-4 |
| [16] |
Zhu K, Pan Q, Jia L Q, et al. MiR-302c inhibits tumor growth of hepatocellular carcinoma by suppressing the endothelial-mesenchymal transition of endothelial cells[J]. Sci Rep, 2014, 4: 5524. doi:10.1038/srep05524 |
| [17] |
Holdt L M, Hoffmann S, Sass K, et al. Alu elements in ANRIL non-coding RNA at chromosome 9p21 modulate atherogenic cell functions through trans-regulation of gene networks[J]. PLoS Genet, 2013, 9(7): e1003588. doi:10.1371/journal.pgen.1003588 |
| [18] |
Holdt L M, Teupser D. Long noncoding RNA ANRIL: lnc-ing genetic variation at the chromosome 9p21 locus to molecular mechanisms of atherosclerosis[J]. Front Cardiovasc Med, 2018, 5: 145. doi:10.3389/fcvm.2018.00145 |
| [19] |
Cremer S, Michalik K M, Fischer A, et al. Hematopoietic deficiency of the long noncoding RNA MALAT1 promotes atherosclerosis and plaque inflammation[J]. Circulation, 2019, 139(10): 1320-34. doi:10.1161/CIRCULATIONAHA.117.029015 |
| [20] |
Qin W, Zhang L, Li Z, et al. SIRT6-mediated transcriptional suppression of MALAT1 is a key mechanism for endothelial to mesenchymal transition[J]. Int J Cardiol, 2019, 295: 7-13. doi:10.1016/j.ijcard.2019.07.082 |
| [21] |
Xiang Y, Zhang Y, Tang Y, et al. MALAT1 modulates TGF-beta1-induced endothelial-to-mesenchymal transition through downregulation of miR-145[J]. Cell Physiol Biochem, 2017, 42(1): 357-72. doi:10.1159/000477479 |
| [22] |
Thomas A A, Biswas S, Feng B, et al. lncRNA H19 prevents endothelial-mesenchymal transition in diabetic retinopathy[J]. Diabetologia, 2019, 62(3): 517-30. doi:10.1007/s00125-018-4797-6 |
| [23] |
He Y, Dan Y, Gao X, et al. DNMT1-mediated lncRNA MEG3 methylation accelerates endothelial-mesenchymal transition in diabetic retinopathy through the PI3K/Akt/mTOR signaling pathway[J]. Am J Physiol Endocrinol Metab, 2021, 320(3): E598-608. doi:10.1152/ajpendo.00089.2020 |
| [24] |
Tan A, Li T, Ruan L, et al. Knockdown of Malat1 alleviates high-glucose-induced angiogenesis through regulating miR-205-5p/VEGF-A axis[J]. Exp Eye Res, 2021, 207: 108585. doi:10.1016/j.exer.2021.108585 |
| [25] |
Neumann P, Jae N, Knau A, et al. The lncRNA GATA6-AS epigenetically regulates endothelial gene expression via interaction with LOXL2[J]. Nat Commun, 2018, 9(1): 237. doi:10.1038/s41467-017-02431-1 |
| [26] |
Zhao X, Sun B, Liu T, et al. Long noncoding RNA n339260 promotes vasculogenic mimicry and cancer stem cell development in hepatocellular carcinoma[J]. Cancer Sci, 2018, 109(10): 3197-208. doi:10.1111/cas.13740 |
| [27] |
Yang L, Han B, Zhang Y, et al. Engagement of circular RNA HECW2 in the nonautophagic role of ATG5 implicated in the endothelial-mesenchymal transition[J]. Autophagy, 2018, 14(3): 404-18. doi:10.1080/15548627.2017.1414755 |
| [28] |
Bai Y, Zhang Y, Han B, et al. Circular RNA DLGAP4 ameliorates ischemic stroke outcomes by targeting miR-143 to regulate endothelial-mesenchymal transition associated with blood-brain barrier integrity[J]. J Neurosci, 2018, 38(1): 32-50. doi:10.1523/JNEUROSCI.1348-17.2017 |
| [29] |
Chao J, Wang X, Zhang Y, et al. Role of MCPIP1 in the endothelial-mesenchymal transition induced by silica[J]. Cell Physiol Biochem, 2016, 40(1-2): 309-25. doi:10.1159/000452547 |
| [30] |
Fang S, Guo H, Cheng Y, et al. circHECTD1 promotes the silica-induced pulmonary endothelial-mesenchymal transition via HECTD1[J]. Cell Death Dis, 2018, 9(3): 396. doi:10.1038/s41419-018-0432-1 |

