


2. 延安大学附属医院肝胆外科,陕西 延安 716000
郑蕊(1994-),女,硕士生,研究方向:肿瘤病因学,共同第一作者,E-mail: ruizheng2023@126.com。
 ,
ZHENG Rui1
,
ZHENG Rui1 ,
LIU Xiao-bin1,
LIU Yong-xian1,
WANG Ya-ping1,
ZHANG Yu-fu2,
ZHANG Jing1,
JIN Xiao-yan1,
LIU Yu-si1
,
LIU Xiao-bin1,
LIU Yong-xian1,
WANG Ya-ping1,
ZHANG Yu-fu2,
ZHANG Jing1,
JIN Xiao-yan1,
LIU Yu-si1

2. Dept of Hepatobiliary Surgery, the Affiliated Hospital of Yan'an University, Yan'an Shaanxi 716000, China
神经胶质瘤是最常见的原发性颅脑恶性肿瘤,其发病率约占颅内肿瘤的60%,具有复发率高且治愈率低等特点[1]。其中,多形性胶质母细胞瘤(glioblastoma,GBM)属于WHO Ⅳ级分型,其分化程度低且预后极差,患者平均生存时间约为14.6个月,5年生存率小于5%[2]。GBM的高侵袭性、遗传异质性加之免疫微环境和血脑屏障的阻碍给治疗带来了巨大挑战。替莫唑胺(temozolomide,TMZ)作为GBM常用的一线化疗药物,其口服利用度高且易透过血脑屏障[3]。但是,约50%的GBM患者会对TMZ产生耐药性,这是由于患者体内存在的DNA修复蛋白可以挽救TMZ对DNA的损伤,进而诱导耐药产生[4]。因此,迫切需要研发高效、低毒的新型抗GBM药物以改善或逆转耐药现状。
中药已成为我国目前重要的药物开发来源,大多数疗效确切,不良反应小,并能有效改善癌症患者症状,延长生存时间[5]。柴胡(Radix bupleuri,RB)是一种传统的天然中草药,也是诸多复方制剂中的重要成分[6]。柴胡皂苷D(saikosaponin D,SSD)是从RB中提取的最有效的活性单体成分之一,具有抗炎、抗病毒和抗肿瘤等多种药理功效,可通过抑制肿瘤细胞增殖、调控凋亡与自噬等途径发挥抑瘤作用[7]。SSD能够穿透血脑屏障,提示其可能成为治疗颅脑恶性肿瘤的“种子候选者”。研究表明,SSD通过协同给药方式可提高多种肿瘤细胞对化疗药如长春新碱、紫杉醇和顺铂的敏感性[8],但将SSD与TMZ联用治疗GBM的研究鲜有报道,且该联合给药法对GBM细胞是否具有广谱性也仍未知。据此,我们将探究不同GBM细胞系对SSD与TMZ的敏感性差异,筛选出联合给药的有效配伍浓度,观察其对GBM细胞的杀伤效应。并在分子水平检测两者体外配伍作用于GBM细胞后胞内内质网应激通路(endoplasmic reticulum stress,ERS)激活状态及下游凋亡通路与自噬通路变化。本文旨在通过协同给药提高SSD对胶质瘤的抑制作用并增强TMZ的化疗效果,促进SSD抗GBM的中药应用从基础研究早日走向临床转化。
1 材料 1.1 材料人胶质瘤细胞U251、人胶质母细胞瘤细胞LN-428和大鼠胶质瘤细胞RG-2购自中科院细胞库。
1.2 试剂SSD(货号20874-52-6,纯度≥99%,上海源叶生物科技有限公司);TMZ(货号85622-93-1,纯度≥99%,索莱宝);H-DMEM培养基、胎牛血清、胰蛋白酶、青-链霉素(BI);CCK-8试剂盒、苏木精-伊红染色液、中性树胶、DAB显色液、Hoechst 33258染色液、MDC染液、BCA蛋白定量试剂盒(博士德);无水乙醇、二甲苯、盐酸乙醇分化液、二甲基亚砜(DMSO)、甲醇、脱脂奶粉(上海慧颖生物科技有限公司);一抗葡萄糖调节蛋白78(glucose regulated protein,GRP78)、C/EBP同源蛋白质(C/EBP homologous protein,CHOP)、磷酸化PKR样内质网激酶(p-PKR-like ER kinase,p-PERK)、转录激活因子6(transcription factor-6,ATF6)、半胱氨酸蛋白酶3(caspase-3)、激活型半胱氨酸蛋白酶3(cleaved-caspase3)、半胱氨酸蛋白酶9(caspase-9)、促凋亡蛋白(Bax)、半胱氨酸蛋白酶12(caspase-12)、微观蛋白轻链3(LC-3)、自噬效应蛋白(Beclin-1)、β-actin购自武汉三鹰生物技术有限公司;辣根过氧化物酶标记山羊抗兔IgG(博奥森);ECL化学发光试剂(Affinity)。
1.3 仪器恒温CO2培养箱(Thermo);全波长酶标仪(BD);离心机(Eppendorf);荧光倒置显微镜(Olympus);凝胶成像分析系统(Bio-Rad)。
2 方法 2.1 GBM细胞系培养RG-2、U251、LN-428细胞使用H-DMEM培养基培养,培养基中添加10%胎牛血清和1%青霉素-链霉素。细胞置于37 ℃、5%CO2培养箱中培养。
2.2 实验分组实验分为空白对照组、SSD给药组、TMZ给药组、SSD联合TMZ给药组(SSD/TMZ)组。细胞化疗敏感性检测实验选用TMZ浓度为0、50、100、200、400 mol·L-1处理GBM细胞;联合给药实验选用SSD浓度9、12 mol·L-1分别与TMZ浓度50和100 mol·L-1配伍处理GBM细胞。
2.3 CCK-8法检测GBM细胞活力制备RG-2、U251、LN-428细胞悬液(3×103个细胞/孔)接种于96孔细胞培养板。待细胞贴壁后按照实验分组选用TMZ与SSD不同浓度给药处理GBM细胞48 h。各孔分别加入10 μL CCK-8试剂,置于培养箱37 ℃孵育1 h。于酶标仪452 nm处检测吸光度值并计算细胞活力。
2.4 HE染色观察GBM细胞形态制备RG-2、U251和LN-428细胞单细胞悬液(7×103个细胞/孔)接种于放有盖玻片的6孔板中,待细胞贴壁加入完全培养基稀释的TMZ和SSD培养48 h;弃培养基,PBS洗3遍,4%多聚甲醛固定20 min,PBS洗去多余固定液;苏木精染色5 min,水洗2~3次;盐酸分化2~3 s,纯水中静置5 min,95%乙醇1 min,伊红染色1 min,常规脱水、透明、中性树胶封片,显微镜下观察并拍照。
2.5 细胞克隆形成实验将对数生长期的RG-2、U251和LN-428细胞制备成单细胞悬液(5×103个细胞/孔)铺于12孔板中;待细胞贴壁后,按照分组加入完全培养基稀释的TMZ和SSD培养5 d;PBS洗3遍,4%多聚甲醛固定15 min,0.1%结晶紫染色20 min,流水冲洗染液,干燥后拍照,ImageJ软件计数集落形成数量。
2.6 Hoechst 33258荧光染色观察GBM细胞核变化制备RG-2、U251和LN-428细胞单细胞悬液(7×103个细胞/孔)接种于放有盖玻片的6孔板中,待细胞贴壁加入完全培养基稀释的TMZ和SSD培养48 h;加入Hoechst 33258荧光染料200 μL,避光静止3~5 min,弃染料,PBS洗3遍,自然晾干;荧光显微镜下观察细胞核情况并拍照。
2.7 MDC染色检测自噬现象制备RG-2、U251和LN-428细胞单细胞悬液(7×103个细胞/孔)接种于放有盖玻片的6孔板中,待细胞贴壁加入完全培养基稀释的TMZ和SSD培养48 h;1×Wash buffer清洗固定液3次,加入MDC(50 mol·L-1)室温避光染色60 min,1×Wash buffer清洗3次,置于荧光显微镜下观察并拍照记录。
2.8 Western blot检测ERS相关蛋白表达筛选出有效配伍给药浓度后按照不同给药实验组处理RG-2、U251和LN-428细胞48 h,去除培养液,PBS洗涤2次。加入细胞裂解液,涡旋振荡仪裂解,4 ℃、13 000 r·min-1离心15 min,吸取上清,加入loading buffer,振荡混匀,沸水浴煮10 min,得到蛋白样品。进行SDS-PAGE凝胶电泳,350 mA恒流电流模式转膜2 h,将PVDF膜置于5%脱脂牛奶中,摇床上室温封闭2 h,4 ℃孵育一抗过夜,一抗为1 ∶1 000稀释的GRP78、CHOP、p-PERK、ATF6、caspase-3、cleaved caspase-3、caspase-9、caspase-12、Bax、LC-3Ⅱ/Ⅰ、Beclin-1和β-actin,次日TBST洗涤3次,室温下与二抗(1 ∶2 000)孵育1 h。ECL化学发光法成像拍照。计算各实验分组目的蛋白表达水平。
2.9 ICC实验验证蛋白表达分布制备RG-2、U251和LN-428细胞单细胞悬液(7×103个细胞/孔)接种于含有爬片皿的6孔板中,加入完全培养基稀释的TMZ和SSD培养48 h。PBS洗3次,加入0.3% TritonX-100,PBS洗3次,加入3%过氧化氢液,PBS洗3次,山羊血清封闭,一抗4 ℃过夜;PBS洗3次,滴加二抗;PBS洗3次,滴加辣根过氧化物酶标记的链霉素亲和素;DAB显色,苏木精复染,封片,显微镜下观察结果并拍照。
2.10 统计学分析本实验使用GraphPad Prism 8.0软件进行统计学分析,所有数据均用x±s表示。两组数据差异分析采用非配对t检验,多组数据差异分析采用One-way ANOVA分析。
3 结果 3.1 GBM细胞对TMZ的敏感性差异分析为确定RG-2、U251和LN-428细胞对TMZ(Fig 1A)敏感性差异,我们选用0、50、100、200、400 mol·L-1 5种TMZ浓度作用于GBM细胞48 h。CCK-8结果表明,当TMZ浓度为50 mol·L-1时,RG-2、U251和LN-428细胞的存活率分别为73.95%、89.2%、94.74%;而TMZ以100 mol·L-1作用于3种细胞后的存活率下降为64.96%、79.06%和82.28%;当TMZ浓度为400 mol·L-1时,RG-2细胞存活率小于50%而U251和LN-428细胞的存活率大于50%(Fig 1B)。HE染色结果显示,对照组细胞呈多边形,细胞核完整,随着TMZ浓度加大,细胞数量逐渐减少,胞质突起延长。3种GBM细胞对TMZ的敏感性程度为RG-2>U251>LN-428(Fig 1C)。

|
| Fig 1 Growth inhibitory effects of TMZ on GBM cells(x±s, n=3) A: Structure of temozolomide; B: CCK-8 cell proliferation assay performed on RG-2, U251 and LN-428 cells with 50, 100, 200 and 400 mol·L-1 TMZ treatments for 48 h; C: HE morphological staining(× 400; scale bars: 50 μm). |
采用CCK-8法检测SSD(Fig 2A)和TMZ联合作用(SSD/TMZ)对GBM细胞增殖的影响。结果表明,RG-2细胞的TMZ(100 mol·L-1)+SSD(12 mol·L-1)组细胞存活率较TMZ(100 mol·L-1)组降低33.5%,较SSD(12 mol·L-1)组降低53.29%(Fig 2B);U251细胞TMZ(100 mol·L-1)+SSD(12 mol·L-1)组细胞存活率较TMZ(100 mol·L-1)组降低26.84%,较SSD(12 mol·L-1)组降低31.04%(Fig 2C);在LN-428细胞中,与单独用药相比,TMZ(100 mol·L-1)+SSD(12 mol·L-1)组分别下降32.61%和35.37%。TMZ(100 mol·L-1)+SSD(12 mol·L-1)组在3种GBM细胞中的抑制率分别为64.24%、59.25%和44.73%(Fig 2D),3种GBM细胞类型对SSD/TMZ的敏感性顺序为RG-2 > U251 > LN- 428。HE染色结果显示(Fig 2E),单独TMZ或SSD给药组细胞数量较多,细胞形态规则,细胞核相对完整;而联合给药组细胞数量明显减少,细胞突起延长,核碎裂程度加重。后续研究选用TMZ(100 mol·L-1)和SSD(12 mol·L-1)作为有效配伍浓度进行联合剂量实验。
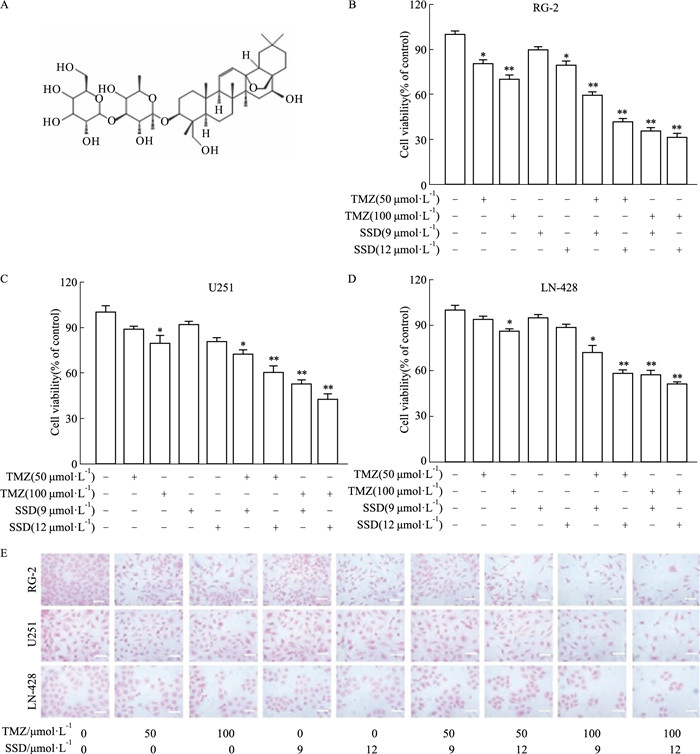
|
| Fig 2 Growth inhibitory effects of saikosaponin D and TMZ on GBM cells(x±s, n=3) A: Structure of saikosaponin D; B, C, D: CCK-8 cell proliferation assay performed on RG-2, U251 and LN-428 cells without and with TMZ (50, 100 mol·L-1), SSD (9, 12 mol·L-1), or SSD+TMZ treatments for 48 h; E: HE morphological staining (× 400; scale bars: 50 μm). *P < 0.05, **P < 0.01 vs Control group. |
平板克隆形成实验显示(Fig 3A),与对照组和单独给药组相比,经有效浓度TMZ联合SSD给药后,细胞克隆形成率明显下降。其中,与TMZ(100 mol·L-1)组相比,RG-2、U251和LN-428细胞的联合给药组克隆细胞数量分别减少了44.29%、36.57%和28.74%。

|
| Fig 3 SSD increased TMZ-induced apoptosis and autophagy on GBM cells(x±s, n=3) A: The changes in cell morphology of RG-2, U251 and LN-428 cells with SSD (12 mol·L-1), TMZ (100 mol·L-1), or SSD+TMZ treatments for 48 h determined by colony formation assay; B: The morphology of apoptosis was observed by Hoechst 33258 fluorescence staining (× 400; scale bars: 50 μm); C: MDC staining (× 400; scale bars: 50 μm). *P < 0.05, **P < 0.01 vs Control group. |
Hoechst荧光染色结果显示(Fig 3B),对照组GBM细胞核形态规则,呈现出弥散均匀的淡蓝色荧光,单独TMZ或SSD给药组细胞质内出现不均匀浓染致密的颗粒块状蓝色荧光,而联合给药组细胞数目明显减少且出现大量不规则细胞核形态,多数细胞核呈现致密浓染的颗粒块状蓝色荧光。结果表明,联合给药可增强TMZ诱导的GBM细胞系凋亡状态。
3.5 有效浓度SSD配伍TMZ对GBM细胞自噬的影响MDC荧光染色结果显示(Fig 3C),对照组GBM细胞核形态规则,胞质呈现出弥散均匀的绿色荧光,单独TMZ或SSD给药组可见细胞质可见致密浓染的绿色颗粒,有效浓度联合给药组胞质内致密浓染的绿色颗粒明显增多,表明联合给药可诱导GBM细胞系自噬小体形成,引发自噬。
3.6 SSD联合TMZ引起GBM细胞ERS相关蛋白激活ICC结果显示(Fig 4A),与对照组及单独给药细胞相比,联合给药组的GBM细胞中GRP78、CHOP、p-PERK和ATF6表达明显升高。Western blot结果表明(Fig 4B),与Control组和TMZ组相比,TMZ联合SSD组处理RG-2细胞后GRP78的表达分别增加了56.37%和43.51%;与TMZ组相比,TMZ联合SSD组处理后U251细胞(37.74%)和LN-428细胞(15.27%)的GRP78水平也明显升高。与TMZ组相比,TMZ联合SSD组处理RG-2、U251、LN-428细胞后CHOP水平分别提高了42.35%、53.40%、62.17%。与TMZ组相比,TMZ联合SSD组处理RG-2、U251、LN-428细胞后p-PERK水平分别提高了52.35%、56.47%,60.12%。与TMZ组相比,TMZ联合SSD组处理RG-2、U251、LN-428细胞后ATF6水平分别提高了15.73%、9.26%和29.18%。

|
| Fig 4 Endoplasmic reticulum stress-related protein activation caused by SSD/TMZ in GBM cells(x±s, n=3) A: Effect of SSD/TMZ on endoplasmic reticulum stress-associated proteins GRP78, CHOP, p-PERK, and ATF6 in RG-2, U251 and LN-428 cell lines detected by ICC staining(×400; scale bars: 50 μm); B, C: Western blot. *P < 0.05, **P < 0.01 vs Control group. |
ICC结果显示(Fig 5A),SSD和TMZ联合处理后,GBM细胞胞质颜色呈深棕色,表明caspase-12、caspase-9和caspase-3主要表达在胞质中,且表达水平与对照组相比均增加。Western blot结果表明(Fig 5B),与TMZ组相比,SSD联合TMZ处理RG-2细胞后胞内caspase-12、caspase-9、caspase-3、Bax的表达水平分别提高了42.36%、38.48%、49.23%和30.34%。SSD联合TMZ给药后,caspase-12、caspase-9、caspase-3和Bax在U251细胞内与TMZ组相比表达水平提高了35.45%、42.21%、31.58%和35.13%;在LN-428细胞内与TMZ组相比表达水平分别提高了42.27%、39.76%、25.54%和26.67%。且与对照组相比,联合给药后可以更大程度地激活caspase-3在GBM细胞中的表达(P<0.05或P<0.01)。

|
| Fig 5 Combination of SSD and TMZ promoted activation of endoplasmic reticulum stress-dependent apoptotic protein in GBM cells(x±s, n=3) 1: Bax; 2: Caspase-12; 3: caspase-9; 4: caspase-3; 5: c-caspase-3. A: The expression of endoplasmic reticulum stress-dependent apoptosis-related proteins Bax, caspase-12, caspase-9, caspase-3 and cleaved caspase-3 in RG-2, U251 and LN-428 cells treated by SSD/TMZ detected by ICC staining (× 400; scale bars: 50 μm); B, C: Western blot. *P < 0.05, **P < 0.01 vs Control group. |
Western blot和ICC结果显示(Fig 6A-C),与TMZ组相比,SSD联合TMZ处理RG-2细胞48 h后,LC3-Ⅱ/LC3-Ⅰ水平升高32.15%,U251细胞升高19.34%,LN-428细胞升高21.89%;细胞中Beclin-1的表达水平分别升高37.82%、28.9%和39.9%。

|
| Fig 6 Combination of SSD and TMZ promoted activation of autophagy protein in GBM cells(x±s, n=3) A: Activated the expression of endoplasmic reticulum stress-dependen autophagy-related proteins LC3 and Beclin-1 in RG-2, U251 and LN-428 cells treated by SSD/TMZ detected by ICC staining (× 400; scale bars: 50 μm); B, C: Western blot. *P < 0.05, **P < 0.01 vs Control group. |
多形性胶质母细胞是最常见的原发性恶性脑肿瘤,患者5年相对生存率位列所有癌症类型中最低(4%~5%)[9]。GBM组织的高度侵袭性使其在临床治疗上不能通过手术完全切除。目前一线化疗药物为TMZ,但由于体内DNA修复蛋白表达上调,50%以上的GBM患者会对TMZ产生耐药[10]。因此,寻求更为安全有效的化疗方案将具有重要的临床意义。
SSD是从天然植物柴胡根茎植物中分离出来的三萜皂苷,是具有抗炎、抗氧化和癌症抑制等重要生物学特性的强效化合物[11]。本研究选用对TMZ具有敏感性差异的3种GBM细胞作为研究对象,采用高、低两种浓度(9、12 mol·L-1)SSD分别与高、低两种浓度(50、100 mol·L-1)TMZ联合应用,评价SSD提高TMZ治疗GBM的可行性。CCK-8法检测RG-2、U251和LN-428细胞的增殖活性结果表明,与TMZ给药组相比,SSD可明显提高TMZ治疗GBM的敏感性,联合给药组培养的细胞增殖明显受抑,且呈现与配伍浓度相关的依赖性抑制。进而筛选12 mol·L-1 SSD联合100 mol·L-1 TMZ作为有效配伍浓度。HE染色结果验证联合给药组细胞形态明显改变。Hoechst染色显示联合给药组呈致密亮蓝色核,DNA损伤严重。且SSD/TMZ组观察到凋亡小体发生。
ERS通路是可以介导与死亡受体和线粒体途径不同的一条凋亡通路[12]。在肿瘤微环境中,癌细胞遇到内外界刺激会导致内质网腔内错误折叠蛋白的积累,未折叠蛋白反应(unfolded protein response,UPR)进而被触发以帮助细胞恢复内质网稳态[13]。其中,PERK、ATF6和IRE1驱动的3个UPR分支的激活对于ERS发生至关重要。PERK和ATF6是ERS的主要转导因子[14],而GRP78是ERS的关键调控因子。以上分子的激活可诱导ERS相关促凋亡分子的表达,如CHOP和caspase-12等,最终导致细胞凋亡。本研究Western blot和ICC结果显示,与TMZ单独处理相比,SSD/TMZ处理后GBM细胞GRP78、CHOP和ATF6的表达水平明显增强,且PERK蛋白被磷酸化,表明SSD/TMZ处理后ERS被激活。内质网持续激活后细胞会启动依赖caspase-12的凋亡。其中,caspase-9是caspase-12诱导凋亡通路的启动子,而caspase-3是执行者。因此,本研究对caspase-12、caspase-9和caspase-3、Bax进行了分析。Western blot和ICC结果显示,与TMZ处理相比,SSD /TMZ处理后细胞质中caspase-12、caspase-9、caspase-3和Bax蛋白表达水平明显升高。结果表明,SSD/TMZ联合治疗GBM细胞系较TMZ单独能够明显提高ERS通路蛋白的表达水平。
在肿瘤发生发展的微环境中,自噬被认为是与凋亡同等重要的影响因素[15]。自噬既可作为细胞生存的保护机制,也是一种细胞死亡方式[16],故被长期视作一把肿瘤治疗的“双刃剑”。TMZ作为GBM的化疗手段,会明显增加细胞氧化应激与DNA损伤。肿瘤细胞可借助自噬从而维持内环境稳态抵抗药物诱导的凋亡作用,同时自噬也可能增强肿瘤细胞对TMZ的敏感性,从而主动诱导程序性细胞死亡的发生。因而,诱导自噬在肿瘤治疗中扮演着重要的角色。本研究通过Western blot和ICC实验验证了联合治疗后GBM细胞自噬标记蛋白LC3-Ⅱ/Ⅰ和Beclin-1的表达。结果显示,与TMZ单独给药组相比,SSD/TMZ处理后GBM细胞LC3-Ⅱ/Ⅰ和Beclin-1水平明显升高,进而表明SSD/TMZ处理能够明显激活GBM细胞自噬的发生。在肿瘤的生存与复发之际,常会导致免疫缺陷与自噬失调。中药对改善肿瘤微环境至关重要。中药能否通过促进肿瘤细胞自噬性死亡达到抑瘤目的,也已成为中药抗肿瘤研究的新方向,进一步研究SSD/TMZ联用介导的GBM凋亡与自噬通过何种交叉方式联系,以及在不同类型GBM细胞中的异同影响,将需要后续大量的实验深入探讨。
综上,SSD联合TMZ作用于大鼠源性RG-2、人源性U251和LN-428胶质母细胞瘤细胞,SSD可能以诱导ERS形式触发凋亡并同时介导自噬,进而增强GBM细胞对TMZ的化疗敏感性。需结合动物体内研究以更深入探究联合给药对GBM细胞生物学特性的影响,在日后多层次的实验基础上利用高效、低毒的中药联合化疗的综合方案将更为安全而广泛地走向临床。
| [1] |
Wu W, Klockow J L, Zhang M, et al. Glioblastoma multiforme (GBM): an overview of current therapies and mechanisms of resistance[J]. Pharmacol Res, 2021, 171: 105780. doi:10.1016/j.phrs.2021.105780 |
| [2] |
Lim S H, Lee H S, Han H K, et al. Saikosaponin A and D inhibit adipogenesis via the AMPK and MAPK signaling pathways in 3T3-L1 adipocytes[J]. Int J Mol Sci, 2021, 22(21): 11409. doi:10.3390/ijms222111409 |
| [3] |
Jiang J, Meng Y, Hu S, et al. Saikosaponin D: a potential therapeutic drug for osteoarthritis[J]. J Tissue Eng Regen Med, 2020, 14(8): 1175-84. doi:10.1002/term.3090 |
| [4] |
Wang B, Min W, Lin S, et al. Saikosaponin-d increases radiation-induced apoptosis of hepatoma cells by promoting autophagy via inhibiting mTOR phosphorylation[J]. Int J Med Sci, 2021, 18: 1465-73. doi:10.7150/ijms.53024 |
| [5] |
洪婷, 王依蕾, 曾海荣, 等. 葫芦素B诱导铁死亡抑制肝癌Huh-7细胞增殖的机制[J]. 中国药理学通报, 2023, 39(4): 638-45. Hong T, Wang Y L, Zeng H R, et al. Mechanism of cucurbitacin B suppresses proliferation of hepatocellular carcinoma Huh-7 cells via inducing ferroptosis[J]. Chin Pharmacol Bull, 2023, 39(4): 638-45. doi:10.12360/CPB202103070 |
| [6] |
Zhang J Y, Ma S, Liu X, et al. Activating transcription factor 6 regulates cystathionine to increase autophagy and restore memory in Alzheimer' s disease model mice[J]. Biochem Biophys Res Commun, 2022, 615: 109-15. doi:10.1016/j.bbrc.2022.05.053 |
| [7] |
Liang J, Sun J, Liu A, et al. Saikosaponin D improves chemosensitivity of glioblastoma by reducing the its stemness maintenance[J]. Biochem Biophys Rep, 2022, 24(32): 101342. |
| [8] |
Luo J, Wang J, Yang J, et al. Saikosaponin B1 and Saikosaponin D inhibit tumor growth in medulloblastoma allograft mice via inhibiting the Hedgehog signaling pathway[J]. J Nat Med, 2022, 76(3): 584-93. doi:10.1007/s11418-022-01603-8 |
| [9] |
周辉, 李睿春, 颜大钧, 等. miR-106a-5p靶向STAT3抑制胶质瘤细胞增殖和侵袭的机制[J]. 实用医学杂志, 2021, 31(20): 2580-5. Zhou H, Li R C, Yan D J, et al. Mechanism of inhibition of proliferation and invasion of glioma cells by miR-106a-5p targeting STAT3[J]. J Pract Med, 2021, 31(20): 2580-5. doi:10.3969/j.issn.1006-5725.2021.20.003 |
| [10] |
Wang M M, Wang X J, Jin X Y. Cell-based and cell-free immunotherapies for glioblastoma: current status and future directions[J]. Front immunol, 2023, 14: 1175118. doi:10.3389/fimmu.2023.1175118 |
| [11] |
Chen X, Cubillos-Ruiz J R. Endoplasmic reticulum stress signals in the tumour and its microenvironment[J]. Nat Rev Cancer, 2021, 21(2): 71-88. doi:10.1038/s41568-020-00312-2 |
| [12] |
冯梦林, 卫心怡, 王楠娅, 等. 过表达lncRNA AC079466.1通过内质网应激信号通路对非小细胞肺癌细胞凋亡的影响[J]. 中国药理学通报, 2023, 39(9): 1689-95. Feng M L, Wei X Y, Wang N Y, et al. Effects of overexpression of lncRNA AC079466.1 on apoptosis of NSCLC cells through endoplasmic reticulum stress signaling pathway[J]. Chin Pharmacol Bull, 2023, 39(9): 1689-95. |
| [13] |
Liu G, Guan Y, Liu Y, et al. Saikosaponin D inducing apoptosis and autophagy through the activation of endoplasmic reticulum stress in glioblastoma[J]. Biomed Res Int, 2022, 2022: 5489553. |
| [14] |
Chandrasekar G, Bansal V S, Panigrahi M, et al. An overview of targets and therapies for glioblastoma multiforme[J]. J Cancer Res Ther, 2022, 18(3): 591-8. doi:10.4103/jcrt.jcrt_1324_21 |
| [15] |
Ramkumar K, Lee A S, Ljungman M, et al. The hydroxyquinoline analogue YUM70 inhibits GRP78 to induce ER stress-mediated apoptosis in pancreatic cancer[J]. Cancer Res, 2021, 81(7): 1883-95. doi:10.1158/0008-5472.CAN-20-1540 |
| [16] |
Shen J, Wang L, Wang X, et al. Cypermethrin induces apoptosis of sertoli cells through the endoplasmic reticulum pathway[J]. Toxicol Ind Health, 2022, 38(7): 399-407. doi:10.1177/07482337221104905 |