

心血管疾病(cardiovascular disease,CVD)是导致人类死亡和健康寿命损失的首要原因,《中国心血管健康与疾病报告2021》显示中国CVD发病率仍居高不下,每5例因病死亡的病例中就有2例死于CVD,占中国疾病死亡人数的40%以上。动脉粥样硬化(atherosclerosis,AS)作为CVD的重要发病基础,典型表现为脂质、钙质和坏死细胞碎片等聚集而形成的粥样硬化斑块沉积在血管壁,导致动脉内膜增厚以及血管狭窄,引发靶器官缺血性改变。由于AS是一种受遗传、生活方式和环境因素影响的多因素疾病,暂无有效的特异性治疗方法选择,特别是个人生活方式,如吸烟、睡眠不足、体力活动以及饮食习惯等均与AS的发生发展息息相关,近些年来,已经证实膳食富含槲皮素、白藜芦醇和儿茶素等天然黄酮类植物化学物可有效降低AS发病风险[1]。
黄酮醇槲皮素是食物中最丰富且分布最广的天然多酚类植物化合物之一,广泛存在于洋葱、西红柿、葡萄等蔬菜水果中。槲皮素的日常膳食摄入量约占总黄酮醇的60%~75%,不同国家和地区槲皮素的具体摄入量也有所差别,主要取决于不同人群蔬菜、水果和茶的摄入水平[2]。近年来,流行病学研究表明,膳食槲皮素摄入量与CVD发病风险之间呈显著负相关[1]。现有研究证实,槲皮素可特异性靶向富集于人AS斑块并发挥生物活性作用[3]。与此同时,槲皮素在AS炎症反应、氧化应激和脂质代谢等方面表现出的良好调控作用亦颇受关注,鉴于国内外相关研究较多,本文总结近年来槲皮素对AS保护作用的研究进展以进一步启发后续研究方向。
1 抗炎作用AS作为一种慢性炎症性疾病,炎症反应始终贯穿AS疾病进展的各个阶段,是内皮功能障碍、单核细胞浸润、巨噬细胞泡沫化以及血管平滑肌细胞(vascular smooth muscle cells,VSMCs)增殖和迁移等多种AS致病机制的共同环节。槲皮素作为一种广泛存在的天然植物化合物,在AS相关体内外炎症模型中均表现出良好的抗炎效果(Fig 1)。
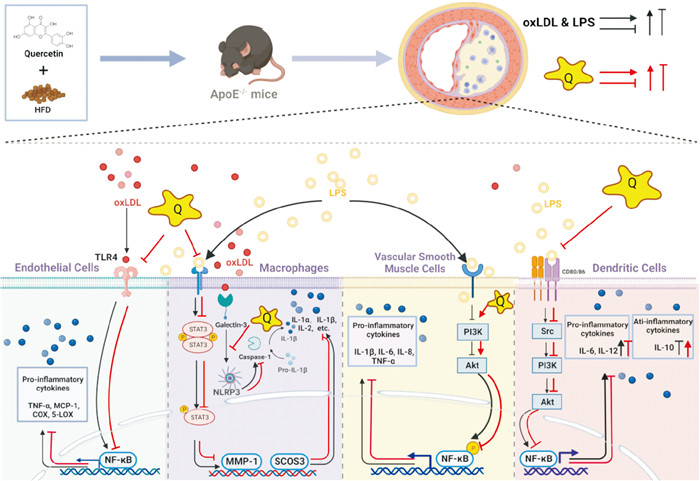
|
| Fig 1 Quercetin regulates inflammation in atherosclerosis |
炎症反应的启动及放大过程中,相关信号通路的激活可以促进募集白细胞中炎症相关介质的合成与释放。核因子κB(nuclear factor kappa-B,NF-κB)促炎信号通路作为炎症反应的核心,通过与其上游因子Toll受体家族(Toll-like receptors,TLRs)、磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)和腺苷酸活化蛋白激酶(AMP- activated protein kinase,AMPK) /沉默信息调节因子1(silent information regulator 1,SIRT1)等通路作用,共同调控AS中的炎症反应。
Bhaskar等[4]发现槲皮素通过抑制由TLR2和TLR4介导的NF-κB通路活化降低氧化型低密度脂蛋白(oxidized low-density lipoprotein,oxLDL)诱导的人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)中单核细胞趋化蛋白1(monocyte chemotactic protein-1,MCP-1)、血管细胞黏附分子1(vascular cell adhesion molecule-1,VCAM-1)和细胞间黏附分子1(intercellular cell adhesion molecule-1,ICAM-1)表达以及炎症相关酶环氧合酶(cyclooxygenase,COX)、5-脂氧合酶(5-lipoxygenase,5-LOX)和C反应蛋白(C reactive protein,CRP)活性,同时通过下调高胆固醇饮食(HCD)喂养AS大鼠中白细胞介素6(interleukin- 6,IL-6)减轻炎症反应。与此同时,研究表明[5],槲皮素可通过激活PI3K/Akt通路拮抗由NF-κB活化介导的IL-1β、IL-6、IL-18及肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等炎性细胞因子表达增加,有效减轻脂多糖(lipopolysaccharide,LPS)诱导的小鼠VSMC炎症及高果糖膳食引发的AS斑块形成。另有研究发现,槲皮素能够通过调控AMPK/SIRT1/NF-κB信号通路有效降低高脂肪饮食(high-fat diet,HFD)喂养的AS模型大鼠中炎性因子IL-1β水平,同时升高抗炎因子IL-10水平[6]。在另一项研究中[7],槲皮素可作为信号转导因子和转录激活因子3(signal transducer and activator of transcription 3,STAT3)信号通路的天然“抑制剂”,通过下调其靶基因基质金属蛋白酶1(matrix metallopeptidase 1,MMP-1)和细胞因子信号转导抑制因子3(recombinant suppressors of cytokine signaling 3,SOCS3)的转录水平,明显降低LPS诱导的RAW264.7巨噬细胞中IL-1α、IL-1β、IL-2、MCP-1和COX-2等炎性因子的表达。
1.2 调控NLRP3炎性小体炎性小体是一类位于胞浆的多蛋白信号复合物,在识别病原与损伤相关分子模式及启动机体固有免疫反应中发挥重要作用。作为目前结构和功能最为明确的细胞内模式识别受体之一,核苷酸结合寡聚化结构域样受体蛋白3(NOD-like receptors family pyrin domain containing 3,NLRP3)炎性小体在AS中的作用备受关注。新近研究发现[8],与对照组相比,人颈AS斑块以及AS模型载脂蛋白E敲除(apolipoprotein E knockout,ApoE-/-)小鼠中NLRP3炎性小体及其下游炎症因子IL-1β水平明显增加,而槲皮素可通过抑制斑块巨噬细胞中NLRP3与其上游蛋白半乳糖凝集素3(galectin-3)结合进而抑制NLRP3激活后分泌IL-1β,减轻AS炎症水平。此外,由NLRP3炎性小体活化诱发的细胞焦亡是Caspase酶依赖性的一种细胞程序性死亡方式,这一过程通过参与AS炎症反应和氧化应激等病理过程,促进斑块处单核细胞募集、纤维帽溶解并加速斑块破裂。一项新近研究发现,槲皮素通过与kelch样ECH关联蛋白1的Arg483位点竞争性结合促进核因子E2相关因子(nuclear factor erythroid-derived factor 2-related factor,Nrf2)活化,从而抑制NLRP3炎性小体介导的巨噬细胞焦亡并延缓ApoE-/-小鼠AS进展[9]。然而,细胞焦亡在槲皮素发挥AS保护效应中的作用及分子机制仍有待阐明。
1.3 其他方面作用树突状细胞(dendritic cells,DCs)作为免疫细胞中的重要成员之一,可通过诱导炎症细胞募集并调控炎性因子分泌促进局部炎症反应级联放大。Lin等[10]研究发现,与对照组ApoE-/-小鼠相比,膳食添加槲皮素可通过抑制Src/ PI3K/Akt和NF-κB通路活化明显降低AS病灶处DC成熟和炎症反应水平,表现为血清IL-6、IL-12水平下降,IL-10水平升高,炎性细胞浸润减少。以上结果在LPS诱导的骨髓来源DC体外实验中得到进一步证实,表明参与调控DC活性从而减轻炎症反应是槲皮素发挥AS保护作用的潜在分子机制之一。
2 抗氧化作用当氧化酶过度激活导致ROS水平超过先天性抗氧化防御系统的清除能力则会引发氧化应激导致组织损伤。研究表明氧化应激在AS疾病进程的各个阶段均发挥重要的病理作用,例如参与脂蛋白和磷脂的氧化修饰、促进内皮细胞活化和巨噬细胞泡沫化等过程[1]。现有研究表明,槲皮素作为一种天然抗氧化剂,主要通过直接清除ROS及调控自由基生成相关酶活性等降低AS斑块氧化应激水平[11-12]。
2.1 抑制氧化酶活性NADPH氧化酶,又称还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶(reduced nicotinamide adenine dinucleotide phosphate oxidase,NADPH oxidase,NOX)作为血管内皮细胞中ROS的主要来源,在人类冠状AS不稳定斑块中异常活跃,其活性与AS进展及其严重程度息息相关[11]。最近研究发现,槲皮素明显改善HFD喂养ApoE-/-小鼠AS斑块形成,主要通过下调NOX2亚单位p47phox表达抑制NOX促生的ROS水平[12]。另一项研究也得到类似的结果[11],即槲皮素干预通过抑制主动脉p47phox、p67phox的异常高表达缓解氧化应激有效减轻AS病变。然而,作为NOX家族的另一成员,NOX4在AS中的作用却具有一定争议,研究表明NOX4表达升高既可以通过催化ROS生成加速AS进展[13],而NOX4特异性缺失会加重血管内皮炎症水平引起AS[14]。研究发现槲皮素可通过部分逆转HFD喂养ApoE-/-小鼠主动脉NOX4的表达下降发挥AS保护作用[11]。另一项体外研究则发现,槲皮素通过调控SIRT1/AMPK通路抑制oxLDL诱导的NOX2和NOX4表达而保护HUVEC免受氧化损伤[13]。因此,槲皮素对AS中NOX4的潜在调控机制仍需进一步阐明。此外,研究发现髓过氧化物酶(myeloperoxidase,MPO)作为一种来源于白细胞的血红素蛋白酶,可通过氧化修饰LDL、损伤高密度脂蛋白(high density lipoprotein,HDL)功能以及产生ROS等途径促进AS事件的发生。Shiba等[15]通过免疫组织化学染色发现槲皮素代谢物—槲皮素3-O-β-D-葡萄糖醛酸苷(quercetin 3-O-β-D-glucuronide,Q3GA)与MPO及其催化的酪氨酸氧化产物二酪氨酸于人AS病变处存在共定位,而槲皮素在HL-60细胞中呈剂量依赖性抑制MPO活性并有效清除酪氨酰自由基。然而,槲皮素是否对如黄嘌呤氧化酶等其他氧化酶具有调控作用并由此发挥AS保护作用仍有待阐明。
2.2 增强抗氧化酶活性血红素氧合酶1(heme oxygenase-1,HO-1)作为一种抗氧化酶,可有效抑制NADPH氧化酶衍生的O2·-产生并调节内源性ROS的生成。Shen等[16]发现, 补充槲皮素可显著延缓ApoE-/-小鼠AS病变进展,调节内皮细胞功能,同时降低血清异前列腺素F2(F2-isoprostane)和增加内皮一氧化氮合酶(endothelial nitric oxide synthase,eNOS)活性,并增加HO-1表达,体外实验结果进一步表明,上述作用可能依赖于槲皮素对Nrf2的诱导作用,从而促进内皮细胞HO-1表达以保护eNOS免受氧化损伤。新近体内外研究也得到类似结果[12]。尽管上述多项研究表明HO-1可能是槲皮素防治AS的潜在靶点,但槲皮素对HO-1的分子调控机制仍有待深入研究。
对氧磷酶(paraoxonase,PON)作为一类参与水解磷酸酯键的芳香酯酶,因其在维持HDL活性、降解过氧化物、水解oxLDL等多方面均表现出良好具有AS保护效应而深受研究者关注。研究发现LDLR基因敲除小鼠经致AS的流质膳食喂养后补充槲皮素,可使肝脏PON1 mRNA表达明显升高并增强血清PON1活性,同时有效减少小鼠主动脉AS斑块面积[17]。与上述研究结论一致,Guo等[18]研究表明,槲皮素通过拮抗HFD诱导的血浆PON1和肝脏以及主动脉中PON2蛋白表达下降提高机体抗氧化能力,从而有效改善ApoE-/-小鼠AS病变。此外,在HFD喂养联合腹膜注射链脲佐菌素建立的糖尿病型大鼠AS模型中,膳食添加槲皮素可通过调控AMPK/SIRT1信号通路,增加血清抗氧化酶超氧化物歧化酶(superoxidedismutase,SOD)、过氧化氢酶(atalase,CAT)和谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)水平,降低丙二醛(malondialdehyde,MDA)水平发挥有效抗氧化作用,从而抑制AS斑块形成[6]。
此外,已有研究表明槲皮素对铁、铜等金属离子具有较强的螯合作用,并由此抑制其引发的芬顿反应来发挥抗氧化作用,如槲皮素可以抑制铁诱导的超氧化物和羟基自由基的产生[2]。铁死亡是一种铁依赖性脂质过氧化介导的细胞程序性死亡方式,研究表明抑制小鼠主动脉内皮细胞铁死亡可有效降低脂质过氧化水平以及胸主动脉AS斑块面积[19],然而槲皮素是否可以通过调控铁死亡发挥AS保护作用尚需进一步探索。
3 调节脂质代谢作用机体胆固醇稳态是通过维持细胞对脂质的摄取、酯化以及流出之间的动态平衡得以实现,这一过程与AS的发生密切相关。现有研究结果表明,槲皮素对加速脂质分解、抑制脂肪酸摄取及脂肪生成均具有积极作用,是一种可多靶点改善脂质代谢紊乱的黄酮类植物化学物[20-22]。
一项体内研究表明[20],在HFD喂养的ApoE-/-小鼠中,模型组小鼠AS斑块面积明显增加,斑块脂质浸润明显并伴发高脂血症,而槲皮素可通过上调胆固醇转运体——TP结合盒转运蛋白A1(recombinant ATP binding cassette transporter A1,ABCA1)及其上游调节蛋白肝X受体α(recombinant liver X receptor alpha,LXRα)并下调前蛋白转化酶枯草杆菌蛋白酶/kexin9型(proprotein convertase subtilisin/kexin type 9,PCSK9)有效减少AS斑块形成。槲皮素的这一保护作用也在Jia等[21]的研究中得到证实,并进一步发现槲皮素可明显诱导过氧化物酶体增殖物激活受体γ(peroxisome proliferators-activated receptors gamma,PPARγ)表达以维持胆固醇稳态。罗纲等[22]近期研究同样表明,槲皮素可通过上调巨噬细胞中细胞色素P450 27羟化酶(cytochrome P450 27-hydroxylase,CYP27A1)表达,激活下游LXRα-ABCA1/三磷酸腺苷结合盒亚家族G1(adenosine triphosphate binding cassette subfamily G1,ABCG1)通路以促进胆固醇外流,有效抑制巨噬细胞泡沫化而发挥AS保护作用。
体外实验研究表明,槲皮素通过抑制RAW264.7巨噬细胞中由LXRα、PCSK9介导的ABCA1表达,降低细胞内脂质蓄积水平,抑制泡沫细胞形成[23]。Chang等[24]报道槲皮素通过激活p38信号通路,诱导RAW264.7巨噬细胞中LXRα与ABCA1启动子的结合,从而上调ABCA1蛋白表达,以促进胆固醇外流。与此同时,清道夫受体作为脂质摄取的另一关键调节受体,在机体脂质代谢调节中起重要作用。研究表明Q3GA可抑制清道夫受体分化抗原36(cluster of differentiation 36,CD36)、A类清道夫受体(class A scavenger-receptor,SR-A)表达并由此减轻oxLDL诱导的RAW264.7巨噬细胞胆固醇蓄积[3],这一结果与Jia等[21]报道一致。然而,最近一项研究发现[25],槲皮素对清道夫受体CD36、SR-A及LXRα基因表达均有上调作用,并由此增加THP-1巨噬细胞胆固醇摄取与流出,共同维持细胞胆固醇稳态,而这一作用与PI3K通路的激活密切相关。此外,另有研究发现,在葡萄糖胺诱导的内质网应激(endoplasmic reticulum stress,ERS)中,分子伴侣萄糖调节蛋白78(glucose regulated protein 78,GRP78)及跨膜蛋白激活转录因子6(recombinant activating transcription factor 6,ATF6)的激活可进一步加剧RAW264.7巨噬细胞中由oxLDL诱导的胆固醇蓄积,而槲皮素可通过拮抗ERS有效阻止脂质积累[26]。
4 抗衰老作用细胞衰老是在一系列刺激因素,如氧化应激、DNA损伤、端粒缩短以及癌基因诱导等作用下引起的一种不可逆的生长停滞状态,与AS发生发展密切相关。研究报道人主动脉AS样本中可观察到相当数量的衰老SMC,而衰老引起的氧化应激损伤和血管炎症可引起动脉功能障碍[27]。因此,通过抑制细胞衰老改善AS的相关治疗策略或有良好临床应用潜力。槲皮素具备促进细胞自我更新和分化能力,可以通过调节细胞周期、恢复异染色体结构和减少ROS产生等多方面延缓细胞衰老,恢复细胞活力,为其通过抑制细胞衰老改善AS提供了新的思路。
Roos等[27]研究显示,采用抗衰老药物(达沙替尼+槲皮素)长期干预可增加ApoE-/-小鼠主动脉组织NO生物利用度并减轻衰老细胞负荷和DNA损伤,从而改善小鼠血管舒缩功能并降低内膜斑块钙化水平。另一项研究发现,oxLDL可诱导RAW264.7巨噬细胞衰老,槲皮素干预通过调节衰老相关蛋白p53、p21以及p16的表达明显降低β-半乳糖苷酶(senescence-associated β-galactosidase,SA-β-Gal)活性,抑制细胞衰老[23]。最新研究发现槲皮素可降低ApoE-/-小鼠血清中衰老相关分泌表型(senescence associated secretory phenotype,SASP),如VCAM-1、ICAM-1、IL-6水平,同时增加抗衰老相关蛋白SIRT1表达水平,有效抑制AS进展。体外实验结果显示,oxLDL可诱导人主动脉内皮细胞(human aortic endothelial cells,HAECs)衰老,表现为SA-β-GAL阳性染色面积增加及细胞呈衰老表型改变,如细胞皱缩、染色质固缩、线粒体数量减少、溶酶体室增大等,而槲皮素可通过调控p53和雷帕霉素机械靶蛋白(mechanistic target of rapamycin,mTOR)信号通路有效延缓HAEC衰老[28]。
自噬作为依赖于溶酶体降解维持细胞组织稳态的一种过程,可通过清除受损蛋白质或线粒体(导致细胞衰老的压力源),衰老或受损的细胞器,抵抗氧化应激等途径有效抑制细胞衰老过程。Cao等[29]发现,槲皮素干预可有效降低HFD诱导的AS模型小鼠主动脉斑块面积,并通过抑制mTOR通路上调自噬相关蛋白微管相关蛋白1的轻链3(microtubule- associated protein1 light chain 3,LC3)Ⅱ/Ⅰ比值,同时明显下调衰老相关蛋白p53、p21以及炎性因子TNF-α、IL-1β、IL-18表达水平,并在用自噬抑制剂3-甲基腺嘌呤(3-MA)处理后,这些蛋白水平进一步下降。而主动脉巨噬细胞中自噬体的增加进一步证实自噬参与槲皮素延缓细胞衰老这一过程。体外实验结果进一步表明[30],RAW264.7巨噬细胞暴露于oxLDL后脂质沉积水平加重,出现衰老表型并伴有自噬体的减少。槲皮素干预通过调节哺乳动物Ste20样激酶1(mammalian STE20-like kinase 1,MST1)增加LC3-Ⅱ/Ⅰ比值和自噬基因肌球蛋白样BCL2结合蛋白(coiled-coil myosin-like BCL2 interacting protein,Beclin 1)表达,有效逆转3-MA的促AS作用,明显减少p21、p16表达以及SA-β-gal阳性细胞。以上结果表明槲皮素可通过抑制MST1促进自噬发挥抗AS作用。
5 抗凋亡作用细胞凋亡作为机体在生理或病理条件下发生的一种程序性死亡形式,是AS病变的独立危险因素,与AS斑块易损性密切相关。在AS体外模型中,高果糖喂养可以诱导细胞凋亡,表现为凋亡抑制基因B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)表达下调同时伴有促凋亡蛋白酶Caspase-3表达上调,而槲皮素可通过PI3K/Akt信号通路抑制细胞凋亡减轻AS[5]。另一项研究发现槲皮素通过阻断ERS相关靶点GRP78/ATF6调控凋亡相关因子C/EBP同源蛋白(C/EBp-homologous protein,CHOP)和Caspase-12信号进而抑制葡萄糖胺诱导的HUVECs凋亡,表明槲皮素可通过调控细胞凋亡发挥对糖尿病AS的保护作用[26]。
6 展望作为主要的黄酮类化合物之一,槲皮素因其价格低廉、来源广泛且出众的药理作用在CVD临床防治中展现出巨大潜力和广阔的前景。如前所述,槲皮素在抑制AS炎症反应、清除ROS、延缓细胞衰老以及脂质调节等方面的生物活性已在动物和细胞模型中得到证实(Fig 2和Tab 1)。尽管目前取得了一定成果,然而由于AS复杂的病理过程以及槲皮素生物利用度较低等特性,关于槲皮素参与防治AS的某些问题仍有待解决。具体问题如下,1)槲皮素在体内外实验模型中对AS的保护作用已得以证实,然而现阶段仍缺乏针对单独槲皮素干预对AS防治效果评价的大规模人群实验证据;2)槲皮素由于水溶性较差、口服生物利用度极低等缺点,极大限制了其在临床中的应用。因此,使用纳米颗粒、脂质体以及聚合物复合物等递送系统来提高槲皮素的代谢活性从而发挥抗AS作用在未来有很大的应用前景,然而递送系统带来的副作用,比如肝毒性,在实际应用中值得特别关注;3)槲皮素与维生素、叶酸和白藜芦醇等同时使用可增加其吸收率,提高生物利用度,因此,相比于单独使用槲皮素,联合补充维生素、叶酸或白藜芦醇等其他类黄酮,或是增强槲皮素的生物活性的方法之一;4)肠道微生物群落结构和功能的明显变化与包括AS在内的多种疾病状态密切相关,而黄酮醇具有类似益生元作用,因此,未来针对槲皮素靶向肠道菌群或可作为AS防治的新策略。
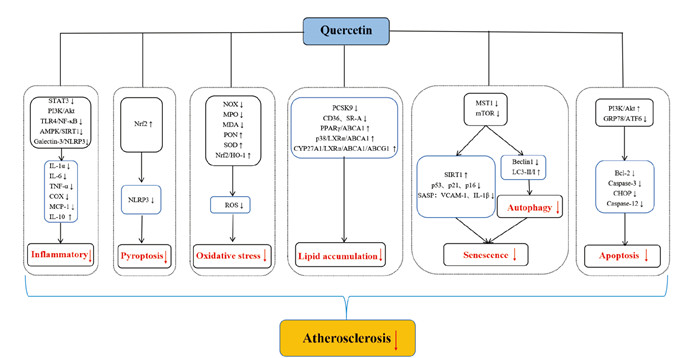
|
| Fig 2 The potential mechanisms involved in protective role of quercetin in atherosclerosis |
| Effects | Possible mechanisms | Regulatory results | References |
| Anti-inflammation | TLR/NF-κB ↓ | ↓ MCP-1、VCAM-1、ICAM-1、COX、5-LOX and CRP | [4] |
| PI3K/Akt ↑ and NF-κB ↓ | ↓ IL-1β、IL-18、TNF-α and IL-6 | [5] | |
| AMPK/SIRT1/NF-κB↓ | ↓ IL-1β and ↑ IL-10 | [6] | |
| STAT3 ↓ | ↓ IL-1α、IL-1β、IL-2、MCP-1、COX-2、MMP-1 and SOCS3 | [7] | |
| Galectin-3/NLRP3↓ | ↓ IL-1β | [8] | |
| Src/PI3K/Akt/NF-κB↓ | ↓ IL-6、IL-12 and ↑ IL-10 | [12] | |
| Antioxidant | Expression of p47phox and p67phox of NADPH oxidase ↓ | ↓ ROS | [11, 12] |
| MPO activity↓ | ↓ Radical scavenging activity | [15] | |
| Nrf2/HO-1↑ | ↓ F2-isoprostane and ↑eNOS and NO bioavailability | [12, 16] | |
| ↑ PON1、PON2 | [17, 18] | ||
| AMPK/SIRT1↓ | ↑ SOD、CAT、GPX and ↓ MDA | [6] | |
| Regulate lipid metabolism | ↑ PPARγ、LXRα、ABCA1、ABCG1 and ↓ PCSK9 | [20, 21, 23] | |
| p38 and CYP27A1 ↑ | ↑ LXRα、ABCA1 and ABCG1 | [22, 24] | |
| ↓ CD36 and SR-A | [3, 21] | ||
| ERS related target GRP78/ATF6 ↓ | ↓ TC、FC and CE/TC | [26] | |
| Anti-senescence | ↑ NO bioavailability and ↓ DNA damage | [27] | |
| ↓ p53、p21、p16 and β-gal positive cells | [23] | ||
| mTOR↓ | ↓ p53、VCAM-1、ICAM-1、IL-6、β-gal positive cells and ↑SIRT1 | [28] | |
| mTOR↓ | ↓ p53、p21、TNF-α、IL-1β、IL-18 and ↑ LC3Ⅱ/Ⅰ | [29] | |
| MST1↓ | ↓ p21、p16、β-gal positive cells and ↑ LC3-Ⅱ/Ⅰ、Beclin1 | [30] | |
| Anti-apoptotic | PI3K/Akt↑ | ↑ Bcl-2 and ↓ Caspase-3 | [5] |
| ERS related target GRP78/ATF6 ↓ | ↓ CHOP and Caspase-12 | [26] |
总之,AS病因纷繁复杂,发病机制尚未完全阐明,使得AS的防治工作困难重重,如何基于现有研究寻找安全有效的AS防治手段显得尤为重要。槲皮素通过调控炎症反应、氧化应激、脂质代谢及细胞衰老等多靶点作用特性在AS防治中的有效作用已得到较多研究证据支持。然而,由于槲皮素固有的缺陷以及疾病复杂性等局限性,关于该主题相关研究仍然有限,因此,对槲皮素药理作用和药代动力学的不断探索可为槲皮素防治AS提供新的思路,具有广阔的使用价值和应用前景。
| [1] |
Meng T, Li X, Li C, et al. Natural products of traditional Chinese medicine treat atherosclerosis by regulating inflammatory and oxidative stress pathways[J]. Front Pharmacol, 2022, 13: 997598. doi:10.3389/fphar.2022.997598 |
| [2] |
Xiao L, Luo G, Tang Y, et al. Quercetin and iron metabolism: what we know and what we need to know[J]. Food Chem Toxicol, 2018, 114: 190-203. doi:10.1016/j.fct.2018.02.022 |
| [3] |
Kawai Y, Nishikawa T, Shiba Y, et al. Macrophage as a target of quercetin glucuronides in human atherosclerotic arteries: implication in the anti-atherosclerotic mechanism of dietary flavonoids[J]. J Biol Chem, 2008, 283(14): 9424-34. doi:10.1074/jbc.M706571200 |
| [4] |
Bhaskar S, Sudhakaran P R, Helen A. Quercetin attenuates atherosclerotic inflammation and adhesion molecule expression by modulating TLR-NF-kappaB signaling pathway[J]. Cell Immunol, 2016, 310: 131-40. doi:10.1016/j.cellimm.2016.08.011 |
| [5] |
Lu X L, Zhao C H, Yao X L, et al. Quercetin attenuates high fructose feeding-induced atherosclerosis by suppressing inflammation and apoptosis via ROS-regulated PI3K/AKT signaling pathway[J]. Biomed Pharmacother, 2017, 85: 658-71. doi:10.1016/j.biopha.2016.11.077 |
| [6] |
Zhang F, Feng J, Zhang J, et al. Quercetin modulates AMPK/SIRT1/NF-kappaB signaling to inhibit inflammatory/oxidative stress responses in diabetic high fat diet-induced atherosclerosis in the rat carotid artery[J]. Exp Ther Med, 2020, 20(6): 280. |
| [7] |
Xue F, Nie X, Shi J, et al. Quercetin inhibits LPS-Induced inflammation and ox-LDL-induced lipid deposition[J]. Front Pharmacol, 2017, 8: 40. |
| [8] |
Li H, Xiao L, He H, et al. Quercetin attenuates atherosclerotic inflammation by inhibiting Galectin-3-NLRP3 signaling pathway[J]. Mol Nutr Food Res, 2021, 65(15): e2000746. doi:10.1002/mnfr.202000746 |
| [9] |
Luo X, Weng X, Bao X, et al. A novel anti-atherosclerotic mechanism of quercetin: competitive binding to KEAP1 via Arg483 to inhibit macrophage pyroptosis[J]. Redox Biol, 2022, 57: 102511. doi:10.1016/j.redox.2022.102511 |
| [10] |
Lin W, Wang W, Wang D, et al. Quercetin protects against atherosclerosis by inhibiting dendritic cell activation[J]. Mol Nutr Food Res, 2017, 61(9): 1700031. doi:10.1002/mnfr.201700031 |
| [11] |
Xiao L, Liu L, Guo X, et al. Quercetin attenuates high fat diet-induced atherosclerosis in apolipoprotein E knockout mice: a critical role of NADPH oxidase[J]. Food Chem Toxicol, 2017, 105: 22-33. doi:10.1016/j.fct.2017.03.048 |
| [12] |
Luo M, Tian R, Lu N. Quercetin inhibited endothelial dysfunction and atherosclerosis in apolipoprotein E-Deficient mice: critical roles for NADPH oxidase and heme oxygenase-1[J]. J Agric Food Chem, 2020, 68(39): 10875-83. doi:10.1021/acs.jafc.0c03907 |
| [13] |
Hung C H, Chan S H, Chu P M, et al. Quercetin is a potent anti-atherosclerotic compound by activation of SIRT1 signaling under oxLDL stimulation[J]. Mol Nutr Food Res, 2015, 59(10): 1905-17. doi:10.1002/mnfr.201500144 |
| [14] |
Yu W, Li S, Wu H, et al. Endothelial Nox4 dysfunction aggravates atherosclerosis by inducing endoplasmic reticulum stress and soluble epoxide hydrolase[J]. Free Radic Biol Med, 2021, 164: 44-57. doi:10.1016/j.freeradbiomed.2020.12.450 |
| [15] |
Shiba Y, Kinoshita T, Chuman H, et al. Flavonoids as substrates and inhibitors of myeloperoxidase: Molecular actions of aglycone and metabolites[J]. Chem Res Toxicol, 2008, 21(8): 1600-9. doi:10.1021/tx8000835 |
| [16] |
Shen Y, Ward N C, Hodgson J M, et al. Dietary quercetin attenuates oxidant-induced endothelial dysfunction and atherosclerosis in apolipoprotein E knockout mice fed a high-fat diet: a critical role for heme oxygenase-1[J]. Free Radic Biol Med, 2013, 65: 908-15. doi:10.1016/j.freeradbiomed.2013.08.185 |
| [17] |
Leckey L C, Garige M, Varatharajalu R, et al. Quercetin and ethanol attenuate the progression of atherosclerotic plaques with concomitant up regulation of paraoxonase1 (PON1) gene expression and PON1 activity in LDLR-/- mice[J]. Alcohol Clin Exp Res, 2010, 34(9): 1535-42. doi:10.1111/j.1530-0277.2010.01238.x |
| [18] |
Guo S, Tian H, Dong R, et al. Exogenous supplement of N-acetylneuraminic acid ameliorates atherosclerosis in apolipoprotein E-deficient mice[J]. Atherosclerosis, 2016, 251: 183-91. doi:10.1016/j.atherosclerosis.2016.05.032 |
| [19] |
Bai T, Li M, Liu Y, et al. Inhibition of ferroptosis alleviates atherosclerosis through attenuating lipid peroxidation and endothelial dysfunction in mouse aortic endothelial cell[J]. Free Radic Biol Med, 2020, 160: 92-102. doi:10.1016/j.freeradbiomed.2020.07.026 |
| [20] |
Li S S, Cao H, Shen D Z, et al. Effect of quercetin on atherosclerosis based on expressions of ABCA1, LXR-alpha and PCSK9 in ApoE(-/-) mice[J]. Chin J Integr Med, 2020, 26(2): 114-21. doi:10.1007/s11655-019-2942-9 |
| [21] |
Jia Q, Cao H, Shen D, et al. Quercetin protects against atherosclerosis by regulating the expression of PCSK9, CD36, PPARgamma, LXRalpha and ABCA1[J]. Int J Mol Med, 2019, 44(3): 893-902. |
| [22] |
罗纲, 向露, 姚平, 等. 槲皮素调控巨噬细胞胆固醇稳态改善载脂蛋白E敲除小鼠动脉粥样硬化[J]. 中国药理学通报, 2022, 38(9): 1395-400. Luo G, Xiang L, Yao P, et al. Quercetin attenuates atherosclerosis in ApoE KO mice bu regulating macrophage cholesterolhomeostasis[J]. Chin Pharmacol Bull, 2022, 38(9): 1395-400. doi:10.12360/CPB202111035 |
| [23] |
Li S, Cao H, Shen D, et al. Quercetin protects against oxLDLinduced injury via regulation of ABCAl, LXRalpha and PCSK9 in RAW264.7 macrophages[J]. Mol Med Rep, 2018, 18(1): 799-806. |
| [24] |
Chang Y C, Lee T S, Chiang A N. Quercetin enhances ABCA1 expression and cholesterol efflux through a p38-dependent pathway in macrophages[J]. J Lipid Res, 2012, 53(9): 1840-50. |
| [25] |
Huwait E A, Saddeek S Y, Al-Massabi R F, et al. Antiatherogenic effects of quercetin in the THP-1 macrophage model in vitro, with insights into its signaling mechanisms using in silico analysis[J]. Front Pharmacol, 2021, 12: 698138. |
| [26] |
Cai X, Bao L, Dai X, et al. Quercetin protects RAW264.7 macrophages from glucosamine-induced apoptosis and lipid accumulation via the endoplasmic reticulum stress pathway[J]. Mol Med Rep, 2015, 12(5): 7545-53. |
| [27] |
Roos C M, Zhang B, Palmer A K, et al. Chronic senolytic treatment alleviates established vasomotor dysfunction in aged or atherosclerotic mice[J]. Aging Cell, 2016, 15(5): 973-7. |
| [28] |
Jiang Y H, Jiang L Y, Wang Y C, et al. Quercetin attenuates atherosclerosis via modulating oxidized LDL-induced endothelial cellular senescence[J]. Front Pharmacol, 2020, 11: 512. |
| [29] |
Cao H, Jia Q, Shen D, et al. Quercetin has a protective effect on atherosclerosis via enhancement of autophagy in ApoE(-/-) mice[J]. Exp Ther Med, 2019, 18(4): 2451-8. |
| [30] |
Cao H, Jia Q, Yan L, et al. Quercetin suppresses the progression of atherosclerosis by regulating MST1-mediated autophagy in ox-LDL-induced RAW264.7 macrophage foam cells[J]. Int J Mol Sci, 2019, 20(23): 6093. |

