


2. 湖南省中药饮片标准化及功能工程技术研究中心,湖南 长沙 410208
陈乃宏(1961-),男,教授,博士生导师,研究方向:神经精神药理学,通信作者,E-mail:chennh@imm.ac.cn
 ,
KUANG Bo-yu1,2,
LIANG Jin-ping1,2,
PEI Xiao-lei1,
ZHAO Jia-zhu1,
CHU Shi-feng1,
CHEN Nai-hong1,2
,
KUANG Bo-yu1,2,
LIANG Jin-ping1,2,
PEI Xiao-lei1,
ZHAO Jia-zhu1,
CHU Shi-feng1,
CHEN Nai-hong1,2
 ,
YANG Yan-tao1,2
,
YANG Yan-tao1,2

2. Center for Standardization and Functional Engineering of Traditional Chinese Medicine in Hunan Province, Changsha 410208, China
随着全球人口老龄化进程的加剧,痴呆症等老年疾病的患病率不断增长,其中阿尔茨海默病(Alzheimer′s disease,AD)占50%~70%。World Alzheimer Report 2022的数据显示[1],2019年痴呆症患病人数为5500万,预计2050年将增至1.39亿,年龄超过65岁的老年人患AD的概率为40%~70%。AD患者最初表现为轻度认知障碍,随着病情的发展进而产生更明显的记忆缺陷。AD发病率高、危害大,现有药物仅仅能缓解AD的症状,亟待研发有效的治疗药物。
1 AD发病的现代医学机制以及有关的中医基本理论AD的发病机制仍未完全阐明,目前总结出Aβ淀粉样蛋白沉积、tau蛋白过度磷酸化、突触功能障碍和神经递质失衡、神经炎症、氧化应激、细胞自噬、肠道菌群失衡等[2]。且大量研究发现,AD的典型病理标志物是脑中β-淀粉样蛋白(amyloid β-protein,Aβ)和tau蛋白。AD起病隐匿、致病因素多,且病情进行性发展具有不可逆性和致死性,现有的诊断方法存在缺乏标准化程序、难以准确评估病程、影响因素多、接受程度低等局限,造成AD诊断困难治疗不及时,进一步加重了病程进展和医疗负担。因此中国科协发布的10个对科学发展具有导向作用的前沿科学问题中,如何早期诊断无症状期AD排在第一位。目前获批的药物如多奈哌齐、卡巴拉汀、加兰他敏、美金刚以及多奈哌齐+美金刚复方制剂、甘露特钠、阿杜那单抗等仅能够从单一机制缓解AD的症状,其效果也有待于进一步验证[3]。说明依据单个致病学说,针对单个靶点的治疗模式是否真正适合AD的诊治仍有待商榷。
中医并无AD病名,多将之归属于“喜忘”“呆证”“呆病”范畴,明代《景岳全书·杂证谟》首立“癫狂痴呆”专论,提出本病由多种病因形成,随年龄增长逐渐发展,且临床表现具有“千奇百怪”、“变易不常”的特点。其病机在于本虚标实,中医认为五脏虚损是本病早期发生的条件,《难经》中强调“脏者,人之神气所藏也”,肾精亏损则髓海空虚、脑失所养,脾胃虚损致气血不足;痰浊瘀血是导致病机转变的关键因素,《临证录》曰“痰积于胸中,盘踞于心外,使神明不清而成呆病矣”;虚、痰、瘀三者互相影响致使毒损脑络是早期痴呆发病的核心。《中医内科学》[4]提出辨明虚实与主病脏腑,虚者补之,实者泻之的辨证施治原则。中医治疗AD多根据辨证从其本展开,注重多器官调节,呆证治疗方中的药物药性以温、平、寒为主,药味以甘、苦、辛居多,归经多属脾、心、肺、肾四脏,人参、石菖蒲是其中的典型药物。唐·孙思邈《备急千金要方》不忘散、开心散,《赤水玄珠》补心丸、《医便》安神定志丸、及《辨证录》生慧汤、扶老丸中也均有对人参、石菖蒲配伍治疗痴呆健忘的记载。人参具有大补元气、补脾益肺、生津养血、安神益智等功效;石菖蒲是传统的开窍药,具有开窍豁痰、醒神益智等功效。结合中医对痴呆的认识和辨证,从中医典籍中记载的取得良好临床效果的中药及其复方中开发抗AD创新药物可能是有效策略之一。有鉴于此,本文尝试对人参、石菖蒲活性成分以及二者所构成的药对防治AD的作用机制进行总结,希望能够为抗AD中药研发提供思路。
2 人参、石菖蒲防治AD的主要活性成分及其作用机制人参中含有多种活性成分,现代化学及药理研究表明,皂苷类是人参中防治AD的主要有效部位。以β-细辛醚和α-细辛醚为主要成分的挥发油是石菖蒲抗AD的主要药效物质基础,如能厘清人参、石菖蒲活性成分治疗AD的作用机制,将为治疗AD的创新药物研发提供支撑。
2.1 调节Aβ水平Aβ假说在AD发病机制中长期处于主导地位,调节Aβ水平是抗AD药物研究开发的重要方向。Rg1可以激活丝裂原活化蛋白激酶(MAPK)/细胞外调节蛋白激酶(ERK)、磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(PKB/AKT)通路增强α-分泌酶活性并促进可溶性淀粉样前体蛋白α(sAPPα)的细胞外分泌,减弱Thr666位点过度磷酸化的APP及β裂解酶1(β-APP cleaving enzyme 1,BACE1)表达,抑制Aβ生成;Rg1还可通过调节细胞周期蛋白依赖性激酶5(CDK5)抑制过氧化物酶体增殖物活化受体γ(PPARγ)磷酸化调节Aβ水平;Rb1通过改变APP裂解模式,将淀粉样蛋白生成模式转变为非淀粉样蛋白生成模式,减少Aβ生成;Re激活PPARγ抑制BACE1减弱Aβ的生成,Rc、Rb2、Rb1、Rg3可作为BACE1抑制剂,Rg3及Rh2、Rd还可作为sAPPα激动剂,均能发挥抑制Aβ累积的作用[5-6]。
β-细辛醚、丁香酚通过降低APP水平减少Aβ的生成,降低Aβ对神经元及突触结构的破坏,进而改善APP/PS1小鼠学习记忆能力[7]。β-细辛醚能透过血脑屏障入脑,可浓度依赖的抑制Aβ单体形成寡聚体,降低因Aβ沉积造成的神经毒性;通过减少PS1表达和Aβ转运受体RAGE的表达,抑制Aβ1-42的生成并减少转运入脑,提示β-细辛醚具有双向调控Aβ水平的能力[8]。因此多种活性成分可协同调节AD患者的Aβ水平,起到延缓AD进程的作用(Fig 1)。
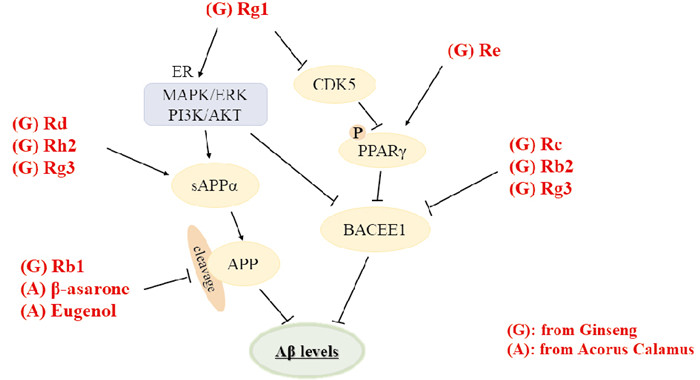
|
| Fig 1 Aβ levels regulated by different active ingredients of ginseng and acorus calamus |
Rb1、Rd可通过PI3K/AKT途径调节糖原合酶激酶-3β(GSK-3β)、tau蛋白去磷酸化的关键酶——蛋白磷脂酶2A(PP2A)、CDK5的活性,缓解脑缺血诱导的tau蛋白磷酸化及Aβ诱导的病理性tau蛋白磷酸化;Rg1通过GSK3β/tau信号通路降低磷酸化tau蛋白水平,并抑制大鼠脑内Aβ的形成来逆转冈田酸(OKA)诱导的记忆障碍[5, 9]。说明Rb1、Rd、Rg1通过参与调解tau蛋白磷酸化水平对早期AD有潜在治疗效果。
2.3 抑制炎症因子表达炎症反应是AD神经元损伤的原因之一,Rg1可以降低炎症因子白细胞介素-1(IL-1)、小胶质细胞标记物(iba-1)水平[10]。Rg1和Rb1均可缓解SAMP8小鼠的神经炎症,Rb1在降低凋亡相关斑点样蛋白(ASC)、caspase家族的半胱氨蛋白酶-1(caspase-1)水平上效果优于Rg1,而Rg1较Rb1在调控诱导型一氧化氮合酶(iNOS)水平上具有明显优势[11]。Re对BV2小胶质细胞具有神经保护作用,可通过调节磷酸化的p38蛋白(p38 MAPK)、iNOS和环氧合酶-2(COX-2)改善神经退行性疾病中的神经炎症[12]。Rd可通过抑制核因子κB(NF-κB)的转录活性,使促炎因子减少,保护因子增加,缓解Aβ引起的炎症;Rg3和Rg5均能在大脑中发挥抗炎活性调节炎症因子水平,改善LPS诱导的AD大鼠认知障碍[5]。
β-细辛醚、丁香酚可通过抑制NF-κB表达,体现出抑制炎症反应的作用;α-细辛醚可以降低肿瘤坏死因子-α (TNF-α)、IL-1β、神经胶质原纤维酸性蛋白(GFAP)的分泌,抑制星形胶质细胞活化,延缓AD进程[13-14]。石菖蒲水提液也体现出一定的抗炎效果,从石菖蒲中提取分离纯化得到的纯化多糖(ATP50-3),可通过抑制Toll样受体4(TLR4)介导的MyD88/NF-κB和PI3K/Akt信号通路减弱脂多糖(LPS)诱导的神经炎症和神经毒性[15](Fig 2)。
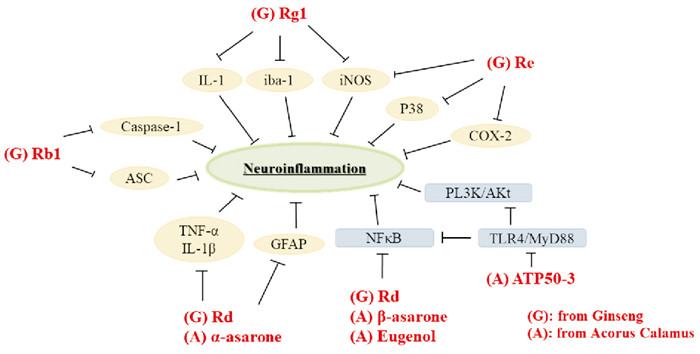
|
| Fig 2 Neuroinflammation inhibited by different active ingredients of ginseng and acorus calamus |
神经元细胞凋亡是AD的重要特征之一。Rg1、Rg2、Rb1、Rd、Re均能提高B淋巴细胞瘤-2(Bcl-2)/Bcl-2关联X蛋白(Bax)比例发挥抗细胞凋亡的作用,Rg1还能通过促进神经元标志物微管相关蛋白2(MAP2),神经元胞核表达,并降低caspase-3、GSK-3β、β-catenin表达,实现其抑制细胞凋亡、保护神经元细胞的作用;Rg2通过增强HSP70蛋白表达减弱神经元损伤;Re通过活性氧(ROS)依赖性机制抑制凋亡信号,调节激酶1(Ask1)/c-Jun氨基末端蛋白激酶(JNK)通路进而抑制Bax活性,并降低caspase-3、caspase-9水平[10, 16]。
β-细辛醚通过抑制Aβ诱导的ASK1-MKK7-JNK信号通路、抑制Bax-mRNA表达,裂解caspase-9减少神经细胞凋亡;还可能通过下调caspase-3的表达和上调Bcl-2的表达或减弱Akt-mTOR自噬信号通路的活性,实现对Aβ损伤PC12细胞凋亡的保护作用;并通过CaMKII/CREB/Bcl-2信号通路抗APP/PS1转基因模型鼠神经细胞凋亡[13, 17]。α-细辛醚也能通过增强Bcl-2表达抑制海马神经元凋亡;Rg2、α-细辛醚和丁香酚可有效减少细胞内钙离子浓度,保护PC12细胞免受Aβ毒性损伤,减少细胞凋亡[5, 13](Fig 3)。
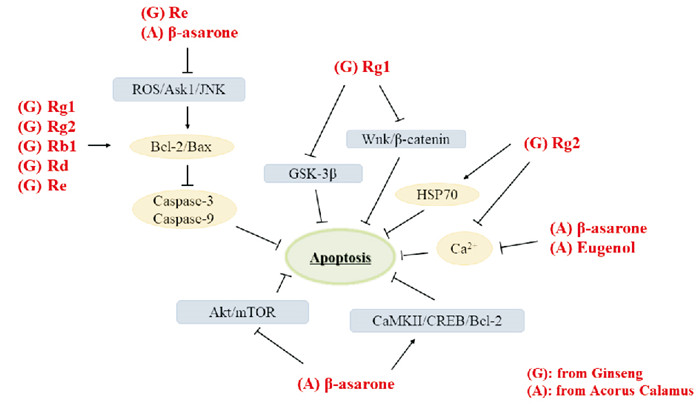
|
| Fig 3 Apoptosis inhibited by different active ingredients of ginseng and acorus calamus |
Rg1可以增强超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)、过氧化氢酶(CAT)活性,提高机体抗氧化能力,应用Rg1治疗后AD树鼩及APP/PS1小鼠中NADPH氧化酶2(NOX2)及ROS活性,硝基酪氨酸(NT)、8-羟基鸟嘌呤(8-OHG)、丙二醛(MDA)的氧化产物含量均下降[10, 18]。Rg1、Re、β-细辛醚可调节线粒体膜电位改善线粒体动力学,Re、β-细辛醚还能激活核因子E2相关因子2(Nrf2)/血红素氧合酶1(HO-1)抗氧化途径,抑制氧化应激造成的神经元损伤;Rg3通过改善AD大鼠中的线粒体功能障碍发挥抗氧化、抗细胞凋亡作用;此外,Rd、Re、β-细辛醚同样具有调节ROS、MDA、SOD、GPx水平的效果[13, 16](Fig 4)。
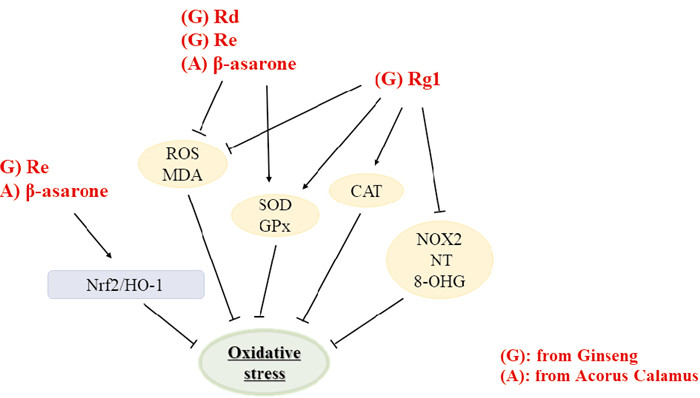
|
| Fig 4 Oxidative stress inhibited by different active ingredients of ginseng and acorus calamus |
连续30 d腹腔注射10 mg·kg-1·d-1 Rg1,可检测到APP/PS1小鼠脑内Aβ1-42和磷酸化的tau蛋白沉积减少,脑源性神经营养因子(BDNF)和酪氨酸蛋白激酶B(TrkB)突触可塑性相关蛋白上调,进而修复了AD模型中海马长期增强作用;Rg2通过抑制乙酰胆碱酯酶(AChE)活性,进而提高胆碱乙酰转移酶(ChAT)活性和乙酰胆碱(ACh)含量发挥增强小鼠学习记忆能力的作用,Rg2还可激活PI3K/Akt信号通路调节单胺类神经递质的含量,对Aβ25-35诱导的PC12细胞凋亡、神经毒性及大鼠记忆障碍起保护作用;Rg5显著促进链脲霉素(STZ)诱导损伤的AD大鼠海马和大脑皮层中胰岛素样生长激素-1(IGF-1)和BDNF的表达,抑制皮层及海马中AChE活性,缓解Aβ沉积。此外,Re和Rg3分别作为AChE、丁酰胆碱酯酶(BChE)的强效抑制剂调节神经递质水平[5, 16]。Rb1给药后APP/PS1小鼠海马内突触相关蛋白PSD-95及神经元尼氏体的表达均增加,小鼠学习记忆能力提高[19]。
2.7 调节血脑屏障结构和功能完整由于Aβ可通过血脑屏障(blood-brain barrier,BBB)转运功能从大脑进入血液进行降解,因此BBB在Aβ清除中起重要作用。血管损伤也与AD发病密切相关,脑微血管内皮细胞(brain microvascular endothelial cells,BMVECs)是BBB的重要组成部分,BMVEC构成毛细血管壁,是BBB的主要屏障,可调节BBB的结构和功能完整性。结合Rg1促血管新生及血管保护作用,有实验显示Rg1可以提高Aβ诱导损伤的BMVEC活性[20],减少BMVEC凋亡,从而保证BBB完整性。
2.8 调节自噬Aβ的过度累积可能会损害自噬清除,而通过调节细胞自噬也可以进一步抑制Aβ生成。β-细辛醚可通过下调自噬的特异性标志物Beclin-1、LC3表达及上调p62表达改善AD模型中细胞自噬失调[13]。大剂量(45 mg·kg-1·d-1)β-细辛醚给药通过激活PINK1-Parkin介导的线粒体自噬降低Aβ1-42水平,改善AD大鼠认知缺陷;进一步研究表明,β-细辛醚联合淫羊藿素使用诱导细胞或线粒体自噬抑制AD模型中有害蛋白质及代谢物的增加,且效果优于单用;在健康的神经元中自噬体很少见,然而在AD患者退化的神经元中观察到自噬体的异常积累,β-细辛醚还可通过增强自噬体-溶酶体融合及溶酶体功能,提高自噬通量来保护PC12细胞免受Aβ诱导的损伤[21]。α-细辛醚同样可以减少自噬体过量,促进海马神经元存活,减轻神经元兴奋性毒性[13]。丁香酚具有良好的抗细胞自噬能力,可通过激活ERK1/2、p38MAPK、IKK/NF-κB信号通路并拮抗这些通路的激动剂,同时发挥抗氧化应激作用共同阻止细胞自噬[14]。因此,以上研究提示,以石菖蒲中主要活性成分作为自噬诱导剂及联合治疗方法有望成为防治AD的潜在策略。
2.9 调节代谢产物基于UPLC/MS的代谢组学研究显示,30 mg·kg-1·d-1 Rg2连续给药1个月后,APP/PS1小鼠大脑中鉴定出11种与溶血磷脂酰胆碱(LPC)、次黄嘌呤和鞘脂代谢相关的潜在生物标志物水平部分恢复;Re给药治疗的AD小鼠血浆中共鉴定出10种潜在的生物标志物,Re给药组中色氨酸、十六烷基鞘氨醇、植物鞘氨醇和LPC水平较AD模型组升高,苯丙氨酸水平降低;4 mg·kg-1·d-1的Re处理可恢复由于AD引起的小鼠代谢紊乱,提高LPC水平,保障细胞膜结构完整性并参与多种细胞功能的调节[5]。人参多糖能通过增强肠道吸收和影响肠道微生物代谢,增强人参皂苷Rb1及微生物代谢物的暴露[22],由此起到协助人参皂苷发挥抗AD效果的作用。
综上所述,已有大量实验表明,人参及石菖蒲中多种活性成分可通过调节AD病理标志物、调节神经递质、抑制神经炎症反应、抗氧化反应及保护神经细胞等方面发挥多途径抗AD疗效。
3 人参、石菖蒲药对防治AD的中医理论基础与现代药理学机制石菖蒲可化痰湿而开窍,人参补心气而安神,两者相伍共奏化痰开窍、安神益智之功。人参、石菖蒲单味药及其活性成分均能在一定程度上减轻神经炎症,延缓细胞凋亡,改善认知障碍并具有一定的相关性。针对痴呆虚实夹杂的特点,人参、石菖蒲相须配伍,可发挥其协同增效的作用,基于药物配伍的关联分析得出人参、石菖蒲为治疗痴呆、健忘常用药对[23],当代医家自拟人参益智汤、智慧汤等均包含该药对且具有较好防治AD的临床效果。现代药理研究表明,人参能益智、提高记忆力、减轻健忘,抗衰老;石菖蒲可改善学习记忆和抗脑损伤,二者均具有双向调节中枢神经系统的作用。但目前对于二药联用的药理作用机制研究不多,有必要进行总结并进一步探讨。
3.1 促进药物吸收现代医学研究表明,石菖蒲挥发油可以提高人参皂苷的细胞通透性,进而改善人参皂苷口服利用度低的问题。中医理论中石菖蒲为开窍药代表药物,具有“芳香走窜,引药上行”的功效,石菖蒲挥发油类成分还具有良好的透BBB能力,可直接进入脑组织发挥作用;并通过可逆性开放BBB增加BBB通透性,有效促进中药成分入脑。石菖蒲挥发油可增强定志小丸中人参皂苷类成分脑部吸收量,使Rg1,Re等具有一定脑靶向性并延长在脑内的驻留时间,提高其生物利用度[24]。因此,石菖蒲挥发油可以引药入经,弥补人参有效成分透BBB能力弱的不足,有效发挥人参皂苷类成分的作用,可能是二者配伍协同增效的模式之一。
3.2 抗氧化作用石菖蒲挥发油联合人参总皂苷可以提高D-半乳糖联合氯化铝诱导的AD模型小鼠SOD和Bcl-2含量,降低MDA和Aβ1-42含量,抑制脑织细胞凋亡,保护脑组织正常[25]。对于血管性痴呆模型小鼠,Rb3联合β-细辛醚给药,可以降低小鼠脑组织内4-HNE、8-OHG、ROS含量,并可通过激活Akt通路降低3-硝基酪氨酸(3-NT)、神经营养因子-3(NT-3)、聚腺苷酸二磷酸核糖基聚合酶1(PARP1)和醛糖还原酶(AR)生成,减轻氧化应激对脑细胞的损伤进而减少细胞凋亡[26]。因此,抗氧化作用的增强也可能是人参、石菖蒲药对协同增效的原因之一。
3.3 调节神经递质作用石菖蒲挥发油联合人参总皂苷能促进APP/PS1双转基因小鼠海马中单胺类神经递质多巴胺(DA)和5-羟色胺(5-HT)、甲肾上腺素(NE)以及胆碱类神经递质ChAT的生成和代谢,从而发挥提高学习记忆作用[25]。动物行为学实验结果显示,人参、石菖蒲配伍后安神益智的功效远胜于单用,可能通过提高脑内相关神经递质ACh含量并抑制GABRA1表达来改善睡眠剥夺后动物学习记忆能力[27]。
3.4 减少Aβ沉积邓敏贞等[25]使用补气开窍法通过石菖蒲挥发油联合人参总皂苷给药治疗APP/PS1小鼠,行为学检测发现AD小鼠认知能力提高,Aβ1-42含量和因Aβ1-42沉淀形成的老年斑减少,自噬相关基因(Beclin-1)表达显著降低,可见石菖蒲挥发油和人参总皂苷可以通过干预细胞自噬来减少Aβ沉积,并通过激活PI3K/Akt/mTOR通路降低Aβ40和GFAP表达,保护海马神经元。
3.5 抗炎症反应作用章程鹏等[28]用人参、石菖蒲水煎提取液干预睡眠剥夺大鼠,发现该药对以细胞因子信号转导抑制蛋白-3(SOCS-3)为靶点抑制JAK2/STAT3通路抑制炎症反应发挥神经保护作用,改善睡眠剥夺大鼠的记忆能力。
因此,在现有研究基础上,整合人参、石菖蒲药效物质,从多成分多靶点多途径的作用模式构建活性成分-靶点-信号通路-疾病多层次网络,阐明其配伍规律及量效关系,进一步进行药对配伍配比优化设计,明确其防治AD的药效物质基础,为将之开发成AD防治药物奠定基础。
4 小结与展望人参、石菖蒲配伍作用缓和、不伤正气、调整脏腑功能、延缓衰老,可以抑制Aβ沉积及tau蛋白过度磷酸化这一AD的重要病理表现,延缓AD进程,提高病人生活质量。石菖蒲对多种人参皂苷在大鼠体内的吸收均有促进作用,也是药对协同增效的可能途径之一。但二药联用是否能够实现协同增效的作用值得深入对比研究,这亦涉及到中药“七情和合”配伍规律科学内涵的阐释。中药及其复方系多成分、多靶点、多通道、多层次综合调节作用,即使是单味中药也是通过综合作用实现其疗效的,显然单纯从成分组成的角度阐释中药复方作用机制以及寻找其物质基础依旧存在局限性,而应以整体观念为指导开展研究。网络药理学的研究模式发挥了一定的作用,有助于筛选复方多成分、多把点、多通道的作用模式。故在网络药理学研究基础上,探索人参、石菖蒲药物组合对复杂生命体的作用和调控、以及药物联用协同增效减毒的机制,可更大程度挖掘该药对的潜在药用价值。
由于人参口服利用度较低,透BBB能力较弱,其如何到达脑内发挥作用有待于进一步探讨,人参、石菖蒲药对作用效果优于单味药是否源自于石菖蒲挥发油引药上行的作用?如能阐明引药上行的科学内涵,将有望推动药物联用作用机制的阐明,推动药物组合理论的完善。外泌体(exosomes,EXOs)具有细胞间通讯功能,药物调控某一细胞EXOs的组装、载货、释放与吞噬过程,以及对EXOs携带的核酸、蛋白质、脂质等丰富内容物的表达调控,纳米级直径的囊泡的EXOs可以透过BBB,无论是通过对EXOs内容物的调控还是携带外源性物质靶向作用于脑区,都是对神经系统疾病治疗的可能方式。有实验显示,Rg1通过抑制巨噬细胞源性外泌体中miR-21的释放,改善血脑屏障的损坏[29],还能促进内皮祖细胞分泌外泌体,并提高外泌体中相关miRNA的表达,促进血管新生[30]。因此,基于外泌体递送miRNA角度展开研究,会为探讨人参、石菖蒲防治AD的作用机制、增强治疗效果提供新的方向。
因此,在中医药基本理论的指导下,借鉴现代科学技术,取中医药传统理论之精华,传承创新发展中医药,深层次阐明中药作用机制,推动中药复方临床应用说得清、讲得明,将有力地推动中医药事业的繁荣与传承,将更好地推动中医药服务于人类健康。
| [1] |
Gauthier S, Webster C, Servaes S, et al. World Alzheimer Report 2022: Life after diagnosis: Navigating treatment, care and support [R]. London: Alzheimer′s Disease International, 2022.
|
| [2] |
Khan S, Barve K H, Kumar M S. Recent advancements in pathogenesis, diagnostics and treatment of Alzheimer′s disease[J]. Curr Neuropharmacol, 2020, 18(11): 1106-25. doi:10.2174/1570159X18666200528142429 |
| [3] |
Athar T, Al Balushi K, Khan S A. Recent advances on drug development and emerging therapeutic agents for Alzheimer's disease[J]. Mol Biol Rep, 2021, 48(7): 5629-45. doi:10.1007/s11033-021-06512-9 |
| [4] |
王永炎, 李明富, 戴锡盟. 中医内科学[M]. 上海: 上海科学技术出版社, 2000. Wang Y Y, Li M F, Dai X M. Chinese Internal Medicine[M]. Shanghai: Shanghai Sci Tech Press, 2000. |
| [5] |
Razgonova M P, veselov V V, zakharenko A M, et al. Panax ginseng components and the pathogenesis of Alzheimer's disease (Review)[J]. Mol Med Rep, 2019, 19(4): 2975-98. |
| [6] |
Quan Q, Li X, Feng J, et al. Ginsenoside Rg1 reduces &beta-amyloid levels by inhibiting CDΚ 5-induced PPARγ phosphorylation in a neuron model of Alzheimer's disease[J]. Mol Med Rep, 2020, 22(4): 3277-88. |
| [7] |
张春霞, 郭俊和, 陈云波, 等. 石菖蒲活性成分对双转基因小鼠APP及神经突触超微结构的影响[J]. 中药新药与临床药理, 2014, 25(1): 18-23. Zhang C X, Guo J H, Chen Y B, et al. Effects of active components of Rhizoma Acori Tatarinowii on APP and synaptic ultrastructure in Tg - APPswe/ PS1dE9 mice[J]. Tradit Chin Drug Res Clin Pharmacol, 2014, 25(1): 18-23. |
| [8] |
杨从. β细辛醚减少AD小鼠脑内老年斑发挥抗凋亡作用的研究[D]. 广州: 广州中医药大学, 2014. Yang C. Study on the anti-apoptotic effect of β-asarone to reduce age spots in the brain of AD mice. [D]. Guangzhou: Guangzhou Univ Chin Med, 2014. |
| [9] |
Li L, Li T, Tian X, et al. Ginsenoside Rd attenuates Tau phosphorylation in olfactory bulb, spinal cord, and telencephalon by regulating glycogen synthase kinase 3beta and cyclin-dependent kinase 5[J]. Evid Based Complement Alternat Med, 2021, 2021: 4485957. |
| [10] |
Yang Y, Wang L, Zhang C, et al. Ginsenoside Rg1 improves Alzheimer's disease by regulating oxidative stress, apoptosis, and neuroinflammation through Wnt/GSK-3beta/beta-catenin signaling pathway[J]. Chem Biol Drug Des, 2022, 99(6): 884-96. doi:10.1111/cbdd.14041 |
| [11] |
Yang Y, Li S, Huang H, et al. Comparison of the protective effects of ginsenosides Rb1 and Rg1 on improving cognitive deficits in SAMP8 mice based on anti-neuroinflammation mechanism[J]. Front Pharmacol, 2020, 11: 834. doi:10.3389/fphar.2020.00834 |
| [12] |
Lee K W, Jung S Y, Choi S M, et al. Effects of ginsenoside Re on LPS-induced inflammatory mediators in BV2 microglial cells[J]. BMC Complement Altern Med, 2012, 12: 196. doi:10.1186/1472-6882-12-196 |
| [13] |
Balakrishnan R, cho D Y, kim I S, et al. Molecular mechanisms and therapeutic potential of alpha- and beta-Asarone in the treatment of neurological disorders[J]. Antioxidants (Basel), 2022, 11(2): 281. doi:10.3390/antiox11020281 |
| [14] |
Barboza J N, Da silva Maia Bezerra Filho C, Silva R O, et al. An overview on the anti-inflammatory potential and antioxidant profile of eugenol[J]. Oxid Med Cell Longev, 2018, 2018: 3957262. |
| [15] |
Zhong J, Qiu X, Yu Q, et al. A novel polysaccharide from Acorus tatarinowii protects against LPS-induced neuroinflammation and neurotoxicity by inhibiting TLR4-mediated MyD88/NF-kappaB and PI3K/Akt signaling pathways[J]. Int J Biol Macromol, 2020, 163: 464-75. doi:10.1016/j.ijbiomac.2020.06.266 |
| [16] |
杨岩涛, 赵佳柱, 肖佳妹, 等. 人参皂苷治疗阿尔茨海默病的药理作用研究进展[J]. 中国药理学通报, 2021, 37(12): 1638-43. Yang Y T, Zhao J Z, Xiao J M, et al. Advances in pharmacological effects of ginsenoside on Alzheimer′s disease[J]. Chin Pharmacol Bull, 2021, 37(12): 1638-43. doi:10.3969/j.issn.1001-1978.2021.12.003 |
| [17] |
Xue Z, Guo Y, Zhang S, et al. Beta-asarone attenuates amyloid beta-induced autophagy via Akt/mTOR pathway in PC12 cells[J]. Eur J Pharmacol, 2014, 741: 195-204. doi:10.1016/j.ejphar.2014.08.006 |
| [18] |
Zhang H, Su Y, Sun Z, et al. Ginsenoside Rg1 alleviates Aβ deposition by inhibiting NADPH oxidase 2 activation in APP/PS1 mice[J]. J Ginseng Res, 2021, 45(6): 665-75. doi:10.1016/j.jgr.2021.03.003 |
| [19] |
许方方, 张珊, 李建玲, 等. 人参皂苷Rb1对阿尔茨海默病模型小鼠术后认知功能、海马内突触后致密蛋白-95及尼氏体表达的影响[J]. 中西医结合心脑血管病杂志, 2022, 20(3): 440-4. Xu F F, Zhang S, Li J L, et al. Effects of ginsenoside Rb1 on postoperative cognitive function, expression of PSD-95 and nissI body in hippocampus of AIzheimer′s disease modeI mice[J]. Chin J Integr Med Cardio-/Cerebrovasc Dis, 2022, 20(3): 440-4. |
| [20] |
高爱社, 杜欢, 范英昌, 等. 通络救脑注射液对Aβ1-40致脑微血管内皮细胞损伤的保护作用[J]. 中药新药与临床药理, 2016, 27(2): 157-60. Gao A S, Du H, Fan Y C, et al. Protective effects of Tongluo Jiunao Injection on brain microvascular endothelial cells injured by β-amyloid 1-40[J]. Tradit Chin Drug Res Clin Pharmacol, 2016, 27(2): 157-60. |
| [21] |
Wang N, Wang H, Pan Q, et al. The combination of beta-asarone and icariin inhibits amyloid-beta and reverses cognitive deficits by promoting mitophagy in models of Alzheimer's disease[J]. Oxid Med Cell Longev, 2021, 2021: 7158444. |
| [22] |
Shen H, Gao X J, Li T, et al. Ginseng polysaccharides enhanced ginsenoside Rb1 and microbial metabolites exposure through enhancing intestinal absorption and affecting gut microbial metabolism[J]. J Ethnopharmacol, 2018, 216: 47-56. doi:10.1016/j.jep.2018.01.021 |
| [23] |
惠怀正. 基于古代医籍数据挖掘的痴呆证治规律研究[D]. 昆明: 云南中医药大学, 2020. Hui H Z, Research on the rule of syndrome and treatment of dementia based on ancient medical data mining[D]. Kunming: Yunnan Univ Tradit Chin Med, 2020. |
| [24] |
孙宇飞. 基于PK-PD关联分析研究定志小丸治疗阿尔茨海默病的药效物质基础及作用机制[D]. 合肥: 中国科学技术大学, 2020. Sun F Y, Study on the pharmacodynamic material basis and mechanism of Ding-Zhi-Xiao-Wan prescription in the treatment of Alzheimer's disease based on PK-PD correlation analysis[D]. Hefei: Univ Sci Tech Chin, 2020. |
| [25] |
邓敏贞. 补气开窍法对APP/PS1双转基因痴呆小鼠的作用及其自噬机理研究[D]. 广州: 广州中医药大学, 2016. Deng M Z. The effect and mechanism of volatile oil of Acorus tatarinowii Schott and total ginsenoside co-administration on APP/PS1 double transgenic mice[D]. Guangzhou: Guangzhou Univ Chin Med, 2016. |
| [26] |
邓敏贞, 钟晓琴, 宁百乐, 等. 定志小丸有效成分中人参皂苷Rb3联合β-细辛醚对血管性痴呆模型小鼠作用研究[J]. 辽宁中医药大学学报, 2021, 23(5): 31-4. Deng M Z, Zhong X Q, Ning B L, et al. Effect of ginsenoside Rb3 and β-asarone in active ingredients of Dingzhi Xiaowan Decoction on vascular dementia model mice[J]. J Liaoning Univ Tradit Chin Med, 2021, 23(5): 31-4. |
| [27] |
孙易娜, 章程鹏, 周燕萍, 等. 人参-石菖蒲药对安神益智作用的动物行为学研究及其机制的初步探索[J]. 时珍国医国药, 2019, 30(3): 576-8. Sun Y N, Zhang C P, Zhou Y P, et al. Preliminary exploration of the behavioral study on the tranquilizing and educational effects of ginseng- acorus calamus and its mechanism in animals[J]. Lishizhen Med Mater Med Res, 2019, 30(3): 576-8. |
| [28] |
章程鹏, 熊振芳, 孙易娜. 人参石菖蒲药对对睡眠剥夺大鼠海马JAK-STAT通路影响的实验研究[J]. 时珍国医国药, 2018, 29(7): 1577-9. Zhang C P, Xiong Z F, Sun Y N. Experimental study on the effect of ginseng-acorus calamus medicine on the hippocampal JAK-STAT pathway in sleep deprived rats[J]. Lishizhen Med Mater Med Res, 2018, 29(7): 1577-9. |
| [29] |
Zhai K, Duan H, Wang W, et al. Ginsenoside Rg1 ameliorates blood-brain barrier disruption and traumatic brain injury via attenuating macrophages derived exosomes miR-21 release[J]. Acta Pharm Sin B, 2021, 11(11): 3493-507. doi:10.1016/j.apsb.2021.03.032 |
| [30] |
熊武, 谭梅鑫, 邹晓玲, 等. 人参皂苷Rg1调控内皮祖细胞分泌外泌体及表达血管新生相关miRNAs的影响[J]. 时珍国医国药, 2022, 33(2): 277-80. Xiong W, Tan M X, Zou X L, et al. Ginsenoside Rg1 regulates the secretion of exosomes and expression of angiogenesis-related miRNAs in endothelial progenitor cells[J]. Lishizhen Med Mater Med Res, 2022, 33(2): 277-80. doi:10.3969/j.issn.1008-0805.2022.02.06 |