

急性肾脏损伤(acute kidney injury, AKI)后的纤维化和炎症反应,导致的慢性结构变化渐进性进展被认为是慢性肾病(chronic kidney disease, CKD)发生的重要病因之一。缺血/再灌注的发生[1]、抗肿瘤药物的应用[2]、横纹肌溶解症[3]、细菌感染甚至服药不当[4], 均会引起AKI的发生,其中药物引起的AKI在所有AKI病例中的比例持续增加[5]。
药物性AKI动物模型的构建有利于研究肾损伤的发病机制,其组织形态的变化与生态指标及临床表现的相互关系的研究,是筛选有效药物,阐明疗效机制的重要媒介。现有技术中,药物性AKI多使用对肾脏有损伤的药物构建,如顺铂(cisplatin, CDDP)、脂多糖等。对药物肾损伤模型的成功构建有助于帮助寻找保护肾功能,促进肾脏AKI恢复,延缓肾脏疾病进展和控制并发症的机制和药物。
C57BL/6作为广泛使用的近交小鼠品系,主要包括C57BL/6J和C57BL/6N两个核心亚型,在研究药物引起的AKI模型中发挥了不可替代的作用。两者由于表型差异的不同出现遗传变异,但还是经常被用于各种疾病模型及潜在机制的研究[6]。Simon等[7]对C57BL/6J和C57BL/6N进行了全面的基因组序列比较和表型分析,发现了这两种亚系在基因组序列、视网膜、心血管、新陈代谢、神经、行为和感觉以及免疫功能等方面存在明显表型差异,可能影响其潜在遗传机制及表现差异。目前尚未发现有研究比较顺铂诱导肾损伤模型在C57BL/6J和C57BL/6N小鼠亚系之间的差异性。顺铂肾损伤主要表现为肾小管扩张或萎缩,肾间质大量炎症细胞浸润,进而发展为肾间质纤维化,最终导致不可逆性肾功能不全[8]。因此,降低炎症细胞浸润和减少肾间质纤维化过程对于临床上寻求促进药物AKI恢复的治疗手段具有重要意义。基于此,本研究将探究顺铂在C57BL/6J和C57BL/6N小鼠亚系肾损伤模型的构建,及其在C57BL/6J和C57BL/6N亚系小鼠肾小管的损伤、间质纤维化和炎症因子的表达是否存在差异影响。
1 材料与方法 1.1 药物及试剂CDDP(cisplatin, 批号:153513), 上海陶素生化科技有限公司;BCA蛋白浓度测定试剂盒、4%多聚甲醛固定液,武汉博士德生物工程有限公司;肌酐(creatinine, CRE)、尿素氮(blood urea nitrogen, BUN)检测试剂盒,南京建成科技有限公司;β2微球蛋白(β2-microglobulin, β2-MG)试剂盒,上海酶免生物科技有限公司;白细胞介素1β(interleukin-1β, IL-1β)(GB11113), 武汉赛维尔生物科技有限公司;白细胞介素6(interleukin-6, IL-6)(A11115)和白细胞介素18(interleukin-18, IL-18)(A1115), 武汉Abcolonal生物科技有限公司;β肌动蛋白单抗(一抗)(AC038), 武汉Abcolonal生物科技有限公司;辣根过氧化物酶标记山羊抗兔IgG抗体(二抗)(BA1054), 武汉博士德生物工程有限公司;ECL超敏发光液,上海羿圣生物科技有限公司。
1.2 仪器电子天平(CP124C, 中国常州), 倒置荧光显微镜(德国Leica); 多功能酶标仪(美国伯腾); 高速冷冻离心机(徳国Eppendorf); 电热恒温培养箱(B667902, 上海智城); 凝胶电泳及成像设备(美国Bio-Rad)。
1.3 实验动物12周C57BL/6J和N雄性小鼠,SPF级,体质量为(26 ± 2)g, 北京维通利华实验动物科技有限公司,实验动物生产许可证号:SCXK(京)2021-0006。饲养于山西医科大学实验动物中心。饲养环境温度(25~26) ℃, 相对湿度45%~60%, 12 h昼夜交替照明,自由摄食饮水,实验前适应性饲养1周。所有动物均经山西医科大学动物实验中心动物福利伦理委员会批准(SYDL2022004), 实验设施许可证编号为SYXK(晋)2019-0007。
1.4 动物分组和给药J及N亚系C57BL/6小鼠置正常环境饲养适应1周,随机分为正常对照组、顺铂组,每组8~10只。顺铂组腹腔注射3.33 mg·kg-1, 隔天给药,共6次,连续给药2周,累积剂量20 mg·kg-1, 建立亚急性肾损伤模型。正常对照组腹腔注射等体积生理盐水。给药结束后观察1周,随后用1%戊巴比妥(0.1 mL/10 g, ip)麻醉小鼠,眼眶采血留取血液标本,留取小鼠双侧肾脏用于后续实验。
1.5 肾功能测定小鼠眼眶静脉采血,血样置非抗凝管中,常温下静置2 h后离心(4 ℃, 3 000 r·min-1, 20 min), 抽取上清,严格按照试剂盒说明书进行血清中血Scr、BUN和β2-MG含量的测定。
1.6 ELISA检测血清中炎症因子的含量同上采血,抽取上清,严格按照试剂盒说明书进行血清中血IL-1β、IL-6、IL-18炎症因子的含量测定。
1.7 肾脏组织病理变化肾脏称重后,取肾脏皮质部分组织置于4%多聚甲醛中浸泡固定至少24 h, 剩余肾脏组织置-80 ℃冰箱用于后续实验。将固定的肾脏组织常规石蜡包埋后切片(厚度4 μm), 按试剂盒说明书分别进行HE、Masson和PAS染色。HE染色用于观察肾脏组织形态变化;Masson染色观察肾脏纤维化程度,PAS染色观察肾脏组织糖原沉积情况,肾小管损伤评分基于肾小管受损的百分比,利用光学显微镜在高倍视野下,对肾小管上皮细胞丢失、坏死、肾小管内碎片和管型形成程度进行评分:无损伤为0分;<25%为1分;25%~50%为2分;50%~75%为3分;> 75%为4分[9]。使用Image-pro plus 8.0软件测量肾脏蓝染胶原纤维相对面积、紫红色糖原沉积相对面积,计算胶原纤维面积百分比、糖原沉积面积百分比,并取平均值。
1.8 Western blot印迹法检测肾脏IL-1β.IL-6和IL-18蛋白表达水平取20 mg肾脏皮质组织加入200 μL裂解液,研磨后置于摇床摇晃,冰上裂解30 min, 离心(4 ℃, 13 000×g, 20 min), 取上清并进行蛋白质定量。取等量蛋白加入蛋白上样缓冲液混匀,煮沸15 min, 进行SDS-PAGE电泳。随后转膜,脱脂牛奶封闭2 h; 分别加入IL-1β (1 ∶1 000)、IL6 (1 ∶1 000)、IL-18 (1 ∶1 000)、β-actin (1 ∶5 000)抗体,4 ℃孵育过夜,二抗室温孵育1 h, 用ECL化学发光剂显影。用Image Lab软件对凝胶条带进行灰度值测定及定量分析,各泳道以β-actin为内参对目的条带进行标准化处理。
1.9 统计学分析采用GraphPad Prism 9.3.1统计分析,实验数据均以x±s表示,所有数据均采用双因素方差分析。
2 结果 2.1 顺铂给药前后C57BL/6J和N亚系体重变化.生存率的差异如Fig 1所示,C57BL/6J和C57BL/6N亚系小鼠给药前体质量均一,CDDP给药后C57BL/6N小鼠体质量比C57BL/6J亚系小鼠体质量下降明显,且差异有统计学意义(P<0.01)。生存曲线结果显示,C57BL/6N小鼠存活率较C57BL/6J亚系小鼠高,存活率100%, C57BL/6J亚系小鼠存活率为80%, 但差异无统计学意义。
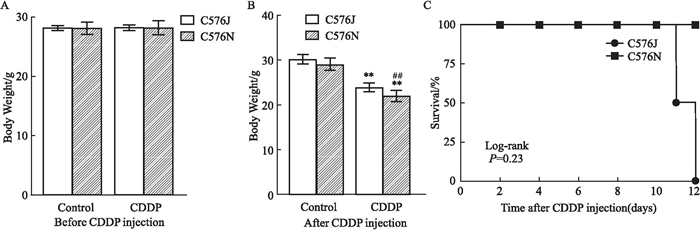
|
| Fig 1 Effects of cisplatin on body weight change and survival rate between C57BL6J and 6N sublines(x±s, n=8~0) A: The body weight change of mice in both groups before CDDP injection; B: The body weight change of mice in both groups after CDDP injection; C: Survival rate in C57BL/6 mice after CDDP injection was observed every other day.**P < 0.01, CDDP group vs Control group; ##P < 0.01, C57BL/6J vs the C57BL/6N. |
如Fig 2所示,与Control组相比,CDDP给药后C57BL/6J和C57BL/6N亚系小鼠血清Scr、BUN和β2-MG值均有升高,且差异有统计学意义。C57BL/6N系小鼠与C57BL/6J系小鼠肾功能指标比较,Scr和BUN均值明显偏高,且差异有统计学意义(P<0.01)。
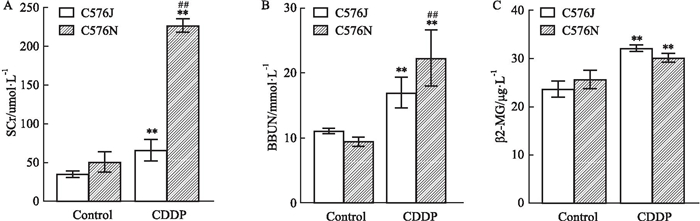
|
| Fig 2 Effect of renal function in cisplatin-induced renal injury model in C57BL/6J and N substrain mice(x±s, n=6) A-C: Changes of Scr, BUN and β2-MG content in serum of mice.**P < 0.01, CDDP group vs Control group; ##P < 0.01, C57BL/6J vs C57BL/6N. |
如Fig 3所示,与Control组相比,CDDP给药后C57BL/6J和C57BL/6N亚系血清中IL-1β、IL-6和IL-18炎症因子分泌水平均明显升高(P<0.05)。C57BL/6N小鼠与C57BL/6J系小鼠比较,IL-1β、IL-6和IL-18均值明显偏高,但无统计学差异。
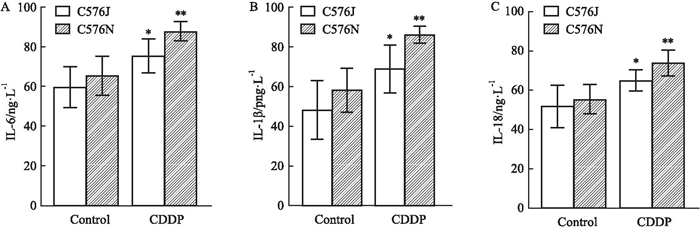
|
| Fig 3 Changes in inflammatory cytokines in cisplatin-induced renal injury model in C57BL/6J and N substrain mice (x±s, n=6) A: Serum IL-6 levels in mice; B: Serum IL-1β levels in mice; C: Serum IL18 levels in mice.*P < 0.05, **P < 0.01, CDDP group vs Control group. |
如Fig 4所示,HE染色结果显示,Control组C57BL/6J和C57BL/6N亚系小鼠肾脏组织无明显异常,CDDP组C57BL/6J和C57BL/6N亚系小鼠均可见大量的肾小管上皮细胞水样变性,细胞肿胀,胞质疏松淡染,肾小管管腔内可见脱落的上皮细胞,肾小管形态不规则,病理组织学评分与Control组相比,肾小管损伤差异有统计学意义(P<0.01)。C57BL/6 N亚系小鼠与C57BL/6 J亚系小鼠相比,肾小管损伤严重,但差异无统计学意义;Masson染色结果显示,C57BL/6N亚系小鼠纤维化蓝染面积增加,与C57BL/6J系相比差异有统计学意义(P<0.01);PAS染色结果显示,C57BL/6 N亚系小鼠与C57BL/6 J亚系Control组小鼠相比肾脏组织可见系膜扩张,糖原沉积增加(P<0.05), CDDP组两亚系组均可见明显糖原沉积,但差异无统计学意义。
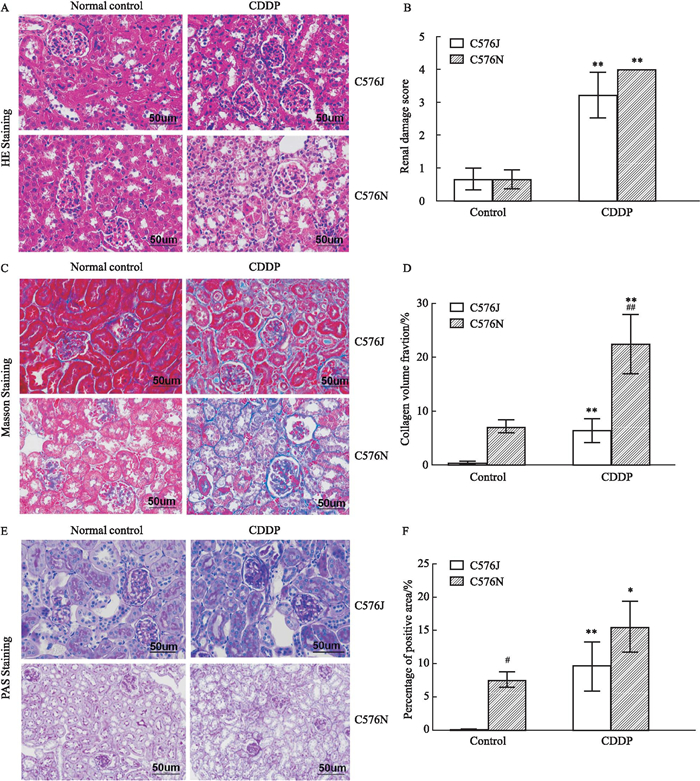
|
| Fig 4 Effect of the pathological changes of renal tissue in cisplatin-induced renal injury model in C57BL/6J and N substrain mice (x±s, n=3) A, C and E: Kidney histological changes were observed using H&E, Masson and PAS staining (×400, scale bar=50 μm). B: Renal damage score. D: Collagen volume fraction of kidney of mice in each group. F: Positive area percentage of kidney of WT mice in each group. *P < 0.05, **P < 0.01, CDDP vs Control group; #P < 0.05, ##P < 0.01, C57BL/6J vs C57BL/6N. |
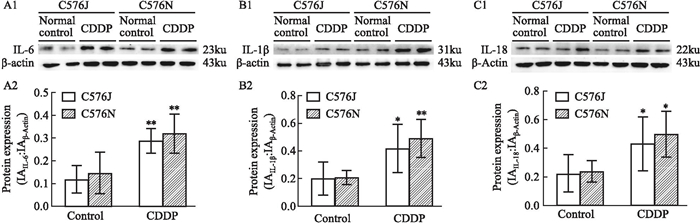
如Fig 5所示,与Control组相比,CDDP组C57BL/6J和C57BL/6N两亚系小鼠肾皮质组织IL-6、IL-1β和IL-18蛋白表达水平明显升高(P<0.01或P<0.05)。C57BL/6N小鼠与C57BL/6J系小鼠比较,其组织中IL-6、IL-1β和IL-18蛋白表达明显偏高,但差异无统计学意义。
|
| Fig 5 Changes in protein expression levels in cisplatin-induced renal injury model in C57BL/6J and N substrain mice(x±s, n=6) A2-C2 were the semi-quantitative results of A1-C1 respectively. *P < 0.05, **P < 0.01, CDDP vs Control group. |
顺铂主要通过肾脏排泄,可通过膜转运蛋白(转运蛋白2、铜转运蛋白1)被近端小管细胞所摄取,其肾毒性主要以肾小管细胞损伤和死亡为常见的组织病理学特征。同时,顺铂在肾小管可引起炎症、氧化应激、内质网应激、线粒体损伤,进一步导致肾血流减少和肾小球滤过率下降[8, 10]。本研究肾功能结果显示,两种小鼠CDDP组血清Scr、BUN和β2-MG含量明显升高,提示肾小球滤过率下降,肾功能受损;病理学检测结果发现,肾小管上皮细胞变性,坏死脱落,这些结果均提示使用顺铂隔天腹腔注射连续两周后肾损伤模型构建成功。以往研究发现,在慢性草酸钙晶体形成出现钙质沉积相关(calcium oxalate, CaOx)肾病模型中,C57BL/6N小鼠比C57BL/6J小鼠更容易出现CaOx晶体沉积,最后发展为CKD[11]。也有研究报道,在急性CaOx肾病模型中发现C57BL/6J小鼠比C57BL/6N小鼠具有更多的肾脏CaOx晶体沉积,这可能与Nnt蛋白有关[12]。本研究结果显示,C57BL/6N小鼠的Scr明显增加,BUN也略高于C57BL/6J小鼠,观察到的这些表型差异可能与小鼠品系之间的遗传变异密切相关[11]。
现有证据表明,在AKI反复发作或加重之后,近端小管上皮反复损伤,修复或反应过程中结缔组织严重积聚,从而持续产生和分泌促纤维化因子,导致肾小管萎缩、肾小管间质纤维化以及长期功能障碍[13-15]。本实验肾脏组织形态学染色结果显示,CDDP给药后肾脏组织可见大量的肾小管上皮细胞水样变性,坏死脱落,肾小管形态不规则;肾脏组织胶原纤维化严重;系膜扩张,糖原过度沉积。在对其进行肾小管损伤评分、纤维化百分比、糖原沉积阳性百分比定量分析后,我们发现顺铂诱导的肾损伤在C57BL/6N小鼠比C57BL6J小鼠病理损伤明显,C57BL/6N小鼠肾脏纤维化程度尤为严重。同时C57BL/6N小鼠注射CDDP后虽然体重较C57BL/6J小鼠下降明显,但精神状态、活跃度较C57BL/6J小鼠表现良好,其生存率也较C57BL/6J高,提示C57BL/6N小鼠更适合作为顺铂肾损伤模型的建立动物。糖原沉积多与遗传、代谢及免疫反应发生有关,我们发现未给药之前,C57BL/6N小鼠肾脏糖原沉积较C57BL/6J小鼠明显,且差异有统计学意义,给予顺铂后C57BL/6N小鼠糖原沉积比C57BL/6J小鼠更为严重,但差异无统计学意义,这些结果提示我们C57BL/6N小鼠可能作为某些糖原沉积症的天然模型或者诱发动物更为合适。
IL-1β和IL-6作为促炎核心因子,二者在感染、自身免疫、癌症和慢性炎症中发挥着至关重要的作用;IL-18作为独特的细胞因子,参与癌症、抑郁症和认知障碍、肾缺血/再灌注以及各种炎症性疾病的发生发展。大量研究表明,强烈的炎症反应与顺铂肾毒性的发病机制息息相关,肾损伤诱导大量促炎细胞因子和趋化因子的合成与释放[16-17]。促炎细胞因子如IL-1β、IL-6和TNF-α等参与CDDP诱导的AKI, 槲皮素可通过降低IL-1β、IL-6和TNF-α参与介导保护顺铂AKI[18]。本研究结果显示,CDDP可诱导小鼠肾脏组织中IL-6、IL-1β、IL-18等炎症因子表达水平的升高。其中C57BL/6N系小鼠与C57BL/6J系小鼠比较,均值明显偏高,但差异无统计学意义,提示C57BL/6N系小鼠较C57BL/6J系小鼠免疫反应强烈,其原因可能与遗传差异有关。
综上所述,本研究主要比较了C57BL/6J和C57BL/6N系小鼠在CDDP给药后肾损伤差异性,结果显示,C57BL/6J和C57BL/6N小鼠顺铂肾损伤模型均可成功制备,但C57BL/6N系小鼠炎症损伤反应高于C57BL/6J系小鼠,生存率及生存状态均优于C57BL/6J系小鼠,肾功能损伤,组织病理损伤、肾脏糖原沉积程度及肾组织纤维化程度均较C57BL/6J系小鼠明显。C57BL/6N系小鼠在炎症、糖原沉积方面的特点和纤维化程度及动物存活率的优点有助于肾脏疾病的研究,这为以后选取疾病模型或指导未来相关领域的研究提供了一定的参考依据。
( 致谢: 特别感谢山西医科大学药理教研室各位老师和同学们的帮助。)
| [1] |
闫聚瀚, 赵朋涛, 闫晓冬, 等. 小鼠肾缺血/再灌注损伤模型的研究进展[J]. 西部医学, 2023, 35(10): 1555-60. Yan J H, Zhao P T, Yan X D, et al. Research progress in mouse models of renal ischemia-reperfusion injury[J]. Med J West Chin, 2023, 35(10): 1555-60. doi:10.3969/j.issn.1672-3511.2023.10.029 |
| [2] |
任春霞, 余自成. 药物性急性肾损伤的研究进展[J]. 中国新药与临床杂志, 2019, 38(5): 257-62. Ren C X, Yu Z C. Research progress in drug-induced acute kidney injury[J]. Chin J New Drugs Clin Rem, 2019, 38(5): 257-62. |
| [3] |
Gaut J P, Liapis H. Acute kidney injury pathology and pathophysiology: a retrospective review[J]. Clin kidney J, 2021, 14(2): 526-36. doi:10.1093/ckj/sfaa142 |
| [4] |
Molinari L, Heskia F, Peerapornratana S, et al. Limiting acute kidney injury progression in sepsis: Study protocol and trial simulation[J]. Crit Care Med, 2021, 49(10): 1706-16. doi:10.1097/CCM.0000000000005061 |
| [5] |
Yu C, Guo D, Yao C, et al. Clinical characteristics of hospitalized patients with drug-induced acute kidney injury and associated risk factors: A case-control study[J]. BioMed Res Int, 2020, 15(2020): 1-8. |
| [6] |
Mekada K, Yoshiki A. Substrains matter in phenotyping of C57BL/6 mice[J]. Exp Anim, 2021, 70(2): 145-60. doi:10.1538/expanim.20-0158 |
| [7] |
Simon M M, Greenaway S, White J K, et al. A comparative phenotypic and genomic analysis of C57BL/6J and C57BL/6N mouse strains[J]. Genome Biol, 2013, 14(7): 1-22. |
| [8] |
Tang C, Livingston M J, Safirstein R, et al. Cisplatin nephrotoxicity: new insights and therapeutic implications[J]. Nat Rev Nephrol, 2023, 19(1): 53-72. |
| [9] |
单娟萍, 官继超, 董志超, 等. 冬虫夏草通过抗氧化抗炎抑制细胞凋亡改善顺铂肾损伤[J]. 中国中西医结合肾病杂志, 2019, 20(6): 474-7. Shan J P, Guan J C, Dong Z C, et al. Cordyceps sinensis ameliorates cisplatin-induced nephrotoxicity in mice through inhibition of oxidative sress, inflammztion and apoptosis[J]. Chin J Integr Tradit Wes Nephrol, 2019, 20(6): 474-7. doi:10.3969/j.issn.1009-587X.2019.06.002 |
| [10] |
Volarevic V, Djokovic B, Jankovic M G, et al. Molecular mechanisms of cisplatin-induced nephrotoxicity: A balance on the knife edge between renoprotection and tumor toxicity[J]. J Biomed Sci, 2019, 26(1): 1-14. |
| [11] |
Ma Q, Grigorescu M, Schreiber A, et al. Genetic background but not intestinal microbiota after co-housing determines hyperoxaluria-related nephrocalcinosis in common inbred mouse strains[J]. Front Immunol, 2021, 12: 673423. |
| [12] |
Usami M, Okada A, Taguchi K, et al. Genetic differences in C57BL/6 mouse substrains affect kidney crystal deposition[J]. Urolithiasis, 2018, 46(6): 515-22. |
| [13] |
赖灿, 李乐乐, 胡塔拉, 等. 肾脏间质纤维化动物模型的研究进展[J]. 实验动物与比较医学, 2023, 43(2): 163-72. Lai C, Li L L, Hu T L, et al. Recent advances of animal models of renal interstitial fibrosis[J]. Lab Animal Comp Med, 2023, 43(2): 163-72. |
| [14] |
Humphreys B D. Mechanisms of renal fibrosis[J]. Annu Rev Physiol, 2018, 80: 309-26. |
| [15] |
Venkatachalam M A, Weinberg J M, Kriz W, et al. Failed tubule recovery, AKI-CKD transition, and kidney disease progression[J]. J Am Soc Nephrol, 2015, 26(8): 1765-76. |
| [16] |
尹连红, 张一萌, 彭金咏. 顺铂诱导肾毒性的分子机制及中药干预研究进展[J]. 中国药理学通报, 2020, 36(1): 13-8. Yin L H, Zhang Y M, Peng J Y. Molecular mechanism of cisplatin-induced nephrotoxicity and intervention of traditional Chinese medicine[J]. Chin Pharm Bull, 2020, 36(1): 13-8. doi:10.3969/j.issn.1001-1978.2020.01.004 |
| [17] |
Akhter J, Khan J, Baghel M, et al. NLRP3 inflammasome in rosmarinic acid-afforded attenuation of acute kidney injury in mice[J]. Sci Rep, 2022, 12(1): 1313. |
| [18] |
Tan R Z, Wang C, Deng C, et al. Quercetin protects against cisplatin-induced acute kidney injury by inhibiting Mincle/Syk/NF-κB signaling maintained macrophage inflammation[J]. Phytother Res, 2020, 34(1): 139-52. |

