


2. 甘肃省中医药防治慢性病重点实验室, 甘肃兰州 730000;
3. 甘肃中医药大学附属医院, 甘肃兰州 730000;
4. 甘肃中医药大学药学院, 甘肃兰州 730000
李应东(1962-), 男, 博士, 教授, 博士生导师, 研究方向: 中西医结合防治心血管病, 通信作者, E-mail: lydj412@163.com
 ,
CHEN Qi-lin1,2,4,
ZHANG Qi-li4,
LYU Xin-fang1,2,3,
ZHI Xiao-dong1,2,3,
GAO Xiang1,2,3,
WU Xue1,2,
LI Xiao-jing1,2,
LIU Kai1,2,3,
ZHAO Xin-ke1,2,3
,
CHEN Qi-lin1,2,4,
ZHANG Qi-li4,
LYU Xin-fang1,2,3,
ZHI Xiao-dong1,2,3,
GAO Xiang1,2,3,
WU Xue1,2,
LI Xiao-jing1,2,
LIU Kai1,2,3,
ZHAO Xin-ke1,2,3
 ,
LI Ying-dong1,2,3
,
LI Ying-dong1,2,3

2. Gansu Province Key Laboratory of Chinese Medicine for the Prevention and Treatment of Chronic Diseases, Lanzhou 730000, China;
3. Affiliated Hospital of Gansu University of Chinese Medicine, Lanzhou 730000, China;
4. College of Pharmacy, Gansu University of Chinese Medicine, Lanzhou 730000, China
放射性心肌纤维化(radiation-induced myocardial fibrosis, RIMF)是放射性心脏疾病终末病理改变,是成年人心力衰竭和心房颤动的主要原因[1-2], 因此,对该病的防治应引起人们的高度重视[3]。近年来,驱动心肌细胞死亡的氧化应激与纤维化之间的机制为研究热点,而铁死亡作为一种特殊的细胞死亡方式,在各种心血管疾病疾病中,已相继证实铁死亡参与其病程的发生发展[4-7], 然而在RIMF中未见相关的研究报道。因此,调控铁死亡缓解RIMF为临床治疗提供潜在靶点。目前,RIMF的发生发展机制尚未得到明确阐述,而且缺乏有效的治疗手段。研究发现,中药防治RIMF已取得一定成效。因此,探索针对防治RIMF的新药物具有重要意义。中医学认为:辐射属于火热毒邪,会损伤人体的心气心血,导致机体出现气虚血瘀的症状。当归和黄芪是我国传统的益气活血类中药,在前期研究中,本课题组根据古方当归补血汤中两味中药的配伍比例,采用超滤膜提取技术制备出了当归黄芪超滤物(Radix Angelica Sinensis and Radix Astragalus ultrafiltration extract, RAS-RA)。为了探讨RAS-RA对RIMF的保护作用及机制,我们利用X射线建立了RIMF大鼠模型,并在此基础上进行了实验研究。这些研究结果为甘肃道地药材的开发提供了理论依据,为进一步探讨中药治疗RIMF的机制奠定了基础。
1 材料与仪器 1.1 动物SPF级5周龄雄性Wistar大鼠50只,体质量为(200±20)g, 购自于斯贝福(北京)生物技术有限责任公司,动物生产许可证号:SCXK9(京)2019-0010, 在甘肃中医药大学实验动物中心SPF级实验室内饲养,实验动物使用许可证号:SYXK(甘)2021-0004。动物于相对湿度45%~55%、温度(22±1) ℃、12 h光暗循环的环境下,适应性饲养2周,自由进食饮水。动物实验经甘肃中医药大学科研实验中心伦理委员会批准(批准号:2022-520)。
1.2 药物RAS-RA为本课题组前期分离[8]所得,批号(国食健字:G20140331)。其中1 g RAS-RA相当于生药11.11 g, 每克原复方制剂中提取出0.09 g。
1.3 试剂GPx4抗体(批号GB124327-100, 武汉Servicebio公司); NOX1抗体(批号DF8684, AffinitY公司); FTH1抗体(批号DF6287, AffinitY公司); α-SMA(批号:100034, 美国Gene Tex公司); Collagen Ⅰ (批号270993, 美国Abcam公司); GAPDH抗体(批号100118, 美国Gene Tex公司); SOD、MDA、GSH试剂盒(批号A003-1、A003-1、A006-2-1, 南京建成生物工程研究所); 组织铁测试盒(批号20230218, 南京建成生物工程研究所); HE、Masson染色试剂盒(批号G1003、G1003, 武汉赛维尔生物科技有公司); OCT包埋剂、PBS缓冲液、DAPI染色试剂(批号G6059-110ML、G0002、G1012, 武汉Servicebio公司); ROS染液(批号D7008, 西格玛奥德里奇(上海)贸易有限公司)。
1.4 仪器VINNO6 LAB便携式数字化彩色超声诊断仪(苏州飞依诺科技有限公司); 透射电子显微镜(日本HITACHI公司), X射线辐照仪(美国Faxitron公司)。Eppendorf移液枪、酶标检测仪(美国USCN公司); 包埋机(浙江省金华市俊杰电子有限公司); 组织摊片机(浙江省金华市科迪仪器设备有限公司)。
2 方法 2.1 RAS-RA制备及质量控制RAS-RA根据金元名医李东垣创立的当归补血汤,课题组按原方比例将当归、黄芪以1 ∶5用量,水煎煮3次,过滤杂质,煎煮浓缩,送甘肃省膜科所采用陶瓷膜微滤,选用中空纤维超滤膜,其截留分子量为100 ku(技术参数为压力0.5 kPa/m3, 压力5~6 kg·m-3, 流量100 L/h·m2, 温度25 ℃), 将超滤液喷雾后干燥成粉状,存储于4 ℃冰箱备用。RAS-RA的活性成分由高压液相色谱分离分析。
2.2 RIMF大鼠模型的建立依据本实验课题组前期研究、预实验和相关文献,建立X射线诱导大鼠心肌纤维化的模型[9]。大鼠照射前1 d禁食水,辐照时,首先用10%的水合氯醛将其麻醉,每只大鼠用量0.3 mL/100 g麻醉,麻醉后大鼠取仰卧位,辐射区域严格限定在大鼠心脏的区域,用铅板挡住大鼠其余的表皮皮肤,48 cm的源表面距离(SSD)照射场进行X射线40 Gy单次局部辐照,辐照后常规饲养30 d后,主要根据心肌组织HE及Masson染色判断RIMF造模是否成功。
2.3 分组及给药SPF级6周龄Wiatar大鼠50只适应性饲养2周后,随机分为5组,每组10只:① 空白组(Control); ② 模型组(Model); ③ 当归黄芪超滤物低剂量组(RAS-RA-L); ④ 当归黄芪超滤物中剂量组(RAS-RA-M); ⑤ 当归黄芪超滤物高剂量组(RAS-RA-H)。除正常对照组不予辐射外,其余各组大鼠均经麻醉后接受40 Gy X射线单次局部胸部照射1次,建立放射性大鼠心肌纤维化。辐射后,当归黄芪超滤物各干预组(低、中、高剂量)大鼠以0.12、0.24、0.48 g·kg-1剂量配以无菌蒸馏水灌胃(剂量按照人与大鼠体表面积法), 空白组与模型组均接受等体积生理盐水灌胃处理。每日一次,连续灌胃30 d。在实验过程中,当归黄芪超滤物中剂量及高剂量组大鼠各死亡1只,模型组及当归黄芪超滤物低剂量组大鼠各死亡2只,死亡原因主要由于操作误伤引起。
2.4 小动物心脏彩超将大鼠水合氯醛麻醉后,采用超声探头进行观察,并测量左室射血分数(LVEF)、左室短轴缩短率(LVFS)的变化。
2.5 比色法检测心肌组织中MDA、GSH、Fe2+含量,SOD活性取大鼠左心室心肌组织,生理盐水冲洗数遍后,制备心肌组织匀浆,严格按试剂盒说明书操作,用比色法检测心肌组织中MDA、GSH、SOD、Fe2+活性。
2.6 大鼠心肌组织形态学观察左心室组织用4%多聚甲醛固定,包埋切片,经脱蜡、水化,进行HE染色、Masson染色,封片后并在显微镜下观察。
2.7 各组大鼠心肌组织超微结构观察取大鼠左心室心尖部组织后浸入电镜液中保存,进行固定、脱水、浸透等步骤,最后用透射电镜观察。
2.8 免疫荧光检测心肌组织中ROS表达取大鼠左心室心尖部肌组织,常规切片、脱蜡、水化、染色、DAPI复染细胞核、封片等步骤,最后置荧光显微镜观察。
2.9 蛋白免疫印迹法(Western blot)检测铁死亡及纤维化的蛋白表达心脏(左心室心尖部)总蛋白样品采用RIPA缓冲液提取,15 μg蛋白通过12% SDS-PAGE电泳分离,转移到聚偏氟乙烯(VDF)膜上。在封闭缓冲液(5%牛奶加TBST)中轻轻摇晃2 h。随后,将膜与一抗孵育过夜。然后,将膜与辣根过氧化物酶标记的二抗结合2 h。采用ECL Western blot试剂盒和增强化学发光系统检测蛋白条带。所有测得的蛋白水平均采用ImageJ软件进行灰度值分析。
2.10 统计学处理采用SPSS 26.0软件进行处理。数据用x±s表示,多组间比较用单因素方差分析,两组间比较用t检验。
3 结果 3.1 RAS-RA成分及质量控制高压液相色谱分离分析RAS-RA主要活性成分为当归阿魏酸、黄芪甲苷、黄芪多糖、当归多糖、芒柄花素。本研究所采用的RAS-RA指纹图谱,见Fig 1。
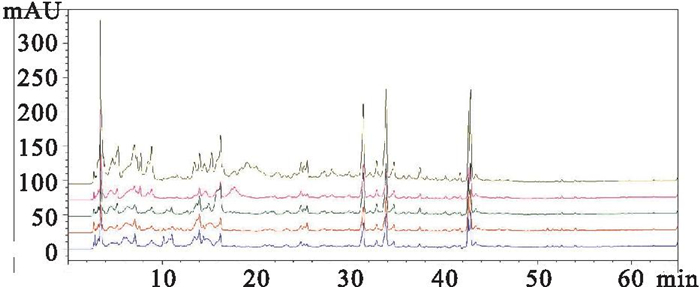
|
| Fig 1 RAS-RA fingerprint map |
空白组大鼠精神焕发,活动自如,食欲佳,饮水稳定,体重持续增长;然而,模型组大鼠则精神不振,毛发枯黄并出现脱毛现象,活动能力明显降低,食欲不振,体型明显消瘦;RAS-RA各干预组大鼠的上述症状均得到了一定程度的改善。
3.3 RAS-RA对各组大鼠心功能指标的影响与正常组比较,模型组大鼠LVEF、LVFS表达降低(P < 0.05)。与模型组比较,RAS-RA各干预组大鼠LVEF、LVFS表达升高(P < 0.05), 见Tab 1。
| Group | n | Cardiac function indicators | |
| LVEF(%)/mmHg | LVFS(%)/mmHg | ||
| Control | 10 | 80.46±3.46 | 47.52±2.21 |
| Model | 8 | 55.74±2.05* | 24.23±1.54* |
| RAS-RA-L | 8 | 64.25±2.83# | 33.56±1.76# |
| RAS-RA-M | 9 | 70.18±2.93# | 37.36±1.74# |
| RAS-RA-H | 9 | 75.28±3.62# | 43.22±2.33# |
| * P < 0.05 vs control; # P < 0.05 vs model. | |||
与正常组比较,模型组大鼠心肌组织MDA、Fe2+水平升高,SOD、GSH水平下降(P < 0.01);与模型组比较,RAS-RA干预组大鼠心肌组织MDA、Fe2+水平下降,SOD、GSH水平升高(P < 0.01), 见Fig 2。
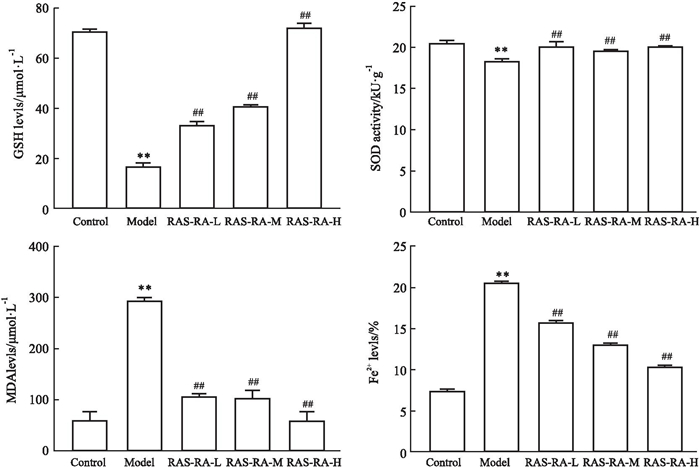
|
| Fig 2 Oxidative stress indicators and Fe2+ levels in heart tissue of each group (x±s) **P < 0.01 vs Control group; ##P < 0.01 vs Model group. |
空白组大鼠心肌组织中荧光信号不明显,ROS表达正常;辐射组大鼠心肌组织中荧光信号强,ROS红色荧光表达增强(P < 0.05);RAS-RA低、中、高剂量组大鼠心肌组织中ROS红色荧光表达减弱(P < 0.05), 见Fig 3和Tab 2。
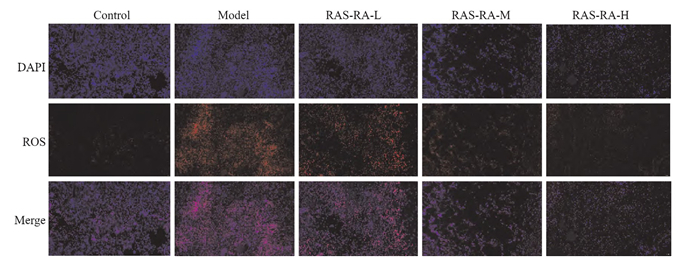
|
| Fig 3 Changes in ROS expression in myocardial tissue of rats in each group ( ×200) |
| Group | n | ROS fluorescence intensity |
| Control | 10 | 4.89±1.67 |
| Model | 8 | 27.46±1.20* |
| RAS-RA-L | 8 | 18.19±1.96# |
| RAS-RA-M | 9 | 11.32±2.11# |
| RAS-RA-H | 9 | 8.56±0.56# |
| * P < 0.05 vs control; # P < 0.05 vs model. | ||
正常组大鼠的心肌细胞排列整齐,肌纤维连接紧密,胞核清晰;辐射模型组大鼠心肌组织可见小面积肌细胞坏死溶解,核固缩,结缔组织增生,肌纤维断裂,排列较紊乱,有炎性胞侵润;RAS-RA干预组大鼠心肌细胞排列较整齐,肌纤维断裂较少,部分间隙稍有增宽,少量炎性细胞侵润,见Fig 4。
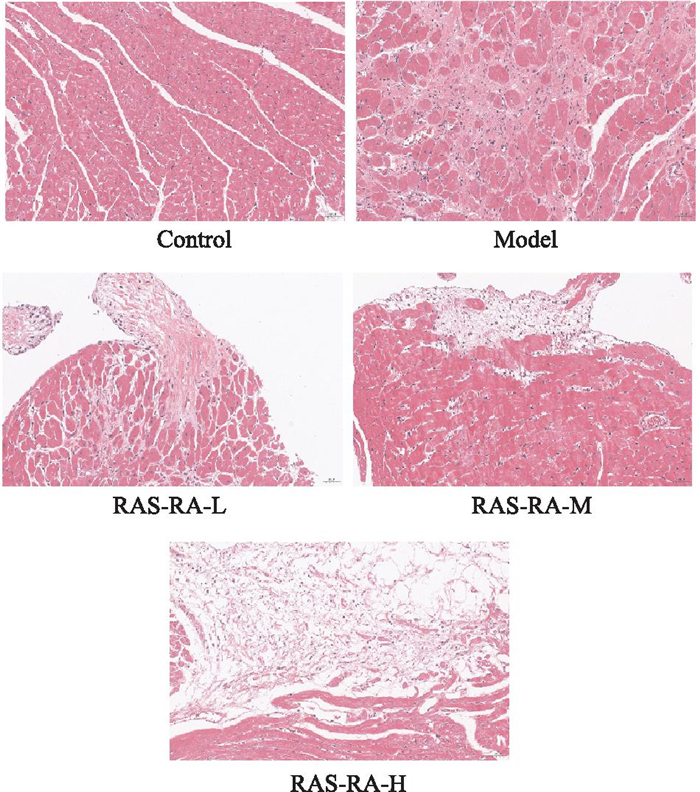
|
| Fig 4 Observation of myocardial tissue structure in each group of rats (HE staining, × 200) |
与正常组比较,模型组大鼠心肌组织中胶原纤维阳性面积增多,心肌纤维化程度加重(P < 0.05, 如蓝色部分所示); 与模型组比较,RAS-RA干预组大鼠心肌中胶原纤维阳性面积减少,心肌纤维化程度减轻(P < 0.05), 见Fig 5和Tab 3。
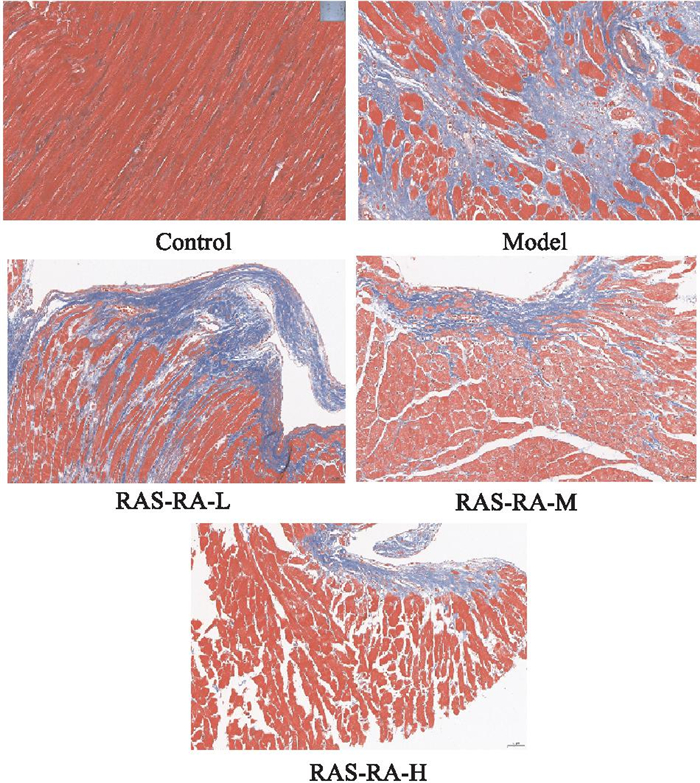
|
| Fig 5 Fibrosis of myocardial tissue in each group (Masson staining, ×200) |
| Group | n | Positive area of collagen fibers/% |
| Control | 10 | 4.94±0.44 |
| Model | 8 | 43.99±3.26* |
| RAS-RA-L | 8 | 25.53±0.93# |
| RAS-RA-M | 9 | 13.92±0.73# |
| RAS-RA-H | 9 | 9.26±0.38# |
| * P < 0.05 vs control; # P < 0.05 vs model. | ||
正常组心肌损伤程度相对偏低,肌丝完整,排列整齐紧密,线粒体排列整齐,形态正常,边界清晰,嵴明显;模型组肌丝排列疏松紊乱,断裂,受损线粒体增多、变小、排列紊乱,形态不规则,嵴紊乱,部分线粒体出现肿胀及空泡;RAS-RA干预组心肌肌丝排列较整齐,线粒体排列较整齐,形态较规则,个别线粒体轻微肿胀,嵴大多排列整齐,少量断裂,见Fig 6。
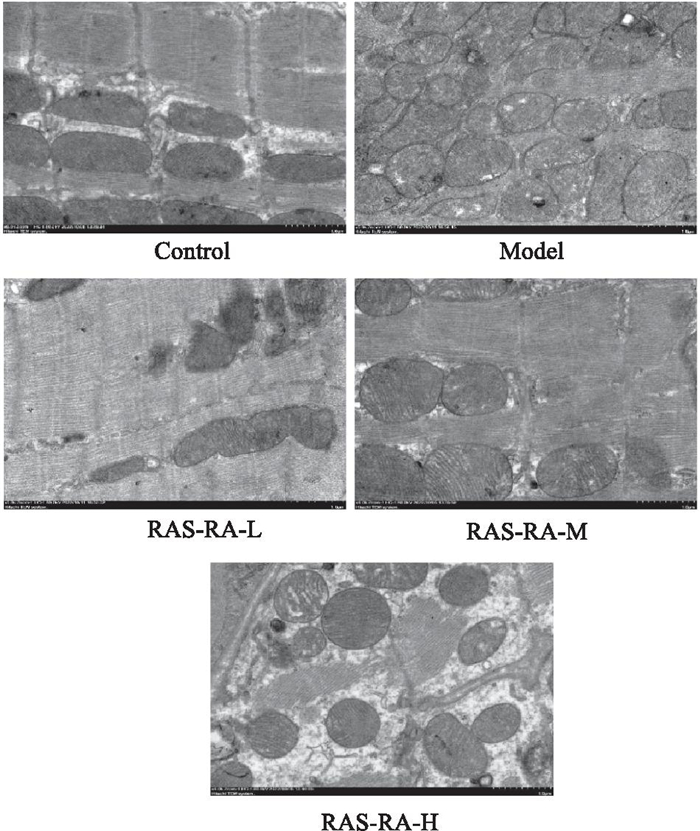
|
| Fig 6 Changes in myocardial ultrastructure of rats in each group (transmission electron microscopy, × 8 000) |
与空白组比较,模型组大鼠α-SMA、Collagen Ⅰ、NOX1蛋白表达升高,GPx4, FTH1蛋白表达降低(P < 0.05)。与模型组比较,RAS-RA中、高剂量组大鼠GPx4, FTH1蛋白表达升高,α-SMA、Collagen Ⅰ、NOX1蛋白表达降低(P < 0.05), 见Fig 7和Tab 4。
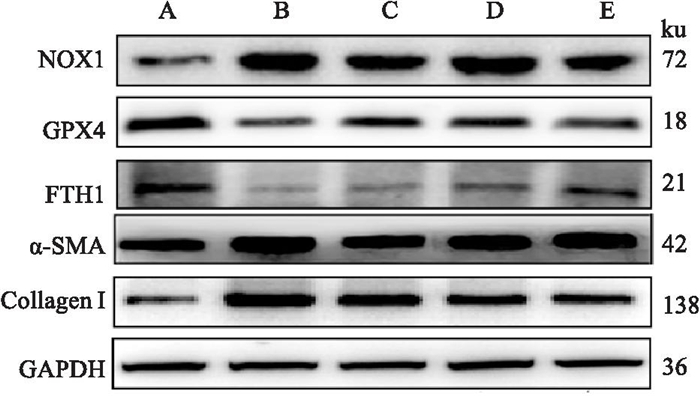
|
| Fig 7 Relative protein expression of each group of rats A: Control; B: Model; C: RAS-RA-L; D: RAS-RA-M; E: RAS-RA-H |
| Group | n | NOX1 | GPx4 | FTH1 | α-SMA | Collagen Ⅰ |
| Control | 10 | 0.36±0.04 | 1.01±0.12 | 0.92±0.10 | 0.52±0.05 | 0.45±0.13 |
| Model | 8 | 1.58±0.21* | 0.56±0.07* | 0.57±0.06* | 1.32±0.17* | 1.41±0.22* |
| RAS-RA-L | 8 | 1.31±0.17# | 0.69±0.09# | 0.62±0.07# | 0.96±0.06# | 0.94±0.12# |
| RAS-RA-M | 9 | 1.22±0.13# | 0.66±0.08# | 0.71±0.08# | 0.88±0.04# | 0.83±0.07# |
| RAS-RA-H | 9 | 0.91±0.11# | 0.87±0.07# | 0.78±0.07# | 0.84±0.05# | 0.71±0.06# |
| * P < 0.05 vs control; # P < 0.05 vs model. | ||||||
中医学认为X射线属于“火热毒邪”, 而RIMF属于火热毒邪损伤心气、心血的致病范畴,其基本病机以气血亏虚,血脉瘀阻为主,故治疗上以“补气生血、扶正祛瘀”为主,药选补益气血的当归和黄芪,二者联合应用可以对于治疗RIMF发挥出协同作用,增强治疗效果。据相关研究表明[10-11]: 当归多糖具有促进心肌细胞增殖、抑制细胞凋亡及抗放射性心肌损伤的作用。丁艳平等[12]研究发现,黄芪甲苷具有显著抗辐射性肺损伤的作用。刘兰婷等[13]研究报道,黄芪甲苷可能通过激活用短链酰基辅酶A脱氢酶(short-chain acyl-CoA dehydrogenase, SCAD), 从而抑AngII诱导的大鼠心肌成纤维细胞增殖和胶原表达。当前认为当归黄芪及其活性成分具有抗辐射损伤作用,但关于RAS-RA通过调控铁死亡机制来防治RIMF的研究尚未见相关的文献报道。因此,本研究旨在全面剖析RAS-RA对防治RIMF的效果,并对其相关的作用机理进行深入阐述。
近年来研究发现,铁死亡在心血管疾病中扮演着重要角色。铁死亡是由细胞内铁离子累积并催化产生ROS驱动的,产生大量脂质过氧化物,由谷胱甘肽(glutathione, GSH)过氧化物酶4(GPx4)控制的细胞内微环境氧化还原状态紊乱引起的一种调节细胞死亡。氧化应激是引起铁死亡的主要原因。脂类过氧化反应是细胞内重要的生物化学过程,其产物MDA不仅可以直观地反映机体内的脂类过氧化程度,还可间接地反映出自由基对心脏的损伤程度。SOD可帮助清除机体内过量的氧自由基,降低ROS积累对生物膜所造成的损害,对机体的氧化和抗氧化系统平衡、阻断脂质过氧化程度起着至关重要的作用。GSH在人体内发挥着重要的生理功能,其中包括清除自由基和促进铁质吸收,也是细胞内一种重要的抗氧化剂,是衡量机体抗氧化能力的重要物质,在铁死亡中均发挥着重要的作用。此外,GPx4是一种脂质修复酶,硒蛋白家庭的唯一成员,其可通过阻断ROS介导的脂质过氧化来抑制铁死亡,通常被用作铁超载的重要分子标记[14]。FTH1是一种新型的保护性分子,是一种独立的因子,与GPx4和GSH协同抑制磷脂过氧化反应和铁中毒[15]。NOX是细胞内非线粒体源ROS生成的主要酶体,也称为NADPH氧化酶。它是胞内过氧化物酶系统中的一种酶,介导ROS的产生。NOX1是促进活性氧生成的主要来源[16], ROS是机体氧化应激损伤过程中最主要的产物之一。而ROS的累积是铁死亡的标志之一,研究表明,铁死亡抑制剂可以减少细胞中ROS的累积并抑制铁死亡[17]。然而心肌纤维化发生发展与胶原纤维蛋白过度分泌和异常沉积是密不可分的。研究证实,心肌成纤维细胞快速增殖可导致细胞外基质胶原蛋白α-SMA、Collagen Ⅰ的沉积,胶原蛋白分泌异常[18], 最终导致心脏纤维化。本研究发现:与空白组相比较,模型组大鼠心脏组织透射电镜示线粒体数量稀疏、排列紊乱,受损线粒体较多,可见膜破裂、嵴断裂模糊不清,有明显的铁死亡形态学改变;细胞间质出现明显纤维组织增生伴炎症细胞浸润,心肌纤维化明显;免疫荧光检测ROS水平上升,比色法检测心肌组织中Fe2+、MDA水平上升、GSH、SOD水平下降;心肌组织中α-SMA、Collagen Ⅰ、NOX1蛋白表达升高,而GPx4、FTH1蛋白表达下降,可见放RIMF大鼠存在铁死亡及氧化应激损伤。与模型组比较,RAS-RA各治疗组大鼠心功能改善,脂质过氧化、抗氧化相关指标恢复;Fe2+含量降低;线粒体结构恢复;纤维化程度减轻;心肌组织中α-SMA、Collagen Ⅰ、NOX1蛋白表达下降,GPx4, FTH1蛋白表达上升。
综上所述,RIMF大鼠存在亚铁离子积累、脂质过氧化、ROS积累等铁死亡特征性改变和氧化应激损伤,RAS-RA具有显著的抗氧化作用,可能是通过抑制Fe2+, 抑制铁死亡,降低脂质过氧化产物MDA水平,减少ROS的积累,减轻氧化应激损伤,从而改善心功能,通过调控ROS/GSH/GPx4轴抑制心肌铁死亡减缓RIMF的发生发展。为了进一步验证结果,后续的研究计划通过细胞实验,使用铁死亡抑制剂、激动剂干预,观察相关指标情况,进一步深入探索并阐明RIMF的发病机制,为临床防治RIMF提供实验依据。
| [1] |
Gonzalez A, Schelbert E, Diez J, et al. Myocardial interstitial fibrosis in heart failure: biol- ogical and translational perspectives[J]. J Am Coll Cardiol, 2018, 71(15): 1696-6. doi:10.1016/j.jacc.2018.02.021 |
| [2] |
Qin W, Cao L, Massey I Y. Role of PI3K/Akt signaling pathway in cardiac fibrosis[J]. Mol Cell Biochem, 2021, 476(11): 4045-59. doi:10.1007/s11010-021-04219-w |
| [3] |
Roth G, Mensah G, Fuster V. The global burden of cardiovascular diseases and risks: A compass for global action[J]. J Am Coll Cardiol, 2020, 76(25): 2980-91. doi:10.1016/j.jacc.2020.11.021 |
| [4] |
Song Y, Wang B, Zhu X, et al. Human umbilical cord blood-derived MSCs exosome attenuate myocardial injury by inhibiting ferroptosis in acute myocardial infarction mice[J]. Cell Biol Toxicol, 2021, 37(1): 51-64. doi:10.1007/s10565-020-09530-8 |
| [5] |
Shan X, Lv Z Y, Yin M J, et al. The protective effect of cyanidin-3-glucoside on myocardial ischemia-reperfusion injury through ferroptosis[J]. Oxid Med Cell Longev, 2021, 6: 8880141. |
| [6] |
Guan X, Wang Y, Li W, et al. The effects and mechanism of LncRNA NORAD on doxorubic in-induced cardiotoxicity[J]. Toxicology, 2023, 494: 153587. doi:10.1016/j.tox.2023.153587 |
| [7] |
Liang Y, Xia L, Lu S, et al. A new mechanism of therapeutic effect of stachydrine on heart failure by inhibiting myocardial ferroptosis[J]. Eur J Pharmacol, 2023, 954: 175881. doi:10.1016/j.ejphar.2023.175881 |
| [8] |
李应东, 刘野. 当归黄芪超滤膜提取物含药血清对辐射心肌成纤维细胞增殖和胶原的影响[J]. 江苏中医药, 2010, 42(3): 70-1. Li Y D, Liu Y. The effect of serum containing Radix Angelica Sinensis and Radix Astragalus ultrafiltration membrane extract on the proliferation and collagen of irradiated myocardial fibroblasts[J]. Jiangsu J Tradit Chin Med, 2010, 42(3): 70-1. |
| [9] |
Ma C, Zhao X, Chang J, et al. Radix Angelica Sinensis and Radix Hedysari ultrafiltration extract protects against x-irradiation-induced cardiac fibrosis in Rats[J]. Evid Based Complement Alternat Med, 2020, 21: 4675851. |
| [10] |
杨萍, 代天, 张苏川. 当归多糖促进大鼠心肌细胞系H9c2增殖[J]. 基础医学与临床, 2021, 41(4): 551-7. Yang P, Dai T, Zhang S C. Angelica polysaccharide promotes the proliferation of rat cardio- myocyte line H9c2[J]. Basic Clin Med, 2021, 41(4): 551-7. |
| [11] |
蒋虎刚, 冯明霞, 刘凯, 等. 基于Rho/Rock通路当归红芪多糖对H9C2细胞放射性心肌损伤的影响[J]. 中国中医药信息杂志, 2019, 26(5): 54-8. Jiang H G, Feng M X, Liu K, et al. Effects of polysaccharide from Angelicae Sinensis Radix and Hedysari Radix on radiation injury of H9C2 cells based on Rho/Rock pathway[J]. Chin J Inf Tradit Chin Med, 2019, 26(5): 54-8. |
| [12] |
丁艳平, 田雨馨, 张晋平. 黄芪甲苷对辐射诱导损伤小鼠肺脏组织结构及Caspase-3, T NF-α表达的影响[J]. 西北师范大学学报(自然科学版), 2020, 56(6): 83-94. Ding Y P, Tian Y X, Zhang J P. Effect of Astragaloside Ⅳ on Caspase-3 and TNF-α in mice lung injured by radiation[J]. J Northwe Norm Univer(Nat Sci), 2020, 56(6): 83-94. |
| [13] |
刘兰婷, 徐庆萍, 彭欢, 等. 黄芪甲苷通过激活短链酰基辅酶A脱氢酶抑制Ang Ⅱ诱导的大鼠心肌成纤维细胞增殖和胶原表达[J]. 中国药理学通报, 2023, 39(8): 1450-6. Liu L T, Xu Q P, Peng H, et al. Astragaloside Ⅳ inhibits Ang Ⅱ-induced cell proliferation and collagen expression in cardiac fibroblasts by activating short-chain acyl-CoA dehydro-genase[J]. Chin Pharmacol Bull, 2023, 39(8): 1450-6. doi:10.12360/CPB202211058 |
| [14] |
Liu Y, Wan Y, Jiang Y, et al. GPx4: The hub of lipid oxidation, ferroptosis, disease and trea-tment[J]. Biochim Biophys Acta Rev Cancer, 2023, 1878(3): 188890. |
| [15] |
Kong N, Chen X, Feng J, et al. Baicalin induces ferroptosis in bladder cancer cells by down- regulating FTH1[J]. Acta Pharm Sin B, 2021, 11(12): 4045-54. |
| [16] |
Hsu N Y, Nayar S, Gettler K, et al. NOX1 is essential for TNFα-induced intestinal epithelial ROS secretion and inhibits M cell signatures[J]. Gut, 2023, 72(4): 654-62. doi:10.1136/gutjnl-2021-326305 |
| [17] |
Badgley M A, Kremer D M, Maurer H C, et al. Cysteine depletion induces pancreatic tumor ferroptosis in mice[J]. Science, 2020, 368(6486): 85-9. doi:10.1126/science.aaw9872 |
| [18] |
Li X, Mo N, Ii Z. Ginsenosides: potential therapeutic source for fibrosis-associated human diseases[J]. J Ginseng Res, 2020, 44(3): 386-98. |