

2. 承德医学院基础医学院解剖学教研室, 河北 承德 067000;
3. 河北北方学院医学检验学院免疫学教研室, 河北 张家口 075000
高亚贤(1984-), 女, 博士, 副教授, 硕士生导师, 研究方向: 中药免疫, 通信作者, E-mail: yaxiangao@163.com
2. Dept of Anatomy, Basic Medical Institute, Chengde Medical College, Chengde Hebei 067000, China;
3. Heibei North University, Zhangjiakou Hebei 075000, China
类风湿性关节炎(rheumatoid arthritis, RA)是一种难治性慢性的全身性自身免疫性疾病,其病理改变为多发和对称性的滑膜异常增生、关节软骨与骨破坏,常侵犯全身小关节[1-2], 从而引发关节畸形和功能的丧失。目前普遍认为遗传因素、环境及免疫失调与之相关[3]。
自噬是将细胞质中的物质运送到溶酶体进行降解,在细胞、组织和有机体的稳态中起着重要作用[4], 有相关研究表明自噬与风湿性疾病的病理改变存在密切联系,例如橘皮素和5-羟基6, 7, 8, 3′, 4′-五甲基甲黄酮被证明通过AKT/mTOR信号传导抑制自噬,从而抑制大鼠与牛Ⅱ型胶原诱导的关节炎相关的病理变化[5]。相比于临床上治疗类风湿药物的非甾体抗炎药(NSAIDs)[1]、糖皮质激素(GC)等,中药具有多靶点、毒副作用小等特点。同时随着网络药理学兴起,越来越多的中医药从经验医学向循证医学体系转化[6]。课题组前期经大量实验研究证实中药穿山龙治疗RA效果肯定[7-10], 并且不良反应少,因此本实验通过建立CIA小鼠模型,探讨穿山龙主要药效成分穿山龙薯蓣皂苷[2]是否通过自噬治疗CIA小鼠。
1 材料与方法 1.1 实验材料 1.1.1 实验动物SPF级DBA1小鼠:雄性,鼠龄6~7周。购自北京维通利华实验动物技术有限公司[许可证号:LAC2021034]
1.1.2 实验药物穿山龙薯蓣皂苷来自中国南京秋实生物科技有限公司,称取1 g羧甲基纤维素钠加入100 mL超纯水中,充分溶解,配成1 %的羧甲基纤维素钠溶剂。称取1.2 g穿山龙薯蓣皂苷加入30 mL溶剂中充分混匀制成40 g·L-1的母液。按母液∶溶剂为1 ∶1比例稀释得到20 g·L-1的中剂量组混悬液,按母液∶溶剂为1 ∶3比例稀释得到10 g·L-1的低剂量组混悬液。
阳性对照药物:雷公藤甲素来自华润三九(黄石)药业有限公司,根据说明书人的雷公藤甲素每日剂量为72 μg, 按照人与鼠体表面积比值计算的小鼠的每日剂量为12 μg·kg-1, 体质量约为20 g的小鼠,每次灌胃100 μL计算的浓度为2.4 mg·L-1, 每片雷公藤片含雷公藤甲素12 μg。将4片雷公藤片研磨成粉末,加入20 mL羧甲基纤维素钠溶剂中,充分混匀制成混悬液。
1.1.3 主要试剂鸡Ⅱ型胶原(美国Chondrex公司)弗氏完全佐剂(美国Sigma公司)BCA蛋白浓度测定试剂盒(美国Thermo公司), 反转录试剂盒、扩增试剂盒(中国SparkJade公司), LC3A/B、Beclin-1(美国Cell Signaling Technology), p62(英国Abcam)。
1.2 实验方法 1.2.1 造模与分组CIA模型建立:适应性饲养DBA1小鼠1周,温度(24 ± 2)℃, 湿度(50 ± 10)%, 将鸡II型胶原与弗氏完全佐剂等体积混合于无菌的EP管中,用玻璃注射器反复抽吸至乳化完全,以滴入水中不分散形成边缘规则的圆点为乳化成功标准。初次免疫:尾根部皮内注射100 μL完全弗氏佐剂与鸡Ⅱ型胶原1 ∶1混合乳剂免疫,其中10只尾根部皮内注射100 μL生理盐水作为对照组,第21天依照上述方法和剂量加强免疫[11]。加强免疫后将胶原免疫的50只小鼠随机分组为CIA模型组、雷公藤组和穿山龙薯蓣皂苷低、中、高剂量组,每组10只。从加强免疫后1 d开始连续灌胃14 d, 雷公藤组灌胃给予雷公藤片混悬液100 μL(按雷公藤甲素计每天12 μg·kg-1), 穿山龙薯蓣皂苷低、中、高剂量组灌胃分别给予每天50、100、200 mg·kg-1穿山龙薯蓣皂苷混悬液100 μL, 对照组和CIA模型组给予等体积溶剂。
1.2.2 CIA小鼠造模后一般情况及关节炎指数(arthritis index, AI)测定在初次免疫21 d对CIA小鼠进行二次免疫后,对小鼠的精神状态、饮食状况、毛发光亮程度进行观察,并且每隔3 d对小鼠进行体质量、足爪厚度、及AI值测量记录。用AI值作为衡量足爪肿胀情况的标准。AI评分如下[12]: 0级:无明显肿胀(0分); I级:趾关节有轻微红肿(1分); Ⅱ级:红肿蔓延足趾关节以下(2分); Ⅲ级:红肿蔓延踝关节以下(3分); Ⅳ级:全足爪肿胀(含踝关节,4分), AI值即四肢骨节肿胀分数合计(0~16)。AI指数值与关节症状严重度呈正比关系。AI评分大于4分即表明小鼠CIA模型已成功创建。
1.2.3 取材小鼠加强免疫后15 d处理小鼠,处死小鼠后自膝关节以下取小鼠足爪去除皮肤和肌肉组织,放入提前配好的4%多聚甲醛溶液,另取小鼠的脾脏,淋巴结放入液氮中保存。
1.2.4 苏木精-伊红(HE)染色在对小鼠膝关节和足爪进行固定和脱钙后,将组织进行脱水、透明、浸蜡、包埋处理,随后对包埋好的组织进行切片,60 ℃烘箱烤片2 h, 将切片进行二甲苯透明和常规乙醇梯度脱水后进行HE染色,再进行乙醇梯度脱水和二甲苯透明,中性树胶封片后显微镜下观察,采集图像进行分析。
1.2.5 qPCR检测Beclin-1、p62、LC3的RNA表达按不同分组分别取小鼠脾和淋巴结进行研磨的检测RNA纯度和浓度(OD260/280介于1.8~2.0), 逆转录为cDNA置-20 ℃冰箱内,封存备用。qPCR引物如下:Beclin-1-F: 5′-CTTTTCTGGACTGTGTGCAGC-3′; Beclin-1-R: 5′-TGGTGAAGACGCCAGTGGA-3′; p62-F: 5′-CGTGGGGTCCCTCAGATTG-3′; p62-R: 5′-TCAGCTTCTTGGACCATGCG-3′; LC3-F: 5′-CCAAGTTCCTGGTGCCTGAC-3′; LC3-R: 5′-CTTCGGAGATGGGAGTGGAC-3′; GAPDH-F: 5′-GCACCGTCAAGGCTGAGAAC-3′; GAPDH-R: 5′-TGTAGACCATGTAGTTGAGGTCA-3′。使用2×SYBR Green qPCR Mix试剂盒,采用PCR循环(两步法), 94 ℃预变性2 min, 94 ℃变性5 s, 退火60 ℃30 s, 循环40次。所测数据运用2-ΔΔCT方法测量mRNA的相对表达量,ΔΔCT=(实验组目的基因ΔΔCT均值-实验组内参基因ΔΔCT均值)-(对照组目的基因ΔΔCT均值-对照组内参照基因ΔΔCT均值)。2-ΔΔCT表示不同组织中靶基因的相应表达水平。
1.2.6 Western blot法检测小鼠脾.淋巴结组织Beclin-1、p62、LC3-Ⅱ/LC3-Ⅰ蛋白相对表达量将100 mg左右脾、淋巴结组织放入2 mL离心管中,每个离心管放入3粒3 mm大小的钢珠,再加入含PMSF的裂解液,随后放入匀浆仪中进行充分匀浆,裂解至无明显组织碎片后,4 ℃静置30 min, 在4 ℃下12 000 r·min-1离心15 min, 取上清液即脾、淋巴结组织总蛋白,BCA法测定和调整浓度后,在100 ℃, 5 min条件下进行蛋白变性。取20 μL样本上样,经10% SDS-PAGE凝胶电泳(80~120 V)、转膜(200 mA)、室温下5%脱脂奶粉封闭2 h, TBST洗膜3次,随后将膜在稀释后的一抗(1 ∶1 000)中4 ℃孵育过夜。TBST洗5次,每次5 min。二抗(1 ∶10 000)中室温孵育1 h, TBST洗3次,每次5 min。配制适量ECL显色液均匀滴加在PVDF膜上,放入超敏全自动成像分析仪器中曝光成像,最后将胶片进行扫描并保存。通过ImageJ软件读取分析条带灰度值,计算每个样本中目标蛋白的相对表达量。
1.3 统计学方法所有的数据采用SPSS 25.0软件和GraphPad Prism 8.0软件进行统计学分析及作图。实验数据用(x±s)表示。若统计数据符合正态分布、方差齐,不同组间结果比较用One-way ANOVA分析,两两比较采用独立样本t检验。若统计数据不符合正态分布则采用非参数检验。当P < 0.05时认为差异有统计学意义。
2 结果 2.1 小鼠足爪AI评分对照组中小鼠足爪无红肿表现,因此AI在本实验中为0;CIA模型组的AI指数对比对照组和穿山龙薯蓣皂苷高剂量组差异具有统计学意义,见Fig 1。
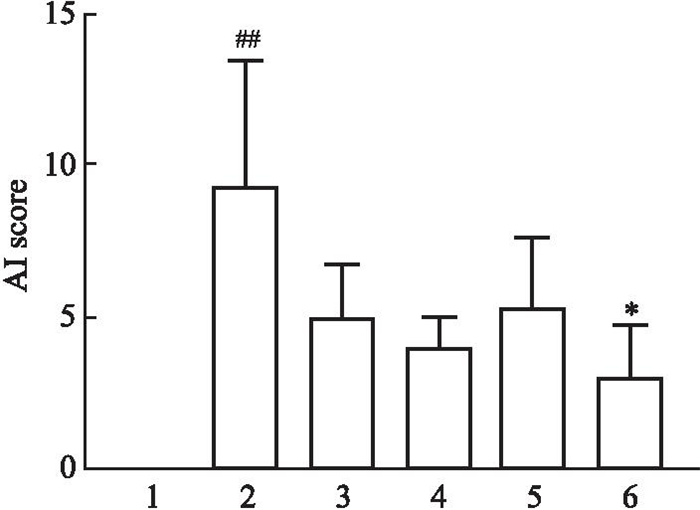
|
| Fig 1 Mouse paw AI score (x±s, n=4) 1: Control; 2: CIA control; 3: Triptolide; 4: DDN-low; 5: DDN-medium; 6: DDN-high.##P < 0.01 vs Control group; *P < 0.05 vs CIA model group. |
与对照组相比,CIA模型组小鼠足爪厚度增加;与CIA模型组相比,雷公藤组及穿山龙薯蓣皂苷组足爪厚度降低,见Fig 2, 3。
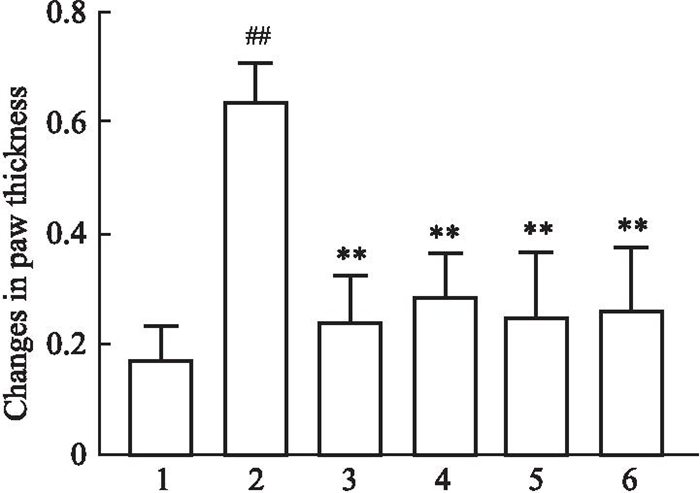
|
| Fig 2 Comparison of mouse paw thickness differences (x±s) 1: Control(n=6); 2: CIA control(n=4); 3: Triptolide(n=7); 4: DDN-low(n=8); 5: DDN-medium(n=9); 6: DDN-high(n=10). ##P < 0. 01 vs Control group; **P < 0.01 vs CIA model group. |
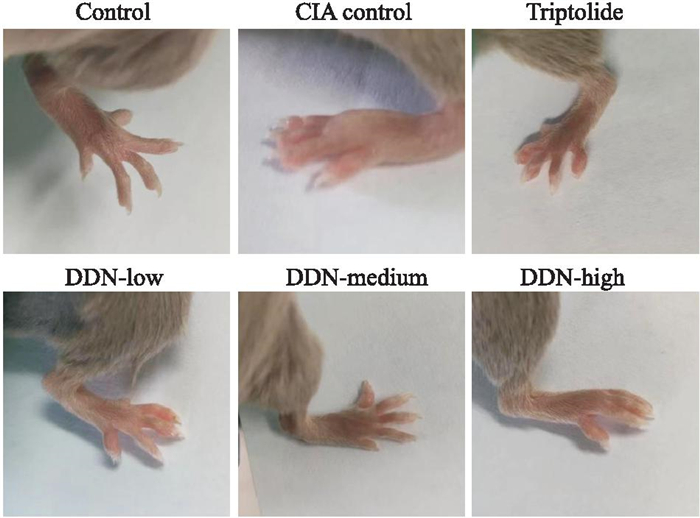
|
| Fig 3 Comparison of swelling degree of mouse paws |
与对照组相比,其余各组体质量均下降,CIA模型组体质量下降明显;雷公藤组及穿山龙薯蓣皂苷低、高剂量组体质量明显回升,见Fig 4。
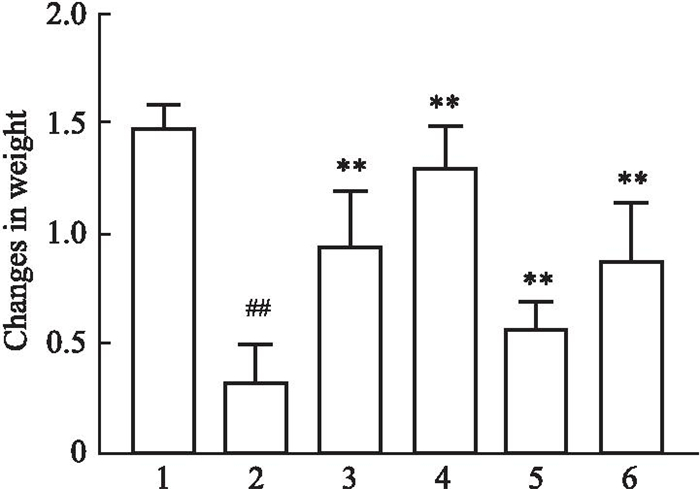
|
| Fig 4 Mouse weight comparison (x±s) 1: Control(n=4); 2: CIA control(n=9); 3: Triptolide(n=9); 4: DDN-low(n=5); 5: DDN-medium(n=10); 6: DDN-high(n=7). ##P < 0. 01 vs Control group; **P < 0. 01 vs CIA model group. |
与对照组相比,CIA模型组关节间隙变窄且有大量炎性细胞浸润,骨组织明显被破坏。与CIA模型组相比,雷公藤组及穿山龙薯蓣皂苷低、中、高剂量组有不同程度缓解,并且穿山龙薯蓣皂苷的中、高剂量组对骨质破坏和细胞浸润情况治疗作用较为明显,见Fig 5。
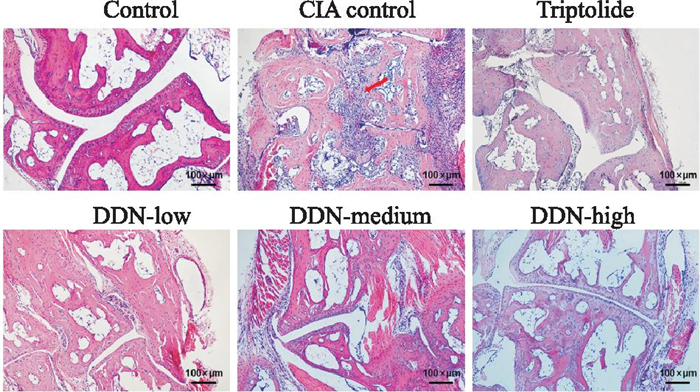
|
| Fig 5 Histopathological effects of mouse ankle joint (×200) |
与对照组相比,CIA模型组出现滑膜组织增生并且有大量炎性细胞浸润。与CIA模型组相比,穿山龙薯蓣皂苷低、中、高剂量组和雷公藤组减轻了炎性细胞浸润情况,且两组间对比无明显差异,见Fig 6。
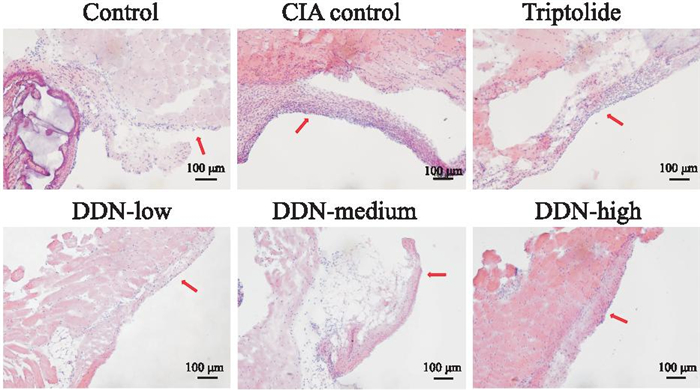
|
| Fig 6 Histopathological effects of mouse knee joint synovium (×200) |
与对照组相比,CIA模型组小鼠脾、淋巴结组织的LC3, Beclin-1的mRNA表达升高,p62的mRNA表达下降;与CIA模型组比较雷公藤组和穿山龙薯蓣皂苷低、中、高剂量组中LC3, Beclin-1的mRNA表达有不同程度下降,p62的mRNA表达水平有不同程度升高,见Fig 7, 8。
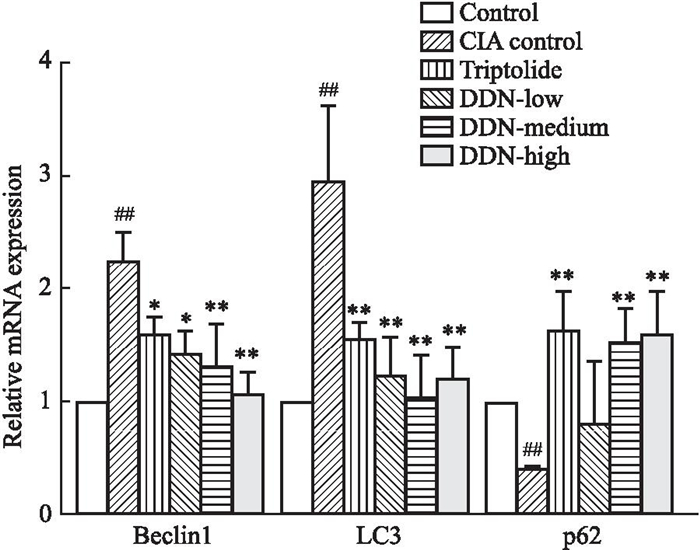
|
| Fig 7 Expression of Beclin-1, p62, and LC3 mRNA levels in mouse spleen tissue (x±s, n=3) ##P < 0. 01 vs control group; *P < 0. 05, **P < 0. 01 vs CIA model group. |
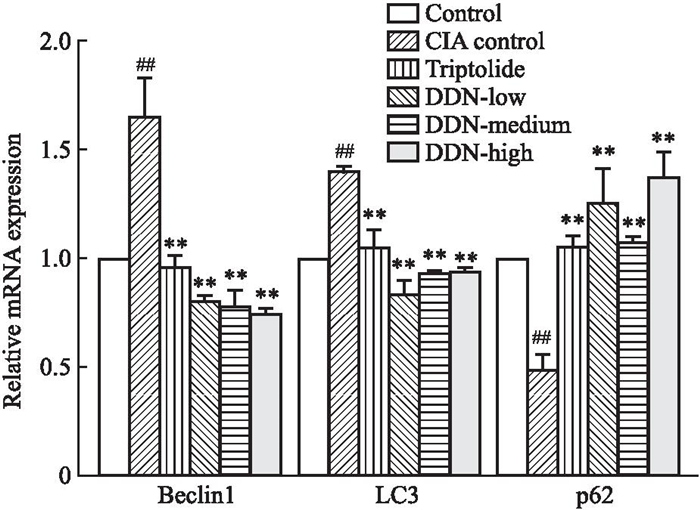
|
| Fig 8 Expression of Beclin-1, p62, and LC3 mRNA levels in mouse lymph node tissue (x±s, n=3) ##P < 0. 01 vs control group; **P < 0. 01 vs CIA model group. |
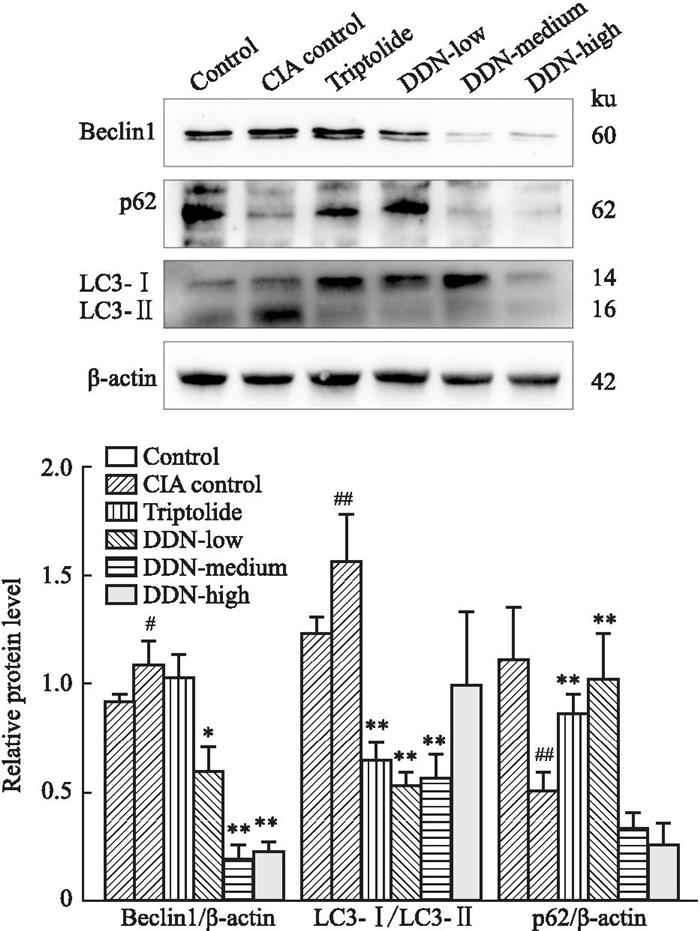
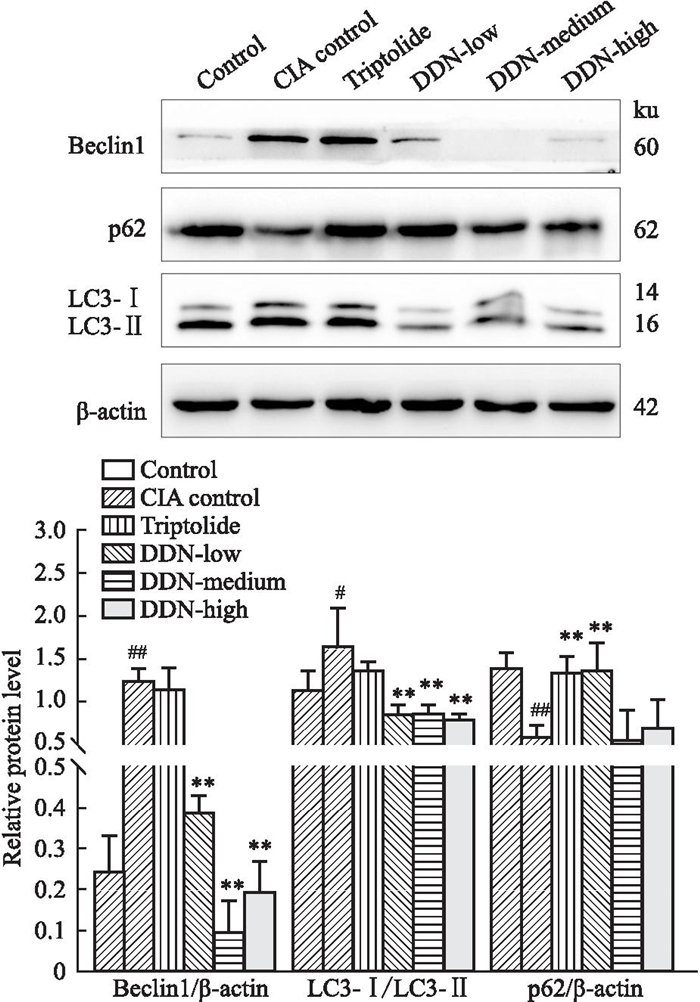
与对照组相比,CIA模型组小鼠脾、淋巴结组织中LC3-Ⅱ/LC3-Ⅰ, Beclin-1蛋白表达显著升高,p62蛋白表达下降;与CIA模型组比较雷公藤组和穿山龙薯蓣皂苷低、中、高剂量组中LC3-Ⅱ/LC3-Ⅰ, Beclin-1蛋白表达均有不同程度下降,p62蛋白表达水平有不同程度升高,Fig 9, 10。
|
| Fig 9 Expression of Beclin-1, p62, and LC3-Ⅱ/LC3-Ⅰ protein levels in mouse spleen tissue (x±s, n=3) ##P < 0.01 vs Control group; *P < 0.05, **P < 0. 01 vs CIA model group. |
|
| Fig 10 Expression of Beclin-1, p62, and LC3-Ⅱ/LC3-Ⅰ protein levels in mouse lymph node tissue (x±s, n=3) ##P < 0. 01 vs Control group; *P < 0. 05, **P < 0. 01 vs CIA model group. |
类风湿性关节炎是一种常见的系统炎症性自身免疫性疾病,严重损害患者身体功能和降低生活质量[13]。而胶原诱导性CIA小鼠作为常用的动物模型[14]主要病理表现为增生性滑膜炎、关节软骨破坏、骨侵蚀以及关节腔内炎性细胞浸润,其病理表现与人类类风湿关节炎相似[15], 并且课题组前期对小鼠CIA动物模型建立过程中的小鼠一般情况、足爪肿胀度、足爪AI值及关节组织病理学进行过动态观察[9-10], 因此被选作为本试验中的模型。本研究中DBA1小鼠首先采用鸡Ⅱ型胶原乳剂初次免疫,第21天再次给予相同剂量加强免疫一次。经观察,初次免疫至加强免疫之前小鼠的一般状态良好与正常组之间无明显区别,关节无明显变化,加强免疫后2~3 d, 小鼠的进食减少,体质量开始减轻,小鼠的背部及尾根部形成多处小溃疡,被毛无光泽,随后有小鼠溃疡愈合,形成皮下结节。加强免疫第7 d, CIA小鼠精神状态差,运动迟缓,体质量增长缓慢,95%小鼠后足出现充血红肿,皮温升高,足垫增厚,逐渐累及后膝关节及前肢,加强免疫第14 d足及膝关节肿胀达高峰,严重的关节不能负重,体质量下降明显。基于前期大量实验基础,在本实验研究中,DBA1小鼠在第21 d再次给予相同剂量刺激加强免疫后,开始给予穿山龙薯蓣皂苷药物治疗干预治疗,通过对小鼠一般状况、体质量、足爪厚度、及AI值等测量记录,与对照组相比,模型组及各治疗组出现不同程度的足趾肿胀,足关节、膝关节滑膜HE染色显示炎症细胞浸润等,表明模型建立成功,且穿山龙薯蓣皂苷治疗组能够不同程度的缓解足爪肿胀及炎症浸润。
自噬是真核细胞中一种常见的正常生理降解机制,有关于自噬的研究表明其对细胞的生存具有两面性,一方面发挥降解蛋白质或细胞器的功能,从而维持代谢平衡起到促进细胞存活的功能[16]; 另一方面,过度的自噬会导致细胞功能的受损,引起自噬性死亡[17]。目前研究表明,自噬水平与RA的病程进展以及病理表现密切相关,RA的细胞炎症水平与相关自噬分子呈正相关。研究有关自噬的重要标志物有LC3、Beclin-1、p62[18-19]。LC3是研究最充分的自噬分子之一,该蛋白具有4个亚型(LC3A、LC3B、LC3B2和LC3C); 通过被蛋白内切酶活性的ATG4剪切后的LC3, 生成的LC3-Ⅰ与ATG3和ATG7发生泛素化反应,继而生成了持续附着在自噬体膜上的LC3-Ⅱ, 并且LC3-Ⅱ/LC3-Ⅰ的表达与自噬水平呈正相关[20]。Beclin-1是最早发现和自噬相关的标志蛋白,是募集自噬效应分子的关键调控节点,也是干预修饰自噬通量的可能点[21], 其表达的水平可以反应自噬的活性[22]。p62/SQSTM1是一种自噬接头蛋白,可以运输泛素化物质[23], 通过和泛素结合结构域结合促进了泛素化集合体的合成与降解。由于p62在自噬过程中不断降解,因此其表达水平与自噬呈负相关[24]。
在此,为了探讨穿山龙薯蓣皂苷能否通过调控自噬的相关分子的表达从而减轻胶原诱导性关节炎小鼠的症状,从而起到治疗和预防的作用。本实验选择检测LC3-Ⅱ/LC3-Ⅰ、Beclin-1、p62这三个与自噬相关的重要标志物的表达来反应自噬水平的高低。实验结果显示,与正常组相比,CIA模型组的小鼠体质量下降,足爪厚度肿胀明显增加,膝关节滑膜和足爪踝关节HE染色显示有大量炎症细胞增生。CIA模型组与正常组相比,脾和淋巴结组织中的LC3-Ⅱ/LC3-Ⅰ、Beclin-1的mRNA和蛋白水平明显升高,p62的mRNA和蛋白水平降低,表明类风湿性关节炎的发生发展与自噬水平的升高相关联。CIA小鼠经过阳性药物(雷公藤)和高、中、低剂量的穿山龙薯蓣皂苷治疗后,与CIA模型组相比,小鼠的一般情况得到改善,体质量回升明显,足爪肿胀程度明显缓解,脾和淋巴结中的LC3-Ⅱ/LC3-Ⅰ、Beclin-1的mRNA和蛋白水平降低,p62的mRNA和蛋白水平升高,表明CIA小鼠通过穿山龙薯蓣皂苷的治疗能够降低自噬的水平。
本研究基于自噬探讨穿山龙薯蓣皂苷对CIA小鼠的治疗作用,实验发现CIA小鼠的滑膜组织的炎性浸润和增生可能与自噬水平升高有密切关系,并且穿山龙薯蓣皂苷可以通过抑制自噬,使自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ、Beclin-1的表达下调和p62水平上调,减轻CIA小鼠关节炎症和滑膜增生的情况,使其RA症状得到改善。本实验为寻找新的治疗靶点,丰富中药治疗RA提供了重要的理论与实际意义。但本次研究没有涉及自噬相关机制研究,今后将进一步探讨穿山龙薯蓣皂苷通过抑制自噬治疗RA的作用机制。
| [1] |
Cush J J. Rheumatoid arthritis: Early diagnosis and treatment[J]. Rheum Dis Clin North Am, 2022, 48(2): 537-47. doi:10.1016/j.rdc.2022.02.010 |
| [2] |
Jang S, Kwon E J, Lee J J. Rheumatoid arthritis: Pathogenic roles of diverse immune cells[J]. Int J Mol Sci, 2022, 23(2): 905. doi:10.3390/ijms23020905 |
| [3] |
Scherer H U, Häupl T, Burmester G R. The etiology of rheumatoid arthritis[J]. J Autoimmun, 2020, 110: 102400. doi:10.1016/j.jaut.2019.102400 |
| [4] |
Levine B, Kroemer G. Biological functions of autophagy genes: a disease perspective[J]. Cell, 2019, 176(1-2): 11-42. doi:10.1016/j.cell.2018.09.048 |
| [5] |
Yang G, Xia X, Zhong H, et al. Protective effect of Tangeretin and 5-Hydroxy-6, 7, 8, 3', 4'-Pentamethoxyflavone on Collagen-induced arthritis by inhibiting autophagy via activation of the ROS-AKT/mTOR signaling pathway[J]. J Agric Food Chem, 2021, 69(1): 259-66. doi:10.1021/acs.jafc.0c06801 |
| [6] |
唐加龙, 周莉, 孙祖越, 等. 网络药理学在中医药治疗自身免疫性疾病中的应用[J]. 中国药理学通报, 2021, 37(3): 323-7. Tang J L, Zou L, Sun Z Y, et al. Application of network pharmacology in treatment of autoimmune diseases with traditional Chinese medicine[J]. Chin Pharmacol Bull, 2021, 37(3): 323-7. |
| [7] |
Guo Y, Xing E, Song H, et al. Therapeutic effect of dioscin on collagen-induced arthritis through reduction of Th1/Th2[J]. Int Immunopharmacol, 2016, 39: 79-83. doi:10.1016/j.intimp.2016.06.029 |
| [8] |
郭亚春, 封桂英, 宋鸿儒, 等. CIA小鼠血清中IL-27、IL-10、IL-17的动态分析[J]. 中国免疫学杂志, 2015, 31(6): 803-5, 821. Guo Y C, Feng G Y, Song H R, et al. Dynamic changes of IL-27, IL-10, IL-17 in serum of collagen-induced arthritis in mice[J]. Chin J Immunol, 2015, 31(6): 803-5, 821. doi:10.3969/j.issn.1000-484X.2015.06.018 |
| [9] |
Gao Y, Wang Y, Song H, et al. Effect of diosgenin on T-helper 17 cells in mice with collagen-induced arthritis[J]. Pharmacogn Mag, 2020, 16(71): 486-92. doi:10.4103/pm.pm_426_19 |
| [10] |
Xing E, Guo Y, Feng G, et al. Effects of dioscin on T helper 17 and regulatory T-cell subsets in chicken collagen type II-induced arthritis mice[J]. J Chin Med Assoc, 2019, 82(3): 202-8. doi:10.1097/JCMA.0000000000000029 |
| [11] |
Wu J, Feng Z, Chen L, et al. TNF antagonist sensitizes synovial fibroblasts to ferroptotic cell death in collagen-induced arthritis mouse models[J]. Nat Commun, 2022, 13(1): 676. doi:10.1038/s41467-021-27948-4 |
| [12] |
Lu Q J, Li J Y, Lin H X, et al. Danggui Niantong granules ameliorate rheumatoid arthritis by regulating intestinal flora and promoting mitochondrial apoptosis[J]. Pharm Biol, 2022, 60(1): 1606-15. doi:10.1080/13880209.2022.2107018 |
| [13] |
Sparks J A. Rheumatoid arthritis[J]. Ann Intern Med, 2019, 170(1): ITC1-16. doi:10.7326/AITC201901010 |
| [14] |
李利青, 张逢, 彭馥芝, 等. 类风湿关节炎实验性动物模型研究进展[J]. 中国药理学通报, 2021, 37(11): 1492-7. Li L Q, Zhang F, Peng F Z, et al. Advances on experimental models of rheumatoid arthritis[J]. Chin Pharmacol Bull, 2021, 37(11): 1492-7. |
| [15] |
Khachigian L M. Collagen antibody-induced arthritis[J]. Nat Protoc, 2006, 1(5): 2512-6. doi:10.1038/nprot.2006.393 |
| [16] |
Deretic V. Autophagy in inflammation, infection, and immunometabolism[J]. Immunity, 2021, 54(3): 437-53. doi:10.1016/j.immuni.2021.01.018 |
| [17] |
Napoletano F, Baron O, Vandenabeele P, et al. Intersections between regulated cell death and autophagy[J]. Trends Cell Biol, 2019, 29(4): 323-38. doi:10.1016/j.tcb.2018.12.007 |
| [18] |
Nasiri-Ansari N, Nikolopoulou C, Papoutsi K, et al. Empagliflozin attenuates non-alcoholic fatty liver disease (NAFLD) in high fat diet fed ApoE(-/-) mice by activating autophagy and reducing er stress and apoptosis[J]. Int J Mol Sci, 2021, 22(2): 818. doi:10.3390/ijms22020818 |
| [19] |
Li Q, Lin Y, Liang G, et al. Autophagy and senescence: The molecular mechanisms and implications in liver diseases[J]. Int J Mol Sci, 2023, 24(23): 16880. doi:10.3390/ijms242316880 |
| [20] |
Li X, He S, Ma B. Autophagy and autophagy-related proteins in cancer[J]. Mol Cancer, 2020, 19(1): 12. doi:10.1186/s12943-020-1138-4 |
| [21] |
Hill S M, Wrobel L, Rubinsztein D C. Post-translational modifications of Beclin 1 provide multiple strategies for autophagy regulation[J]. Cell Death Differ, 2019, 26(4): 617-29. doi:10.1038/s41418-018-0254-9 |
| [22] |
Yang P, Li Z, Tye K D, et al. Effects of an orally supplemented probiotic on the autophagy protein LC3 and Beclin1 in placentas undergoing spontaneous delivery during normal pregnancy[J]. BMC Pregnancy Childbirth, 2020, 20(1): 216. doi:10.1186/s12884-020-02905-z |
| [23] |
Turco E, Witt M, Abert C, et al. FIP200 Claw domain binding to p62 promotes autophagosome formation at ubiquitin condensates[J]. Mol Cell, 2019, 74(2): 330-46. e11. doi:10.1016/j.molcel.2019.01.035 |
| [24] |
Jeong S J, Zhang X, Rodriguez-Velez A, et al. p62/SQSTM1 and selective autophagy in cardiometabolic diseases[J]. Antioxid Redox Signal, 2019, 31(6): 458-71. doi:10.1089/ars.2018.7649 |

