

2. 国家禁毒委员会办公室-中国药科大学禁毒关键技术联合实验室, 北京 100193;
3. 中国药科大学药学院, 江苏 南京 210009
 ,
CHEN Yuan-yuan2,3,
QIAO Yan-ling1,2,3,
LI Nan2,3,
XU Ya-wen2,3,
ZENG Xian-bin2,3,
XU Peng1,2,3
,
CHEN Yuan-yuan2,3,
QIAO Yan-ling1,2,3,
LI Nan2,3,
XU Ya-wen2,3,
ZENG Xian-bin2,3,
XU Peng1,2,3

2. Office of China National Narcotics Control Commission-China Pharmaceutical University Joint Laboratory on Key Technologies of Narcotics Control, Beijing 100193, China;
3. School of Pharmacy, China Pharmaceutical University, Nanjing 210009, China
新精神活性物质(new psychoactive substances, NPS)是指具有滥用潜力的、没有被联合国《1961年麻醉品单一公约》和《1971年精神药品公约》所列管、可引起公共健康风险的物质[1]。与海洛因、甲基苯丙胺等传统毒品相比,新精神活性物质具有相似或更强的药理作用,可引起急性精神障碍以及暴力倾向等,给社会治安和公共安全带来严重威胁。新精神活性物质的种类繁多、作用复杂,根据联合国毒品和犯罪问题办公室的报告,从2009年到2021年底共发现1 127种NPS, 涉及134个国家和地区。根据化学结构分类NPS可分为十一大类,包括:合成大麻素类、合成卡西酮类、苯乙胺类、色胺类、氨基茚满类、哌嗪类、氯胺酮及苯环利啶类、芬太尼类、苯二氮䓬类、植物类及其他类[2]。根据其药理学作用则可分为七大类,包括:兴奋剂类、合成大麻素受体激动剂类、经典致幻剂类、合成阿片类、身心分离剂类、镇静催眠类和效果未知类[2]。本篇综述将从药理学分类入手,针对不同种类NPS的药理作用及其机制进行综述,为其成瘾性与危害性研究提供参考。
1 兴奋剂类兴奋剂类是NPS中占比最多的一类物质,截至2021年底共报道413种,约占NPS总体的36%, 主要包含合成卡西酮类、苯乙胺类、哌嗪类和氨基茚满类。兴奋剂类NPS通常模拟传统兴奋类毒品如甲基苯丙胺或MDMA的作用,通过调节多巴胺(dopamine, DA)、去甲肾上腺素(norepinephrine, NE)和5-羟色胺(5-hydroxytryptamine, 5-HT)的释放以刺激中枢神经系统,从而引起兴奋和致幻作用[2]。
1.1 合成卡西酮类合成卡西酮类物质化学结构骨架与苯丙胺类物质类似,其结构式中的R1、R2、R3和R4可以有多种变化(Fig 1)。同时,由于其结构中有一个手性碳原子,因此存在R和S异构体,且具有不同的生理活性[3]。合成卡西酮类物质主要作用于单胺类转运蛋白,包括多巴胺转运体(dopamine transporter, DAT)、去甲肾上腺素转运体(norepinephrine transporter, NET)和5-羟色胺转运体(serotonin transporter, SERT), 通过抑制单胺类神经递质的重摄取来升高突触间隙神经递质水平,同时合成卡西酮类物质还可提高电压门控钙离子通道的兴奋性来诱导DA的释放[3]。
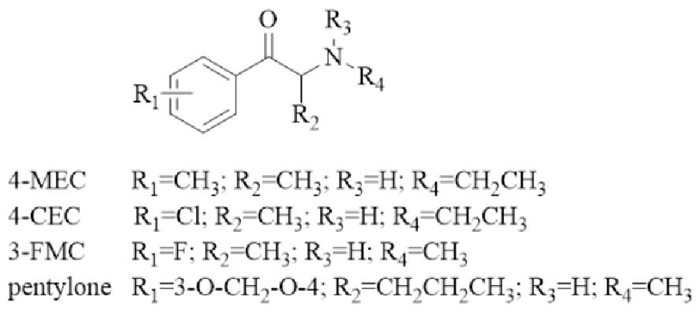
|
| Fig 1 Chemical structures of synthetic cathinones |
苯乙胺类物质主要分为苯乙胺类衍生物和二甲氧基苯乙胺衍生物(即2C类)两类(Fig 2)。2C类物质在苯环的2位和5位上有两个甲氧基取代,同时通过对苯环上的4位取代基进行修饰以得到新的具有致幻效应的物质。根据文献报道,2C类物质的致幻作用强弱与4位取代基有关[4]。
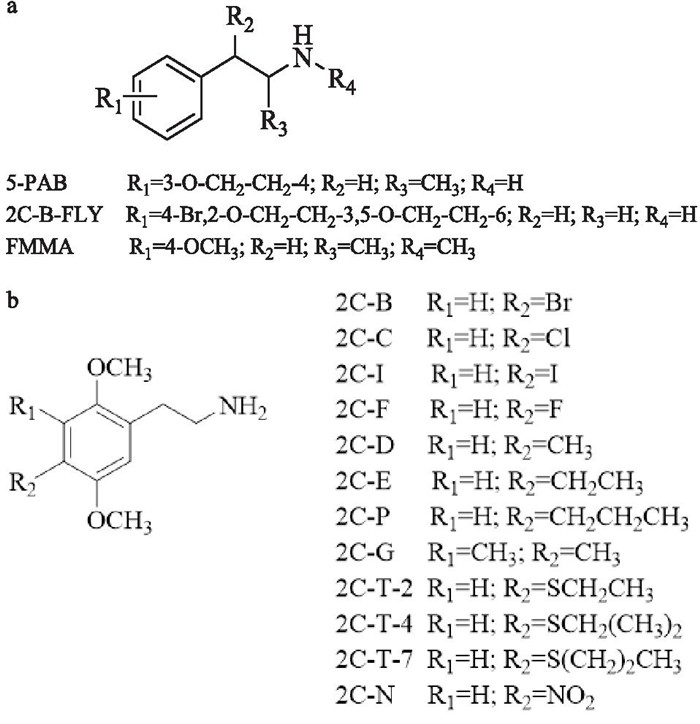
|
| Fig 2 Chemical structures of phenethylamines (a) and 2C series(b) |
苯乙胺类物质均可诱导三类单胺类神经递质DA、NE和5-HT的释放,通过抑制单胺氧化酶(monoamine oxidase, MAO)来阻止单胺类神经递质的分解;此外,还可以抑制单胺类转运蛋白以阻止神经递质的重摄取,使脑内单胺类递质水平升高,以达到兴奋和致幻的作用;其中致幻作用主要通过激活5-HT系统产生,兴奋作用则主要与激活DA受体有关[4]。由于苯乙胺类衍生物及2C类物质在结构上的差别,以及与单胺类受体的结合力不同,导致这两类物质的作用效果有不同的偏向性,即苯乙胺类衍生物多产生苯丙胺类兴奋作用,2C类物质则多为MDMA类致幻作用。长期滥用苯乙胺类NPS会导致成瘾,其机制主要是激活DA受体,影响中脑-边缘多巴胺系统,从而产生奖赏效应。
1.3 哌嗪类一般为苯基哌嗪或苄基哌嗪的衍生物,1、4位有2个氮原子的六元杂环在4位氮原子的位置连接一个苯基或苄基,具有类似甲基苯丙胺和MDMA的兴奋和致幻作用,但效果较温和、持续时间较长[5]。在其苯环上和杂环的4位氮原子上进行取代可以得到一系列哌嗪类衍生物,包括BZP、DBZP、mCPP、TFMPP等。(Fig 3)
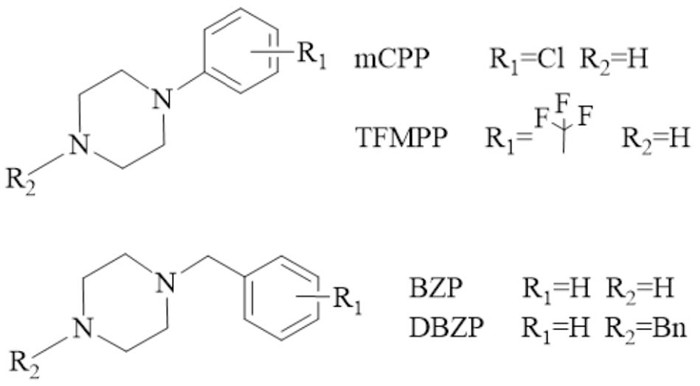
|
| Fig 3 Chemical structures of piperazines |
哌嗪类最早开始滥用的是BZP, 该物质对DAT表现为高选择性,可刺激DA、5-HT和NE的释放并抑制其转运体阻止重摄取,呈现兴奋和致幻的混合效果,多作为苯丙胺和MDMA的替代品滥用[5]。随后,通过对BZP的结构进行细微修饰而得到了一系列的哌嗪类物质,如m-CPP、TFMPP等。有研究表明TFMPP可以激动5-羟色胺受体,但产生的自身给药反应较弱,而BZP则表现出很强的成瘾性并呈剂量依赖性,提示不同结构的哌嗪类NPS可能有不同的作用机制,进而会产生不同的甲基苯丙胺类作用或MDMA类作用[6]。此外,有研究表明哌嗪类骨架化合物有镇痛抗炎潜能,因此还有一类以MT-45为代表的哌嗪类物质,该类物质具有镇痛作用,被划分在阿片类NPS中。
1.4 氨基茚满类2-AI是苯丙胺的环状类似物,氨基茚满类通过在2-AI骨架结构的芳香环上取代或添加亚甲二氧基桥或通过N-烷基化来获得,包括MDAI、MDMAI、5-IAI、MMAI等[2](Fig 4)。2-AI是一种温和的中枢神经系统兴奋剂,对5-羟色胺受体有高度选择性,可以诱导5-羟色胺释放并抑制其再摄取,呈现MDMA类作用,致幻效应较强[7]。此外,2-氨基茚满还有轻微的支气管扩张活性和强烈的镇痛作用,但具体作用机制还需进一步研究。其他氨基茚满类物质与2-氨基茚满相似,可以增加5-HT的释放并抑制其重摄取,表现MDMA类作用。

|
| Fig 4 Chemical structures of aminoindanes |
总体而言,兴奋剂类NPS主要是通过对DAT、SERT和NET的作用,使脑内DA、5-HT和NE的水平提高,从而产生以兴奋和致幻为主的作用效果。绝大部分兴奋剂类NPS均对NET起作用,但不同种类的兴奋剂类物质对DAT和SERT的亲和力不同,通常用DAT/SERT抑制比率将其作用分为甲基苯丙胺类作用(DAT/SERT > 10)和MDMA类作用(DAT/SERT < 0.1)。DAT/SERT > 10的物质通常有剂量依赖性和较高的成瘾潜能,而DAT/SERT < 0.1的物质则成瘾潜能较低[4]。
2 合成大麻素受体激动剂类合成大麻素受体激动剂(synthetic cannabinoid receptor agonists, SCRA), 即合成大麻素类物质,是指能够激动大麻素受体的人工合成化合物,是目前滥用最为广泛的NPS类别之一。截至2021年12月,全球共发现合成大麻素类物质327种,约占NPS的29%。合成大麻素类物质种类繁杂,分类方式多样,根据化学结构将其分为7大类,即经典大麻素类、非经典大麻素类、混合大麻素类、氨基烷基吲哚类、氨基烷基吲唑类,类二十烷酸类和其他类[2]。我国于2021年7月1日起,基于母核结构将合成大麻素类物质整类列入《非药用类麻醉药品和精神药品管制品种增补目录》(Fig 5)。
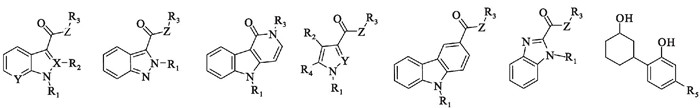
|
| Fig 5 Chemical structures of synthetic cannabinoids R1 indicates substituted or unsubstituted C3-C8 alkyl; substituted or unsubstituted heterocyclyl containing 1-3 heteroatoms; and methyl group or ethyl group substituted by substituted or unsubstituted heterocyclyl containing 1-3 heteroatoms. R2 indicates hydrogen or methyl group, or without any atom. R3 indicates substituted or unsubstituted C6-C10 aryl group; substituted or unsubstituted C3-C8 alkyl; substituted or unsubstituted heterocyclyl containing 1-3 heteroatoms; and methyl group or ethyl group substituted by substituted or unsubstituted heterocyclyl containing 1-3 heteroatoms. R4 indicates hydrogen; substituted or unsubstituted phenyl group; and substituted or unsubstituted benzyl. R5 indicates substituted or unsubstituted C3-C10 alkyl. X indicates N or C. Y indicates N or CH. Z indicates O or NH, or without any atom. |
合成大麻素类物质主要通过与大麻素受体结合发挥作用,大麻素受体属于G蛋白偶联受体(G protein-coupled receptor, GPCR), 主要有CB1受体(cannabinoid-type1 receptor, CB1)和CB2受体(cannabinoid-type 2 receptor, CB2)两种亚型。合成大麻素类物质通过与CB1受体作用,可产生抗焦虑和致焦虑的双向效应,并通过多个脑区5-HT水平的失调导致抑郁、精神分裂等多种精神疾病。使用合成大麻素还会影响认知、学习和记忆能力,机制主要是通过CB1受体干扰海马突触传递,从而损害短期记忆和长期记忆。Sullivan等[8]认为,大麻素可作用于海马锥体细胞突触前膜上的CB1受体,使G蛋白的βγ亚基与α亚基分离,βγ亚基移动并作用到N型或P/Q型钙离子通道,使Ca2+不能通过离子通道进入膜内,降低突触后膜的去极化,同时还进一步阻碍了突触后膜N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid, NMDA)受体上Mg2+的移除,最终使得突触后膜上的长时程改变减弱。合成大麻素类物质还能够使啮齿类动物产生典型的四联效应,即镇痛、体温降低、运动抑制和僵住。Wang等[9]通过基因敲除技术研究发现,CB1在四联效应中起最主要作用,CB2作用次于CB1, 而GPR55则对大麻素四联效应产生抑制作用,可能对大麻素的毒性产生神经保护作用。重复摄入合成大麻素类物质后可产生戒断症状和依赖综合征,提示合成大麻素类物质具有一定的成瘾潜力。药物成瘾与中脑边缘多巴胺系统的奖赏通路密切相关,其中伏隔核(nucleus accumben, NAc)是奖赏效应的主要靶脑区,摄入合成大麻素可刺激NAc多巴胺的释放;此外还有观点认为大麻素可结合位于γ-氨基丁酸(gamma-aminobutyric acid, GABA)能末梢的CB1受体,抑制GABA能神经元的活性,解除了GABA能神经元对DA能神经元的抑制作用,增强了DA神经元的兴奋性,从而产生奖赏效应[10]。
除了合成大麻素外,人体内本身还存在内源性大麻素2-AG和AEA, 它们与其他各种合成和代谢酶以及CB1、CB2受体组成内源性大麻素系统,具有调节疼痛、记忆、情绪和食欲等功能。当多巴胺或其他神经元活性增加时,细胞内Ca2+增加,从而激活内源性大麻素合成酶,内源性大麻素被合成并释放,在突触外空间逆行激活突触前膜的大麻素CB1受体来调节神经元活动。2-AG可能会增强多巴胺释放,是奖赏效应中调节多巴胺释放的主要内源性大麻素;而AEA则可能减少多巴胺释放和奖赏寻求,是参与调节多个脑区突触可塑性的主要内源性大麻素[11]。由于内源性大麻素系统的存在,使得合成大麻素的作用有别于其他毒品,机制也更加复杂,还需要进一步研究。
3 经典致幻剂类经典致幻剂是一类具有致幻作用的NPS, 约占NPS总体的15%。从化学结构上分类,主要包括苯乙胺类和色胺类[2]。苯乙胺类在兴奋剂类中做过描述,是一类具有兴奋和致幻双重作用的NPS, 本部分主要介绍色胺类。色胺类致幻剂是以色胺为母核的一类化学物质,化学结构与5-HT类似,因此具有与5-HT相似的药理作用。色胺类物质吲哚核上不同位置的化学修饰造成了该类物质之间理化性质、药效的差异,主要有5个位点可进行化学修饰,化学修饰类型以烷基取代为主(Fig 6)。
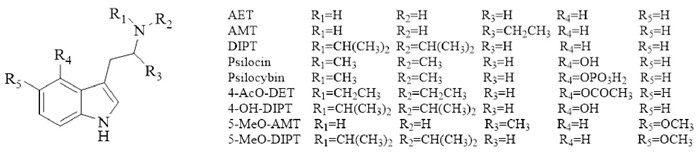
|
| Fig 6 Chemical structures of tryptamines |
目前普遍认为,色胺类物质产生致幻作用的机制与5-HT2A受体结合有关。5-HT2A受体在中枢神经系统分布广泛,主要分布在大脑皮质区域,在海马、丘脑核、下丘脑的乳突体和中脑的不同核团中也有分布,给予5-HT2A受体拮抗剂M100907可以阻断色胺类物质的致幻效应,而且不同色胺类物质与5-HT2A受体的亲和力也有不同[12]。此外,5-HT2A受体属于G蛋白偶联受体,偶联的G蛋白主要有Gq/11蛋白和Gi/o蛋白,色胺类物质可特异性激活Gi/o蛋白介导的信号通路,引起细胞外信号调节激酶1/2(extracellular regulated kinase1/2, ERK1/2)的磷酸化,此通路可能是介导致幻剂效应的主要通路[13]。此外,一些临床研究显示色胺类致幻剂在慢性疼痛、抑郁症、焦虑症和药物成瘾方面具有治疗潜力,但具体机制还需进一步研究。
除色胺类物质外,还有一些新型的麦角酰二乙胺类似物近几年也被合成出来,用于替代LSD产生致幻效应。通常是在LSD的二乙胺结构上进行化学取代,如ECPLA、LAMPA、MIPLA等,但其效力都弱于LSD。目前研究认为,麦角酰胺类物质的致幻作用也与激活5-HT2A受体有关,且可通过β-arrestin 2介导[14], 但具体的作用机制还需进一步研究。
4 合成阿片类合成阿片类物质是NPS中增长速度最快的种类之一,约占10%。按化学结构类型可分为八类,其中苯乙基哌啶类(主要包括芬太尼类物质)是阿片类NPS中最主要的一类物质,并且增长速度最快,所以阿片类物质又可分为芬太尼类物质和其他阿片类物质衍生物[2]。阿片类物质产生药理作用的主要机制是激动阿片受体产生吗啡样效应,属于中枢神经系统抑制剂。阿片受体属于G蛋白偶联受体,现在已知的阿片受体可分为四类,包括μ阿片受体(μ opioid receptor, MOR)、δ受体(δ opioid receptor, DOR)、κ阿片受体(κ opioid receptor, KOR)和孤啡肽受体(nociceptin opioid receptor, NOP), 阿片类物质主要与前三类阿片受体结合产生药理作用。研究表明激动MOR主要是产生镇痛作用和引起呼吸抑制,同时显示出增强情绪和愉悦的特性,激动DOR也可增强情绪和使人愉悦;而激动KOR在产生镇痛作用的同时还会导致烦躁和焦虑,但引起呼吸抑制的可能性较小[15]。
4.1 芬太尼类物质芬太尼类物质是指化学结构与芬太尼相比,符合以下一个或多个条件的物质:一、使用其他酰基替代丙酰基;二、使用任何取代或未取代的单环芳香基团替代与氮原子直接相连的苯基;三、哌啶环上存在烷基、烯基、烷氧基、酯基、醚基、羟基、卤素、卤代烷基、氨基及硝基等取代基;四、使用其他任意基团(氢原子除外)替代苯乙基(Fig 7)。
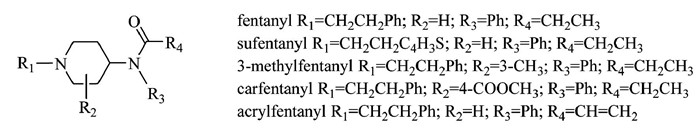
|
| Fig 7 Chemical structures of fentanyl analogues |
芬太尼类物质有较强的镇痛作用,其机制主要是与中枢神经系统的MOR结合,调节突触前和突触后感觉神经元,改变信号转导和离子传导来减少疼痛的传递,使人处于没有疼痛和焦虑的“清醒镇静”状态。芬太尼类物质还可引起呼吸抑制,这也是其使用过量致死的主要原因,其作用机制是激动脑干呼吸中枢的MOR受体,从而导致呼吸频率的抑制和呼吸驱动的抑制[16]。芬太尼类物质具有较强的成瘾性,摄入芬太尼类物质后可产生奖赏效应,主要是通过与MOR结合从而抑制GABA神经元,并增加腹侧被盖区(ventral tegmental area, VTA)中DA神经元活性和伏核中DA释放;此外,芬太尼类物质还可通过促进谷氨酸释放和抑制5-HT的再摄取等参与成瘾的形成[17]。
4.2 其他阿片类物质其他阿片类物质包括环己基苯酚类(如O-desmethyltramadol)、苯基哌啶类(如desmethylprodine)、硝基苯并咪唑类(如isotonitazene)、环己基苯甲酰胺类(如U-47700)、硫铵类(如piperidylthiambutene)、二苯哌嗪类(如MT-45)和肉桂基哌嗪类(如AP-237)(Fig 8)。这些阿片类物质都可与阿片受体结合产生吗啡样效应,如镇痛作用和呼吸抑制等,但对其具体作用机制还研究较少。
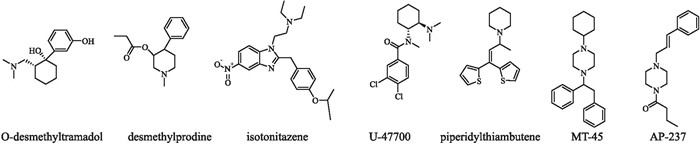
|
| Fig 8 Chemical structures of other synthetic opioids |
除了阿片类NPS, 吗啡、海洛因等传统阿片类毒品也主要通过与MOR结合产生药理作用,但它们对MOR的亲和力以及作用强度都弱于阿片类NPS, 这可能与MOR受体不同结合区域有关。如芬太尼倾向于与MOR跨膜蛋白的TM6和TM7结合,而吗啡倾向于与TM3和TM5结合,而TM6和TM7的构象变化在MOR的激活中是最为关键的部分[18]。此外,它们的下游信号通路也有所不同。有研究表明MOR下游的β-arrestin2和Gα相关的两条信号通路分别与阿片类物质的镇痛作用和不良反应有较强关联,并已有研究结合新型阿片类毒品对两条信号通路的偏向性对其药理作用进行了初步评估[19]。所以,虽然阿片类物质都是与阿片受体结合,但基于它们不同的化学结构以及与阿片受体结合后可能导致的不同构象变化等原因,针对阿片类物质的作用机制还需进一步研究。
5 身心分离剂类身心分离剂类约占NPS的2%, 主要包括氯胺酮及苯环利啶类物质,根据化学结构可分为芳环环己胺类和芳环环己酮胺类[2](Fig 9)。该类物质具有麻醉、镇痛、致幻的精神活性作用,由于服用后能让人产生一种精神与躯体分离的感觉,因此被称为“身心分离剂”或“解离剂”[1]。苯环利啶和氯胺酮是身心分离剂中最具有代表性且滥用程度比较高的物质,但近年来一些与苯环利啶和氯胺酮结构类似的物质如NENK、MXE和DCK等的滥用现象也逐渐显现。
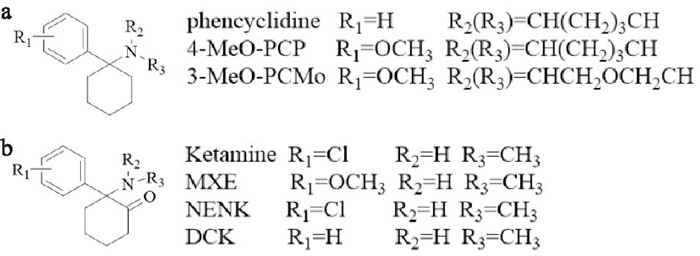
|
| Fig 9 Chemical structures of arylcyclohexylamine (a) and arylcyclohexanoneamine (b) |
身心分离剂类物质的麻醉、镇痛和抗抑郁作用主要与拮抗NMDA受体有关。NMDA受体是离子谷氨酸受体,可调节大脑神经突触的可塑性,参与慢性痛中枢敏化的形成,也参与药物成瘾的过程。目前,针对氯胺酮的相关研究较为深入。研究表明,氯胺酮可通过抑制NMDA受体通道活性参与突触传递及突触可塑性信号通路的调控,进而恢复慢性压力导致的皮层与海马区域的突触损伤,其中GluN1-N616的氢键作用和GluN2A-L642的疏水作用在氯胺酮与NMDA受体的结合过程中起着关键作用[20]。此外,氯胺酮能够通过增加伏隔核内DA受体的活性以及拮抗NMDA受体与GABA受体而激活脑内奖赏通路,产生依赖性。目前对于其他身心分离剂研究较少,李锋等[21]对氟胺酮(近年来作为氯胺酮的替代物被发现并有滥用)进行了成瘾性评估,发现其滥用潜力与氯胺酮相当。
身心分离剂产生致幻作用的机制目前仍不清楚。相关研究显示,氯胺酮虽然有与经典致幻剂类似的致幻作用,但其与5-HT2A受体的亲和力较低,机制与传统致幻剂不同。近期有研究认为氯胺酮介导的致幻作用可能与背侧纹状体DA水平的增高有关[22], 具体的信号通路还需进一步研究。
6 镇静催眠类镇静催眠类NPS是一类对中枢神经系统起抑制作用的物质,约占3%, 主要是模拟已经列入管制的苯二氮䓬类药物如地西泮、阿普唑仑等的新型苯二氮䓬类物质,也称策划苯二氮䓬类物质(designer benzodiazepines, DBZD)[2]。这些新型物质具有与苯二氮䓬类药物相似的作用,主要包括抗焦虑、催眠、肌肉放松、抗惊厥、致欣快等作用,按结构可分为三类:1,4-苯二氮䓬类、三唑苯二氮䓬类、噻吩三唑二氮杂䓬类[23](Fig 10)。
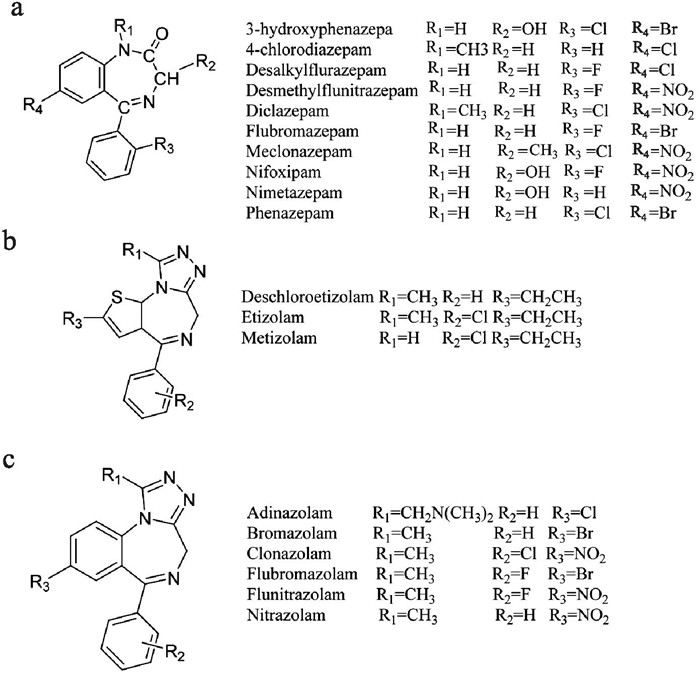
|
| Fig 10 Chemical structures of 1,4-benzodiazepines(a)、triazolobenzodiazepines(b) and thienotriazolobenzodiazepines(c) |
DBZD与苯二氮䓬类物质作用机制相似,主要是通过GABA神经元发挥作用。GABA是一种活跃于中枢神经系统的内源抑制性神经递质,可以与GABA受体相结合,GABA受体有A、B和C 3种亚型,DBZD类药物主要作用于A型受体[23]。GABA-A型受体是一种配体门控的氯离子通道,DBZD可以与中枢神经突触前膜和后膜上的GABA-A受体结合,引起氯离子通道发生构象变化引发超极化,进而导致中枢神经系统抑制作用。GABA-A受体的配体门控离子通道是由2个α亚基、2个β亚基和1个γ亚基组成的五聚体环,在GABA-A受体的胞外段,还含有由2个α亚基与β亚基形成的与GABA分子结合的疏水口袋,以及1个α亚基和γ亚基组成的苯二氮䓬结合口袋[24]。GABA-A受体的亚基还有不同的亚型,如α亚基有6种亚型,β亚基与γ亚基分别有3种亚型,这些不同的亚型导致GABA-A受体有不同的作用,如α1βγ2受体亚型在镇静作用中起着显著的作用,而α2βγ2则与焦虑有关[25]。此外,不同的DBZD与GABA-A受体亲和力也不同,三唑苯二氮䓬类药物的受体亲和力高于1, 4苯二氮䓬类药物。DBZD类药物具有成瘾性,主要与GABA-A受体中的α1亚基有关,当药物作用于腹侧背盖区中的α1-GABA-A受体时,可以削弱中间抑制性神经元的抑制作用,引起多巴胺能去抑制化,导致多巴胺水平增加[23]。此外,除了与α1-GABA-A受体作用,DBZD类药物还可调节含有α2、α3和α5亚基的GABA-A受体,分别参与不同的功能。如α2GABA-A和α3GABA-A受体具有强化抗焦虑的能力,而α5GABA-A受体则具有调节认知功能的能力[25], 具体的作用机制还需进一步研究。
7 总结与展望总体而言,不同种类的NPS通过作用于脑内不同的受体来发挥其主要的药理作用。兴奋剂类主要与DA受体结合,致幻剂类主要与5-HT受体结合,合成大麻素受体激动剂类主要与CB1受体结合,合成阿片类主要作用于μ阿片受体,身心分离剂主要作用于NMDA受体,镇静催眠类则主要作用于GABA受体。但是,这些NPS并不是只与单一的受体结合。如兴奋剂类物质还会与5-HT受体和NE受体结合发挥相应的药理作用,身心分离剂氯胺酮除了与NMDA受体结合外,还对DA受体和GABA受体有作用。此外,同一类化学结构的NPS其作用机制也并不都相同。例如化学结构上归属于哌嗪类NPS的MT-45并没有像其他哌嗪类物质一样与DA受体结合,而是与μ阿片受体结合产生镇痛抗炎作用;此外,MT-45的代谢物还可拮抗NMDA受体,产生类似分离的作用。因此,可采用受体配体结合技术如SPR等对NPS的作用靶点进行筛选,确定其与脑内相关受体或转运体的结合情况;同时还可进一步结合新精神活性物质化学结构的变化筛选出发挥特异性作用的关键结构,如芬太尼类物质哌啶环3位碳的取代基为甲基时可显著增强与μ阿片受体的亲和力,且镇痛效应往往也相应增强。
不同于以往滥用的传统毒品如海洛因或冰毒等,NPS种类繁多、化学结构多样化、更新换代速度快,只需对其化学结构稍加修饰就可筛选出全新的未被管控的物质,对其有效管控带来极大挑战。通过对NPS的药理作用进行归纳总结,利用其药理特异性达到成瘾性和危害性快速评估的目的,可为其管控提供新的思路。除了对NPS进行有效管控外,我们还希望通过药理学研究探索NPS产生作用的可能机制,寻找临床治疗潜能。
| [1] |
马岩, 王优美, 徐鹏, 方文军. 绪论[M] //马岩, 王优美, 徐鹏, 等, 主编. 新精神活性物质办案实用手册. 北京: 法律出版社; 2019: 1-27. Ma Y, Wang Y M, Xu P, Fang W J. Introduction[M]// Ma Y, Wang Y M, Xu P, Fang W J. Editor. Handbook of new psychoactive substances for judicial practice. Bei Jing: Law Press China, 2019: 1-27. |
| [2] |
UNODC. UNODC Early Warning Advisory on New Psychoactive Substances[EB/OL] 2022. [2022-08-03]: https://www.unodc.org/LSS/Page/NPS.
|
| [3] |
李香豫, 张圣捷, 邱毅, 等. 合成卡西酮类新型毒品的药理学研究进展[J]. 中国法医学杂志, 2019, 34(3): 279-84. Li X Y, Zhang S J, Qiu Y, et al. Advances in pharmacological research of synthetic cathinones[J]. Chin J Forensic Med, 2019, 34(3): 279-84. |
| [4] |
Luethi D, Liechti M E. Designer drugs: Mechanism of action and adverse effects[J]. Arch Toxicol, 2020, 94(4): 1085-133. |
| [5] |
常颖, 胡羽鹏, 赵阳, 等. 哌嗪类新精神活性物质综述[J]. 刑事技术, 2016, 41(4): 317-21. Chang Y, Hu Y P, Zhao Y, et al. Review of new piperazine-type psychoactive substances[J]. Foren Sci Technol, 2016, 41(4): 317-21. |
| [6] |
Fantegrossi W E, Winger G, Woods J H, et al. Reinforcing and discriminative stimulus effects of 1-benzylpiperazine and trifluoromethylphenylpiperazine in rhesus monkeys[J]. Drug Alcohol Depend, 2005, 77(2): 161-8. doi:10.1016/j.drugalcdep.2004.07.014 |
| [7] |
Pinterova N, Horsley R R, Palenicek T. Synthetic aminoindanes: A summary of existing knowledge[J]. Front Psychiatry, 2017, 8: 236. |
| [8] |
Sullivan J M. Cellular and molecular mechanisms underlying learning and memory impairments produced by cannabinoids[J]. Learn Mem, 2000, 7(3): 132-9. doi:10.1101/lm.7.3.132 |
| [9] |
Wang X F, Galaj E, Bi G H, et al. Different receptor mechanisms underlying phytocannabinoid- versus synthetic cannabinoid-induced tetrad effects: Opposite roles of CB(1) /CB(2) versus GPR55 receptors[J]. Br J Pharmacol, 2020, 177(8): 1865-80. doi:10.1111/bph.14958 |
| [10] |
唐双奇, 陆阳. 内源性大麻素—生物合成、信号转导及生物降解[J]. 中国药理学通报, 2013, 29(8): 1037-41. Tang S Q, Lu Y. Endocannabinoids—biosynthesis, signal transduction and biodegradation[J]. Chin Pharm Bull, 2013, 29(8): 1037-41. |
| [11] |
Peters K Z, Oleson E B, Cheer J F. A brain on Cannabinoids: The role of dopamine release in reward seeking and addiction[J]. Cold Spring Harb Perspect Med, 2021, 11(1): a039305. |
| [12] |
孙毅, 苏瑞斌. 致幻剂的药理作用及其机制研究进展[J]. 中国药理学与毒理学杂志, 2021, 35(4): 241-50. Sun Y, Su R B. Research progress in function and mechanism of psychedelics[J]. Chin J Pharm Toxicol, 2021, 35(4): 241-50. |
| [13] |
González-Maeso J, Weisstaub N V, Zhou M, et al. Hallucinogens recruit specific cortical 5-HT(2A) receptor-mediated signaling pathways to affect behavior[J]. Neuron, 2007, 53(3): 439-52. |
| [14] |
Rodriguiz R M, Nadkarni V, Means C R, et al. LSD-stimulated behaviors in mice require β-arrestin 2 but not β-arrestin 1[J]. Sci Rep, 2021, 11(1): 17690. |
| [15] |
Otte L, Wilde M, Auwärter V, et al. Investigation of the μ- and κ-opioid receptor activation by eight new synthetic opioids using the [(35) S]-GTPγS assay: U-47700, isopropyl U-47700, U-49900, U-47931E, N-methyl U-47931E, U-51754, U-48520, and U-48800[J]. Drug Test Anal, 2022, 14(7): 1187-99. |
| [16] |
Schaefer C P, Tome M E, Davis T P. The opioid epidemic: A central role for the blood brain barrier in opioid analgesia and abuse[J]. Fluids Barriers CNS, 2017, 14(1): 32-43. |
| [17] |
Volkow N D, Jones E B, Einstein E B, et al. Prevention and treatment of opioid misuse and addiction: A review[J]. Jama Psychiatry, 2019, 76(2): 208-16. |
| [18] |
Ricarte A, Dalton J A R, Giraldo J. Structural assessment of agonist efficacy in the μ-opioid receptor: Morphine and fentanyl elicit different activation patterns[J]. J Chem Inf Model, 2021, 61(3): 1251-74. |
| [19] |
Vandeputte M M, Persson M, Walther D, et al. Characterization of recent non-fentanyl synthetic opioids via three different in vitro μ-opioid receptor activation assays[J]. Arch Toxicol, 2022, 96(3): 877-97. |
| [20] |
Zhang Y, Ye F, Zhang T, et al. Structural basis of ketamine action on human NMDA receptors[J]. Nature, 2021, 596(7871): 301-5. |
| [21] |
Li F, Du H, Wu B, et al. 2-Fluorodeschloroketamine has similar abuse potential as ketamine[J]. Addict Biol, 2022, 27(3): e13171. |
| [22] |
Schmack K, Bosc M, Ott T, et al. Striatal dopamine mediates hallucination-like perception in mice[J]. Science, 2021, 372(6537): eabf4740. |
| [23] |
Manchester K R, Lomas E C, Waters L, et al. The emergence of new psychoactive substance (NPS) benzodiazepines: A review[J]. Drug Test Anal, 2018, 10(1): 37-53. |
| [24] |
Zhu S, Noviello C M, Teng J, et al. Structure of a human synaptic GABAA receptor[J]. Nature, 2018, 559(7712): 67-72. |
| [25] |
El Balkhi S, Monchaud C, Herault F, et al. Designer benzodiazepines' pharmacological effects and potencies: How to find the information[J]. J Psychopharmacol, 2020, 34(9): 1021-9. |