

肝纤维化是肝损伤到肝硬化甚至肝细胞癌(hepatocellular carcinoma, HCC)的重要过程,严重威胁着人类的身体健康。据估计,中国有多达700万人患有肝硬化,而肝硬化可发展为HCC, 目前HCC已成为最常见的癌症之一,发病率为4.7%, 死亡率为8.3%[1]。肝脏移植手术是终末期肝硬化最有效的治疗手段,但手术费用高且存在诸多并发症。而HCC虽然可以通过手术治疗,但术后复发率高,预后不良。因此,在肝纤维化尚未发展致肝硬化甚至HCC之前采取有效措施预防和治疗肝纤维化是一个重要的环节。
肝星状细胞(hepatic stellate cells, HSCs)在肝纤维化发生发展中起着重要作用。在生理条件下,HSCs处于静止状态,含有类维生素A脂滴。慢性病毒感染、酒精成瘾和非酒精性脂肪性肝炎等反复损伤导致的炎症反应和氧化应激,能够使静止的HSCs转化为激活的HSCs, 激活的HSCs转化为肌成纤维细胞,产生大量的胶原蛋白并表达α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA), 导致细胞外基质(extracellular matrix, ECM)进行性积累。此外,与静止的HSCs相比,激活的HSCs具有更强的迁移能力,这在肝纤维形成中也发挥了关键作用[2]。因此,抑制炎症反应和氧化应激,从而减少HSCs的激活是一种抗肝纤维化的有效策略。HSCs的激活对肝纤维化的影响一直是研究者关注的焦点,并且已经取得了一定的进展。此外,研究表明,激活的HSCs凋亡也是HSCs消退的机制之一,诱导激活的HSCs发生凋亡已成为抗肝纤维化治疗的突破口[18]。磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase, PI3K)是一种胞内脂质激酶家族的成员,广泛表达于多种细胞和组织中,参与多种生物学功能的调控。研究表明,PI3K信号通路参与调节肝纤维化的炎症反应、氧化应激和凋亡,其持续激活与肝纤维化密切相关。异常激活的PI3K信号通路可导致肝脂肪变性、肝肿大、纤维化和HCC。与之相反,抑制PI3K信号通路导致HSCs活化、增殖、迁移减少,ECM沉积减少[3]。由此可见,靶向抑制PI3K信号通路可能是抗肝纤维化的有效策略。然而,目前临床上仍缺少通过抑制PI3K信号通路发挥抗肝纤维化的药物,故针对靶向PI3K信号通路的化合物进行深入研究具有重要的意义。
天然产物一直是药物研究和开发的重要来源。天然产物中提取的黄酮类和萜类化合物具有多种生物活性,包括抗炎、抗氧化、调节凋亡、抗纤维化,并能够通过靶向PI3K信号通路发挥抗肝纤维化作用。本文就PI3K信号通路在改善肝纤维化中的作用进行综述,并总结了近年来通过抑制PI3K信号通路改善肝纤维化的天然产物的研究,以期为抗肝纤维化天然药物的开发提供参考。
1 PI3K信号通路在减轻肝纤维化中的作用 1.1 PI3K信号通路PI3K信号通路由PI3K、丝/苏氨酸蛋白激酶(serine/threonine specific protein kinase, AKT)和下游的效应分子组成。PI3K是一组与质膜相关的脂质激酶,能够使质膜上磷脂酰肌醇的3-OH基团发生磷酸化。根据结构和特定底物的不同,PI3K分为3类:Ⅰ类、Ⅱ类、Ⅲ类。Ⅰ类PI3K的生物学功能最为广泛,因而被研究得最彻底。I类PI3K由IA类(PI3Kα, PI3Kβ和PI3Kδ)和IB类(PI3Kγ)组成。IA类PI3K是一种具有p85调控亚基和p110(α, β和δ)催化亚基的异源二聚体。IB类PI3K由调控亚基p101和p87以及催化亚基p110γ组成。生理条件下,PI3K信号通路可被多种细胞外信号刺激,包括细胞因子、活性氧(reactive oxygen, ROS)、生长因子和激素等。以上细胞外信号主要通过激活受体酪氨酸激酶(receptor tyrosine kinase, RTK)和G蛋白偶联受体(G protein-coupled receptors, GPCR)激活PI3K信号通路[4]。AKT亚型(AKT1, AKT2和AKT3)作为PI3K信号通路的下游关键分子,在PI3K介导的信号转导中发挥重要作用。AKT包含3个结构域,PH结构域、中心丝氨酸/苏氨酸催化区和羧基末端调控区。AKT通过PH结构域与磷脂酰肌醇-3, 4, 5-三磷酸结合,进而从细胞质转移到细胞膜上,在磷酸肌醇依赖性蛋白激酶1(3-phosphoinositide-dependent protein kinase 1, PDK1)和雷帕霉素机械靶蛋白复合物2(mechanistic target of rapamycin complex 2, mTORC2)的催化下,其激酶结构域(苏氨酸308)和羧基端调控结构域(丝氨酸473)磷酸化而被激活[5]。活化的AKT可以正或负调节下游蛋白,如核因子-kappa B(nuclear factor-kappa B, NF-κB)、还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶(nicotinamide adenine dinucleotide phosphate oxidases, NOXs)、B-细胞淋巴瘤因子-2(B-cell lymphoma-2, Bcl-2)、含半胱氨酸的天冬氨酸蛋白水解酶9(cysteinyl aspartate specific proteinase 9, caspase 9)和雷帕霉素机械靶蛋白(mechanistic target of rapamycin, mTOR)等。
PI3K/AKT通过调控下游效应分子参与炎症反应、氧化应激、凋亡等细胞过程(Fig 1)。近年研究表明,PI3K与肝纤维化的发生密切相关,孙芳芳等[6]采用免疫组化法对乙肝肝纤维化患者肝组织的PI3K蛋白表达量进行分析,发现随着肝纤维化分期增大,PI3K蛋白的表达量增多。Huang等[7]对慢性丙肝患者肝脏组织进行免疫组化染色,发现AKT蛋白高表达与晚期肝纤维化相关,提示肝纤维化可能与PI3K信号通路的激活有关。因此,靶向PI3K信号通路可能是抗肝纤维化的有效策略。
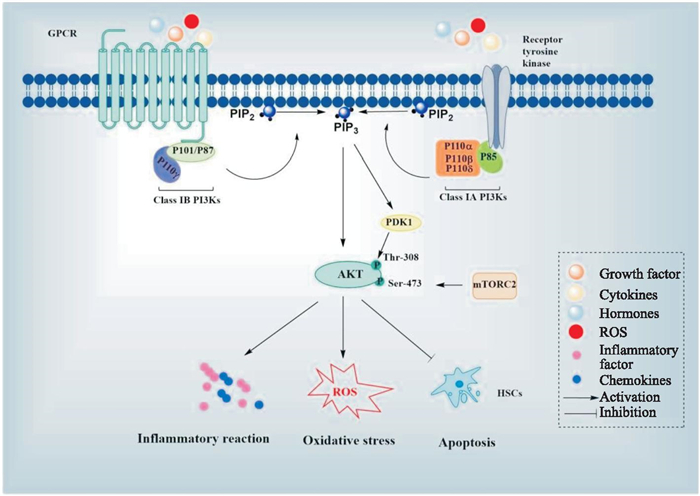
|
| Fig 1 PI3K signaling pathway |
炎症细胞、炎症细胞因子和趋化因子在肝纤维化的发病机制中起着至关重要的作用。损伤诱导的炎症反应可触发炎症细胞向肝脏募集,产生细胞因子和趋化因子激活HSCs。例如,在受损的肝脏中,Kupffer细胞和HSCs分泌C-C基序趋化因子配体2, 招募单核细胞来源的巨噬细胞到肝脏并释放炎症细胞因子驱动HSCs活化,从而促进胶原形成[8]。另有研究报道,炎症因子白介素6(interleukin-6, IL-6)或IL-1β基因缺失可减轻肝纤维化的进展[9], 这提示炎症因子与肝纤维化密切相关。此外,C-C基序趋化因子受体2/5拮抗剂cenicriviroc治疗也可改善肝纤维化[8]。以上研究表明,减轻纤维化肝脏的炎症反应可能是治疗肝纤维化的有效策略。
PI3K是与炎症反应相关信号级联的重要介质。PI3K/AKT信号通路的激活可增加炎性细胞因子肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)、IL-1β和IL-6的分泌,引起组织基质金属蛋白酶抑制剂-1(tissue inhibitor of metalloproteinases-1, TIMP-1)、基质金属蛋白酶-2(matrix metalloproteinase-2, MMP-2)、MMP-9、α-SMA、I型胶原蛋白(collagen type-I, COL-1)、COL-3表达失衡并与肝纤维化的程度密切相关[10]。与之相反,siRNA介导的AKT2沉默显著抑制了细胞炎症标志物TNF-α和IL-1β的mRNA水平,抑制了HSCs增殖、迁移和HSCs中α-SMA, COL-1的生成[11]。类似的,HSCs能够自分泌CXC基序趋化因子配体1, 从而促进其激活,而抑制PI3K/AKT信号通路可以减少CXC基序趋化因子配体1的自分泌,从而减少HSCs的激活,减轻肝纤维化[12]。因此,PI3K/AKT通路可能是改善肝纤维化炎症的潜在靶点。
1.3 抑制PI3K信号通路能够降低肝纤维化氧化应激反应氧化应激是指体内氧化与抗氧化作用失衡的一种状态,是导致肝损伤和启动肝纤维化的关键环节之一。当机体受到内、外不良刺激作用时,ROS产生过多,超过机体的抗氧化能力,氧化与抗氧化系统之间严重失衡从而导致细胞和组织出现损伤。肝脏易受到ROS的攻击,从而引起氧化应激介导的肝损伤。线粒体和NOXs是细胞ROS的主要来源。在胆管结扎术小鼠模型中,敲除NOX1能够降低氧化应激水平从而减轻肝脏损伤和纤维化[13]。实验表明,ROS可参与HSCs的激活,诱导HSCs增殖和胶原蛋白合成。ROS介导的氧化应激小鼠模型中,TIMP-1表达明显增加,肝脏形态学改变显示胶原沉积增加。此外,体外HSCs和使用砷刺激的氧化应激肝细胞(ROS水平升高)共培养模型表明,氧化应激的肝细胞能够促进HSCs的激活[14]。
PI3K信号通路与细胞的氧化应激水平密切相关。研究发现,损伤启动PI3K/AKT信号通路和蛋白激酶C的激活,导致NOXs的激活和ROS的产生,而抑制PI3K信号通路能够降低氧化应激水平。例如,Jee等[15]研究发现与野生型小鼠成纤维细胞相比,沉默了AKT基因的AKT1-/-细胞中ROS生成减少。当暴露于氧化应激时,PI3K信号通路抑制剂可上调多种细胞抗氧化因子的表达,如使用BYL-719选择性抑制PI3K的p110α亚型可增加抗氧化基因的表达,如核因子E2相关因子2、过氧化氢酶、超氧化物歧化酶1和超氧化物歧化酶2[16]。这表明抑制PI3K信号通路降低氧化应激水平可能是抗肝纤维化的作用机制之一,然而目前尚缺乏直接表明抑制PI3K信号通路降低氧化应激水平进而改善肝纤维化的研究。
1.4 抑制PI3K信号通路能够诱导HSCs凋亡HSCs的凋亡是一个复杂的过程,涉及多种分子机制和多种因素,包括死亡受体介导途径(FAS或TRAIL)的激活、Caspase-3、Caspase-8和Bcl-2关联X蛋白(Bcl-2 associated X, Bax)的激活以及抗凋亡蛋白Bcl-2 xL(Bcl-2 extra large, Bcl-xL)、Bcl-2的下调等。HSCs的凋亡被认为是缓解肝纤维化的机制之一,诱导活化的HSCs发生凋亡有助于肝纤维化的自发消退。PI3K/AKT通路主要通过影响Bcl-2家族等凋亡相关因子参与凋亡的调控过程。PI3K/AKT信号通路激活可直接磷酸化Bcl-2相关死亡启动子(Bcl-2 associated death promoter, Bad)的Ser136位点介导Bad和Bcl-xL之间的相互作用,维持了线粒体的完整性并阻止细胞色素C外流从而抑制细胞凋亡。PI3K/AKT信号通路还可以激活Bcl-2和抑制Bax从而促进细胞存活,故抑制PI3K通路则可诱导HSCs凋亡。例如,研究者在激活的HSCs中加入PI3K/AKT通路抑制剂,结果显示阻断PI3K/AKT通路可上调cleaved caspase-9、cleaved caspase-3水平,增加HSCs线粒体中细胞色素C的释放,提示抑制PI3K信号通路可诱导HSCs凋亡[17]。另有研究报道,在人HSCs(LX-2细胞)中,眼镜蛇毒可以抑制PI3K/AKT信号通路,促进LX-2细胞凋亡,改善肝纤维化[18]。以上结果表明,抑制PI3K信号通路可以诱导HSCs凋亡,具有此作用的化合物可能成为抗肝纤维化的潜在药物。
2 天然产物靶向抑制PI3K信号通路有利于改善肝纤维化近年来,对天然产物的研究取得了显著的进展。据报道,多种天然产物可以调节肝纤维化。黄酮类和萜类化合物广泛存在于天然产物中,许多研究表明黄酮类和萜类化合物具有通过抑制PI3K信号通路抗纤维化的特性。因此,本文将对黄酮类和萜类化合物的抗肝纤维化作用及与PI3K信号通路相关的潜在机制进行总结(Tab 1)。
| Natural product | Source | Experimental model | Efficient dose | Effect | Mechanism | Reference |
| Oroxylin A | Scutellaria baicalensis Georgi | CCl4 induced mice, CCl4 induced primary HSCs. | 20, 30 and 40 mg·kg-1, 20, 30 and 40 μmol·L-1 | Anti-inflammation, activation of autophagy, anti-fibrosis, decreasing ROS level. | Inhibition of PI3K/AKT/mTOR signaling | [19] |
| Naringin | citrus fruits and grape fruits | TAA induced rats | 40 mg·kg-1 | Decreasing liver injury, anti-inflammation, anti-oxidant stress, anti-fibrosis, inducing HSCs apoptosis. | Inhibition of PI3K/AKT signaling | [20] |
| Wogonoside | Scutellaria baicalensis Georgi | CCl4 induced rats, TGF-β induced T-6 cells. | 4 and 8 mg·kg-1g, 5, 10, and 20 μmol·L-1. | Ameliorating liver injury, decreasingliver index, anti-fibrosis, anti-oxidant stress, anti-inflammation. | Inhibition of PI3K/AKT/mTOR signaling and NF-κB pathway | [21] |
| Galangin | Alpinia officinarum Hance | TGF-β1 induced LX-2 cells | 6, 8, and 10 mg·L-1 | Inducing LX-2 cells apoptosis, anti-fibrosis. | Inhibition of PI3K/AKT signaling and Wnt/β-catenin Signaling | [22] |
| Asiatic acid | Centella asiatica | CCl4 induced rats | 5 and 15 mg·kg-1 | Ameliorating liver injury, anti-fibrosis, anti-oxidant stress, anti-inflammation. | Inhibition of the PI3K/AKT/mTOR signaling | [23] |
| Astragaloside IV | Astragalus membranaceus | CCl4 induced rats | 20 mL·kg-1 | Ameliorating liver injury, anti-inflammation, anti-fibrosis. | Inhibition of the PI3K/AKT/mTOR signaling | [26] |
| Germacrone | Rhizoma Curcuma | CCl4 induced rats, TGF-β1 induced LX-2 cells. | 25, 50 and 100 mg·kg-1, 40, 80, and 160 μmol·L-1. | Anti-fibrosis, ameliorating liver injury, repressing HSC proliferation and hepatic EMT, inducing LX-2 cells apoptosis. | Inhibition of the PI3K/AKT/mTOR signaling | [28] |
| Cucurbitacin E | cucurbitaceae | TAA induced mice, TNF-α induced T-6 cells. | 5 and 10 mg·kg-1, 1.56, 3.125, 6.25, and 12.5 μmol·L-1. | Inhibiting proliferation of activated T-6 cells, inducing T-6 cell apoptosis, anti-fibrosis. | Inhibition of PI3K-AKT-mTOR-p70S6K and AMPK signaling pathway | [29] |
| Curcumol | Curcuma phaeocaulis Val | Activated T-6 cells | 300 μmol·L-1 | Inducing T-6 cells apoptosis. | Inhibition of PI3K/NF-κB pathway | [30] |
黄酮类化合物广泛存在于天然来源的植物中,且存在多种药理学活性,如抗炎、抗氧化、调节细胞异常凋亡、调节脂质代谢等。研究发现,黄酮类化合物能够有效改善肝脏疾病,包括急性肝损伤,脂肪肝等。临床上使用的水飞蓟宾就是一种黄酮类化合物,可用于肝纤维化的治疗,说明黄酮类化合物具有开发成抗肝纤维化药物的潜力。本文总结了通过抑制PI3K信号通路改善肝纤维化的黄酮类化合物,主要包括千层纸素A、柚皮苷、汉黄芩苷和高良姜素等。
2.1.1 千层纸素A千层纸素A(oroxylin A, OA)主要来源于黄芩的根,是一种天然黄酮类化合物。OA在大鼠体内代谢为千层纸素A-7-O-葡萄糖醛酸苷(oroxylin A-7-O-glucuronide, OG)和千层纸素A磺酸钠。除胃和肠外,OA及其两种代谢物在大鼠体内主要分布于肝、肾。而与代谢产物相比,OA在组织中的分布更为广泛。Shen等[19]发现,在四氯化碳诱导的小鼠中毒性肝纤维化模型中,OA能够下调肝纤维化炎症标志物,包括IL-1β、IL-6、IL-18、TNF-α和干扰素γ(interferon, IFN-γ)等的表达,降低肝脏炎症反应进而抑制肝纤维化。此外,OA还可降低从四氯化碳诱导的小鼠中毒性肝纤维化模型中分离出的HSCs中ROS和升高谷胱甘肽的含量抑制氧化应激。进一步机制研究发现,OA可显著抑制PI3K、AKT和mTOR磷酸化蛋白的表达,但不抑制其mRNA水平,表明OA可能是通过转录后调控的方式下调PI3K/AKT /mTOR信号通路进而抑制炎症反应和氧化应激。
2.1.2 柚皮苷柚皮苷(naringin)是一种黄酮苷,存在于柑橘类水果和葡萄果实中。柚皮苷主要分布于胃肠道、肝、肾、肺和气管。El-Mihi等[20]使用硫代乙酰胺诱导大鼠中毒性肝纤维化模型,发现柚皮苷能够抑制PI3K信号通路,增加抗氧化因子表达并减少炎症细胞因子产生。同时柚皮苷可降低肝组织中胶原沉积及α-SMA和纤维连接蛋白的表达。此外,柚皮苷还可诱导HSCs凋亡。由此可见,柚皮苷能够抑制硫代乙酰胺引起的肝纤维化,其作用机制可能是抑制PI3K信号通路。
2.1.3 汉黄芩苷汉黄芩苷(wogonoside)是从黄芩根中提取的一类黄酮类化合物。Wang等[21]发现,汉黄芩苷能够降低四氯化碳诱导的大鼠中毒性肝纤维化模型中门冬氨酸氨基转移酶、丙氨酸氨基转移酶的水平,减轻肝损伤。除了保护肝脏的特性,汉黄芩苷具有明确的抗炎和抗肝纤维化的特性。例如,汉黄芩苷可降低纤维化肝脏中TGF-β、MMP-2、MMP-9的表达,逆转四氯化碳诱导的胶原沉积,表明汉黄芩苷能够缓解肝纤维化。另有研究发现,汉黄芩苷可降低PI3K、AKT、mTOR和p65蛋白的磷酸化水平,证实了其对PI3K/AKT/mTOR和NF-κB通路有抑制作用。
2.1.4 高良姜素高良姜素(galangin)是一种从高良姜根茎中分离得到的3, 5, 7-三羟基黄酮,研究表明高良姜素能逆转TGF-β1诱导的COL-1和ɑ-SMA的表达,诱导LX-2细胞凋亡。进一步研究发现,高良姜素可通过抑制PI3K/AKT信号通路、Wnt/β-catenin信号通路和诱导Bax/Bcl-2信号通路改善肝纤维化[22]。因此,作为一种来自食物来源的有益化合物,高良姜素有望成为一种有效的抗肝纤维化药物。
2.2 萜类化合物萜类化合物是以异戊二烯单元为基本结构单元的化合物。有文献报道,部分萜类化合物具有抗肝纤维化的作用,其中积雪草酸,黄芪甲苷,吉马酮,葫芦素E, 莪术醇能够抑制PI3K信号通路,发挥抗炎,抗氧化应激和调节细胞凋亡的作用。
2.2.1 积雪草酸积雪草酸(asiatic acid)从积雪草中分离得到,具有五环三萜结构。研究显示其具有抗炎、抗氧化和保护肝脏的作用。积雪草酸对四氯化碳诱导的大鼠慢性肝损伤有保护作用。研究发现,积雪草酸能提高超氧化物歧化酶、谷胱甘肽过氧化物酶等抗氧化酶活性,降低丙二醛水平。此外,积雪草酸可以通过降低血清中透明质酸酶、层粘连蛋白、III型前胶原和COL-IV的含量和降低TIMP-1、TIMP-2 mRNA表达水平从而减轻肝纤维化。进一步机制研究发现,积雪草酸通过抑制PI3K/AKT/mTOR信号通路抑制肝纤维化的发展[23]。由于积雪草酸溶解性差、代谢速度快,故其生物利用度低。另据报道,纳米脂质载体修饰的积雪草酸也具有抗肝纤维化的作用,其生物利用度较原型积雪草酸而言较高[24]。
2.2.2 黄芪甲苷黄芪甲苷(astragaloside IV)是从黄芪中分离得到的环马烷型三萜苷。Wei等[25]发现黄芪甲苷具有抗氧化和抗炎进而改善肝纤维化的特性。机制研究表明,黄芪甲苷可下调四氯化碳诱导的小鼠中毒性肝纤维化模型肝脏组织中p-PI3K/PI3K、p-AKT/AKT和p-mTOR/mTOR的比例。因此,黄芪甲苷的抗纤维化活性可能与抑制PI3K/AKT/mTOR信号通路有关。也有报道称黄芪甲苷主要通过抑制HSCs增殖和胶原合成来减轻猪血清诱导的大鼠免疫性肝纤维化[26]。
2.2.3 吉马酮吉马酮(germacrone, GM)是一种从姜黄中分离得到的倍半萜,对蛋氨酸和胆碱缺乏饮食诱导的代谢性肝纤维化具有治疗潜力[27]。Ji等[28]研究表明,吉马酮能改善四氯化碳介导的中毒性肝纤维化。此外,在转化生长因子(transforming growth factor β, TGF-β)诱导的LX-2细胞中,吉马酮可抑制HSCs的活化、增殖和诱导凋亡。机制研究表明,吉马酮通过PI3K/AKT/mTOR信号通路改善肝纤维化。
2.2.4 葫芦素E葫芦素E(cucurbitacin E)是一种存在于葫芦科植物中的三萜化合物。在血浆和人肝微粒体中,葫芦素E水解为葫芦素I。该化合物对活化的大鼠HSCs(T-6细胞)的存活和增殖有负向调节作用。Wu等[29]发现,葫芦素E可诱导活化的T-6细胞凋亡,抑制α-SMA、TIMP-1和COL-1的表达,改善肝纤维化。进一步的研究证明,葫芦素E的作用机制与抑制PI3K/AKT/mTOR/p70S6K信号通路和激活AMPK信号通路有关,此作用在硫代乙酰胺诱导的小鼠中毒性肝纤维化模型中也得到了验证。
2.2.5 莪术醇莪术醇(curcumol)是一种愈创木烷型倍半萜。已有文献表明,莪术醇具有抗炎、抗肝纤维化等特性。研究表明,在活化的T-6细胞中,莪术醇能够增加Caspase-3活性,提高cleaved Caspase-3和PARP裂解片段表达,抑制Bcl-2和Bcl-xL表达,具有促凋亡活性。有趣的是,莪术醇对细胞凋亡的影响与抑制PI3K和NF-κB通路有关[30]。这些数据表明,莪术醇具有治疗肝纤维化的潜力。
3 展望肝纤维化是一个多环节、多因素共同作用的复杂病理过程。越来越多的研究证实,抑制PI3K信号通路,进而改善炎症反应、氧化应激和诱导HSCs凋亡能够减轻肝纤维化。这表明靶向PI3K信号通路可能是对抗肝纤维化的一种有效策略。天然产物活性成分因其具有安全性高,有效性良好等独特优势被广泛地用于肝脏疾病的防治,其中对黄酮类和萜类化合物的开发研究更是成为当前抗肝纤维化领域的热点。这些天然产物活性成分可通过抑制PI3K信号通路降低炎症反应、氧化应激水平和诱导HSCs凋亡,进而减轻肝纤维化。然而,尽管这些天然产物中提取的黄酮类化合物和萜类化合物在体内和体外模型中显示出明显的抗肝纤维化优势,但仍存在一些不足。例如,生物利用度低、缺乏药代动力学参数等。此外,由于基础实验研究与临床疗效之间存在差距,仍需要进一步的临床试验来确定PI3K抑制剂治疗肝纤维化的安全性和有效性。总之,基于天然产物活性成分抗肝纤维化药物的开发和应用充满了希望和挑战,进行更广泛和深入的研究对确定这些化合物治疗肝纤维化的潜力具有重要意义。
| [1] |
Sung H, Ferlay J, Siegel R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-49. doi:10.3322/caac.21660 |
| [2] |
Zhang F, Xu M, Yin X, et al. TWEAK promotes hepatic stellate cell migration through activating EGFR/Src and PI3K/AKT pathways[J]. Cell Biol Int, 2019, 44(1): 278-85. |
| [3] |
Son G, Hines I N, Lindquist J, et al. Inhibition of phosphatidylinositol 3-kinase signaling in hepatic stellate cells blocks the progression of hepatic fibrosis[J]. Hepatology, 2009, 50(5): 1512-23. doi:10.1002/hep.23186 |
| [4] |
Zhan M, Deng Y, Zhao L, et al. Design, synthesis, and biological evaluation of dimorpholine substituted thienopyrimidines as potential class I PI3K/mTOR dual inhibitors[J]. J Med Chem, 2017, 60(9): 4023-35. doi:10.1021/acs.jmedchem.7b00357 |
| [5] |
Endicott S J, Ziemba Z J, Beckmann L J, et al. Inhibition of class I PI3K enhances chaperone-mediated autophagy[J]. J Cell Biol, 2020, 219(12): 1-17. |
| [6] |
孙芳芳, 万亿, 张蔓娜, 等. 乙肝肝纤维化患者肝组织FAK、PI3K的表达及意义[J]. 中国实验诊断学, 2022, 26(5): 740-3. Sun F F, Wan Y, Zhang M N, et al. Expression and significance of FAK and PI3K in liver tissue of patients with hepatitis B fibrosis[J]. Chin J Lab Diagn, 2022, 26(5): 740-3. doi:10.3969/j.issn.1007-4287.2022.05.027 |
| [7] |
Huang J F, Chuang Y H, Dai C Y, et al. Hepatic Akt expression correlates with advanced fibrosis in patients with chronic hepatitis C infection[J]. Hepatol Res, 2011, 41(5): 430-6. doi:10.1111/j.1872-034X.2011.00786.x |
| [8] |
Krenkel O, Puengel T, Govaere O, et al. Therapeutic inhibition of inflammatory monocyte recruitment reduces steatohepatitis and liver fibrosis[J]. Hepatology, 2018, 67(4): 1270-83. doi:10.1002/hep.29544 |
| [9] |
Miura K, Kodama Y, Inokuchi S, et al. Toll-like receptor 9 promotes steatohepatitis by induction of interleukin-1beta in mice[J]. Gastroenterology, 2010, 139(1): 323-34. doi:10.1053/j.gastro.2010.03.052 |
| [10] |
Cui W, Zhou S, Wang Y, et al. Cadmium exposure activates the PI3K/AKT signaling pathway through miRNA-21, induces an increase in M1 polarization of macrophages, and leads to fibrosis of pig liver tissue[J]. Ecotoxicol Environ Saf, 2021, 228: 113015. doi:10.1016/j.ecoenv.2021.113015 |
| [11] |
Reyes-Gordillo K, Shah R, Arellanes-Robledo J, et al. Akt1 and Akt2 isoforms play distinct roles in regulating the development of inflammation and fibrosis associated with alcoholic liver disease[J]. Cells, 2019, 8(11): 1337. doi:10.3390/cells8111337 |
| [12] |
Shi W P, Ju D, Li H, et al. CD147 promotes CXCL1 expression and modulates liver fibrogenesis[J]. Int J Mol Sci, 2018, 19(4): 1145. doi:10.3390/ijms19041145 |
| [13] |
Cui W, Matsuno K, Iwata K, et al. NOX1/nicotinamide adenine dinucleotide phosphate, reduced form (NADPH) oxidase promotes proliferation of stellate cells and aggravates liver fibrosis induced by bile duct ligation[J]. Hepatology, 2011, 54(3): 949-58. doi:10.1002/hep.24465 |
| [14] |
Ghatak S, Biswas A, Dhali G K, et al. Oxidative stress and hepatic stellate cell activation are key events in arsenic induced liver fibrosis in mice[J]. Toxicol Appl Pharmacol, 2011, 251(1): 59-69. doi:10.1016/j.taap.2010.11.016 |
| [15] |
Jee H J, Kim H J, Kim A J, et al. UV light induces premature senescence in Akt1-null mouse embryonic fibroblasts by increasing intracellular levels of ROS[J]. Biochem Biophys Res Commun, 2009, 383(3): 358-62. doi:10.1016/j.bbrc.2009.04.017 |
| [16] |
Hedges C P, Pham T, Shetty B, et al. Prolonged treatment with a PI3K p110α inhibitor causes sex-and tissue-dependent changes in antioxidant content, but does not affect mitochondrial function[J]. Biosci Rep, 2020, 40(10): BSR20201128. doi:10.1042/BSR20201128 |
| [17] |
Chen Q, Chen L, Wu X, et al. Dihydroartemisinin prevents liver fibrosis in bile duct ligated rats by inducing hepatic stellate cell apoptosis through modulating the PI3K/Akt pathway[J]. Iubmb Life, 2016, 68(3): 220-31. doi:10.1002/iub.1478 |
| [18] |
蔡凤桃, 张学荣, 孙林, 等. 眼镜蛇毒NGF通过PI3K/Akt促人肝星状细胞凋亡的机制研究[J]. 中国药理学通报, 2018, 34(1): 23-7. Cai F T, Zhang X R, Sun L, et al. Effect of cobra venom NGF on inducing apoptosis of LX2 cells by inhibiting PI3K/Akt signaling pathway and its mechanism[J]. Chin Pharmacol Bull, 2018, 34(1): 23-7. doi:10.3969/j.issn.1001-1978.2018.01.007 |
| [19] |
Shen M, Guo M, Wang Z, et al. ROS-dependent inhibition of the PI3K/Akt/mTOR signaling is required for Oroxylin A to exert anti-inflammatory activity in liver fibrosis[J]. Int Immunopharmacol, 2020, 85: 106637. doi:10.1016/j.intimp.2020.106637 |
| [20] |
El-Mihi K A, Kenawy H I, El-Karef A, et al. Naringin attenuates thioacetamide-induced liver fibrosis in rats through modulation of the PI3K/Akt pathway[J]. Life Sci, 2017, 187: 50-7. doi:10.1016/j.lfs.2017.08.019 |
| [21] |
Wang Q, Wen R, Lin Q, et al. Wogonoside shows antifibrotic effects in an experimental regression model of hepatic fibrosis[J]. Dig Dis Sci, 2015, 60(11): 3329-39. doi:10.1007/s10620-015-3751-4 |
| [22] |
Xiong Y, Lu H, Xu H. Galangin reverses hepatic fibrosis by inducing HSCs apoptosis via the PI3K/Akt, Bax/Bcl-2, and Wnt/β-Catenin pathway in LX-2 cells[J]. Biol Pharm Bull, 2020, 43(11): 1634-42. doi:10.1248/bpb.b20-00258$https://www.cnki.com.cn/Article/CJFDTOTAL-YAOL202103006.htm=2021&firstpage=77&issue=11 |
| [23] |
Wei L, Chen Q, Guo A, et al. Asiatic acid attenuates CCl(4)-induced liver fibrosis in rats by regulating the PI3K/AKT/mTOR and Bcl-2/Bax signaling pathways[J]. Int Immunopharmacol, 2018, 60: 1-8. doi:10.1016/j.intimp.2018.04.016 |
| [24] |
Zhang Y W, Tu L L, Zhang Y, et al. Liver-targeted delivery of asiatic acid nanostructured lipid carrier for the treatment of liver fibrosis[J]. Drug Deliv, 2021, 28(1): 2534-47. doi:10.1080/10717544.2021.2008054 |
| [25] |
Wei R, Liu H, Chen R, et al. Astragaloside IV combating liver cirrhosis through the PI3K/Akt/mTOR signaling pathway[J]. Exp Ther Med, 2019, 17(1): 393-7. |
| [26] |
Liu H, Wei W, Sun W Y, et al. Protective effects of astragaloside IV on porcine-serum-induced hepatic fibrosis in rats and in vitro effects on hepatic stellate cells[J]. J Ethnopharmacol, 2009, 122(3): 502-8. doi:10.1016/j.jep.2009.01.035 |
| [27] |
Li Z, Wang Z, Dong F, et al. Germacrone attenuates hepatic stellate cells activation and liver fibrosis via regulating multiple signaling pathways[J]. Front Pharmacol, 2021, 12: 745561. doi:10.3389/fphar.2021.745561 |
| [28] |
Ji D, Zhao Q, Qin Y, et al. Germacrone improves liver fibrosis by regulating the PI3K/AKT/mTOR signalling pathway[J]. Cell Biol Int, 2021, 45(9): 1866-75. doi:10.1002/cbin.11607 |
| [29] |
Wu Y L, Zhang Y J, Yao Y L, et al. Cucurbitacin E ameliorates hepatic fibrosis in vivo and in vitro through activation of AMPK and blocking mTOR-dependent signaling pathway[J]. Toxicol Lett, 2016, 258: 147-58. doi:10.1016/j.toxlet.2016.06.2102 |
| [30] |
Chen G, Wang Y, Li M, et al. Curcumol induces HSC-T6 cell death through suppression of Bcl-2: Involvement of PI3K and NF-κB pathways[J]. Eur J Pharm Sci, 2014, 65: 21-8. doi:10.1016/j.ejps.2014.09.001 |

