

cGAS-STING通路是中枢细胞胞质DNA传感器,不仅能够识别病原体入侵所引入的外源DNA,还能够识别肿瘤细胞、死亡细胞以及破损线粒体所产生的内源DNA,感知机体内的感染、炎症、癌症等病理状态,活化机体免疫防御反应,是一种进化上高度保守的免疫防御机制,在原核生物和真核生物中都存在其同源物,以干扰素基因刺激因子(stimulator ofinterferongenes, STING,又称为TMEM173/MPYS/MITA/ERIS)为靶点的药物开发已成为近年创新药领域的研发热点。
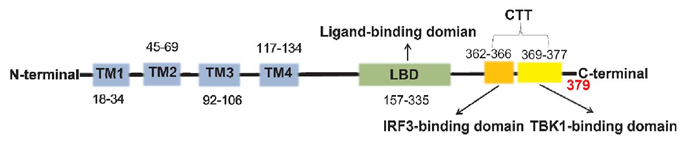
1 STING蛋白的结构干扰素基因刺激因子(stimulator of interferon genes, STING, 又称为TMEM173/MPYS/MITA/ERIS)作为一种先天性免疫调节信号分子于2008年首次报道,主要位于细胞内质网(endoplasmic reticulum, ER), 由TMEM173基因编码,人源STING(hSTING)由379个氨基酸组成,鼠源STING(mSTING)由378个氨基酸组成,两者相似度约81%。hSTING的N末端结构域(N terminal domain, NTD)主要分为4个跨膜结构域(TM 1~4), 与其细胞内位置密切相关。C末端结构域(C terminal domain, CTD)包括配体结合结构域(ligand-binding domian, LBD)和C尾端结构域(C-terminal tail, CTT)两部分,LBD负责与2′ 3′-cGAMP等配体相结合诱导STING蛋白构象转变,CTT负责与TANK结合激酶1(TANK binding kinase 1, TBK1)和干扰素调节因子3(interferon regulatory factor 3, IRF3)相结合,促进信号的级联传导。
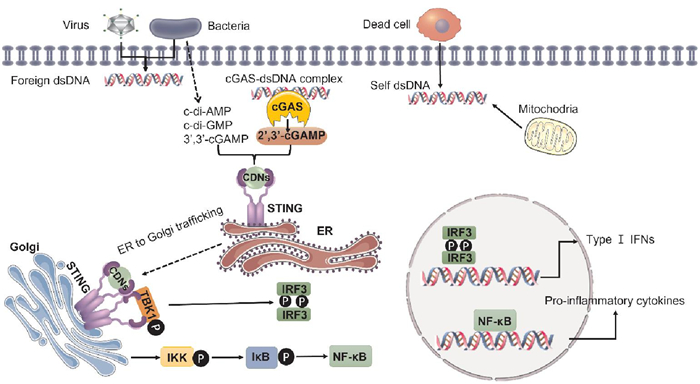
2 cGAS-STING通路激活及其应用环状GMP-AMP合成酶(cyclic GMP-AMP synthase, cGAS)包含一个核苷酸转移酶结构域和两个DNA结合结构域,当胞质中无双链DNA(double-stranded DNA, dsDNA)时,cGAS会以自我抑制的状态存在,当存在dsDNA时,cGAS会与dsDNA以序列非特异性的方式相结合,催化ATP和GTP环化,形成2′3′-cGAMP。2′ 3′-cGAMP是内源性环二核苷酸(cyclic dinucleotide, CDN)类化合物,除此之外,在细菌感染的过程中也会产生其他种类的CDNs, 如2′2′-cGAMP、3′3′-cGAMP、c-diAMP、c-diGMP等。作为CDNs的下游受体蛋白,静息状态下STING以同源二聚体形式存在,与CDNs结合后形成四聚体或多聚体复合物,多聚化STING脱离内质网,转位到高尔基体,募集TBK1和IRF3。TBK1二聚体自身磷酸化激活其激酶活性,然后将STING CTD磷酸化并将IRF3磷酸化激活,活化的IRF3二聚化并转位到细胞核,促进Ⅰ型干扰素(interferon, IFN)基因的转录表达。除此之外,STING激活后还会激活激酶IKK, 催化IκB蛋白的磷酸化,磷酸化的IκB蛋白通过泛素-蛋白酶体途径降解,从而将NF-κB释放出来,进入细胞核,与IRF3和其他转录因子一起发挥作用,诱导炎症细胞因子(如TNF、IL-6)的表达。激活后的STING最终会被溶酶体所降解。
cGAS-STING通路是病原体识别和机体免疫防御的桥梁,在机体病原体感染中诱导产生免疫应答发挥保护作用。作为胞质DNA传感器,cGAS-STING通路对巨细胞病毒、疱疹病毒、腺病毒、痘病毒和乙型肝炎病毒(hepatitis B virus, HBV)等DNA病毒均具有保护作用。后续的研究发现,STING通路激活也可以使机体产生对人类免疫缺陷病毒(human immunodeficiency virus, HIV)、热病病毒(yellow fever virus, YFV)、登革病毒(Dengue virus, DENV)和寨卡病毒(Zika virus, ZIKV)等RNA病毒的抵御作用。抗HIV等逆转录病毒的作用源于对逆转录生成的DNA中间体的识别,抗其他RNA病毒的具体分子机制尚不清楚,可能是由于病毒的感染导致细胞核或线粒体中原本封闭DNA的“泄漏”。STING还可以直接作为DNA感受器,识别细菌携带的CDNs, 引发免疫应答。此外,cGAS和STING缺陷的小鼠对恶性疟原虫、弓形虫更易感,小鼠模型显示更高的寄生虫负荷和寄生虫血症。
cGAS-STING通路的缺陷或下调与多种肿瘤的发生发展相关。在6种恶性黑色素瘤细胞系(G361、MeWo、SK-MEL-5、SK-MEL-2、SK-MEL-28、WM115)、KRAS突变的肺癌细胞系和一些人结直肠癌细胞系中均发现了STING沉默或表达明显受到抑制。cGAS-STING通路的激活不仅可以阻碍早期肿瘤细胞的进展,促进癌细胞的衰老,帮助肿瘤细胞自主控制肿瘤,还可以上调Ⅰ型IFN的产生,增加免疫细胞如T细胞、自然杀伤细胞(nature killer cell, NK cell)浸润,诱导炎症细胞因子、趋化因子等免疫刺激因子的产生,激起宿主免疫应答对抗肿瘤。
3 STING激动剂cGAS-STING通路在抗感染免疫和抗肿瘤免疫中发挥着重要的作用,研究者们大力开发相关药物,靶向该通路以达到治疗疾病的目的。本文将重点介绍STING激动剂的研究进展。
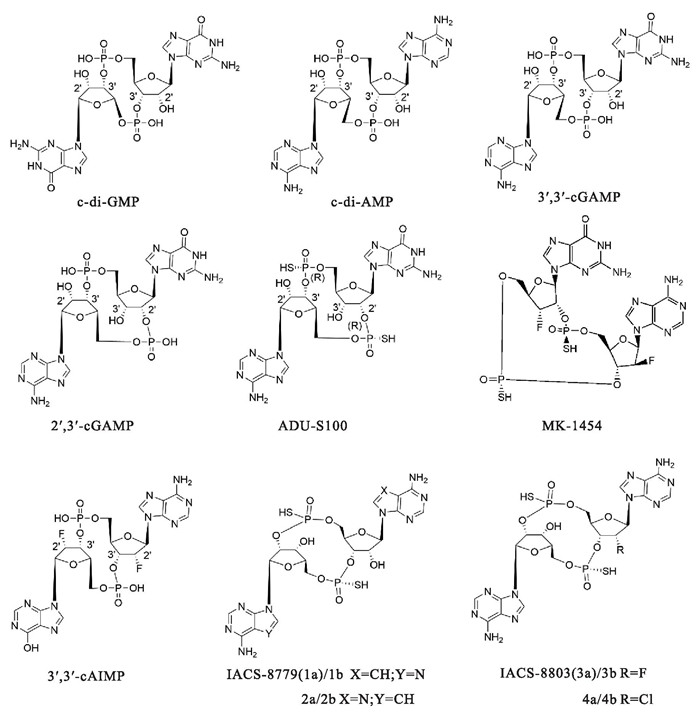
3.1 CDN类STING激动剂 3.1.1 临床试验药物内源性2′3′-cGAMP可以通过激活cGAS-STING通路,引发机体强有力的固有免疫应答。研究表明,瘤内注射cGAMP, 可以有效增强抗肿瘤CD8+T细胞反应,从而控制注射瘤和对侧瘤的发生发展进程;阻断PD1和CTLA4后,cGAMP触发抗肿瘤免疫的能力进一步增强。天然CDNs分子可有效激活STING, 但这些分子对磷酸二酯酶十分敏感,易被降解。
ADU-S100(ML-RR-S2-CDA/MIW815)是一种通过生物电子等排体设计合成的环二腺苷单磷酸类似物,具有硫代磷酸二酯键,既能抵抗磷酸二酯酶的水解,又能诱导THP-1细胞表达更高水平Ⅰ型IFN。B16F10小鼠模型中瘤内注射ADU-S100可以使小鼠肿瘤显著消退,并产生长期的免疫记忆[1]。作为首个进入临床的STING激动剂,最初应用于头颈部鳞状细胞癌和晚期或转移性实体瘤或淋巴瘤的治疗,但在临床Ⅰ期试验阶段,ADU-S100与PD-1抗体联用疗效不佳,目前该试验已被终止;后来ADU-S100陆续被应用于镇痛等其他方面的研究。
|
| Fig 1 Structure and function of human STING protein |
|
| Fig 2 cGAS-STING pathway |
默沙东在研药MK-1454在MC38小鼠模型瘤内注射给药可产生强大的抗肿瘤细胞因子和有效的抗肿瘤活性。在MC38和B16F10小鼠模型中,MK-1454与完全鼠化的抗鼠PD-1抗体mDX400联合用药显示出协同疗效,促使肿瘤进一步缩小[2]。MK-1454用于晚期实体瘤和淋巴瘤的临床试验中,单一疗法未见明显疗效,而与派姆单抗(Pembrolizumab)联合用药组中24%的患者表现出持续6个月以上的反应,但两个治疗组中部分患者都出现了注射部位疼痛、发热等不良反应。
SB11285不仅能够全身递送,而且还可以在不引起机体系统性炎症反应的同时,促进激活的免疫细胞从外周转移至肿瘤病灶,CT26小鼠模型显示出持久完全的抗肿瘤活性[3]。临床上晚期实体瘤患者静脉注射,I期临床试验结果显示不管是单药使用还是和阿替利珠单抗(Atezolizumab)联合使用都显示出来很好的耐药性。
BMS-986301在CT26和MC38小鼠模型中瘤内注射给药,注射和未注射肿瘤的完全消退率高于90%。CT26小鼠模型中,单用抗PD-1治疗无效组,联合单剂量BMS-986301治疗,注射和未注射肿瘤完全消退率高达80%[4]。
BI-1387446是BI-STING类激动剂的一种,该类激动剂通过模拟天然STING配体,瘤内给药可以产生剂量依赖性的抗肿瘤活性。
已经进入临床试验的CDN类STING激动剂相关情况见Tab 1。
| Agent | Administration method | Phase | Condition/Disease | Clinical trial ID | Active companies | |
| ADU-S100/MIW815 | +Pembrolizumab | IT | Ⅱ | Head and Neck Cancer | NCT03937141 | Chinook Therapeutics |
| Single Agent/+Ipilimumab | IT | Ⅰ | Solid Tumors Lymphomas | NCT02675439 | ||
| +PDR001 | IT | Ⅰ | Solid Tumors Lymphomas | NCT03172936 | Novartis Pharmaceuticals | |
| MK-1454 | +Pembrolizumab | IT | Ⅱ | HNSCC | NCT04220866 | Merck Sharp & Dohme LLC |
| Single Agent/+Pembrolizumab | IT | Ⅰ | Solid Tumors Lymphoma | NCT03010176 | ||
| SB11285 | Single Agent/+Atezolizumab | Ⅳ | Ⅰ | Melanoma HNSCC Solid Tumor | NCT04096638 | F-star Therapeutics |
| BMS-986301 | Single Agent/+Nivolumab+Ipilimumab | IM/IT/Ⅳ | Ⅰ | Solid Cancers | NCT03956680 | Bristol-Myers Squibb |
| BI-1387446 | Single Agent/+Ezabenlimab | IT | Ⅰ | Neoplasms | NCT04147234 | Boehringer Ingelheim |
| IM: intramuscular, IT: intratumoral, Ⅳ: intravenous, HNSCC: Head and Neck Squamous Cell Carcinoma. | ||||||
有研究者通过更换CDNs的核苷组成,发现了环腺苷-磷酸肌苷(cyclic adenosine-inosine monophosphate, cAIMP)类似物,不仅更能抵抗酶切,而且在人类和小鼠免疫细胞系中均具有更强的cGAS-STING通路激活能力,3′3′-cAIMP在小鼠肝癌模型中,瘤内注射给药可以有效促进CD8+T细胞的增殖,促进肿瘤细胞凋亡,减轻小鼠肿瘤负荷,但对多病灶模型无法解决所有的病变[5]。
在ADU-S100研究的基础之上,对CDN的碱基和核酸进一步修饰获得了IACS-8779和IACS-8803两种2′3′-硫代磷酸CDN类似物,体外实验显示出了更为强劲的STING通路激活作用,在B16黑色素瘤小鼠模型中具有更好的系统性抗肿瘤活性[6]。
另一种激动剂JNJ-67544412(JNJ-4412)与STING具有更高的亲和能力,可以与人类STING的所有主要等位基因相结合。瘤内注射可以引发促炎细胞因子和CD8+T细胞水平升高,给药后肿瘤显著消退。虽有体重减轻的不良反应,但通过减少给药次数可有效改善。
GSK532激动剂不仅能够在不同STING单倍型的外周血单个核细胞(peripheral blood mononuclear cell, PBMC)中诱导细胞因子反应,还能够激活不同临床前物种(小型猪、狗、小鼠和大鼠等)的STING直系同源物。GSK532在人体全血中表现出高度的稳定性,降解速率明显减慢,CT26小鼠模型中瘤内注射给药可以诱导强烈的抗肿瘤作用,治愈小鼠的肿瘤再接种表现出明显的抗性,表明其参与诱导适应性免疫反应的发展。
3.2 Non-CDN类STING激动剂CDN类STING激动剂受其理化性质的限制,如分子量大、膜通透性差、易被磷酸二酯酶降解、半衰期短等,改造空间和临床应用受限,越来越多的科研工作者致力于开发新型的Non-CDN类小分子STING激动剂。
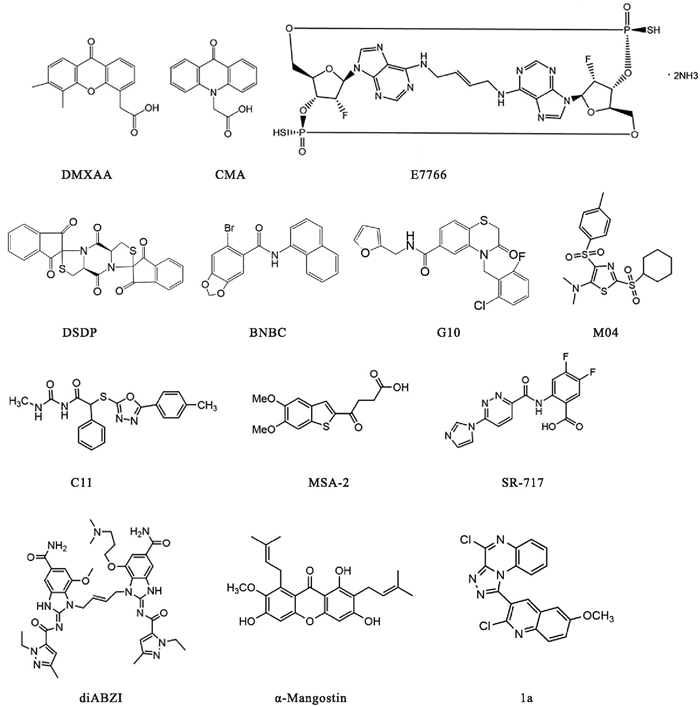
3.2.1 临床试验药物DMXAA(也称作Vadimezan / ASA404 / NSC640488)是黄酮类血管破坏剂,在小鼠体内通过激活STING蛋白,进而诱导IFN-β等细胞因子的产生,可有效抑制多种实体瘤的生长。但是该药在一项针对非小细胞肺癌的Ⅲ期临床试验中,与标准化疗联合使用,未能观察到明显的疗效。后经结构研究分析表明,DMXAA作为mSTING的直接配体,能够有效激活mSTING, 但却无法激活hSTING。DMXAA还被发现在HBV小鼠模型中,可以显著诱导干扰素刺激基因(IFN-stimulated genes, ISGs)的表达,发挥抗HBV作用。目前DMXAA已被广泛用作临床前STING激动剂研究的工具化合物。
|
| Fig 3 Chemical structure of STING CDN agonists |
CMA是吖啶酮类化合物,能有效诱导Ⅰ型IFN的产生,对乙脑病毒具有明显的治疗和预防作用,同样也是因只能激活mSTING导致临床试验失败。
研究者在核酸碱基之间引入跨环大环桥来锁定环二核苷酸的生物活性U形构象,从而产生一种拓扑结构新颖的大环桥STING激动剂(MBSA), 其对STING的激动效力显著增强。E7766就是其中一种,在小鼠肝转移瘤模型中显示出具有强大的抗肿瘤活性和持久的免疫记忆,且对所有主要人类STING变体具有激活能力[7]。
SNX281也对所有人类主要STING变体均具有激活能力,该化合物稳定性高,可系统给药。CT26小鼠模型中单次静脉注射可使肿瘤完全消退,且与抗PD-1抗体具有协同抗肿瘤的疗效[4]。
已经进入临床试验的Non-CDN类STING激动剂相关情况见Tab 2。
| Agent | Administration method | Phase | Condition/Disease | Clinical trial ID | Active Companies | |
| DMXAA/ASA404 | single agent | Ⅳ | Ⅰ | Solid Tumors | NCT00863733 | Cancer Research UK |
| single agent/+Taxane | Ⅳ | Ⅰ | Solid Tumor Malignancies | NCT01290380 | Novartis Pharmaceuticals | |
| single agent | Ⅳ | Ⅰ | Solid Tumors | NCT01299701 | ||
| +Fluvoxamine | Ⅳ | Ⅰ | Solid Tumors | NCT01299415 | ||
| single agent | Ⅳ | Ⅰ | Metastatic Cancer | NCT01278758 | ||
| +Carboplatin+Paclitaxel | Ⅳ | Ⅰ | NSCLC | NCT00674102 | ||
| single agent | Ⅳ | Ⅰ | Solid Tumors | NCT01278849 | ||
| +Docetaxel | Ⅳ | Ⅱ | Urothelial Carcinoma | NCT01071928 | ||
| single agent | Ⅳ | Ⅰ | Metastatic Cancer | NCT01240642 | ||
| +Docetaxel | Ⅳ | Ⅰ | Solid Tumors | NCT01285453 | ||
| +Docetaxel | Ⅳ | Ⅲ | NSCLC | NCT00738387 | ||
| +Carboplatin+Paclitaxel+Cetuximab | Ⅳ | Ⅰ | Tumors | NCT01031212 | ||
| +Paclitaxel+Carboplatin | Ⅳ | Ⅲ | NSCLC | NCT00662597 | ||
| single agent | Ⅳ | Ⅰ | Refractory Tumors | NCT00856336 | Antisoma Research | |
| +Carboplatin+Paclitaxel | Ⅳ | Ⅰ | NSCLC | NCT00832494 | ||
| single agent | Ⅳ | Ⅱ | Prostate Cancer | NCT00111618 | ||
| +Paclitaxel+Carboplatin | Ⅳ | Ⅱ | Lung Cancer | NCT01057342 | SAKK | |
| single agent | Ⅳ | Ⅰ | Solid Tumor | NCT00003697 | University of Glasgow | |
| E7766 | single agent | IT | Ⅰ | Lymphoma Solid Tumors | NCT04144140 | Eisai |
| single agent | Intravesical | Ⅰ | Urinary Bladder Neoplasms | NCT04109092 | ||
| GSK3745417 | single agent/+Dostarlimab | Ⅳ | Ⅰ | Neoplasms | NCT03843359 | GlaxoSmithKline |
| SNX281 | single agent/+Pembrolizumab | Ⅳ | Ⅰ | Solid Tumor Lymphoma | NCT04609579 | Stingthera |
| MK2118 | single agent/+Pembrolizumab | IT | Ⅰ | Solid Tumor Lymphoma | NCT03249792 | Merck Sharp & Dohme LLC |
| TAK-676 | single agent/+Pembrolizumab | Ⅳ | Ⅰ | Solid Neoplasms | NCT04420884 | Takeda |
| +Radiation+Pembrolizumab | Ⅳ | Ⅰ | NSCLC TNBC SCCHN | NCT04879849 | ||
| /+Carboplatin/+5-FU/+Paclitaxel | IT | Ⅰ | Solid Tumor | NCT04541108 | Presage Biosciences | |
| NSCLC: Non-small-cell lung cancer, TNBC: Triple-negative breast cancer, SCCHN: Squamous-cell carcinoma of the head and neck. | ||||||
化合物二酮哌嗪(dispiro diketopiperzine, DSDP)和苯甲酰胺类化合物(6-bromo-N-(naphthalen-1-yl)benzo[d][1,3] dioxole-5-carboxamide, BNBC)是基于人肝癌细胞HepAD38/cGAS-STING/ISG54 Luc报告细胞系进行高通量筛选发现的。二者以hSTING依赖的方式诱导IFN主导的细胞因子反应,保护细胞免受YFV、DENV和ZIKV等黄病毒的感染。BNBC还可以诱导树突状细胞的细胞因子反应和细胞成熟,可能进一步对CD4+、CD8+等适应性免疫应答进行调节[8-9]。
G10、C11和M04 3种hSTING激动剂是基于人成纤维细胞hSTING-IFN/IRF3报告细胞系进行高通量筛选时发现的,这3种化合物可以激活hSTING介导的IFN/IRF3信号通路,而不激活NF-κB信号通路。其中M04可以促进人树突状细胞成熟标志物的表达和CD8+T细胞的增殖活化。G10、C11对委内瑞拉马脑炎病毒、痘苗病毒、西尼罗河病毒等不同的甲病毒分支具有不同程度的保护作用[10-12]。
diABZI是小分子氨基苯并咪唑(amidobenzimidazole, ABZI)家族的一员,可以与cGAMP竞争结合STING, 剂量依赖性诱导STING的激活和IFN-β的分泌,在结直肠癌小鼠模型中可显著抑制肿瘤的生长[13]。此外,diABZI激活STING还具有显著的抗病毒活性,如副流感病毒3型和人类鼻病毒16型[14]。近期发现diABZI可以高效限制SARS-CoV-2在细胞和动物中的复制,在小鼠新冠病毒感染模型中,在病毒感染之前或之后通过鼻内给药diABZI-4可完全保护其免受SARS-CoV-2感染引起的严重呼吸系统疾病的侵袭[15]。
苯并噻吩类化合物MSA-2是基于THP1-hSTING-IFNβ报告细胞系在化合物库中筛选得到的,瘤内注射、皮下注射和口服给药都能有效激活STING, 诱导IFN-β、IL-6等细胞因子水平升高,MSA-2的弱酸性使其能够选择性激活肿瘤细胞中的STING, MC38小鼠模型中80%~100%的小鼠给药后肿瘤消退,再次注射95%的小鼠都没有出现肿瘤复发的现象,MC38、CT26、B16F10、LL-2多种肿瘤模型中单药治疗有效,与抗鼠PD-1抗体muDX400联合用药显示出协同疗效[16]。
SR-717是咪唑哒嗪类化合物,两分子SR-717可以模拟cGAMP结合并激活mSTING和hSTING, 剂量依赖性的升高IFN-β、IL-6等细胞因子的水平,促进CD8+T、NK等免疫细胞的增殖活化,瘤内注射显示出强劲的抗肿瘤活性,腹腔注射给药也可以降低肿瘤负荷,在侵袭性黑色素瘤、结直肠癌、肺结节等小鼠模型中均有效,其抗肿瘤效果优于PD-1或PD-L1抗体[17]。
从山竹中提取得到的天然黄酮类化合物的α-Mangostin能够与hSTING结合,提高其稳定性,激活下游STING-TBK1-IRF3信号通路,产生抗病毒和抗肿瘤活性,同时还能够诱导巨噬细胞促肿瘤M2表型转变为抗肿瘤M1表型[18]。
除此之外,一些新型小分子STING激动剂陆续被开发出来。基于结构虚拟筛选和荧光偏振实验从化合物库中筛选并经结构改造获得的三唑喹喔啉类化合物1a可以有效激活STING及其下游TBK1-IRF3信号轴,剂量依赖性地促进人THP-1细胞和小鼠BMDM细胞中IFN-β、CXCL10、IL-6的表达[19]。非核苷酸非环状Selvita和Ryvu′s STING激动剂可以在PBMC和树突状细胞等细胞中有效诱导细胞因子反应,Ryvu′s激动剂在CT26小鼠模型中可使肿瘤完全消退,且形成免疫记忆。TTI-10001可以激活hSTING和mSTING, 瘤内注射给药可以诱导免疫细胞因子的表达,产生良好的抗肿瘤活性。ALG-031048与ADU-S100相比,稳定性更高,瘤内注射给药肿瘤消退率更高,皮下注射给药也显示出很好的抗肿瘤效果,与抗PD-1抗体协同作用,增强对肿瘤生长的抑制。CRD-5500可以通过多种途径给药,临床前数据显示,瘤内注射和静脉注射给药都可以使CT26小鼠模型肿瘤消退,与免疫检查点抑制剂协同作用,抗肿瘤效果更佳[4]。
3.3 STING激动剂新剂型的开发和应用高剂量的小分子激动剂会激活“脱靶”细胞类型中的STING, 如效应T细胞,导致细胞凋亡的发生,最终阻碍免疫记忆的形成。为此,人们陆续通过开发STING激动剂的新剂型以实现cGSA-STING通路的靶向激活。
NBTXR-3新型纳米药物,是一种放射增敏剂,一次性肿瘤内注射给药,放射疗法激活。与单纯放疗相比,NBTXR3激活后可剂量依赖性地增加cGAS-STING通路的激活,增加了肿瘤细胞的杀伤效率和免疫原性细胞的死亡。临床前研究显示,通过NBTXR3、放疗和免疫检查点抑制剂的三重组合,可以“重新编程”局部和远处肿瘤的微环境,延缓靶向和远处肿瘤的生长,提高生存率。
SYN-STING(SYNB 1891)是一种可以调控表达DacA蛋白的大肠杆菌工程菌株,DacA蛋白可以催化生成环状AMP二聚体,模拟cGAMP激活STING。瘤内注射给药后,在肿瘤组织中表现出定位、持久性、代谢活性和中等水平抗肿瘤活性。在B16F10黑色素瘤、EL4淋巴瘤、CT26结肠癌小鼠模型中可形成有效抗肿瘤免疫和良好的免疫记忆,并激活抗原提呈细胞[20]。
exoSTING(CDK-002)是一种工程化的外泌体,可以选择性地将装载的STING激动剂输送至肿瘤部位抗原提呈细胞,产生更为有效的肿瘤抗原特异性的免疫应答,和抗PD-1抗体联合治疗可进一步增强抗肿瘤免疫反应。
4 STING激动剂研发的挑战与展望STING无疑是一个有前途的免疫治疗靶点,但在STING激动剂的研究和开发过程中也不乏问题和挑战。
|
| Fig 4 Chemical structure of STING Non-CDN agonists |
| Agent | Administration method | Phase | Condition/Disease | Clinical trial ID | Active companies | |
| NBTXR-3/PEP-503 | +RT | IT | Ⅳ | Pancreatic Cancer | NCT04484909 | M.D. Anderson Cancer Center |
| +RT | IT /IN | Ⅳ | NSCLC | NCT04505267 | ||
| +RT+Pembrolizumab | IT /IN | Ⅱ | HNSCC | NCT04862455 | ||
| +Chemotherapy+RT | IT/IN | Ⅳ | Esophageal Cancer | NCT04615013 | ||
| +RT+Ipilimumab+Nivolumab | IT | Ⅳ Ⅱ | Lung and/or Liver Metastases From Solid Malignancy | NCT05039632 | ||
| +Pembrolizumab | IT | Ⅳ | HNSCC | NCT04834349 | ||
| +RT | IT | Ⅳ | Adult Soft Tissue Sarcoma | NCT01433068 | Nanobiotix | |
| +Nivolumab/+Pembrolizumab | IT | Ⅳ | Advanced Cancers | NCT03589339 | ||
| +RT | IT | Ⅱ Ⅲ | Adult Soft Tissue Sarcoma | NCT02379845 | ||
| +RT | IT | Ⅳ | Head and Neck Cancer | NCT01946867 | ||
| Single agent/+Cetuximab | IT /IN | Ⅲ | HNSCC | NCT04892173 | ||
| Single agent | IL / IA | Ⅳ Ⅱ | Liver Cancer | NCT02721056 | ||
| Single agent | Intraprostate | Ⅳ Ⅱ | Prostate Cancer | NCT02805894 | ||
| +Cisplatin+RT | IT | Ⅳ Ⅱ | HNSCC | NCT02901483 | PharmaEngine | |
| +5-FU/Capecitabine+RT | IT | Ⅳ Ⅱ | Rectal Cancer | NCT02465593 | ||
| SYNB 1891 | Single agent/+Atezolizumab | IT | Ⅳ | Metastatic Solid Neoplasm Lymphoma | NCT04167137 | Synlogic |
| exoSTING/CDK-002 | Single agent | IT | Ⅳ Ⅱ | Advanced Solid Tumor | NCT04592484 | Codiak BioSciences |
| IL: Intralesional, IA: Intraarterial, IN: Intranodal, RT: Radiation therapy. | ||||||
首先,STING蛋白本身是一把双刃剑。激活STING可以激发机体的固有和适应性免疫应答,产生良好的抗感染和抗肿瘤活性。但STING的激活也会对机体产生一些负面作用。(1)肿瘤细胞中染色体的不稳定性和基因组DNA的泄漏可能会导致肿瘤细胞以STING依赖的方式增强其侵袭、转移能力和耐药性[21]; (2)STING对内源性DNA的异常识别和基因突变所致组成性激活与各种自身免疫性疾病的发生密切相关[22]; (3)cGAS-STING通路的激活可以加重衰老和老龄化疾病[23], 该通路的下调或沉默可以有效改善心血管、脂肪组织炎症反应,降低心血管疾病、肝脏疾病等慢性疾病的严重程度[24]。越来越多的研究表明,STING是一些自身炎症和自身免疫性疾病发病机制中的核心驱动因素。鉴于此,以STING为靶点抑制剂的研发正在进行中,现有的抑制剂主要包括以Astin C为代表的竞争性拮抗剂和以硝基脂肪酸(NO2-FAs)、硝基呋喃类化合物为代表的共价抑制剂两种类型。
其次,越来越多的研究发现病原微生物逐渐衍生出了各种针对STING的免疫逃逸策略。如DENV NS2B/3蛋白酶复合体结合并切割STING蛋白;丙型肝炎病毒NS4B蛋白结合并灭活STING; 冠状病毒HCoV-NL63通过木瓜蛋白酶、HBV通过聚合酶可以破坏K63介导的STING的多聚泛素化,而STING的多聚泛素化正是激活IFN信号所必需的[25]。
最后,在STING激动剂的研发过程中还有一些必须要纳入考虑的问题。(1)STING的广泛表达;(2)STING的单核苷酸多态性,目前已发现的STING突变体主要有四种:R232H、R293Q、AQ和HAQ, 不同突变体对同一STING激动剂的敏感性是有差别的;(3)经典CDNs激活STING需要一个封闭的“盖子”构象,而一些激动剂如diABZI却能在保持构象开放的同时激活STING。因此,STING构象的改变和对下游信号通路激活的倾向性仍需要进一步研究确定。
| [1] |
Corrales L, Glickman L H, McWhirter S M, et al. Direct activation of STING in the tumor microenvironment leads to potent and systemic tumor regression and immunity[J]. Cell Rep, 2015, 11(7): 1018-30. doi:10.1016/j.celrep.2015.04.031 |
| [2] |
Chang W, Altman M D, Lesburg C A, et al. Discovery of MK-1454: A potent cyclic dinucleotide stimulator of interferon genes agonist for the treatment of cancer[J]. J Med Chem, 2022, 65(7): 5675-89. doi:10.1021/acs.jmedchem.1c02197 |
| [3] |
Challa S V, Zhou S, Sheri A, et al. Preclinical studies of SB 11285, a novel STING agonist for immuno-oncology[J]. J Clin Oncol, 2017, 35(15_suppl): e14616. doi:10.1200/JCO.2017.35.15_suppl.e14616 |
| [4] |
Amouzegar A, Chelvanambi M, Filderman J N, et al. STING agonists as cancer therapeutics[J]. Cancers (Basel), 2021, 13(11): 2695. doi:10.3390/cancers13112695 |
| [5] |
Thomsen M K, Skouboe M K, Boularan C, et al. The cGAS-STING pathway is a therapeutic target in a preclinical model of hepatocellular carcinoma[J]. Oncogene, 2020, 39(8): 1652-64. doi:10.1038/s41388-019-1108-8 |
| [6] |
Ager C R, Zhang H, Wei Z, et al. Discovery of IACS-8803 and IACS-8779, potent agonists of stimulator of interferon genes (STING) with robust systemic antitumor efficacy[J]. Bioorg Med Chem Lett, 2019, 29(20): 126640. doi:10.1016/j.bmcl.2019.126640 |
| [7] |
Kim D S, Endo A, Fang F G, et al. E7766, a macrocycle-bridged stimulator of interferon genes (STING) agonist with potent pan-genotypic activity[J]. ChemMedChem, 2021, 16(11): 1740-3. |
| [8] |
Liu B, Tang L, Zhang X, et al. A cell-based high throughput screening assay for the discovery of cGAS-STING pathway agonists[J]. Antiviral Res, 2017, 147: 37-46. doi:10.1016/j.antiviral.2017.10.001 |
| [9] |
Zhang X, Liu B, Tang L, et al. Discovery and mechanistic study of a novel human-stimulator-of-interferon-genes agonist[J]. ACS Infect Dis, 2019, 5(7): 1139-49. |
| [10] |
Sali T M, Pryke K M, Abraham J, et al. Characterization of a novel human-specific STING agonist that elicits antiviral activity against emerging alphaviruses[J]. PLoS Pathog, 2015, 11(12): e1005324. doi:10.1371/journal.ppat.1005324 |
| [11] |
Abraham J, Botto S, Mizuno N, et al. Characterization of a novel compound that stimulates STING-mediated innate immune activity in an allele-specific manner[J]. Front Immunol, 2020, 11: 1430. doi:10.3389/fimmu.2020.01430 |
| [12] |
Gall B, Pryke K, Abraham J, et al. Emerging alphaviruses are sensitive to cellular states induced by a novel small-molecule agonist of the STING pathway[J]. J Virol, 2018, 92(6): e01913-7. |
| [13] |
Ramanjulu J M, Pesiridis G S, Yang J, et al. Design of amidobenzimidazole STING receptor agonists with systemic activity[J]. Nature, 2018, 564(7736): 439-43. |
| [14] |
Zhu Q, Hu H, Liu H, et al. A synthetic STING agonist inhibits the replication of human parainfluenza virus 3 and rhinovirus 16 through distinct mechanisms[J]. Antiviral Res, 2020, 183: 104933. |
| [15] |
Humphries F, Shmuel-Galia L, Jiang Z, et al. A diamidobenzimidazole STING agonist protects against SARS-CoV-2 infection[J]. Sci Immunol, 2021, 6(59): eabi9002. |
| [16] |
Pan B S, Perera S A, Piesvaux J A, et al. An orally available non-nucleotide STING agonist with antitumor activity[J]. Science, 2020, 369(6506): eaba6098. |
| [17] |
Chin E N, Yu C, Vartabedian V F, et al. Antitumor activity of a systemic STING-activating non-nucleotide cGAMP mimetic[J]. Science, 2020, 369(6506): 993-9. |
| [18] |
Zhang Y, Sun Z, Pei J, et al. Identification of α-Mangostin as an agonist of human STING[J]. ChemMedChem, 2018, 13(19): 2057-64. |
| [19] |
Hou H, Yang R, Liu X, et al. Discovery of triazoloquinoxaline as novel STING agonists via structure-based virtual screening[J]. Bioorg Chem, 2020, 100: 103958. |
| [20] |
Leventhal D S, Sokolovska A, Li N, et al. Immunotherapy with engineered bacteria by targeting the STING pathway for anti-tumor immunity[J]. Nat Commun, 2020, 11(1): 2739. |
| [21] |
Bakhoum S F, Ngo B, Laughney A M, et al. Chromosomal instability drives metastasis through a cytosolic DNA response[J]. Nature, 2018, 553(7689): 467-72. |
| [22] |
Liu Y, Jesus A A, Marrero B, et al. Activated STING in a vascular and pulmonary syndrome[J]. N Engl J Med, 2014, 371(6): 507-18. |
| [23] |
王凌, 尤鸿美, 潘雪银, 等. 老年性疾病通过cGAS-STING通路调控衰老相关分泌表型[J]. 中国药理学通报, 2021, 37(4): 450-4. Wang L, You H M, Pan X Y, et al. Senile disease regulates aging-related secretion phenotype through cGAS-STING pathway[J]. Chin Pharmacol Bull, 2021, 37(4): 450-4. |
| [24] |
Bao T, Liu J, Leng J, et al. The cGAS-STING pathway: More than fighting against viruses and cancer[J]. Cell Biosci, 2021, 11(1): 209. |
| [25] |
Maringer K, Fernandez-Sesma A. Message in a bottle: Lessons learned from antagonism of STING signalling during RNA virus infection[J]. Cytokine Growth Factor Rev, 2014, 25(6): 669-79. |

